一种纳米诊疗剂及其制备方法与应用与流程
本发明涉及医用纳米材料领域,尤其涉及一种纳米诊疗剂及其制备方法与应用。
背景技术:
wnt/β-连环蛋白信号通路在组织和器官发育及平衡中起极其重要的作用,能够维持体内组织的平衡,再生和损伤修复。然而,突变、表观遗传学改变或肿瘤微环境中的细胞能异常激活wnt/β-连环蛋白信号传导途径,导致乳腺癌等各种癌症的发生。在信号级联反应中,β-连环蛋白作为t细胞因子/淋巴增强因子(tcf/lef)家族的共激活因子,起着至关重要的作用。axin/gsk3β(糖原合成酶激酶3β)/apc(腺瘤性结肠息肉)破坏复合物通过泛素化降解途径降解β-连环蛋白,从而紧密调控β-连环蛋白的活性及其蛋白质水平。癌症基因组测序揭示了wnt信号通路上游卷曲蛋白(fzd)家族成员、低密度脂蛋白受体相关蛋白(lrp)5或6及apc的频繁突变、大量突变累积能够导致wnt/β-连环蛋白信号传导受阻,最终导致信号通路的异常激活。
奥巴克拉(obatoclax,obx)、灵菌红素(prodigiosin)、舒林酸(sulindac)和盐霉素(salinomycin)等均被验证为治疗多种癌症的实验性药物,上述化疗药物能够通过调控wnt信号通路来抑制wnt信号通路相关蛋白的表达。例如,奥巴克拉及其类似物灵菌红素,能够有效阻断lrp6和dvl2的磷酸化,并且在体外和体内激活糖原合成酶激酶3β,是一种有效的wnt/β-连环蛋白信号拮抗剂。然而,由于这些化疗药物水溶性差且具有较大的毒副作用,因此发展合适的药物载体,提高其水溶性并降低毒副作用,具有广泛的临床应用前景。
技术实现要素:
鉴于上述问题,本发明的目的在于提供一种纳米诊疗剂及其制备方法与应用,旨在提高现有化疗药物水溶性和降低它们的毒副作用等问题,实现肿瘤的光声成像和核磁共振成像,以及双模态影像指导下的抑制wnt/β-连环蛋白信号通路的化疗。。
本发明的技术方案如下:
一种纳米诊疗剂,其中,包括磁性黑色素纳米颗粒(mnns)和化疗药物,所述化疗药物用于调控wnt/β-连环蛋白信号通路,所述化疗药物通过π-π共轭装载在所述磁性黑色素纳米颗粒上。
所述的纳米诊疗剂,其中,所述化疗药物选自奥巴克拉、舒林酸、灵菌红素或盐霉素中的一种或多种。
所述的纳米诊疗剂,其中,所述磁性黑色素纳米颗粒的直径为10-30nm。
所述的纳米诊疗剂,其中,所述磁性黑色素纳米颗粒与所述化疗药物的质量比为0.5-2:1。
一种本发明所述的纳米诊疗剂的制备方法,其中,包括:
提供磁性黑色素纳米颗粒;
将所述磁性黑色素纳米颗粒与用于调控wnt/β-连环蛋白信号通路的化疗药物混合并超声3-10min,放置在35-45ºc摇床下,并以80-120rpm震荡12h,得到所述纳米诊疗剂。
所述的纳米诊疗剂的制备方法,其中,所述磁性黑色素纳米颗粒的制备方法包括:使用仿生合成方法,在碱性条件下将黑色素与铁离子和亚铁离子共沉淀,得到所述磁性黑色素纳米颗粒。
所述的纳米诊疗剂的制备方法,其中,按质量比为0.5-2:1将所述磁性黑色素纳米颗粒与用于调控wnt/β-连环蛋白信号通路的化疗药物进行混合。
一种本发明所述的纳米诊疗剂用于肿瘤诊断和治疗。
有益效果:本发明所述纳米诊疗剂,实现肿瘤的光声成像和核磁共振成像,同时具有肿瘤化疗作用,该纳米药物在肿瘤部位高效蓄积,可以大大降低化疗药物的全身毒副作用。因此,该诊疗剂在肿瘤的诊断与治疗领域将具有良好的应用前景。
附图说明
图1为实施例1中合成mnns的透射电镜照片;
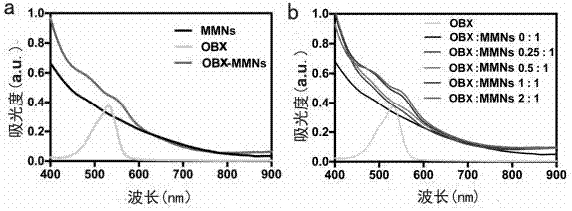
图2为实施例2中mnns装载上obx以及装载不同浓度的obx的吸收谱图;
图3为实施例3中评价体外obx-mnns和游离obx长时间释放和激光刺激释放的药量;
图4为实施例4中评价obx-mnns对mda-mb-231和mda-mb-468肿瘤细胞的杀伤效果;
图5为实施例5中评价obx-mnns对mda-mb-231肿瘤细胞中wnt信号通路相关蛋白表达情况的影响;
图6为实施例5中评价obx-mnns对mda-mb-468肿瘤细胞中wnt信号通路相关蛋白表达情况的影响;
图7为实施例6中评价obx-mnns在光声成像指导下不同时间的肿瘤细胞摄取量;
图8为实施例6中评价obx-mnns在核磁共振成像指导下不同时间的肿瘤细胞摄取量;
图9为实施例7中评价obx-mnns对肿瘤生长的抑制效果。
具体实施方式
本发明提供一种纳米诊疗剂及其制备方法与应用,为使本发明的目的、技术方案及效果更加清楚、明确,以下对本发明进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明实施例提供一种纳米诊疗剂,其中,包括磁性黑色素纳米颗粒(mnns)和化疗药物,所述化疗药物用于调控wnt/β-连环蛋白信号通路,所述化疗药物通过π-π共轭装载在所述磁性黑色素纳米颗粒的表面。
本实施例以mnns作为载体,应用该载体材料负载临床上已批准的调控wnt/β-连环蛋白信号通路的化疗药物,比如奥巴克拉、舒林酸、灵菌红素和盐霉素等。黑色素作为人体本身存在的生物色素,具有良好的生物相容性和生物可降解性,可通过π-π共轭作用和氢键等作用力高效装载化疗药物。此外,黑色素在近红外区域具有强吸收,可实现肿瘤的光声成像。黑色素偶联铁离子后还具有良好的核磁共振成像效果。因此,mnns能够作为光热剂和多模态造影剂构建多功能的纳米诊疗剂。
本实施例利用mnns装载一系列调控wnt/β-连环蛋白信号通路的化疗药物,具体是mnns通过π-π堆积吸引并装载具有大量共轭结构的化疗药物,从而实现多模态成像指导下的肿瘤化疗。所述纳米诊疗剂具有以下几个优点:1.提高了药物的水溶性和它们在肿瘤部位的蓄积效率;2.实现了光声成像和核磁共振成像指导的肿瘤治疗;3.在近红外激光照射下,该纳米诊疗剂可以产热,低热能有效促进药物在肿瘤部位的蓄积,同时实现光控的药物释放,从而增强化疗药物的治疗效果。
在一种优选的实施方式中,所述磁性黑色素纳米颗粒的直径为10-30nm,其具有很好的水溶性和稳定性。
在一种优选的实施方式中,所述磁性黑色素纳米颗粒与所述化疗药物的质量比为0.5-2:1,在该质量比下具有较高的装载效率。例如,所述化疗药物为obx时,所述mnns与所述obx的重量比可以为1:1。
本发明实施例还提供一种所述的纳米诊疗剂的制备方法,其中,包括:
提供磁性黑色素纳米颗粒;
将所述磁性黑色素纳米颗粒与用于调控wnt/β-连环蛋白信号通路的化疗药物混合并超声3-10min,放置在35-45ºc摇床下,并以80-120rpm震荡12h,得到所述纳米诊疗剂。
在一种优选的实施方式中,所述磁性黑色素纳米颗粒的制备方法包括:使用仿生合成方法,在碱性条件下将黑色素与铁离子(fe3+)和亚铁离子(fe2+)共沉淀,得到所述磁性黑色素纳米颗粒。
在一种优选的实施方式中,按质量比0.5-2:1将所述磁性黑色素纳米颗粒与用于调控wnt/β-连环蛋白信号通路的化疗药物进行混合。
作为其中的一个具体实施方式,所述obx-mnns(mnns负载obx)的制备方法包括:
a)制备mnns:使用仿生合成方法,在碱性(如氨水)条件下将黑色素与铁离子(fe3+)和亚铁离子(fe2+)共沉淀;
b)纯化mnns:将上述步骤a)制备的mnns多次离心水洗后分散在水中,获得纯化的mnns;
c)obx装载的mnns:将上述步骤b)制备的mnns与有机溶剂(如二甲基亚砜)溶解的obx以质量比为1:1,超声3-10min,放置在35-45ºc摇床下,并以80-120rpm震荡12h,获得奥巴克拉-黑色素纳米颗粒(obx-mnns)。
本实施例纳米诊疗剂的合成方法简单、操作方便,易于实现工业化生产,同时黑色素作为人体生物色素具有极好的生物相容性和生物可降解性,因此在肿瘤的诊断与治疗领域具有良好的应用前景。
本发明实施例还提供一种所述的纳米诊疗剂在肿瘤诊断和治疗中的应用。通过本实施例所述制备方法制备的纳米诊疗剂可实现肿瘤的光声成像和核磁共振成像,同时具有肿瘤化疗作用,该纳米药物在肿瘤部位高效蓄积,可以大大降低化疗药物的全身毒副作用。因此在肿瘤的诊断与治疗领域将具有良好的应用前景。本实施例所述纳米诊疗剂在治疗肿瘤的同时还作为多模态造影剂来进行光声成像和核磁共振成像。
下面结合具体实施例对本发明做进一步阐述:
实施例1:合成mnns
分别称取146mgfecl3·6h2o和126mgfeso4·7h2o共同溶解于少量去离子水中,之后用去离子水定容到10ml。迅速加入氮气保护的圆底烧瓶中,80ºc油浴下剧烈搅拌10min,接着加入4ml黑色素氨溶液(黑色素2.5mg/ml,1.5mnh3·h2o),持续n2保护并80ºc下快速搅拌30min,得到mnns。
合成的mnns对应的tem图如图1所示。
实施例2:mnns装载obx
将2mgobx溶解于dmso(10μl)中,将上述溶液加入到2mlmnns(1mg/ml)中,超声5min,并在40ºc摇床下以100rpm震荡12h得到obx-mnns,离心水洗,分离,全过程避光处理。
图2中(a)表示mnns装载上obx的紫外图;图2中(b)为mnns装载不同浓度的obx的紫外图。
实施例3:评价体外obx-mnns和游离obx长时间释放和激光刺激释放的药量
长时间释放:将制备好的obx-mnns分别加入到ph为7.4和6的500μl25%乙醇溶液中,并分别加入到1.5ml的超滤离心管中,置于37ºc摇床下以100rpm震荡。分别在1、2、4、6、8、10、24h离心收集滤液并添加等量的上述溶液(n=3)。
激光刺激释放:将制备好的obx-mnns分别加入到ph为7.4和ph为6的500μl25%乙醇溶液中,并分别加入到1.5ml的超滤离心管中,置于37ºc摇床下以100rpm震荡。分别在1、2、3h离心收集滤液并添加相同的乙醇溶液(n=3)。并在上述时间点后,溶液立即用808nm近红外激光(1.0w·cm-2)照射5min,再次收集滤液。通过分光光度计在540nm波长下测量obx的释放量。
图3中(a)为在ph为7.4时,obx-mnns在24h内仅释放31.65%的obx,表明在中性条件下obx-mnns具有良好的稳定性。相反,由于质子化obx的溶解度增加,在ph为6.0时释放约50.93%。然后还研究了nir触发的药物释放,如图3中(b)所示,在808nm近红外激光(1.0w·cm-2,5min)的照射下,在ph为7.4和6.0的条件下,都观察到obx的急剧释放,在180min时约有27.31%和44.9%的obx释放。obx-mnns的这种ph/nir双重刺激响应药物释放行为使其能够实现肿瘤部位特异性的化疗。
实施例4:评价obx-mnns对mda-mb-231和mda-mb-468肿瘤细胞的杀伤效果
本实验采用标准的mtt法检测obx-mnns对mda-mb-231(左)和mda-mb-468(右)细胞存活率的影响。mda-mb-231和mda-mb-468细胞分别以每孔5*103细胞密度接种到96孔板中,并置于37ºc、5%co2条件下的培养箱中培育24h。之后,吸出96孔板中的旧培养基,分别加入含有1000nmobx-mnns、游离obx以及单独的mnns的dmem培养基。培育4h,在808nm近红外激光(1.0w·cm-2)条件下,每孔照射5min后,吸出孔板中的旧培养基,在每个孔中加入100μl新鲜的dmem培养基。继续培养至24h后,吸出96孔板中的旧培养基,在每个孔中加入100μlmtt的培养基溶液,继续培养4h。吸出96孔板中的残余培养基,在每个孔中加入dmso溶液(150μl),轻轻摇晃后,在酶标仪上检测每孔的od值(检测波长为490nm),用如下公式计算细胞存活率。细胞存活率(%)=(样品的od490值/空白od490值)×100%,实验结果见图4。
如图4所示,单纯的mnns组和mnns+激光组对细胞基本无毒性,obx-mnns+激光组会显著降低mda-mb-231和mb468细胞存活率;并且obx-mnns+激光组对细胞的杀伤效果显著优于obx-mnns组、obx组对细胞的杀伤效果。
实施例5:评价obx-mnns对mda-mb-231和mda-mb-468肿瘤wnt信号通路相关蛋白表达含量的影响
在细胞分子水平,采用wb检测了obx对wnt/β-catenin信号通路相应靶蛋白的作用变化情况。以一定浓度的obx以及当量的obx-mnns处理mda-mb-231和mda-mb-4683h后,在808nm近红外激光(1.0w·cm-2)条件下,每孔照射5min后,吸出孔板中的旧培养基,在每个孔中加入100μl新鲜的dmem培养基。继续培养至24h,收集细胞进行wb及实时pcr。
如图5-6所示,obx组和obx-mnns组均能显著降低乳腺癌细胞系p-lrp6(1490)、lrp6、磷酸化的dvl2、abc、β-catenin和ser9磷酸化的gsk3β的表达,且obx-mnns+激光组的靶蛋白表达明显低于未经过激光处理的obx-mnns组。同时,实时pcr结果显示obx-mnp+激光组对靶基因cyclind1,lef1,纤连蛋白的降低作用也强于obx-mnns组。与obx组相比,obx+激光组对相应的靶蛋白及靶基因的影响并无明显变化。
实施例6:评价obx-mnns在不同时间进入肿瘤的量的变化。
构建小鼠的乳腺癌模型。购买雌性无胸腺裸鼠(六周,20-25g),在裸鼠前腿皮下注射肿瘤瘤块。当肿瘤体积达50mm3时,将200μl10mg/mlobx-mnns溶液通过尾静脉注射的方式注入小鼠体内,利用小动物光声成像系统(visualsonicsvevolazrsystem)及1.5t动物核磁共振成像检测肿瘤区的光声信号和磁信号随时间的变化。实验结果见图7和图8。
如图7所示,在光声成像指导下,肿瘤在obx-mnns注入后24h后有很强的光声信号,同时如图8所示,在核磁共振成像下,obx-mnns注入24h后肿瘤区明显变暗。
实施例7:评价obx-mnns对肿瘤生长的抑制效果
构建小鼠的乳腺癌模型。购买雌性无胸腺裸鼠(六周,20-25g),在裸鼠前腿皮下注射肿瘤瘤块。荷瘤小鼠随机分为五组:(1)空白组(对照);(2)mnns+激光组;(3)游离obx组;(4)obx-mnns组;(5)obp-mnns+激光组。每隔一天用游标卡尺测量肿瘤体积,并按照公式v=ab2/2计算肿瘤体积,其中a是肿瘤的长径,b是肿瘤的短径(mm)。每次测量结果均通过处理前的起始肿瘤体积归一化,并且观察每组老鼠的生存周期。实验结果见图7。
图9中(a)表示不同治疗组肿瘤体积随时间的变化情况,如图9所示,obp-mnns+激光组能够显著抑制肿瘤的生长,且效果显著优于obx-mnns组、游离obx组、mnns以及空白组;(b)表示不同治疗组老鼠的生存周期随时间的变化情况,如图7所示,obp-mnns+激光组显著提高老鼠的生存周期,且效果显著优于obx-mnns组、游离obx组、mnns以及空白组。
综上所述,本发明所述的纳米诊疗剂可实现肿瘤的诊疗一体化。通过本发明所述制备方法获得的纳米诊疗剂可实现肿瘤的光声成像和核磁共振成像,同时具有肿瘤化疗作用,该纳米药物在肿瘤部位高效蓄积,可以大大降低化疗药物的全身毒副作用。本发明合成方法简单、操作方便,易于实现工业化生产,同时黑色素作为人体生物色素具有极好的生物相容性和生物可降解性,因此在肿瘤的诊断与治疗领域具有良好的应用前景。
应当理解的是,本发明的应用不限于上述的举例,对本领域普通技术人员来说,可以根据上述说明加以改进或变换,所有这些改进和变换都应属于本发明所附权利要求的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种纳米粉体工业生产系统的制作方法
- 一种高红外辐射粉体及其制备方法
- 一种铈锌共掺NiFe<sub>2</sub>O<sub>4</sub>纳米粉体及其制备方法
- 一种纳米Al<sub>2</sub>O<sub>3</sub>/Er<sub>3</sub>Al<sub>5</sub>O<sub>12</sub>/ZrO<sub>2</sub>复合粉体材料的制备方法
- 一种β?氢氧化镍纳米片的制备方法
- 一种硫化亚铜纳米玫瑰花的制备方法
- 一种球形氧化钇粉体的制备方法
- 一种亚微米级碳化硼粉体及其制备方法和用图
- 一种B<sub>4</sub>C纳米片的制备方法及B<sub>4</sub>C纳米片的制作方法
- 氮化铝粉体的制备方法