氮化硼纳米片粉体及其低成本批量制备方法与流程
本发明特别涉及一种氮化硼纳米片粉体及其低成本制备方法,属于无机纳米材料技术领域。
背景技术:
氮化硼纳米片(bnns)具有许多优异的物理化学性质,比如优异的电绝缘性、高的导热系数、宽的直接带隙,以及良好的化学惰性(耐腐蚀、抗高温氧化性能)、良好的生物兼容性,以及大的比表面积,在电子器件、深紫外发光、复合材料、散热材料、摩擦材料、药物负载、催化剂负载等诸多领域都有着广泛的应用前景。
目前,关于bnns的合成方法,有“自上而下法”,即将微米级的bn颗粒逐层剥离,得到bn纳米片。比如液相剥离法、机械剥离法、液相-机械结合剥离、熔融碱剥离、熔融盐剥离等。这些方法成本低,但是生产周期较长、工艺复杂、效率低下,产量不能满足工业需求。同时,也有关于“化学鼓泡”法(adv.mater.2011,23,4072-4076)、置换法(scientificreports,4,(2014):4211)等方法的报道,但其均存在缺陷,例如前者成本高不利于批量生产,后者产率低等。此外,cn103787288b,cn101913576a、cn103043634a、cn103539085a等还公布了一些相对小众的合成方法,这些方法虽然有各自的优势,但同时也存在诸多的不足,例如产物质量差、产量低等。
另外,氮化硼纳米片的合成也有“自下而上”的方法,比如化学气相沉积法(cvd)。cvd法将含有硼和氮元素的气体(比如bf3和nh3)在高温下反应,或者将同时含有硼和氮元素的气体分子(比如b3n3h6)在高温下分解,在具有催化活性的基底表面沉积,得到氮化硼纳米片(或连续的膜)。该方法合成的氮化硼纳米片具有较好的结晶质量和较大的片层尺寸,具有原子级的平整表面,是石墨烯、过渡金属二硫化物等材料的理想衬底材料。在电子器件方面具有广泛的应用前景。因而可见,cvd法制备的bnns在特定领域有其独特的优势,但是由于其依赖于基底,而且产量低、合成工艺复杂,在复合材料、散热材料、摩擦材料、药物负载、催化剂负载等领域的应用尚不具有竞争力。
纵观bnns的生产技术,较高的成本和较低的效率严重制约了进一步的科学研究与实际应用。开发bn纳米片粉体低成本的批量制备技术,具有十分重要的现实意义。
技术实现要素:
针对现有技术的不足,本发明的主要目的在于提供一种氮化硼纳米片粉体的低成本批量制备方法。
为实现前述发明目的,本发明采用的技术方案包括:
本发明实施例提供了一种氮化硼纳米片粉体的低成本批量制备方法,其包括:将固态硼源在含氮反应气氛中加热至1000~1500℃并保温反应,之后在保护性气氛中降温至室温,获得粗产物,再对所述粗产物进行后处理,获得氮化硼纳米片粉体;所述硼源选自硼酸盐,所述硼源选自含有锂、铍、镁、钙、锶、钡、铝、镓、铟、锌、钛中至少一种元素的硼酸盐。
本发明实施例还提供了由所述方法制备的氮化硼纳米片粉体,所述氮化硼纳米片粉体为纯度在99%以上的六方氮化硼纳米片,所述六方氮化硼纳米片的厚度为1~20原子层,径向尺寸为1~20μm。
与现有技术相比,本发明的优点包括:
1.本发明提供的氮化硼纳米片粉体低成本批量制备方法,采用固态金属硼酸盐为原料,其中金属硼酸盐可由相应的金属氧化物(或氢氧化物、金属的盐类等)和硼酸、氧化硼等反应得到,而且这些原产物非常廉价易得,其次硼酸盐氮化合成bnns的工艺一步完成,工序简单,成本低廉,是目前公开的所有方法中最具有成本优势的方案。
2.本发明提供的氮化硼纳米片粉体低成本批量制备方法,原料反应效率高达85%,提纯后产物纯度高达99%。
3.本发明提供的氮化硼纳米片粉体低成本批量制备方法,单批次反应可制备克级以上的氮化硼纳米片粉体,能实现批量生产。
4.本发明提供的氮化硼纳米片粉体低成本批量制备方法,酸洗产物可以通过结晶提纯得到相应的氯化物副产品,并可以进一步作为原材料合成硼酸盐前躯体,实现循环利用,是一种绿色环保的方法。
附图说明
图1为本实施例1中所得bn纳米片粉体的实物照片;
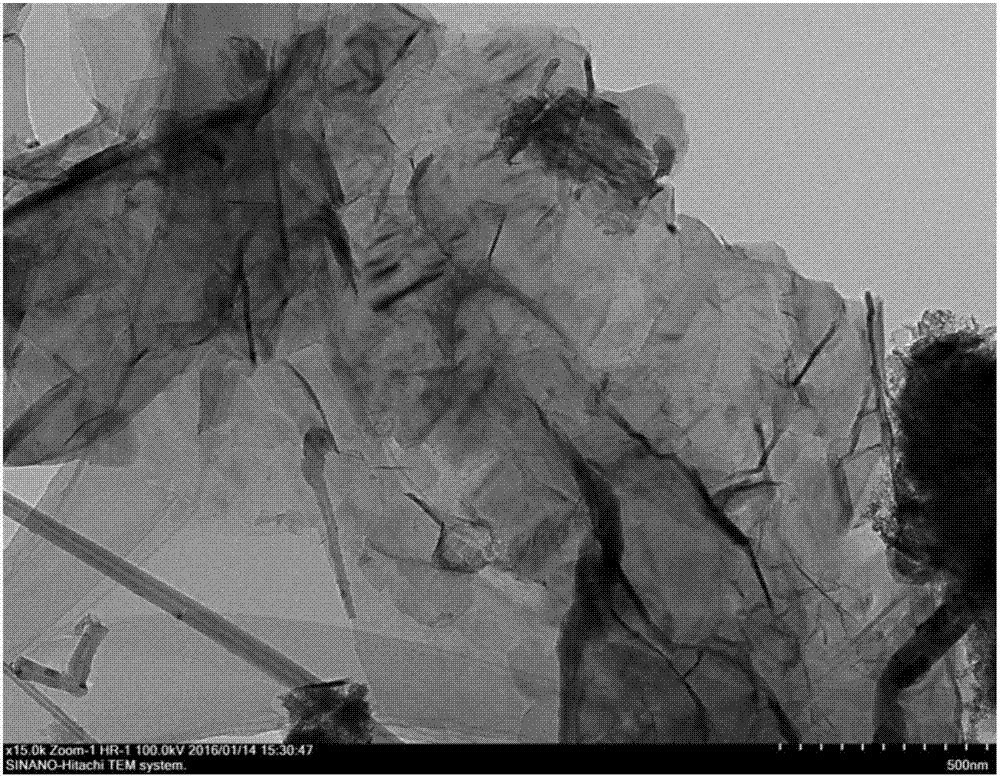
图2为本实施例1中所得bnns粉体的tem形貌图片;
图3为本实施例2中所得bn纳米片的sem图;
图4为本实施例2中所得的bnns的xrd图;
图5为本实施例2中所得产物的tem图;
图6为本实施例3中获得的bnns的拉曼图谱;
图7为本实施例4中获得的bnns的tem图。
具体实施方式
鉴于现有技术中的不足,本案发明人经长期研究和大量实践,非常意外的发现,当采用含有锂、铍、镁、钙、锶、钡、铝、镓、铟、锌、钛中的至少一种元素的硼酸盐在高温条件下与氨气、氮气等氮源反应时,可以高产率的获得高质量的二维氮化硼纳米片。基于此意外发现,本案发明人得以提出本发明的技术方案,其主要涉及一种低成本批量制备氮化硼纳米片粉体的方法,如下将予以详细解释说明。
本发明实施例的一个方面提供的一种氮化硼纳米片粉体的低成本批量制备方法包括:将硼源在含氮反应气氛中加热至1000~1500℃并保温反应,之后在保护性气氛中降温至室温,获得粗产物,再对所述粗产物进行后处理,获得氮化硼纳米片粉体;所述硼源选自含金属元素的硼酸盐。
进一步的,所述硼源可选自含有锂、铍、镁、钙、锶、钡、铝、镓、铟、锌、钛中的至少一种元素的硼酸盐。例如,所述硼源可以优选自硼酸钙(cab4o7、ca2b2o5、ca3b2o6)、硼酸镁(mgb4o7、mgb2o5、mg3b2o6)、硼酸锂(li2b4o7)以及铝、锌等金属的硼酸盐,或其之间的混合物,并且这些硼盐的几乎所有晶型在本发明中都是适用的。
较为优选的,所述低成本批量制备方法包括:将硼源在反应气氛中加热至高于1250℃而小于或等于1500℃的温度且保温反应。
进一步优选的,所述低成本批量制备方法包括:将硼源在反应气氛中加热至高于1250℃而小于或等于1500℃且保温反应0.5h以上,例如0.5h~5h。
进一步的,所述含氮反应气氛可优选自氨气气氛、氮气气氛或者氨气及氮气中的至少一种与氩气形成的混合气氛,但不限于此。
进一步的,所述保护性气氛可优选自氮气气氛、氩气气氛或者氮气-氩气混合气氛,但不限于此。
在一些实施方案中,所述后处理包括:将所述粗产物以酸溶液洗涤、过滤,再在60~80℃干燥1~12h,获得所述氮化硼纳米片。
其中,所述的粗产物为氮化硼纳米片与相应的金属氧化物的复合、混合体,其中氧化物为副产物,可以用酸洗掉。
例如,所述酸溶液的浓度可以选用任意合适浓度的,例如优选大于0.1mol/l,其中所含的酸能与所述粗产物中的副产物反应形成可溶性物质。
在一些实施方案中,所述后处理还包括:配合机械方法,以酸溶液对所述粗产物进行充分洗涤;所述机械方法包括搅拌或球磨。该洗涤过程配合机械方法,可使洗涤彻底。
在一些实施方案中,所述低成本批量制备方法还包括:在所述的后处理中,收集所述粗产物中的副产物与洗涤用酸溶液反应形成的可溶性副产物,并用于合成所述硼源。例如,副产物mgo经酸洗后形成相应的盐溶液(mgcl2、mg(no3)2、mgso4等溶液),经过提取结晶,可以当做原料再次用来合成硼酸镁,是一种绿色环保的合成方法。
本发明实施例的一个方面提供了由前述任一种方法制备的氮化硼纳米片粉体,所述氮化硼纳米片粉体为纯度在99%以上的六方氮化硼纳米片,所述六方氮化硼纳米片的厚度为1~20原子层,径向尺寸为1~20μm。
在本发明的一典型实施案例中,一种氮化硼纳米片粉体的低成本批量制备方法包括以下步骤:
(1)将硼源在含有氨气的气氛中加热至1000~1500℃(优选为高于1250℃而小于或等于1500℃),保温0.5~5h,在氮气或氩气的保护下降温至室温,得到白色粗产物。
(2)将步骤(1)所获的粗产物提纯、过滤、干燥,可得纯度在99%以上的氮化硼纳米片粉体。
藉由前述的方法,根据前驱物的量和设备体积,单批次的产量可达克级以上。在较优合成条件下,净产率(以硼当量计算)高达85%。
在一更为具体的方案中,所述制备方法涉及以下化学反应(以三种成分的硼酸镁在氨气中反应为例):
mgb4o7+4nh3→4bn+mgo+6h2o
mg2b2o5+2nh3→2bn+2mgo+3h2o。
mg3b2o6+2nh3→2bn+3mgo+3h2o
优选地,步骤(1)包括:将硼源在含有氨气的气氛中加热至1000~1500℃并保温0.5~4h,在氮气或氩气的保护下降温至室温,得到白色粗产物。例如,其中一种反应的方程式为:li2b4o7+4nh3→4bn+li2o+6h2o。
步骤(2)中所述的提纯优选为:用水洗3~5遍。经过水洗、过滤等操作,可以高效去除反应副产物,得到高纯度的bn纳米片。
步骤(2)中所述的干燥优选为:在60~80℃下干燥6~12h。
通过上述方法制备得到的一种六方氮化硼二维超薄纳米片(六方氮化硼纳米片)的厚度为1~20原子层,大小为1~20μm,宏观上呈粉体形态。
上述六方氮化硼二维超薄纳米片可应用于深紫外发光、复合材料、散热材料、摩擦材料、药物负载、催化剂载体等诸多领域。
以下结合若干实施例对本发明的技术方案进行详细说明。
实施例1取cab4o72g盛于敞口氧化铝坩埚中,然后置入管式炉中,抽真空至10-3pa,通入200标准毫升/分钟(sccm)的nh3,升温到1250℃。在1250℃恒温反应180min后关闭nh3,通入200sccm的n2,在n2气氛中降温至室温,取出,得到粗产物。然后将所得产物采用超声水洗5h,再过滤、干燥,可得纯度在99%以上的氮化硼纳米片粉体。本实施例可以获得95%的目标产物产率。图1为本实施例制备所得bn纳米片粗产物的实物照片。图2为本实施例所得bnns粉体的tem形貌图,可见其尺寸在微米级别。
实施例2取mg2b2o52g置于敞口氧化铝坩埚中,然后放入管式炉中。通入1000标准毫升/分钟(sccm)的ar排除炉管内的空气。然后再200sccmar和200sccmnh3中升温到1300℃。在1300℃恒温反应4h后关闭nh3,通入500sccm的ar降温至室温,取出坩埚得到粗产物。然后将所得产物采用3mol/l硝酸,超声酸洗1h,再过滤、干燥,可得纯度在99%以上的氮化硼纳米片粉体。本实施例可以获得85%的目标产物产率。图3为本实施例所得bn纳米片的sem图,可以观察到鳞片状的bn纳米片。图4为本实施例获得的bnns的xrd图,证实所得产物为单一物相的六方bn。图5为本实施例获得产物的tem图,证实产物为纳米片,片层尺寸在微米尺度。
实施例3取al4b2o9置于敞口氧化铝坩埚中,然后放入管式炉中,抽真空到10-3pa。然后在300sccmnh3中升温到1500℃。在1500℃恒温反应120min后关闭nh3,通入200sccm的ar降温至室温,取出坩埚得到粗产物。然后将所得产物采用3mol/l硝酸,超声酸洗5h,再过滤、干燥,可得纯度在99%以上的氮化硼纳米片粉体。本实施例可以获得95%的目标产物产率。图6为本实施例获得的bnns的拉曼图谱,由1367.9cm-1的峰可以判定为六方结构bn。
实施例4取znb4o7若干置于敞口的氮化硼坩埚中,然后放入管式炉中,抽真空到10-3pa。然后在300sccmnh3中升温到1300℃。在1300℃恒温反应2h后关闭nh3,通入200sccm的ar降温至室温,取出坩埚得到粗产物。然后将所得产物采用超声水洗2h,再过滤、干燥,可得纯度在99%以上的氮化硼纳米片粉体。本实施例可以获得80%的目标产物产率。图7为本实施例获得的bnns的tem图,由图可见其纳米片的厚度约为15个原子层。
实施例5取lioh和b2o3若干,以1:1的比例混合,置于敞口的氮化硼坩埚中,然后放入管式炉中,抽真空到10-3pa。然后在300sccmar中升温到800℃保温1h使得反应生成硼酸锂li2b4o7。然后再升温到1300℃,关闭ar打开nh3,在1300℃恒温反应3h后关闭nh3,通入200sccm的ar降温至室温,取出坩埚得到粗产物。然后将所得产物采用机械搅拌的方式进行水洗5h,再过滤、干燥,可得纯度在99%以上的氮化硼纳米片粉体。本实施例可以获得80%的目标产物产率。
实施例6取mgo和b2o3若干,以2:1的比例混合,置于敞口的氮化硼坩埚中,然后放入管式炉中,抽真空到10-3pa。然后在300sccmar中升温到1000℃保温3h,使得反应生成硼酸镁。然后再升温到1400℃,关闭ar打开nh3,在1400℃恒温反应3h后关闭nh3,通入200sccm的ar降温至室温,取出坩埚得到粗产物。然后将所得产物采用机械搅拌的方式进行水洗5h,再过滤、干燥,可得纯度在99%以上的氮化硼纳米片粉体。本实施例可以获得85%的目标产物产率。
实施例7取al(oh)3和h3bo3若干,以9:2的比例混合,置于敞口的氮化硼坩埚中,然后放入管式炉中,抽真空到10-3pa。然后在300sccmar中升温到1000℃保温3h,使得反应生成硼酸铝。然后再升温到1500℃,关闭ar打开nh3,在1500℃恒温反应3h后关闭nh3,通入200sccm的ar降温至室温,取出坩埚得到粗产物。然后将所得产物采用机械搅拌的方式进行水洗5h,再过滤、干燥,可得纯度在99%以上的氮化硼纳米片粉体。本实施例可以获得90%的目标产物产率。
需要说明的是,上述实施例中仅从发明的核心内容作以举例说明。尤其应当注意的是,本方法的核心是以硼酸盐作为前驱物,而在实际的生产中,硼酸盐作为反应物的本质可能隐匿在某些反应过程中不容易被认识到。比如,实施例5中,以氧化硼(b2o3)、氢氧化锂(lioh)为前驱物制备氮化硼为例,在加热过程中实际发生了两个化学反应:一是lioh和b2o3生成硼酸锂(li2b4o7、li3bo3、libo2等),二是硼酸锂(li2b4o7、li3bo3、libo2等)与氨气反应。其本质仍然是硼酸锂作为有效成分参与反应,只是该化学本质在一步操作过程中被隐藏。实施例6、7同理。应当理解,只要有前述的任一种硼酸盐生成并参与了bnns合成反应的,都在本发明专利的涵盖范围之内。
说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!