一种层状双金属氢氧化物的制备方法及其制备的产品与流程
本发明涉及功能材料制备技术领域,特别是涉及一种层状双金属氢氧化物的制备方法及其制备的产品。
背景技术:
层状双金属氢氧化物(layereddoublehydroxide,ldh),是由层间阴离子及带正电荷层板堆积而成的层状化合物。由于其独特的结构特点,ldh的层间阴离子具有可交换性,可以与各种无机阴离子、有机阴离子、杂多酸离子等进行交换。利用ldh的这一性质可以制备不同阴离子插层的ldh,从而得到具有不同功能的新材料。并且通过调节ldh层板上mⅱ(二价金属离子)与mⅲ(三价金属离子)的比例,可以调节层板上电荷密度,进而控制层间客体阴离子的数量。ldh经焙烧后所得的复合金属氧化物具有更大的比表面积、更强的碱性,并且还具有“记忆效应”,在重新吸收各种阴离子后或者置于空气中可恢复原来的层状结构。由于ldh独特的特性,使其在磁学、光学、药物传输、生物传感器、催化和吸附等方面的应用研究一直以来受到广泛关注。
ldh的传统制备方法主要有共沉淀法、均匀沉淀法、水热法、离子交换法、焙烧重构法等。这些方法制得的ldh尽管具有较高的结晶度和较大的晶粒尺寸,但是排列较为杂乱无章,限制了其在催化、药物传输领域的应用。
技术实现要素:
本发明实施例的目的在于提供一种层状双金属氢氧化物的制备方法及其制备的产品,以实现所制备出排列更为规整的层状双金属氢氧化物。具体技术方案如下:
本发明首先提供了一种层状双金属氢氧化物的制备方法,包括:
将三价金属氢氧化物和二价金属盐与ph值在9-10之间的缓冲溶液混合,得到反应混合物;
将所得的反应混合物在100-300℃的温度下反应10小时以上,反应结束后,分离、洗涤,得到层状双金属氢氧化物。
其中,所述三价金属氢氧化物选自al(oh)3、cr(oh)3、fe(oh)3、v(oh)3、co(oh)3、la(oh)3及ti(oh)3中的至少一种,优选为一种或两种,更优选为一种。
其中,所述二价金属盐选自mg2+、ca2+、sr2+、ba2+、zn2+、ni2+、fe2+、cu2+、co2+、mn2+的硫酸盐、硝酸盐、碳酸盐或氯化物中的至少一种,优选为一种或两种,更优选为一种。
其中,缓冲溶液选自nh3·h2o-nh4cl缓冲溶液、nahco3-na2co3缓冲溶液、na2b4o7-hcl缓冲溶液、甘氨酸-氢氧化钠缓冲液中的至少一种。
其中,在将反应混合物升温反应之前,还向其中加入强碱,所述强碱为氢氧化钠和/或氢氧化钾。
其中,反应温度为140-200℃。
其中,反应时间为12-24小时。
其中,二价金属盐相对于三价金属氢氧化物化学计量过量;优选地,二价金属盐和三价金属氢氧化物的摩尔比为(2.5-5):1。
其中,所述强碱与二价金属盐的摩尔比为(1-3):1。
本发明还提供了由前述的方法制备的层状双金属氢氧化物。
本发明以三价金属氢氧化物为前驱体,在弱碱性缓存溶液中制备层状双金属氢氧化物,所得到的层状双金属氢氧化物能够保持前驱体三价金属氢氧化物的基本形貌,且边缘整齐,排列规整。这种微观结构的改进扩大了其在催化、药物传输领域的应用。并且,本方法工艺流程较为简单,适合层状双金属氢氧化物的大规模生产。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为实施例2-6制备的mgal-ldh的xrd图,其中(a)为实施例2在140℃条件下水热反应的xrd图;(b)为实施例3在160℃条件下水热反应的xrd图;(c)为实施例4在170℃条件下水热反应的xrd图;(d)为实施例5在180℃条件下水热反应的xrd图;(e)为实施例6在200℃条件下水热反应的xrd图。
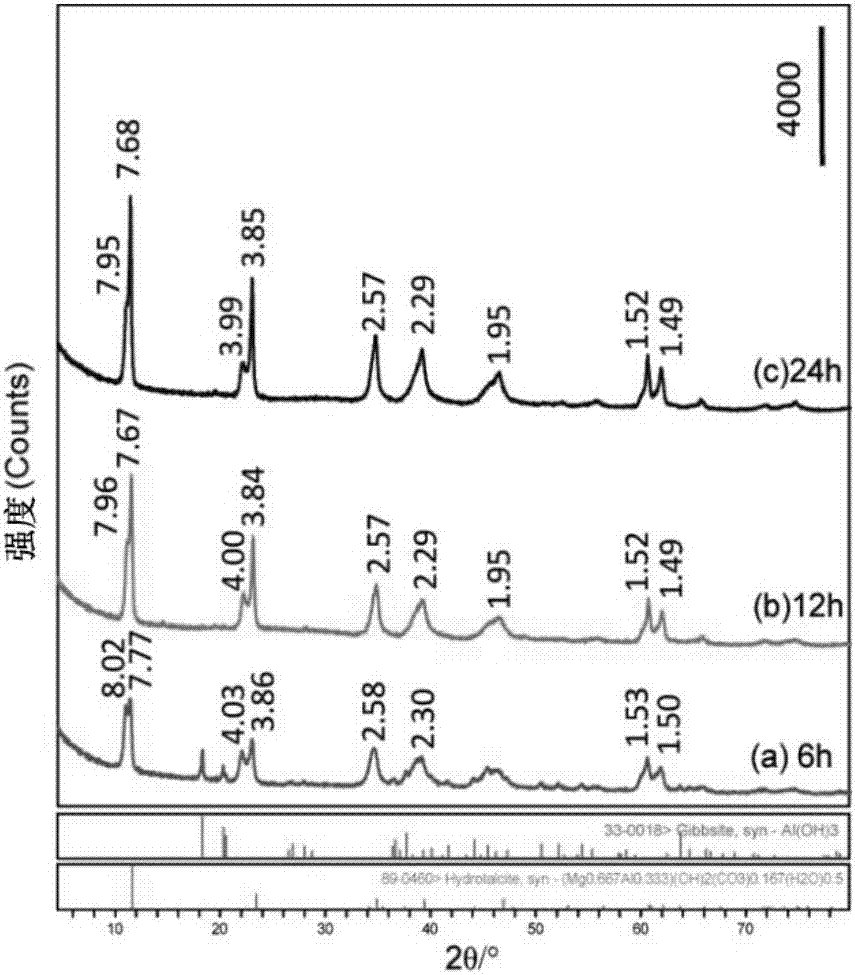
图2为实施例5、7、9制备的mgal-ldh的xrd图,其中(a)为实施例7水热反应6小时的xrd图;(b)为实施例8水热反应12小时的xrd图;(c)为实施例5水热反应24小时的xrd图。
图3为实施例5制备的mgal-ldh、原料al(oh)3及对比例制备的mgal-ldh进行表征测得的sem图;其中,a、b、c是原料al(oh)3的sem图;d、e、f是实施例5制备的mgal-ldh的sem图,g、h、i图是对比例采用传统的共沉淀法得到的mgal-ldh的sem图。
具体实施方式
本发明提供了一种层状双金属氢氧化物的制备方法,包括:
将三价金属氢氧化物和二价金属盐与ph值在9-10之间的缓冲溶液混合,得到反应混合物;
将所得的反应混合物在100-300℃的温度下反应10小时以上,反应结束后,分离、洗涤,得到层状双金属氢氧化物。
在一种具体实施方案中,所述三价金属氢氧化物选自al(oh)3、cr(oh)3、fe(oh)3、v(oh)3、co(oh)3、la(oh)3及ti(oh)3中的至少一种,优选为一种或两种,更优选为一种。在一种具体实施方案中,所述二价金属盐溶于缓冲溶液,且选自mg2+、ca2+、sr2+、ba2+、zn2+、ni2+、fe2+、cu2+、co2+、mn2+的硫酸盐、硝酸盐、碳酸盐或氯化物中的至少一种,优选为一种或两种,更优选为一种。在一种具体实施方案中,反应温度优选为140-200℃。在一种具体实施方案中,反应时间为12-24小时。
需要说明的是,层状双金属氢氧化物及其结构在现有技术中已多有报道,其中最典型的层状双金属氢氧化物包含一种三价金属离子及一种二价金属离子,但随着技术的不断发展,在一种层状双金属氢氧化物中包含两种或两种以下的二价金属离子,和或包含两种或两种以上的三价金属离子的技术也已有报道。而本发明所提供的层状双金属氢氧化物的制备方法,其可以制备经典的包含一种三价金属离子及一种二价金属离子层状双金属氢氧化物,例如镁铝层状双金属氢氧化物(简称mgal-ldh)、锌铝层状双金属氢氧化物(简称znal-ldh)、钴铝层状双金属氢氧化物(简称coal-ldh)、镍铝层状双金属氢氧化物(简称nial-ldh)、镍铁层状双金属氢氧化物(nife-ldh);其也可以通采用两种或两种以上的三价金属氢氧化物和/或两种或两种以上的二价金属盐来制备包含两种或两种以上的二价金属离子,和或包含两种或两种以上的三价金属离子的层状双金属氢氧化物。例如锌铝镁三元水滑石(简称znalmg-ldh)、镍钴铁三元水滑石(简称nicofe-ldh)。
在一种具体实施方案中,缓冲溶液选自nh3·h2o-nh4cl缓冲溶液、nahco3-na2co3缓冲溶液、na2b4o7-hcl缓冲溶液、甘氨酸-氢氧化钠缓冲液中的至少一种。发明人发现,在反应过程中采用缓冲溶液,可以很好的控制了反应过程的ph值,使ph值一直稳定在9.0~10.0之间,不仅给层状双金属氢氧化物的形成提供了适宜的酸碱度,同时还避免了al(oh)3在强碱性环境下的溶解,为二价金属离子插入三价金属氢氧化物层板提供了保证。需要说明的是,上述缓冲溶液的配制方法均为现有技术,本领域技术人员可以根据本发明所限定的ph值在9-10之间,根据现有技术来获得相应的缓冲溶液。
在一种具体实施方案中,在制备层状双金属氢氧化物时,让二价金属盐相对于三价金属氢氧化物化学计量过量。
例如当制备mgal-ldh时,预先设计其反应方程式为:
al(oh)3+2mg2++3ohˉ=[mg2al(oh)6]+
根据该反应方程式,二价金属盐与三价金属氢氧化物的化学计量比为2:1;在实际反应时,优选至少按过量30%,即按2.6:1的比例,或者更大,例如3:1的比例加入二价金属盐。对于不同的二价金属盐与三价金属氢氧化物来说,过量的具体值可能有所差异,一般地,二价金属盐和三价金属氢氧化物的摩尔比为(2.5-5):1。发明人发现,反应过程中适当过量的二价金属盐,不仅加快了反应速率,同时还避免了高温情况下al(oh)3脱水形成alo(oh)。
在一种具体实施方式中,将三价金属氢氧化物和二价金属盐与ph值在9-10之间的缓冲溶液混合均匀后,还向其中加入强碱,所述强碱为氢氧化钠和/或氢氧化钾。优选地,所述强碱与二价金属盐的摩尔比为(1-3):1。发明人发现,强碱的加入,不仅可以为层状双金属氢氧化物的构建引入ohˉ,还可以加快反应速率。
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
制备实施例
实施例1
配制缓冲溶液
称量14.0gnh4cl,加入9.6mlnh3·h2o,用去离子水稀释至200ml,磁力搅拌均匀,得到nh3·h2o-nh4cl缓冲溶液,用ph计测量溶液的ph=9.30。
实施例2
制备mgal-ldh
在50ml缓冲溶液中加入0.1950g(2.5mmol)al(oh)3和1.9232g(7.5mmol)mg(no3)2·6h2o,充分搅拌均匀,加入0.4500g(11.25mmol)naoh,搅拌均匀后倒入100ml水热釜中,混合溶液在140℃条件下水热反应24h。反应结束后在室温下冷却,产物离心,用去离子水洗涤5次,然后在70℃烘箱内干燥24h,得到白色固体粉末mgal-ldh。
实施例3
实施例3与实施例2的区别在于混合溶液在160℃条件下水热反应。
实施例4
实施例4与实施例2的区别在于混合溶液在170℃条件下水热反应。
实施例5
实施例5与实施例2的区别在于混合溶液在180℃条件下水热反应。
实施例6
实施例6与实施例2的区别在于混合溶液在200℃条件下水热反应。
实施例7
实施例7与实施例5的区别在于反应时间为6h。
实施例8
实施例7与实施例5的区别在于反应时间为12h。
实施例9
实施例8与实施例2的区别在于naoh的加入量为0.60g(15mmol)。
实施例10
实施例9与实施例2的区别在于naoh的加入量为0.30g(7.5mmol)。
对比例共沉淀法制备的mgal-ldh
在50ml去离子水中加入0.95g(2.5mmol)al(no3)3·9h2o,1.28g(5.0mmol)mg(no3)2·6h2o,1.50g(25mmol)尿素,搅拌均匀后倒入100ml水热釜中,混合溶液在140℃条件下水热反应24h。反应结束后在室温下冷却,产物离心,用去离子水洗涤5次,然后在70℃烘箱内干燥24h,得到白色固体粉末mgal-ldh。
测试与表征
xrd测试
采用荷兰phillips公司生产的x射线粉末衍射仪(型号:xpertprompd)对实施例2-8制备的mgal-ldh进行xrd表征,放射源为cu-kα,测定步长为0.017°,扫描时间为10秒/步。结果如图1(实施例2-6)和图2(实施例5、7、8)所示;
图1是实施例2-6不同温度水热24h后所得产物的xrd衍射图谱,从图中可以观察到,在较低的温度140℃时,al(oh)3就完全转变为mgal-ldh,并且随着反应温度的升高,mgal-ldh的特征衍射峰(2θ=11.5、23.1、34.8、39.2、46.6、60.7、62.0°)强度逐渐增强,且峰形尖锐,说明产物的结晶度良好并且随温度的升高而增高。通常情况下,高温水热条件下al(oh)3会发生脱水反应,生成alo(oh),而采用本发明提供的方法制备mgal-ldh时,即使反应温度提高到200℃,也没有生成alo(oh)的杂相。
图2是实施例5、7、9在180℃条件下水热反应不同时间后所得产物的xrd衍射图谱,从图2中可以观察到,随着反应时间的增长,al(oh)3的特征衍射峰(2θ=18.4、20.4°)强度逐渐降低,mgal-ldh的特征衍射峰(2θ=11.5、23.1、34.8、39.2、46.6、60.7、62.0°)强度逐渐增强,且峰形尖锐,说明产物的结晶度良好。反应12h后,al(oh)3的衍射峰的衍射峰完全消失,al(oh)3完全转化为mgal-ldh。
扫描电子显微镜(sem)测试
采用hitachi公司的扫描电子显微镜(scanningelectronmicroscope,sem,型号:s-4800,加速电压:5kv)对实施例5制备的mgal-ldh、原料al(oh)3及对比例制备的mgal-ldh进行表征测得的sem图,结果如图3所示;
图3中的a、b、c图是原料al(oh)3的sem图,从3张图中可以看到原料al(oh)3是颗粒大小500nm左右的结晶度良好的纳米颗粒,可以观察到边缘清晰的六边形结构。图3中的d、e、f图是实施例5制备的mgal-ldh的sem图,可以观察到明显的层状结构和边缘清晰的六边形片层,颗粒大小在2μm左右。此外在e图中,可以明显看到整齐排列的六边形的边缘结构,这和原料al(oh)3的原始形貌相一致,也证明了我们所制得的mgal-ldh是由al(oh)3层板转换而来,是一个局部规整反应。图3中的g、h、i图是对比例采用传统的共沉淀法得到的mgal-ldh的sem图,图中可以看到六边形片层的堆叠杂乱无章,和由以al(oh)3为原料直接形成的mgal-ldh的形貌有很大不同。
综上所述,与传统共沉淀法制备的ldh相比,本方法得到的产物结晶度较高,晶粒尺寸也较大。其次在形貌方面,本方法得到的mgal-ldh,不仅保持了原料al(oh)3的基本形貌,而且边缘整齐,排列规整。这种局部规整反应扩大了其在催化、药物传输等领域的应用。最后,本方法工艺流程较为简单,适合大规模的生产,而且我们预期这种方法也可以推广到其他层状双金属氢氧化物的制备。
以上对本发明所提供的一种层状双金属氢氧化物的制备方法及其制备的产品进行了详细介绍。本文中应用了具体实施例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其中心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种铁锰复合氧化物除砷材料及其制备和应用方法
- 一种铁铜双金属氧化物的制备装置的制造方法
- 含钾的钛基氧化物K<sub>2</sub>Ti<sub>8</sub>O<sub>17</sub>的制备方法及其产品和应用
- 具有含氮的氧化物薄膜的场效应晶体管器件及其制备方法
- 一种提升金属氧化物纳米材料气敏性能的制备方法
- 一种镁合金表面双羟基金属氧化物封闭膜层的制备方法
- 一种硫氧化物绿色荧光粉及其制备方法
- 钴氧化物、锂钴氧化物、制备它们的方法、和锂二次电池的制作方法
- 一种纳米氧化物Ti<sub>2</sub>Nb<sub>10</sub>O<sub>29</sub>的制备方法
- 一种去除水溶液中环丙沙星CMC稳定化的Fe?Mn氧化物复合材料及其制备方法