吡喃酮和吡啶酮衍生物的制备方法与流程
技术领域
本发明涉及显示帽依赖性内切核酸酶抑制活性的新型抗流感药物的合成中间体即吡喃酮衍生物和吡啶酮衍生物、它们的制备方法、以及它们的使用方法。
背景技术:
流感是由于流感病毒的感染而引起的急性呼吸道感染。在日本,每个冬季有数百万人的类流感患者的报告,流感伴随着高罹患率和死亡率。在婴幼儿、老年人等高风险人群中是特别重要的疾病,老年人中,肺炎并发率高,老年人占了因流感而死亡的人数的大多数。
公知的抗流感药物是:抑制病毒的脱壳过程的盐酸金刚烷胺(Symmetrel,商品名:金刚烷胺(Amantadine))或盐酸金刚乙胺(Flumadine,商品名:金刚乙胺(Rimantadine))、抑制病毒自细胞中出芽·释放的神经氨酸酶抑制剂即奥塞米韦(Oseltamivir,商品名:达菲(Tamiflu))或扎那米韦(Zanamivir,商品名:瑞乐沙(Relenza))。但是,出于对耐药株的出现或副作用的问题、以及病原性或致死性高的新型流感病毒的世界性大流行等的担心,人们希望开发出新型机理的抗流感药物。
来自流感病毒的酶即帽依赖性内切核酸酶是病毒增殖所必须的,且具有宿主所不具有的病毒特异性酶活性,因此适合作为抗流感药物的靶。帽依赖性内切核酸酶的活性是:以宿主mRNA前体为底物、生成包含帽结构的9~13个碱基(帽结构的碱基不包含在该数目中)的片段。该片段发挥病毒RNA聚合酶的引物的功能,用于编码病毒蛋白的mRNA的合成。即,可以认为抑制帽依赖性内切核酸酶的物质是通过抑制病毒mRNA的合成来抑制病毒蛋白的合成,结果抑制病毒增殖。
已报道的抑制帽依赖性内切核酸酶的物质有:氟他胺(flutimide,专利文献1以及非专利文献1和2)或4-取代2,4-二氧代丁酸(非专利文献3~5)等,但尚未在临床上作为抗流感药物使用。专利文献2~11和非专利文献6中记载了与显示帽依赖性内切核酸酶抑制活性的新型抗流感药物具有类似结构的化合物以及它们的制法。另外,非专利文献7~9中公开了吡喃酮衍生物和吡啶酮衍生物。
现有技术文献
专利文献
专利文献1:GB第2280435号说明书
专利文献2:国际公开第2007/049675号小册子
专利文献3:国际公开第2006/088173号小册子
专利文献4:国际公开第2006/066414号小册子
专利文献5:国际公开第2005/092099号小册子
专利文献6:国际公开第2005/087766号小册子
专利文献7:国际公开第2005/016927号小册子
专利文献8:国际公开第2004/024078号小册子
专利文献9:国际公开第2006/116764号小册子
专利文献10:国际公开第2006/030807号小册子
专利文献11:日本国特许公开公报2006-342115号
非专利文献
非专利文献1:Tetrahedron Lett 1995,36(12),2005
非专利文献2:Tetrahedron Lett 1995,36(12),2009
非专利文献3:Antimicrobial Agents And Chemotherapy,Dec.1994,2827-2837页
非专利文献4:Antimicrobial Agents And Chemotherapy,May 1996,1304-1307页
非专利文献5:J.Med.Chem.2003,46,1153-1164
非专利文献6:Bioorganic&Medicinal Chemistry Letters 17(2007)5595-5599
非专利文献7:Journal of Organic Chemistry 1960,25,1052-1053页
非专利文献8:Tetrahedron Lett 1981,22(23),2207
非专利文献9:Journal of Organic Chemistry 1991,56,4963-4967页
技术实现要素:
发明所要解决的课题
本发明的目的在于提供新型的抗流感药物的合成中间体即新型的吡喃酮衍生物和吡啶酮衍生物、它们的制备方法、以及它们的使用方法。具体来说,可高效率地制备可用作抗流感药物的式(I)、式(II)或式(III)所例示的化合物等:
[化学式1]
(式中,R1为羟基、任选被取代基组E取代的低级烷基氧基、任选被取代基组E取代的碳环低级烷基氧基、任选被取代基组E取代的杂环低级烷基氧基、任选被取代基组E取代的碳环低级烷基氨基、或任选被取代基组E取代的杂环低级烷基氨基,
Z为CR12R13、或单键,
Y为CH2、氧原子、或N-R14,
R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13和R14各自独立,为氢、任选被取代基组E取代的低级烷基、任选被取代基组E取代的低级链烯基、任选被取代基组E取代的低级炔基、任选被取代基组E取代的碳环低级烷基、或任选被取代基组E取代的杂环低级烷基,
R3和R5可以一起形成4~8元的任选被取代基组E取代的碳环式基、或任选被取代基组E取代的杂环式基,或者R7和R5可以一起形成4~8元的任选被取代基组E取代的杂环式基,
这里,Z为单键时,R14和R10可以一起形成4~8元的任选被取代基组E取代的杂环式基;
取代基组E:卤素、氰基、羟基、羧基、甲酰基、氨基、氧代基、硝基、低级烷基、卤代低级烷基、低级烷基氧基、任选被取代基组F取代的碳环式基、任选被取代基组F取代的杂环式基、任选被取代基组F取代的碳环低级烷基氧基、任选被取代基组F取代的杂环低级烷基氧基、任选被取代基组F取代的碳环低级烷硫基、任选被取代基组F取代的杂环低级烷硫基、任选被取代基组F取代的碳环低级烷基氨基、任选被取代基组F取代的杂环低级烷基氨基、任选被取代基组F取代的碳环氧基、任选被取代基组F取代的杂环氧基、任选被取代基组F取代的碳环羰基、任选被取代基组F取代的杂环羰基、任选被取代基组F取代的碳环氨基羰基、任选被取代基组F取代的杂环氨基羰基、卤代低级烷基氧基、低级烷基氧基低级烷基、低级烷基氧基低级烷基氧基、低级烷基羰基、低级烷基氧基羰基、低级烷基氧基羰基氨基、低级烷基氨基、低级烷基羰基氨基、低级烷基氨基羰基、低级烷基磺酰基、和低级烷基磺酰基氨基;
取代基组F:卤素、羟基、羧基、氨基、氧代基、硝基、低级烷基、卤代低级烷基、低级烷基氧基、和氨基保护基)。
解决课题的手段
本发明提供以下的项目。
(项目1)
式(X4)表示的化合物或其盐的制备方法,该方法包含以下步骤:
(步骤B)
使式(X2)表示的化合物与式(V2)表示的化合物反应,得到式(X3)表示的化合物的步骤:
[化学式2]
(式中,R1d为氢、卤素、任选被取代基组E取代的低级烷基氧基、任选被取代基组E取代的碳环低级烷基氧基、任选被取代基组E取代的杂环低级烷基氧基或、-OSi(R1e)3,
R1e各自独立,为任选被取代基组E取代的低级烷基、任选被取代基组E取代的碳环式基、任选被取代基组E取代的杂环式基、任选被取代基组E取代的碳环低级烷基、或任选被取代基组E取代的杂环低级烷基,
R2d为氢、任选被取代基组E取代的低级烷基、任选被取代基组E取代的碳环低级烷基、或任选被取代基组E取代的杂环低级烷基,
R3d为氢、任选被取代基组E取代的低级烷基、-N(R3e)2、或-OR3e,
R3e各自独立,为任选被取代基组E取代的低级烷基、还可以一起形成杂环式基,以及
波浪线表示E构型和/或Z构型或它们的混合物;
取代基组E:卤素、氰基、羟基、羧基、甲酰基、氨基、氧代基、硝基、低级烷基、卤代低级烷基、低级烷基氧基、任选被取代基组F取代的碳环式基、任选被取代基组F取代的杂环式基、任选被取代基组F取代的碳环低级烷基氧基、任选被取代基组F取代的杂环低级烷基氧基、任选被取代基组F取代的碳环低级烷硫基、任选被取代基组F取代的杂环低级烷硫基、任选被取代基组F取代的碳环低级烷基氨基、任选被取代基组F取代的杂环低级烷基氨基、任选被取代基组F取代的碳环氧基、任选被取代基组F取代的杂环氧基、任选被取代基组F取代的碳环羰基、任选被取代基组F取代的杂环羰基、任选被取代基组F取代的碳环氨基羰基、任选被取代基组F取代的杂环氨基羰基、卤代低级烷基氧基、低级烷基氧基低级烷基、低级烷基氧基低级烷基氧基、低级烷基羰基、低级烷基氧基羰基、低级烷基氧基羰基氨基、低级烷基氨基、低级烷基羰基氨基、低级烷基氨基羰基、低级烷基磺酰基、和低级烷基磺酰基氨基;
取代基组F:卤素、羟基、羧基、氨基、氧代基、硝基、低级烷基、卤代低级烷基、低级烷基氧基、和氨基保护基)
[化学式3]
(式中,R4d为任选被取代基组E取代的低级烷基、任选被取代基组E取代的碳环低级烷基、或任选被取代基组E取代的杂环低级烷基,
R5d为氢、卤素、任选被取代基组E取代的低级烷基氧基、或-O-SO2-R5e,
R5e为任选被取代基组E取代的低级烷基、任选被取代基组E取代的碳环式基、或任选被取代基组E取代的杂环式基、任选被取代基组E取代的碳环低级烷基、或任选被取代基组E取代的杂环低级烷基,取代基组E与上述相同含义)
[化学式4]
(式中,各符号与上述相同含义);
(步骤C)
使式(X3)表示的化合物与式(V3)表示的化合物反应,得到式(X4)表示的化合物的步骤:
[化学式5]
H2N-R6d
(V3)
(式中,R6d为任选被取代基组E取代的低级烷基、任选被取代基组E取代的低级链烯基、取代基E任选被取代的氨基、取代基E任选被取代的低级烷基氨基、任选被取代基组E取代的碳环式基、或任选被取代基组E取代的杂环式基,取代基组E与上述相同含义)
[化学式6]
(式中,各符号与上述相同含义)。
(项目2)
项目1的制备方法,其特征在于:将步骤B和步骤C连续进行。
(项目3)
式(XA4)表示的化合物或其盐的制备方法:
[化学式10]
(式中,Ra为氢、羟基、任选被取代基组E取代的低级烷基氨基、任选被取代基组E取代的低级链烯基氨基、任选被取代基组E取代的低级炔基氨基、任选被取代基组E取代的碳环低级烷基氨基、或任选被取代基组E取代的杂环低级烷基氨基,各符号与上述相同含义),
该方法包含以下步骤:
使式(X2)表示的化合物与式(VA2)表示的化合物反应的步骤:
[化学式7]
(式中,各符号与上述相同含义);
[化学式8]
(式中,R4e各自独立,为氢、任选被取代基组E取代的低级烷基、任选被取代基组E取代的碳环式基、或任选被取代基组E取代的杂环式基,R5d和取代基组E与上述相同含义);以及
使式(V3)表示的化合物反应的步骤:
[化学式9]
H2N-R6d
(V3)
(式中,R6d与上述相同含义)。
(项目4)
式(X3)或式(XA3)表示的化合物或其盐的制备方法:
[化学式13]
(式中,各符号与项目1相同含义),
其特征在于:使式(X2)表示的化合物与式(V2)或式(VA2)表示的化合物反应,
[化学式11]
(式中,各符号与项目1相同含义);
[化学式12]
(式中,各符号与项目1相同含义)。
(项目5)
式(X4)或式(XA4)表示的化合物或其盐的制备方法:
[化学式16]
(式中,各符号与项目1和项目3相同含义),
该方法包含以下步骤:使式(X3)或式(XA3)表示的化合物、或者式(XA3)的衍生物与式(V3)表示的化合物反应,
[化学式14]
(式中,各符号与项目1相同含义);
[化学式15]
H2N-R6d
(V3)
(式中,符号与项目1相同含义)。
(项目6)
式(X4’)或式(XA4’)表示的化合物或其盐的制备方法:
[化学式20]
(式中,各符号与项目1相同含义),
其特征在于:使式(X2)表示的化合物与式(V2)或式(VA2)表示的化合物、以及式(V2’)表示的化合物反应,
[化学式17]
(式中,各符号与项目1相同含义);
[化学式18]
(式中,各符号与项目1相同含义);
[化学式19]
NH4+Xd- (V2′)
(式中,Xd-为铵阳离子的抗衡阴离子)。
(项目7)
式(X4)或式(XA4)表示的化合物或其盐的制备方法:
[化学式23]
(式中,各符号与项目1或项目3相同含义),
该方法包含以下步骤:使由项目6所述的制备方法得到的式(X4’)或式(XA4’)表示的化合物、或者式(XA4’)的衍生物与式(V3’)表示的化合物反应,
[化学式21]
(式中,各符号与项目1相同含义);
[化学式22]
R6d——Ld (V3′)
(式中,R6d与项目1相同含义,Ld为离去基团,以及Ph表示苯基)。
(项目8)
项目1、2、3、4或6所述的制备方法,其中,式(X2)表示的化合物是通过使式(X1)表示的化合物与式(V1)表示的化合物反应而得到的化合物,
[化学式24]
(式中,各符号与项目1相同含义);
[化学式25]
(式中,Pd为任选被取代基组E取代的低级烷基,R3d和取代基组E与项目1相同含义)。
(项目9)
项目1、2、3、4或6所述的制备方法,其中,式(X2)表示的化合物是通过使式(Z1)表示的化合物与式(Z2)表示的化合物反应而得到的化合物,
[化学式26]
(式中,各符号与项目1相同含义);
[化学式27]
(式中,各符号与项目1相同含义)。
(项目10)
式(X3)表示的化合物或其制药上可接受的盐或它们的溶剂合物:
[化学式28]
(式中,各符号与项目1相同含义)。
(项目11)
式(X4)表示的化合物或其制药上可接受的盐或它们的溶剂合物:
[化学式29]
(式中,各符号与项目1相同含义)。
(项目12)
式(X4’)表示的化合物或其制药上可接受的盐或它们的溶剂合物:
[化学式30]
(式中,各符号与项目1相同含义)。
(项目13)
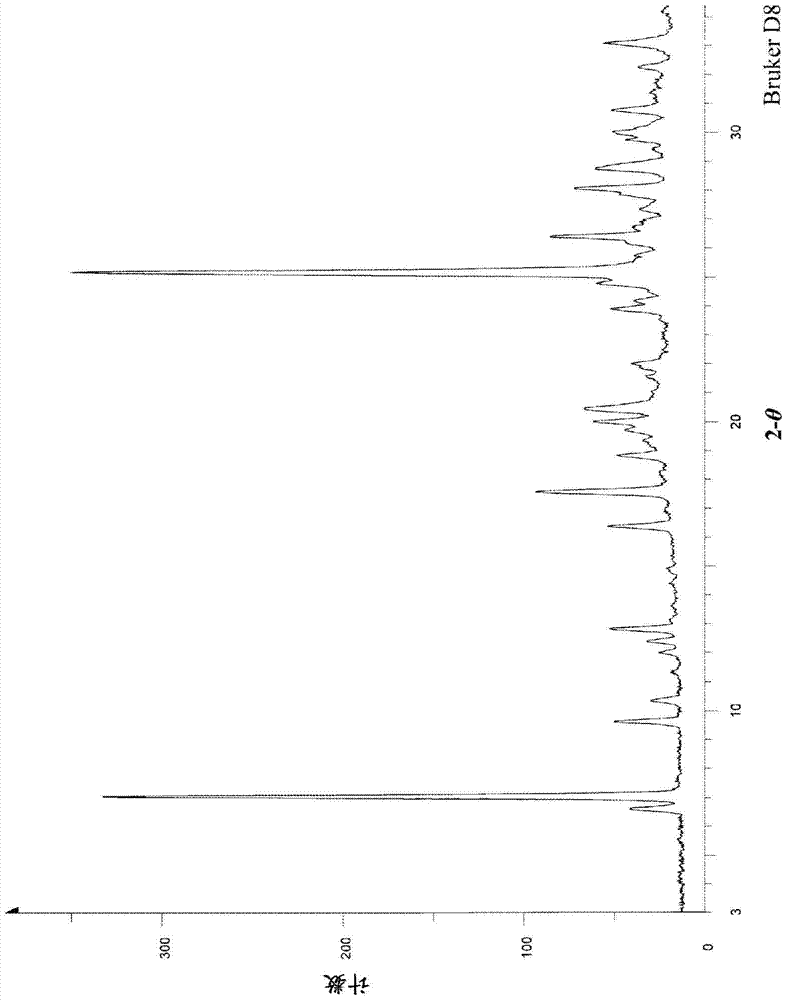
式(1D)表示的化合物或其溶剂合物的晶体:
[化学式31]
(式中,Me表示甲基和Bn表示苄基),
其中,在粉末X射线衍射谱中,在衍射角(2θ):7.9°±0.2°、10.0°±0.2°、11.5°±0.2°、20.0°±0.2°、23.4°±0.2°和34.0°±0.2°具有峰。
(项目14)
式(2D)表示的化合物或其溶剂合物的晶体:
[化学式32]
(式中,Me表示甲基、Et基表示乙基和Bn表示苄基),
其中,在粉末X射线衍射谱中,在衍射角(2θ):17.6°±0.2°、25.2°±0.2°、26.4°±0.2°和28.1°±0.2°具有峰。
(项目15)
式(9C’)表示的化合物或其溶剂合物的晶体:
[化学式33]
(式中,Me表示甲基和Bn表示苄基),
其中,在粉末X射线衍射谱中,在衍射角(2θ):14.2°±0.2°、16.0°±0.2°、22.0°±0.2°、22.2°±0.2°、24.4°±0.2°和25.9°±0.2°具有峰。
(项目16)
项目13所述的晶体,其特征在于:该晶体具有与图1实质上一致的粉末X射线衍射谱。
(项目17)
项目14所述的晶体,其特征在于:该晶体具有与图2实质上一致的粉末X射线衍射谱。
(项目18)
项目15所述的晶体,其特征在于:该晶体具有与图3实质上一致的粉末X射线衍射谱。
发明效果
本发明涉及的制备方法是可以以高收率、高效率和/或短的步骤来制备新型抗流感药物即式(I)、式(II)或式(III)等中所包含的化合物的方法。通过进行本发明涉及的制备方法有以下多种优点:可以避免使用伴有毒性的反应试剂,可避免伴有危险的反应,可避免使用昂贵的反应试剂,可避免使用对环境有害的试剂或溶剂等。本发明化合物的吡喃酮衍生物(X3)、吡啶酮衍生物(X4)和/或(X4’)作为式(I)、式(II)或式(III)等中所包含的化合物制备时的共通中间体,具有通用性,是有用的。并且可以以晶体获得吡喃酮衍生物(X3)和/或吡啶酮衍生物(X4)。这些晶体吸湿性小、对光或热显示高的稳定性,因此具有保存或制备上的操作性优异等的优点。因此,本发明涉及的制备方法以及中间体和它们的晶体可用于药物(抗流感药物、抗HIV药物、抗炎症剂、镇痛剂、抗肿瘤药物等)的工业化制备。
[化学式34]
(式中,各符号与上述相同含义)。
附图说明
图1为实施例1中得到的化合物1D的粉末X射线图谱。纵轴表示峰强度,横轴表示衍射角(2θ)。
图2为实施例2中得到的化合物2D的粉末X射线图谱。纵轴表示峰强度,横轴表示衍射角(2θ)。
图3为实施例9中得到的化合物9C’的粉末X射线图谱。纵轴表示峰强度,横轴表示衍射角(2θ)。
具体实施方式
本说明书中,“卤素”含有氟原子、氯原子、溴原子、碘原子。
本说明书中,“低级烷基”包含碳原子数1~15、优选碳原子数1~10、更优选碳原子数1~6、进一步优选碳原子数1~4的直链或支链状的烷基,例如可举出:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、己基、异己基、正庚基、异庚基、正辛基、异辛基、正壬基和正癸基等。“低级烷基”的优选的形式可举出:甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基。进一步优选的形式可举出:甲基、乙基、正丙基、异丙基、叔丁基。
本说明书中,“低级链烯基”包含在任意的位置上具有1个以上的双键的碳原子数2~15、优选碳原子数2~10、更优选碳原子数2~6、进一步优选碳原子数2~4的直链或支链状的链烯基。具体可举出:乙烯基、烯丙基、丙烯基、异丙烯基、丁烯基、异丁烯基、异戊二烯基、丁二烯基、戊烯基、异戊烯基、戊二烯基、己烯基、异己烯基、己二烯基、庚烯基、辛烯基、壬烯基、癸烯基、十一碳烯基、十二碳烯基、十三碳烯基、十四碳烯基、十五碳烯基等。“低级链烯基”的优选方式可举出:乙烯基、烯丙基、丙烯基、异丙烯基、丁烯基。
本说明书中,“低级炔基”包含在任意的位置上具有1个以上的三键的碳原子数2~10、优选碳原子数2~8、进一步优选碳原子数3~6的直链或支链状的炔基。具体包含:乙炔基、丙炔基、丁炔基、戊炔基、己炔基、庚炔基、辛炔基、壬炔基、癸炔基等。它们可进一步在任意的位置具有双键。“低级炔基”的优选方式可举出:乙炔基、丙炔基、丁炔基、戊炔基。
本说明书中,“低级烷基氧基”、“低级烷基羰基”、“低级烷基氧基羰基”、“碳环低级烷基”、“杂环低级烷基”、“碳环氧基低级烷基”、“杂环氧基低级烷基”、“卤代低级烷基”、“碳环低级烷基氧基”、“杂环低级烷基氧基”、“碳环低级烷硫基”、“杂环低级烷硫基”、“碳环低级烷基氨基”、“杂环低级烷基氨基”、“卤代低级烷基氧基”、“低级烷基氧基低级烷基”、“低级烷基氧基低级烷基氧基”、“低级烷基羰基”、“低级烷基氧基羰基”、“低级烷基氨基”、“低级烷基羰基氨基”、“低级烷基氨基羰基”、“低级烷基氧基羰基氨基”、“低级烷基磺酰基”、和“低级烷基磺酰基氨基”的低级烷基部分也与上述“低级烷基”同样。
本说明书中,“低级链烯基氨基”的低级链烯基部分也与上述“低级链烯基”同样。
本说明书中,“低级炔基氨基”的低级炔基部分也与上述“低级炔基”同样。
本说明书中,“卤代低级烷基”和“卤代低级烷基氧基”的卤素部分也与上述“卤素”同样。这里,各“低级烷基”和“低级烷基氧基”的烷基上的任意位置任选被相同或不同的1个或多个卤素原子取代。
本说明书中,“碳环式基”是指碳原子数3~20、优选碳原子数3~16、更优选碳原子数4~12的碳环式基,包含环烷基、环烯基、芳基和非芳族缩合碳环式基等。
具体来说,“环烷基”是碳原子数3~16、优选碳原子数3~12、更优选碳原子数4~8的碳环式基,包含例如环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环壬基和环癸基等。
具体来说,“环烯基”包含在上述环烷基的环中的任意位置上具有1个以上的双键的基团,例如可举出:环丙烯基、环丁烯基、环戊烯基、环己烯基、环庚烯基(ツクロヘプラニル,cycloheptenyl)、环辛烯基(ツクロオクラニル,cyclooctenyl)和环己二烯基等。
具体来说,“芳基”包含苯基、萘基、蒽基和菲基等,特别优选苯基。
具体来说,“非芳族缩合碳环式基”包含选自上述“环烷基”、“环烯基”和“芳基”的2个以上的环状基缩合而成的基团,例如可举出:茚满基、茚基、四氢萘基、芴基、金刚烷基、和以下所示的基团等:
[化学式35]
“碳环式基”的优选方式可举出:环烷基、芳基和非芳族缩合碳环式基,具体可举出:环丙基、环丁基、环戊基、环己基、环庚基、苯基等。
“碳环低级烷基”、“碳环低级烷基氧基”、“碳环低级烷硫基”、“碳环低级烷基氨基”、“碳环氧基”、“碳环羰基”、和“碳环氨基羰基”的碳环部分也与上述“碳环式基”同样。
本说明书中,“杂环式基”包含环内具有1个以上从O、S和N任意选择的相同或不同杂原子的杂芳基、非芳族杂环式基、双环缩合杂环式基和三环缩合杂环式基等的杂环式基。
具体来说,“杂芳基”可举出:吡咯基、咪唑基、吡唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、三唑基、三嗪基、四唑基、呋喃基、噻吩基、异唑基、唑基、二唑基、异噻唑基、噻唑基、噻二唑基等的5~6元的芳族环式基。
具体来说,“非芳族杂环式基”可举出:二烷基、硫杂丙环基、环氧乙烷基、氧杂环丁烷基、氧硫杂环戊基、氮杂环丁基、チアニル(thianyl)、噻唑烷基、吡咯烷基、吡咯啉基、咪唑烷基、咪唑啉基、吡唑烷基、吡唑啉基、哌啶基、哌嗪基、吗啉基、吗啉代基、硫代吗啉基、硫代吗啉代基、二氢吡啶基、四氢吡啶基、四氢呋喃基、四氢吡喃基、二氢噻唑基、四氢噻唑基、四氢异噻唑基、二氢嗪基、氮杂环庚烷基、四氢二氮杂基、四氢哒嗪基、六氢嘧啶基、二氧戊环基等。
具体来说,“双环的缩合杂环式基”可举出:吲哚基、异吲哚基、吲唑基、中氮茚基、二氢吲哚基、异二氢吲哚基、喹啉基、异喹啉基、噌啉基、2,3二氮杂萘基、喹唑啉基、1,5-二氮杂萘基、喹喔啉基、嘌呤基、蝶啶基、苯并吡喃基、苯并咪唑基、苯并三唑基、苯并异唑基、苯并唑基、苯并二唑基、苯并异噻唑基、苯并噻唑基、苯并噻二唑基、苯并呋喃基、异苯并呋喃基、苯并噻吩基、苯并三唑基、噻并吡啶基、噻并吡咯基、噻并吡唑基、噻并吡嗪基、氟吡咯基、噻并噻吩基、咪唑并吡啶基、吡唑并吡啶基、噻唑并吡啶基、吡唑并嘧啶基、吡唑并三嗪基(ピラゾロトリアヅニル)、哒嗪并吡啶基、三唑并吡啶基、咪唑并噻唑基、吡嗪并哒嗪基、喹唑啉基、喹啉基、异喹啉基、1,5-二氮杂萘基、二氢噻唑并嘧啶基、四氢喹啉基、四氢异喹啉基、二氢苯并呋喃基、二氢苯并嗪基、二氢苯并咪唑基、四氢苯并噻吩基、四氢苯并呋喃基、苯并二氧杂环戊烯基、苯并二氧杂环己烯基(ベンゾヅオキソニル)、苯并二氢吡喃基、色满基、色烯基、八氢色烯基、二氢苯并二氧杂环己烯基(ヅヒドロベンゾヅオキツニル,dihydrobenzodioxynyl)、二氢苯并オキセヅニル(dihydrobenzoxezinyl)、二氢苯并二氧杂环庚烯基、二氢噻并二氧杂环己烯基(ヅヒドロチエノヅオキツニル,dihydrothienodioxynyl)等。
具体来说,“三环的缩合杂环式基”可举出:咔唑基、吖啶基、呫吨基、吩噻嗪基、吩噻基、吩嗪基、二苯并呋喃基、咪唑并喹啉基、四氢咔唑基、以及以下所示的基团等:
[化学式36]
“杂环式基”的优选的方式可举出:5~6元的杂芳基或非芳族杂环式基、三环的缩合杂环式基。
“杂环低级烷基”、“杂环低级烷基氧基”、“杂环低级烷硫基”、“杂环低级烷基氨基”、“杂环氧基”、“杂环羰基”、和“杂环氨基羰基”的杂环部分也与上述“杂环式基”同样。
“将步骤B和步骤C连续进行”是指进行了步骤B之后,不进行步骤B中生成的产物的分离操作或柱层析纯化等,即实施步骤C。进行步骤B的反应容器与进行步骤C的反应容器可以相同也可以不同。
“任选被取代基组E取代的低级烷基”是指“低级烷基”为无取代,或者键合有1个或多个化学上可接受的、选自取代基组E的取代基。键合多个取代基时,多个取代基可以相同或不同。例如包含甲基、氟甲基、三氟甲基、氯二氟甲基、和
[化学式37]
等。
“任选被取代基组E取代的碳环式基”是指“碳环式基”为无取代,或者键合有1个或多个化学上可接受的、选自取代基组E的取代基。键合多个取代基时,多个取代基可以相同或不同。例如包含氟苯基、二氟苯基、甲氧基氟苯基等。
“任选被取代基组E取代的碳环低级烷基”是指“碳环式基”和/或“低级烷基”为无取代,或者键合有1个或多个化学上可接受的、选自取代基组E的取代基。键合多个取代基时,多个取代基可以相同或不同。例如包含4-氟苄基、2,4-二氟苄基、4-甲氧基2-氟苄基、4-甲氧基苯基二氟甲基等。
“任选被取代基组E取代的低级烷基氧基”、“任选被取代基组E取代的碳环低级烷基氧基”、“任选被取代基组E取代的杂环低级烷基氧基”、“任选被取代基组E取代的低级链烯基”、“任选被取代基组E取代的氨基”、“任选被取代基组E取代的低级烷基氨基”、“任选被取代基组E取代的低级链烯基氨基”、“任选被取代基组E取代的低级炔基氨基”、“任选被取代基组E取代的碳环低级烷基氨基”、和“任选被取代基组E取代的杂环低级烷基氨基”也为同样的含义。
“任选被取代基组F取代的碳环式基”是指“碳环式基”为无取代,或者键合有1个或多个化学上可接受的、选自取代基组F的取代基。键合多个取代基时,多个取代基可以相同或不同。例如包含氟苯基、二氟苯基、甲氧基氟苯基等。
“任选被取代基组F取代的低级烷基氧基”是指“碳环式基”部分为无取代,或者键合有1个或多个化学上可接受的、选自取代基组F的取代基。键合多个取代基时,多个取代基可以相同或不同。例如包含氟苄基氧基、二氟苄基氧基、甲氧基氟苄基氧基等。
“任选被取代基组F取代的杂环式基”、“任选被取代基组F取代的杂环低级烷基氧基”、“任选被取代基组F取代的碳环低级烷硫基”、“任选被取代基组F取代的杂环低级烷硫基”、“任选被取代基组F取代的碳环低级烷基氨基”、“任选被取代基组F取代的杂环低级烷基氨基”、“任选被取代基组F取代的碳环氧基”、“任选被取代基组F取代的杂环氧基”、“任选被取代基组F取代的碳环羰基”、“任选被取代基组F取代的杂环羰基”、“任选被取代基组F取代的碳环氨基羰基”、和“任选被取代基组F取代的杂环氨基羰基”也为同样的含义。
“-N(R3e)2的R3e可以一起形成杂环式基”例如包含以下所示的式等。
[化学式38]
“-N(R3e)2的R3e可以一起形成杂环式基”中的“杂环式基”的定义也与上述相同。
“氨基保护基”可以是常规的氨基的保护基,例如可例举Protective Groups in Organic Synthesis,Theodora W Green(John Wiley&Sons)中记载的氨基保护基。优选叔丁基氧基羰基、苄基氧基羰基。
“羧基保护基”可以是常规的羧基的保护基,例如可例举Protective Groups in Organic Synthesis,Theodora W Green(John Wiley&Sons)中记载的羧基保护基。优选甲基、乙基、叔丁基、甲氧基甲基、烯丙基、苄基、对甲氧基苄基等。
Xd中的“铵阳离子的抗衡阴离子”可举出:卤素-、CH3COO-、HCOO-、NO3-、BF4-、PF6-、HO-、Ph-SO3-、CH3-Ph-SO3-、CH3-SO3-、PO43-、SO42-或HSO4-等。优选卤素-、CH3COO-、NO3-、SO42-。阴离子为二价或三价时,是指分别键合2个分子或3个分子NH4+阳离子,形成不带电的状态。NH4+Xd-的具体例子可举出:(NH4+)2SO42-、(NH4+)3PO43-等。
“离去基团”表示因亲核反应而离去的取代基,可举出卤素、-O-SO2-CH3、-O-SO2-CF3、-O-SO2-Ph、或-O-SO2-Ph-CH3等。优选卤素。
“式(XA3)的衍生物”是指烯烃部位氧化开裂形成醛基或羧基,或者与羧基缩合反应形成酰胺。具体如下式(XA3a)、式(XA3b)或式(XA3c)所示:
[化学式39]
(式中,Rb为氢、任选被取代基组E取代的低级烷基、任选被取代基组E取代的低级链烯基、任选被取代基组E取代的低级炔基、任选被取代基组E取代的碳环低级烷基、或任选被取代基组E取代的杂环低级烷基,其它的各符号与项目1和项目3相同含义)。
上述的式(XA3a)与式(V3)反应时,生成Ra为氢的式(XA4)。上述的式(XA3b)与式(V3)反应时,生成Ra为羟基的式(XA4)。上述的式(XA3b)与式(V3)反应时,生成Ra为羟基的式(XA4)。上述的式(XA3c)与式(V3)反应时,生成Ra为任选被取代基组E取代的低级烷基氨基、任选被取代基组E取代的低级链烯基氨基、任选被取代基组E取代的低级炔基氨基、任选被取代基组E取代的碳环低级烷基氨基、或任选被取代基组E取代的杂环低级烷基氨基的式(XA4)。
“式(XA3)的烯烃部位氧化开裂形成醛基或羧基,或者与羧基缩合反应形成酰胺”中的“氧化开裂”可在常规的公知的氧化反应条件(例如、臭氧氧化反应、RuCl3-NaIO4氧化反应等)下进行。反应产物为醛体(XA3a)时,可以通过接续的常规的氧化反应条件(例如Cr3-吡啶、PCC氧化、SO3-吡啶氧化、NaClO2氧化等)导入到羧基中。
“通过缩合反应酰胺化”可通过对羧基的常规脱水缩合反应(光延反应,使用羧酸酰卤化物、羧酸酐、或缩合剂(例如WSC、羰基二咪唑、二环己基碳二亚胺)等的反应)进行。
“式(XA4’)的衍生物”是指烯烃部位氧化开裂形成醛基或羧基,或者与羧基缩合反应形成酰胺。具体如下式(XA4’a)、式(XA4’b)或式(XA4’c)所示:
[化学式40]
(式中,各符号与项目1、项目3以及上述相同含义)。
上述的式(XA4’a)与式(V3’)反应时,生成Ra为氢的式(XA4)。上述的式(XA4’b)与式(V3’)反应时,生成Ra为羟基的式(XA4)。上述的式(XA4’c)与式(V3’)反应时,生成Ra为任选被取代基组E取代的低级烷基氨基、任选被取代基组E取代的低级链烯基氨基、任选被取代基组E取代的低级炔基氨基、任选被取代基组E取代的碳环低级烷基氨基、或任选被取代基组E取代的杂环低级烷基氨基的式(XA4)。
“式(XA4’)的烯烃部位氧化开裂形成醛基或羧基,或者与羧基缩合反应形成酰胺”也与上述(XA3)的情形同样。
以下对本发明的制备方法进行说明。
(步骤A)
本步骤如以下的反应式所示,是使化合物(X1)与化合物(V1)反应,得到含有化合物(X2)的溶液的步骤。
这里,“溶液”是指化合物(X2)溶解的状态,也包含化合物(X2)未完全溶解、分散的悬浮液状态,或者淤浆状态。以下,本说明书中的“溶液”也完全同样地包含悬浮液状态或淤浆状态。
[化学式41]
(式中,各符号与上述相同含义)
化合物(X1)是市售的试剂,可通过公知的方法获得。
R1d为卤素时,通过在溶剂中加入任选被取代基组E取代的低级醇、任选被取代基组E取代的碳环低级烷基醇、任选被取代基组E取代的杂环低级烷基醇、或(R1e)3Si-OH等的醇试剂,根据需要,在碱存在下进行亲核取代反应,由此可得到R1d为任选被取代基组E取代的低级烷基氧基、任选被取代基组E取代的碳环低级烷基氧基、任选被取代基组E取代的杂环低级烷基氧基、或-OSi(R1e)3的化合物(X1)。
R1d中的“任选被取代基组E取代的低级烷基氧基”的例子可举出:甲氧基、乙氧基、异丙氧基、三氯甲氧基、三氟甲氧基等。优选甲氧基。
R1d中的“任选被取代基组E取代的碳环低级烷基氧基”的例子可举出:苄基氧基、苯乙基氧基、2,4-三氟苄基氧基、4-甲氧基苄基氧基等。优选苄基氧基。
R1d中的“任选被取代基组E取代的杂环低级烷基氧基”的例子可举出:吡啶基甲基氧基等。
R1d的优选方式是:氢、氯、溴、甲氧基、苄基氧基。
R2d中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、正丙基、异丙基、叔丁基等。
R2d中的“任选被取代基组E取代的碳环低级烷基”的例子可举出:苄基、4-甲氧基苄基等。
R2d中的“任选被取代基组E取代的杂环低级烷基”的例子可举出:吡啶基甲基等。
R2d的优选方式是:甲基、乙基、正丙基、异丙基、叔丁基、苄基等。
R1e的优选方式是:甲基、乙基、正丙基、异丙基、叔丁基等。
上述的得到(X1)的亲核取代反应的反应溶剂优选非质子性的溶剂。例如可举出:乙腈、四氢呋喃、二烷、二乙醚、二氯甲烷、氯仿、甲苯、二甲苯、乙酸乙酯、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二甲基咪唑啉酮等。
上述的碱可以是可进行醇试剂的去质子化的碱,例如可举出:正丁基锂、叔丁基锂、叔丁醇钠、叔丁醇钾、叔戊醇钠、甲醇钠、乙醇钠、氢化钠、二异丙基氨基锂、双(三甲基甲硅烷基)氨基锂等。
碱的量是相对于R1d为卤素的化合物(X1)约为1.0~3.0摩尔当量。
醇试剂的量是相对于R1d为卤素的化合物(X1)约为0.5~1.5摩尔当量。
反应温度通常为0℃~回流温度,优选室温~50℃。
反应时间通常为10分钟~50小时、优选1~4小时。
化合物(V1)可以使用市售试剂,或通过公知的方法获得。
Pd中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、三氟甲基等。Pd的优选方式为甲基。
R3d中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、三氟甲基等。
R3e中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、三氟甲基等。
R3d的优选方式为-N(CH3)2、-OCH3或吡咯烷基。
使化合物(X1)与化合物(V1)反应、获得化合物(X2)的反应的反应溶剂例如可举出:乙腈、四氢呋喃、二烷、二乙醚、二氯甲烷、氯仿、甲苯、二甲苯、乙酸乙酯、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二甲基咪唑啉酮等。
化合物(V1)的用量是相对于化合物(X1)约为1.0~3.0摩尔当量,或者可以将化合物(V1)作为溶剂使用。
反应温度通常为0℃~回流温度,优选室温。
反应时间通常为30分钟~50小时,优选2~8小时。
通过本步骤,可得到含有化合物(X2)的溶液。化合物(X2)可以通过常规的纯化方法(萃取、蒸馏、柱层析、晶析等)分离,也可以无需分离即用于后面的反应。
(步骤A’)
化合物(X2)可通过以下所示的反应获得:
[化学式42]
(式中,R7d为卤素、任选被取代基组E取代的低级烷基氧基、或-O-SO2-R5e,其它各符号与上述相同)。
化合物(Z1)可以使用市售的试剂,或通过公知的方法获得。
R2d中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、正丙基、异丙基、叔丁基等。
R2d中的“任选被取代基组E取代的碳环低级烷基”的例子可举出:苄基、4-甲氧基苄基等。
R2d中的“任选被取代基组E取代的杂环低级烷基”的例子可举出:吡啶基甲基等。
R2d的优选方式为甲基、乙基、正丙基、异丙基、叔丁基、苄基等。
R3d中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、三氟甲基等。
R3e中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、三氟甲基等。
R3d的优选方式为-N(CH3)2、-OCH3、或吡咯烷基。
R1d中的“任选被取代基组E取代的低级烷基氧基”的例子可举出:甲氧基、乙氧基、异丙氧基、三氯甲氧基、三氟甲氧基等。优选甲氧基。
R1d中的“任选被取代基组E取代的碳环低级烷基氧基”的例子可举出:苄基氧基、苯乙基氧基、2,4-三氟苄基氧基、4-甲氧基苄基氧基等。优选苄基氧基。
R1d中的“任选被取代基组E取代的杂环低级烷基氧基”的例子可举出:吡啶基甲基氧基等。
R1d的优选方式为氢、氯、溴、甲氧基、苄基氧基。
化合物(Z1)可以使用市售的试剂,或通过公知的方法获得。
R7d的优选方式可举出:氯、溴、甲氧基、乙氧基、乙酰氧基、甲磺酰基氧基、三氟甲磺酰基氧基、对甲苯磺酰基氧基等。
使化合物(Z1)与化合物(Z2)反应、获得化合物(X2)的反应的反应溶剂例如可举出:乙腈、四氢呋喃、二烷、二乙醚、二氯甲烷、氯仿、甲苯、二甲苯、乙酸乙酯、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二甲基咪唑啉酮等。
化合物(Z2)的用量是相对于化合物(Z1)约为1.0~3.0摩尔当量。
反应温度通常为-10℃至回流温度,优选室温。
反应时间通常为10分钟~10小时,优选1~4小时。
可以根据需要添加叔胺。叔胺可举出:吡啶、三乙胺、二甲基氨基吡啶、N-甲基吗啉等。
通过本步骤,可得到含有化合物(X2)的溶液。化合物(X2)可通过常规的纯化方法(萃取、蒸馏、柱层析、晶析等)分离,也可以无需分离即用于后面的反应。
(步骤B)
本步骤如以下的反应式所示,是根据需要,在碱存在下使化合物(X2)与化合物(V2)反应,得到含有化合物(X3)的溶液的步骤。
[化学式43]
(式中,各符号与上述相同含义)
R1d中的“任选被取代基组E取代的低级烷基氧基”的例子可举出:甲氧基、乙氧基、异丙氧基、三氯甲氧基、三氟甲氧基等。优选甲氧基。
R1d中的“任选被取代基组E取代的碳环低级烷基氧基”的例子可举出:苄基氧基、苯乙基氧基、2,4-三氟苄基氧基、4-甲氧基苄基氧基等。优选苄基氧基。
R1d中的“任选被取代基组E取代的杂环低级烷基氧基”的例子可举出:吡啶基甲基氧基等。
R1d的优选方式为氢、氯、溴、甲氧基、苄基氧基。
R2d中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、正丙基、异丙基、叔丁基等。
R2d中的“任选被取代基组E取代的碳环低级烷基”的例子可举出:苄基、4-甲氧基苄基等。
R2d中的“任选被取代基组E取代的杂环低级烷基”的例子可举出:吡啶基甲基等。
R2d的优选方式为甲基、乙基、正丙基、异丙基、叔丁基等。
R3d中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、三氟甲基等。
R3e中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、三氟甲基等。
R3d的优选方式为-N(CH3)2、-OCH3、或吡咯烷基。
化合物(V2)可以使用市售的试剂,或者通过公知的方法获得。
R4d中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、正丙基、异丙基、叔丁基等。
R4d中的“任选被取代基组E取代的碳环低级烷基”的例子可举出:苄基、4-甲氧基苄基等。
R4d中的“任选被取代基组E取代的杂环低级烷基”的例子可举出:吡啶基甲基等。
R4d的优选方式可举出:甲基、乙基、正丙基、异丙基、叔丁基、苄基、4-甲氧基苄基等。
R5d的优选方式可举出:氯、溴、甲氧基、乙氧基、乙酰氧基、甲磺酰基氧基、三氟甲磺酰基氧基、对甲苯磺酰基氧基等。特别优选氯、甲氧基、乙氧基。
反应溶剂例如可举出:乙腈、四氢呋喃、二烷、甲苯、二甲苯、乙酸乙酯、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二甲基咪唑啉酮、N-甲基吗啉、N-甲基吡咯烷酮等。
碱例如可举出:正丁基锂、叔丁基锂、叔丁醇钠、叔丁醇钾、叔戊醇钠、甲醇钠、乙醇钠、氢化钠、二异丙基氨基锂、双(三甲基甲硅烷基)氨基锂等。
碱的用量是相对于化合物(X2)约为1.0~5.0摩尔当量。
化合物(V2)的用量是相对于化合物(X2)约为1.5~5.0摩尔当量,或者可以将化合物(V2)作为溶剂使用。
反应温度通常为-80℃至回流温度,优选-20℃至50℃。
反应时间通常为30分钟~50小时,优选2~12小时。
通过本步骤,可得到含有化合物(X3)的溶液。化合物(X3)可通过常规的纯化方法(萃取、蒸馏、柱层析、晶析等)分离,也可以无需分离即用于后面的反应。优选以通过晶析除去了杂质的晶体形式分离。
(步骤B-II)
本步骤如以下的反应式所示,是根据需要,在碱存在下使化合物(X2)与化合物(VA2)反应、得到含有化合物(XA3)的溶液的步骤。
[化学式44]
(式中,各符号与上述相同含义)
式(X2)和(VA2)中的R1d、R2d、R3d和R5d的例子以及优选方式分别与上述相同。
化合物(VA2)可以使用市售的试剂,或者通过公知的方法获得。
R4e的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基等。
R4e的“任选被取代基组E取代的碳环式基”的例子可举出:苯基、环己基。
R4e“任选被取代基组E取代的杂环式基”的例子可举出:吡啶基、哌嗪基。
R4e优选一方为氢、另一方为苯基的基团。
反应溶剂例如可举出:乙腈、四氢呋喃、二烷、甲苯、二甲苯、乙酸乙酯、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二甲基咪唑啉酮、N-甲基吗啉、N-甲基吡咯烷酮等。
碱例如可举出:正丁基锂、叔丁基锂、叔丁醇钠、叔丁醇钾、叔戊醇钠、甲醇钠、乙醇钠、氢化钠、二异丙基氨基锂、双(三甲基甲硅烷基)氨基锂等。
碱的用量是相对于化合物(XA2)约为1.0~5.0摩尔当量。
化合物(VA2)的用量是相对于化合物(X2)约为1.0~2.0摩尔当量。
反应温度通常为-80℃至20℃,优选-80℃至-40℃。
反应时间通常为5分钟~6小时,优选15分钟~2小时。
通过本步骤,可得到含有化合物(XA3)的溶液。化合物(XA3)可通过常规的纯化方法(萃取、蒸馏、柱层析、晶析等)分离,也可以无需分离即用于后面的反应。优选以通过晶析除去了杂质的晶体形式分离。
(步骤C)
本步骤如以下的反应式所示,是使化合物(X3)与化合物(V3)反应、得到化合物(X4)的步骤。
[化学式45]
(式中,各符号与上述相同含义)
R1d中的“任选被取代基组E取代的低级烷基氧基”的例子可举出:甲氧基、乙氧基、异丙氧基、三氯甲氧基、三氟甲氧基等。优选甲氧基。
R1d中的“任选被取代基组E取代的碳环低级烷基氧基”的例子可举出:苄基氧基、苯乙基氧基、2,4-三氟苄基氧基、4-甲氧基苄基氧基等。优选苄基氧基。
R1d中的“任选被取代基组E取代的杂环低级烷基氧基”的例子可举出:吡啶基甲基氧基等。
R1d的优选方式为氢、氯、溴、甲氧基、苄基氧基。
R2d中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、正丙基、异丙基、叔丁基等。
R2d中的“任选被取代基组E取代的碳环低级烷基”的例子可举出:苄基、4-甲氧基苄基等。
R2d中的“任选被取代基组E取代的杂环低级烷基”的例子可举出:吡啶基甲基等。
R2d的优选方式为甲基、乙基、正丙基、异丙基、叔丁基等。
R4d中的“任选被取代基组E取代的低级烷基”的例子可举出:甲基、乙基、正丙基、异丙基、叔丁基等。
R4d中的“任选被取代基组E取代的碳环低级烷基”的例子可举出:苄基、4-甲氧基苄基等。
R4d中的“任选被取代基组E取代的杂环低级烷基”的例子可举出:吡啶基甲基等。
R4d的优选方式可举出:甲基、乙基、正丙基、异丙基、叔丁基、苄基、4-甲氧基苄基等。
化合物(V3)可以使用市售的试剂,或者通过公知的方法获得。
R6d中的“任选被取代基组E取代的低级烷基”的例子可举出:HC(=O)-CH2-、CH(-OH)2-CH2-、MeO-CH(-OH)-CH2-、二甲氧基乙基、二乙氧基乙基、CH2=CH-CH2-、HO-CH2-CH(-OH)-CH2-、
[化学式46]
或者
[化学式47]
等。
R6d中的“取代基E任选被取代的氨基”的例子可举出:甲基氨基、乙基氨基、苄基氧基羰基氨基、叔丁氧基羰基氨基等。
R6d中的“任选被取代基组E取代的碳环式基”的例子可举出:
[化学式48]
等。
R6d中的“任选被取代基组E取代的杂环式基”的例子可举出:
[化学式49]
等。
反应溶剂例如可举出:乙腈、四氢呋喃、二烷、甲苯、二甲苯、乙酸乙酯、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二甲基咪唑啉酮、N-甲基吗啉、N-甲基吡咯烷酮、甲醇、乙醇、异丙醇等。
化合物(V3)的用量是相对于化合物(X3)约为1.0~2.0摩尔当量。
反应温度通常为0℃~回流温度,优选20℃~70℃。
反应时间通常为30分钟~50小时,优选2~12小时。
生成的化合物(X4)的R6d不为具有HC(=O)-CH2-、MeO-CH(-OH)-CH2-或CH(-OH)2-CH2-等醛基或其等价体的基团时,可按照Protective Groups in Organic Synthesis,Theodora W Green(John Wiley&Sons)中记载的对醛基的保护基进行脱保护的方法、或者国际公开第2006/116764号小册子或国际公开第2006/088173号小册子等所示的公知的方法导出具有醛基或其等价体的基团即HC(=O)-CH2-、MeO-CH(-OH)-CH2-或CH(-OH)2-CH2-等。
例如,化合物(X4)的R6d为二甲氧基乙基时,通过在含有化合物(X4)的溶液中加入酸,可导出HC(=O)-CH2-。酸没有特别限定,可例举盐酸、氢溴酸、硫酸、硝酸、磷酸、对甲苯磺酸、甲磺酸、甲酸、乙酸、三氟乙酸、马来酸、草酸等。酸的用量是相对于化合物(X4)为2.0~10.0摩尔当量。乙酸或甲酸可作为溶剂使用,也可以与上述酸混合使用。
反应温度通常为约0℃~80℃,优选10℃~40℃。
反应时间通常为30分钟~50小时,优选2~12小时。
氨基被氨基保护基保护时,可通过Protective Groups in Organic Synthesis,Theodora W Green(John Wiley&Sons)中记载的对氨基的保护基脱保护的方法、或公知的方法得到脱保护的化合物。进行脱保护反应的顺序可适当变更。
通过本步骤,可得到含有化合物(X4)的溶液。化合物(X4)可通过常规的纯化方法(萃取、蒸馏、柱层析、晶析等)分离,也可以无需分离即用于后面的反应。优选以通过晶析除去了杂质的晶体形式分离。
(步骤C-II)
本步骤如以下的反应式所示,是根据需要,在碱存在下使化合物(XA3)与化合物(V3)反应、得到含有化合物(XA4)的溶液的步骤。
[化学式50]
(式中,各符号与上述相同含义)
式(XA3)和(VA4)中的R1d、R2d、R4e的例子以及优选方式分别与上述同样。
式(XA4)中,Ra的“任选被取代基组E取代的低级烷基氨基”的例子可举出:甲基氨基、乙基氨基、异丙基氨基、叔丁基氨基、甲氧基甲基氨基、甲氧基乙基氨基、乙氧基乙基氨基、甲氧基丙基氨基、羟基乙基氨基、哌嗪基羰基乙基氨基、吗啉基羰基乙基氨基、甲基氨基乙基氨基、甲基磺酰基乙基氨基、叔丁基羰基氨基乙基氨基、异丙基氧基羰基氨基乙基氨基、甲基羰基氨基乙基氨基、氨基乙基氨基、叔丁基氧基羰基氨基乙基氨基等。
Ra的“任选被取代基组E取代的低级链烯基氨基”的例子可举出:乙烯基氨基、丙烯基氨基等。
Ra的“任选被取代基组E取代的低级炔基氨基”的例子可举出:丙炔基氨基。
Ra的“任选被取代基组E取代的碳环低级烷基氨基”的例子可举出:苄基氨基、二氟苄基氨基、氯氟苄基氨基、环丙基甲基氨基、4-氟苄基氨基、环己基亚甲基氨基、环丙基氨基、乙基氧基羰基乙基氨基、羧基乙基氨基、二甲基氨基羰基、4-甲氧基苄基氨基、4-甲基苄基氨基等。
Ra的“任选被取代基组E取代的杂环低级烷基氨基”的例子可举出:吡啶基甲基氨基、四氢吡喃基亚甲基氨基、甲基异唑基亚甲基氨基等。
R6d中的“任选被取代基组E取代的低级烷基”的例子可举出:HC(=O)-CH2-、CH(-OH)2-CH2-、MeO-CH(-OH)-CH2-、二甲氧基乙基、二乙氧基乙基、CH2=CH-CH2-、HO-CH2-CH(-OH)-CH2-、
[化学式51]
或者Ra为羟基时,R6d为
[化学式52]
等,或者
Ra为“任选被取代基组E取代的低级烷基氨基”、“任选被取代基组E取代的低级链烯基氨基”、“任选被取代基组E取代的低级炔基氨基”、“任选被取代基组E取代的碳环低级烷基氨基”或“任选被取代基组E取代的杂环低级烷基氨基”时,R6d为
[化学式53]
等。
R6d中的“任选被取代基组E取代的氨基”的例子可举出:甲基氨基、乙基氨基、苄基氧基羰基氨基、叔丁氧基羰基氨基等。
R6d中的“任选被取代基组E取代的碳环式基”的例子可举出:
[化学式54]
等。
R6d中的“任选被取代基组E取代的杂环式基”的例子可举出:
[化学式55]
等。
对于由烯烃体(-CH=C(R4e)2)向-CO-Ra的转换,Ra为羟基时,对于在常规公知的氧化反应条件(例如臭氧氧化反应、RuCl3-NaIO4氧化反应等)下得到的醛(Ra为氢),可以在接下来的常规氧化反应条件(例如Cr3-吡啶、PCC氧化、SO3-吡啶氧化、NaClO2氧化等)下进行。
Ra为“任选被取代基组E取代的低级烷基氨基”、“任选被取代基组E取代的低级链烯基氨基”、“任选被取代基组E取代的低级炔基氨基”、“任选被取代基组E取代的碳环低级烷基氨基”或“任选被取代基组E取代的杂环低级烷基氨基”时,对于羧基(Ra为羟基),可通过常规的脱水缩合反应(光延反应,使用羧酸酰卤化物、羧酸酐或缩合剂(例如使用WSC、羰基二咪唑、二环己基碳二亚胺)的反应)进行。
反应溶剂例如可举出:乙腈、四氢呋喃、二烷、甲苯、二甲苯、乙酸乙酯、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二甲基咪唑啉酮、N-甲基吗啉、N-甲基吡咯烷酮、甲醇、乙醇、异丙醇等。
化合物(V3)的用量是相对于化合物(XA3)约为1.0~3.0摩尔当量。
反应温度通常为0℃~回流温度,优选20℃~70℃。
反应时间通常为10分钟~50小时,优选1~12小时。
生成的化合物(X4)的R6d不为具有HC(=O)-CH2-、MeO-CH(-OH)-CH2-或CH(-OH)2-CH2-等醛基或其等价体的基团时,可按照与上述同样的方法导出具有醛基或其等价体的基团即HC(=O)-CH2-、MeO-CH(-OH)-CH2-或CH(-OH)2-CH2-等。
氨基被氨基保护基保护时,可按照Protective Groups in Organic Synthesis,Theodora W Green(John Wiley&Sons)中记载的对氨基的保护基脱保护的方法、或按照公知的方法得到脱保护的化合物。进行脱保护反应的顺序可适当变更。
通过本步骤,可得到含有化合物(XA4)的溶液。化合物(XA4)可通过常规的纯化方法(萃取、蒸馏、柱层析、晶析等)分离,也可以无需分离即用于后面的反应。优选以通过晶析除去了杂质的晶体形式分离。
(步骤B’)
本步骤如以下的反应式所示,是根据需要,在碱存在下使化合物(X2)与化合物(V2)和化合物(V2’)反应,得到化合物(X4’)的步骤。
[化学式56]
(式中,各符号与上述相同含义)
式(X2)和(V2)中的R1d、R2d、R3d、R4d和R5d的例子以及优选方式分别与上述相同。
反应溶剂例如可举出:乙腈、四氢呋喃、二烷、甲苯、二甲苯、乙酸乙酯、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二甲基咪唑啉酮、N-甲基吗啉、N-甲基吡咯烷酮等。
碱例如可举出:正丁基锂、叔丁基锂、叔丁醇钠、叔丁醇钾、叔戊醇钠、甲醇钠、乙醇钠、氢化钠、二异丙基氨基锂、双(三甲基甲硅烷基)氨基锂等。
碱的用量是相对于化合物(X2)约为1.0~5.0摩尔当量。
化合物(V2)的用量是相对于化合物(X2)约为1.0~3.0摩尔当量,或者可以将化合物(V2)作为溶剂使用。
反应温度通常为-80℃至回流温度,优选-20℃至30℃。
反应时间通常为10分钟~10小时,优选30分钟~4小时。
接着,在上述反应液中加入化合物(V2’)进行反应。
化合物(V2’)的例子可举出:乙酸铵、氯化铵、臭化铵、硫酸铵、硫酸氢铵、甲酸铵、硝酸铵、氢氧化铵、磷酸铵、NH4+BF4-、NH4+PF6-、NH4+Ph-SO3-、NH4+CH3-Ph-SO3-、NH4+CH3-SO3-等。优选乙酸铵、氯化铵、硫酸铵、硫酸氢铵、甲酸铵。
化合物(V2’)的用量是相对于化合物(X2)约为1.0~3.0摩尔当量。
反应温度通常为0℃~回流温度,优选20℃~80℃。
反应时间通常为10分钟~10小时,优选30分钟~4小时。
通过本步骤,可得到含有化合物(X4’)的溶液。化合物(X4’)可通过常规的纯化方法(萃取、蒸馏、柱层析、晶析等)分离,也可以无需分离即用于后面的反应。优选以通过晶析除去了杂质的晶体形式分离。
(步骤C’)
本步骤如以下的反应式所示,是根据需要,在碱存在下使化合物(X4’)与化合物(V3’)反应,得到化合物(X4)的步骤。
[化学式57]
(式中,各符号与上述相同含义)
式(X4’)和(V3’)中的R1d、R2d、R4d和R6d的例子以及优选方式分别与上述相同。
Ld中的“离去基团”可举出:卤素、-O-SO2-CH3、-O-SO2-CF3、-O-SO2-Ph或-O-SO2-Ph-CH3等。优选卤素。
生成的化合物(X4)中的R6d不具有HC(=O)-CH2-、MeO-CH(-OH)-CH2-或CH(-OH)2-CH2-等醛基或其等价体时,导出醛基或其等价体的方法也与上述相同。
反应溶剂例如可举出:乙腈、乙酸乙酯、N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二甲基咪唑啉酮、N-甲基吗啉、N-甲基吡咯烷酮等。
碱可举出:碳酸钾、碳酸铯、氢化钠、正丁基锂、叔丁基锂、叔丁醇钠、叔丁醇钾、叔戊醇钠、甲醇钠、三乙胺、4-二甲基氨基吡啶、二异丙基乙胺、DBU(1,8-二氮杂双环[5.4.0]十一碳-7-烯)等。
碱的用量是相对于化合物(X4')约为1.0~5.0摩尔当量。
化合物(V3’)的用量是相对于化合物(X4’)约为1.0~4.0摩尔当量,或者可以将化合物(V3’)作为溶剂使用。
反应温度通常为0℃~回流温度,优选20℃~80℃。
反应时间通常为30分钟~24小时,优选1~8小时。
通过本步骤,可得到含有化合物(X4)的溶液。化合物(X4)可通过常规的纯化方法(萃取、蒸馏、柱层析、晶析等)分离,也可以无需分离即用于后面的反应。优选以通过晶析除去了杂质的晶体形式分离。
化合物(X4)中的R6d为-NH2时,也可根据需要,在碱存在下使O-(2,4-二硝基苯基)羟胺试剂与化合物(X4’)反应获得。
反应溶剂可举出:N,N-二甲基甲酰胺、N,N-二甲基乙酰胺、二甲基咪唑啉酮、N-甲基吗啉、N-甲基吡咯烷酮等。
碱可举出碳酸钾、碳酸铯、碳酸钠、碳酸锂等。
碱的用量是相对于化合物(X4’)约为1.0~5.0摩尔当量。
上述试剂的用量是相对于化合物(X4')约为1.0~4.0摩尔当量。
反应温度通常为0℃~回流温度,优选20℃~60℃。
反应时间通常为30分钟~24小时,优选1~8小时。
(步骤D-1)
本步骤是在化合物(X4A)为以下的结构时、获得化合物(I)的步骤。
[化学式58]
(式中,R15为氨基保护基、氢、任选被取代基组E取代的低级烷基、任选被取代基组E取代的低级链烯基、任选被取代基组E取代的低级炔基、任选被取代基组E取代的碳环低级烷基、或任选被取代基组E取代的杂环低级烷基,各符号与上述相同含义)
对化合物(XA4)的酰胺部位(-CONH-R15)和羟基进行分子内脱水缩合反应(例如光延反应),由此可得到闭环物。R15为氨基保护基时,可在进行了公知的脱保护反应之后进行上述分子内脱水缩合反应。
R7不为氢时,可通过对氨基进行公知的亲核取代反应来获得目标R7。
对于-COOR2d部位,R2d不为氢时,可进行公知的反应(酯水解反应、羧基保护基的脱保护反应等),使R2d为氢,然后与任选被取代基组E取代的碳环低级烷基胺、任选被取代基组E取代的低级烷基醇等进行公知的反应(脱水缩合反应等),由此导出-COR1。R2d为甲基或乙基等低级烷基时,通过进行氨解反应,可直接导出-COR1。
R1d为任选被取代基组E取代的低级烷基氧基、任选被取代基组E取代的碳环低级烷基氧基、任选被取代基组E取代的杂环低级烷基氧基或-OSi(R1e)3时,通过进行公知的羟基脱保护反应,可导出羟基。
R1d为卤素时,通过使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,可导出羟基。氢化钠/水(Bioorganic Medicinal Chemistry Letters,17,1713,2007)、氢氧化钾/三(二亚苄基丙酮)二钯(Pd2dba3)/二叔丁基芳基膦(Journal of the American Chemical Society,128,10694,2006)、磷酸钾水合物(K3PO4·H2O)/三(二亚苄基丙酮)二钯(Pd2dba3)/三叔丁基膦(Tetrahedoron Letters,48,473,2007)作为其它的条件,也可作为卤素向羟基的变换反应举出。这样,原料的R1d为卤素时,可以直接进行衍生物化,因此与实施醇的保护和/或脱保护反应的方法比较,反应步骤数减少,可以构建更为有利的工业制法。
R1d为氢时,通过使其与N-溴琥珀酰亚胺、N-氯琥珀酰亚胺、磺酰氯等的卤化剂反应,在将R1d变换为卤素后,同样地使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。因此,可根据反应底物的反应性适当地选择这些R1d。
上述步骤中,可以将各反应的顺序适当更替。
(步骤D-2)
本步骤是当化合物(X4A)为以下结构时,获得化合物(II)的步骤。
[化学式59]
(式中,各符号与上述相同含义)
通过对化合物(XA4)的酰胺部位(-CONH-R15)和羟基进行分子内脱水缩合反应(例如光延反应),可得到闭环物。R15为氨基保护基时,可进行公知的脱保护反应,然后进行上述分子内脱水缩合反应。
R7不为氢时,通过对氨基进行公知的亲核取代反应,可得到目标R7。
对于-COOR2d部位,R2d不为氢时,可进行公知的反应(酯水解反应、羧基保护基的脱保护反应等),使R2d为氢,然后与任选被取代基组E取代的碳环低级烷基胺、任选被取代基组E取代的低级烷基醇等进行公知的反应(脱水缩合反应等),由此可导出-COR1。R2d为甲基或乙基等低级烷基时,通过进行氨解反应,可直接导出-COR1。
R1d为任选被取代基组E取代的低级烷基氧基、任选被取代基组E取代的碳环低级烷基氧基、任选被取代基组E取代的杂环低级烷基氧基或-OSi(R1e)3时,通过进行公知的羟基脱保护反应,可以导出羟基。
R1d为卤素时,使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。氢化钠/水(Bioorganic Medicinal Chemistry Letters,17,1713,2007)、氢氧化钾/三(二亚苄基丙酮)二钯(Pd2dba3)/二叔丁基芳基膦(Journal of the American Chemical Society,128,10694,2006)、磷酸钾水合物(K3PO4·H2O)/三(二亚苄基丙酮)二钯(Pd2dba3)/三叔丁基膦(Tetrahedoron Letters,48,473,2007)作为其它的条件,也可作为卤素向羟基的变换反应举出。这样,原料的R1d为卤素时,可直接进行衍生物化,因此与实施醇的保护和/或脱保护反应的方法比较,反应步骤数减少,可构建更为有利的工业制法。
R1d为氢时,通过使其与N-溴琥珀酰亚胺、N-氯琥珀酰亚胺、磺酰氯等卤化剂反应,在将R1d变换为卤素后,同样地与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。由此可根据反应底物的反应性适当地选择这些R1d。
上述步骤中,各反应的顺序可适当更替。
(步骤D-3)
本步骤是当化合物(X4A)为以下的结构时,获得化合物(I)的步骤。
[化学式60]
(式中,各符号与上述相同含义)
通过对化合物(XA4)的羧基(-COOH)和氨基进行分子内脱水缩合反应(例如光延反应,使用缩合剂的酰胺化反应等),可得到闭环物。R15为氨基保护基时,可以进行公知的脱保护反应,然后进行上述分子内脱水缩合反应。
R7不为氢时,对氨基进行公知的亲核取代反应,由此可获得目标R7。
对于-COOR2d部位,R2d不为氢时,可进行公知的反应(酯水解反应、羧基保护基的脱保护反应等),使R2d为氢,然后与任选被取代基组E取代的碳环低级烷基胺、任选被取代基组E取代的低级烷基醇等进行公知的反应(脱水缩合反应等),由此可导出-COR1。R2d为甲基或乙基等低级烷基时,通过进行氨解反应,可直接导出-COR1。
R1d为任选被取代基组E取代的低级烷基氧基、任选被取代基组E取代的碳环低级烷基氧基、任选被取代基组E取代的杂环低级烷基氧基或-OSi(R1e)3时,通过进行公知的羟基脱保护反应,可以导出羟基。
R1d为卤素时,使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。氢化钠/水(Bioorganic Medicinal Chemistry Letters,17,1713,2007)、氢氧化钾/三(二亚苄基丙酮)二钯(Pd2dba3)/二叔丁基芳基膦(Journal of the American Chemical Society,128,10694,2006)、磷酸钾水合物(K3PO4·H2O)/三(二亚苄基丙酮)二钯(Pd2dba3)/三叔丁基膦(Tetrahedoron Letters,48,473,2007)作为其它的条件,也可作为卤素向羟基的变换反应举出。这样,原料的R1d为卤素时,可直接进行衍生物化,因此,与实施醇的保护和/或脱保护反应的方法比较,反应步骤数减少,可构建更为有利的工业制法。
R1d为氢时,通过使其与N-溴琥珀酰亚胺、N-氯琥珀酰亚胺、磺酰氯等卤化剂反应,将R1d变换为卤素,然后同样地使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。因此,可根据反应底物的反应性适当地选择这些R1d。
上述步骤中,各反应的顺序可适当更替。
(步骤D-4)
本步骤是当化合物(X4A)为以下的结构时,获得化合物(II)的步骤。
[化学式61]
(式中,各符号与上述相同含义)
通过对化合物(XA4)的羧基(-COOH)和氨基进行分子内脱水缩合反应(例如光延反应,使用缩合剂的酰胺化反应等),可得到闭环物。R15为氨基保护基时,进行公知的脱保护反应,然后进行上述分子内脱水缩合反应。
R7不为氢时,通过对氨基进行公知的亲核取代反应,可得到目标R7。
对于-COOR2d部位,R2d不为氢时,进行公知的反应(酯水解反应、羧基保护基的脱保护反应等),使R2d为氢,然后与任选被取代基组E取代的碳环低级烷基胺、任选被取代基组E取代的低级烷基醇等进行公知的反应(脱水缩合反应等),由此可导出-COR1。R2d为甲基或乙基等低级烷基时,通过进行氨解反应,可直接导出-COR1。
R1d为任选被取代基组E取代的低级烷基氧基、任选被取代基组E取代的碳环低级烷基氧基、任选被取代基组E取代的杂环低级烷基氧基或-OSi(R1e)3时,通过进行公知的羟基脱保护反应,可导出羟基。
R1d为卤素时,使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。氢化钠/水(Bioorganic Medicinal Chemistry Letters,17,1713,2007)、氢氧化钾/三(二亚苄基丙酮)二钯(Pd2dba3)/二叔丁基芳基膦(Journal of the American Chemical Society,128,10694,2006)、磷酸钾水合物(K3PO4·H2O)/三(二亚苄基丙酮)二钯(Pd2dba3)/三叔丁基膦(Tetrahedoron Letters,48,473,2007)作为其它条件,也可作为卤素向羟基的变换反应举出。这样,原料的R1d为卤素时,可直接进行衍生物化,因此,与实施醇的保护和/或脱保护反应的方法比较,反应步骤数减少,可构建更为有利的工业制法。
R1d为氢时,使其与N-溴琥珀酰亚胺、N-氯琥珀酰亚胺、磺酰氯等卤化剂反应,由此将R1d变换为卤素,然后同样地使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。因此,可根据反应底物的反应性适当地选择这些R1d。
上述步骤中,各反应的顺序可适当更替。
(步骤D-5)
本步骤是当化合物(XA4)为以下的结构时,获得化合物(II)的步骤。
[化学式62]
(式中,各符号与上述相同含义)
使化合物(X4)的酰胺部位(-CONH-R15)和氨基(-NH-R3)与具有羰基的化合物(R5-CO-R6)进行缩合反应,由此可得到闭环物。R5-CO-R6的例子可举出多聚甲醛,这种情况下,R5和R6为氢。进行上述缩合反应时,可根据需要加入酸。酸例如可举出乙酸、甲酸、硫酸等。
R15为氨基保护基时,进行公知的脱保护反应后可进行上述缩合反应。
R7不为氢时,通过对氨基进行公知的亲核取代反应,可得到目标R7。
对于-COOR2d部位,R2d不为氢时,进行公知的反应(酯水解反应、羧基保护基的脱保护反应等),使R2d为氢,然后与任选被取代基组E取代的碳环低级烷基胺、任选被取代基组E取代的低级烷基醇等进行公知的反应(脱水缩合反应等),由此可导出-COR1。R2d为甲基或乙基等低级烷基时,通过进行氨解反应,可直接导出-COR1。
R1d为任选被取代基组E取代的低级烷基氧基、任选被取代基组E取代的碳环低级烷基氧基、任选被取代基组E取代的杂环低级烷基氧基、或-OSi(R1e)3时,通过进行公知的羟基脱保护反应,可导出羟基。
R1d为卤素时,使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。氢化钠/水(Bioorganic Medicinal Chemistry Letters,17,1713,2007)、氢氧化钾/三(二亚苄基丙酮)二钯(Pd2dba3)/二叔丁基芳基膦(Journal of the American Chemical Society,128,10694,2006)、磷酸钾水合物(K3PO4·H2O)/三(二亚苄基丙酮)二钯(Pd2dba3)/三叔丁基膦(Tetrahedoron Letters,48,473,2007)作为其它的条件,也可作为卤素向羟基的变换反应举出。这样,原料的R1d为卤素时,可直接进行衍生物化,因此与实施醇的保护和/或脱保护反应的方法比较,反应步骤数减少,可构建更为有利的工业制法。
R1d为氢时,使其与N-溴琥珀酰亚胺、N-氯琥珀酰亚胺、磺酰氯等卤化剂反应,将R1d变换为卤素,然后同样地使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。因此,可根据反应底物的反应性适当选择这些R1d。
上述步骤中,各反应的顺序可适当更替。
(步骤D-6)
本步骤是当化合物(X4)为以下的结构时,获得化合物(III)的步骤。
[化学式63]
(式中,各符号与上述相同含义)
化合物(X4)的醛部位与化合物(V4)的氨基和-Y-H反应,由此可得到三环系的化合物。Z为单键时,R14和R10可以一起形成4~8元的任选被取代基组E取代的杂环式基,这种情况下,化合物(III)形成四环系的化合物。
化合物(V4)的例子可举出3-氨基丁醇等。
对于-COOR2d部位,R2d不为氢时,进行公知的反应(酯水解反应、羧基保护基的脱保护反应等),使R2d为氢,然后与任选被取代基组E取代的碳环低级烷基胺、任选被取代基组E取代的低级烷基醇等进行公知的反应(脱水缩合反应等),由此可导出-COR1。R2d为甲基或乙基等低级烷基时,通过进行氨解反应,可直接导出-COR1。
R1d为任选被取代基组E取代的低级烷基氧基、任选被取代基组E取代的碳环低级烷基氧基、任选被取代基组E取代的杂环低级烷基氧基、或-OSi(R1e)3时,进行公知的羟基脱保护反应,由此可以导出羟基。
R1d为卤素时,使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。氢化钠/水(Bioorganic Medicinal Chemistry Letters,17,1713,2007)、氢氧化钾/三(二亚苄基丙酮)二钯(Pd2dba3)/二叔丁基芳基膦(Journal of the American Chemical Society,128,10694,2006)、磷酸钾水合物(K3PO4·H2O)/三(二亚苄基丙酮)二钯(Pd2dba3)/三叔丁基膦(Tetrahedoron Letters,48,473,2007)作为其它的条件,也可作为卤素向羟基的变换反应举出。这样,原料的R1d为卤素时,可直接进行衍生物化,因此与实施醇的保护和/或脱保护反应的方法比较,反应步骤数减少,可构建更为有利的工业制法。
R1d为氢时,通过使其与N-溴琥珀酰亚胺、N-氯琥珀酰亚胺、磺酰氯等卤化剂反应,将R1d变换为卤素,然后同样地使其与三甲基硅烷醇酸钾、三甲基硅烷醇酸锂反应,加入无机酸的水溶液,由此可导出羟基。因此,可根据反应底物的反应性适当选择这些R1d。
上述步骤,各反应的顺序可适当更替。
以下给出本发明的实施例和试验例,进一步详细说明本发明,但本发明并不受它们的限定。实施例中使用的各符号的含义如下所示。
DMF:N,N-二甲基甲酰胺
DMA:N,N-二甲基乙酰胺
NMP:N-甲基吡咯烷酮
DMI:二甲基咪唑啉酮
THF:四氢呋喃
Ms:甲磺酰基
Ts:对甲苯磺酰基
Boc:叔丁氧基羰基
DIBALH:二异丁基氢化铝
WSC:N-乙基-N'-(3-二甲基氨基丙基)碳二亚胺
HOBt:1-羟基苯并三唑
HATU:O-(7-氮杂苯并三唑-1-基)-N,N,N’,N’-四甲基脲六氟磷酸酯
NBS;N-溴琥珀酰亚胺
NCS:N-氯琥珀酰亚胺
TEMPO:2,2,6,6-四甲基哌啶-1-氧基自由基
PDC:二盐酸吡啶鎓(ピリヅニウムヅクロロメ一ト,Pyridinium dichloromate)
DEAD:偶氮二甲酸二乙酯
DIAD:偶氮二甲酸二异丙基酯
DMAP:4-二甲基氨基吡啶
mCPBA:间氯过氧苯甲酸
DBU:1,8-二氮杂双环[5.4.0]-7-十一碳烯
以下以实施例的形式给出本申请的合成方法。
实施例1
[化学式64]
步骤1
在氮气氛下、室温下,在2.55g叔戊醇钠(23.2mmol)的4ml THF悬浮液中加入1.00g苄基醇(9.25mmol)的3ml THF溶液,在40℃下搅拌2小时。将该反应液在冰浴中冷却,在0~10℃下滴加1.53g化合物1A(10.2mmol)的3ml THF溶液。将反应液在室温下搅拌2小时,然后加入15ml的2N盐酸,用乙酸乙酯萃取2次。将合并的萃取液用水、饱和碳酸氢钠水、水、饱和盐水依次洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得的油状物用硅胶柱层析(正己烷-乙酸乙酯4∶1,v/v)纯化,得到1.89g为油状物的化合物1B(收率92%)。
1H-NMR(CDCl3)δ:3.56(2H,s),3.71(3H,s),4.14(2H,s),4.59(2H,s),7.27-7.42(5H,m).
步骤2
将1.80g化合物1B(8.1mmol)溶解于18mL的1,4-二烷中,加入1.45g N,N-二甲基甲酰胺二甲基缩醛(12.2mmol),在室温下搅拌6小时。将反应液减压浓缩,然后将残留物用硅胶柱层析(正己烷-乙酸乙酯1∶4,v/v)纯化,得到1.77g为油状物的化合物1C(收率79%)。
1H-NMR(CDCl3)δ:2.90(3H,br),3.25(3H,br),3.69(3H,s),4.45(2H,s),4.59(2H,s),7.24-7.40(5H,m),7.73(s,1H).
步骤3
在氮气氛下,在三颈烧瓶中加入2.55g叔丁醇钠(23.2mmol)、639mg草酸二甲酯(5.41mmol)、3ml DMI,在25~30℃下向其中滴加0.50g化合物1C(1.80mmol)的2ml DMI溶液。在室温下搅拌7小时,然后加入10ml 2N盐酸,在室温下搅拌15小时。用乙酸乙酯萃取2次,将合并的萃取液用水、饱和碳酸氢钠水、水、饱和盐水依次洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得残余物用硅胶柱层析(正己烷-乙酸乙酯2∶1至1∶1,v/v)纯化,得到488mg为白色晶体的化合物1D(收率85%)。
1H-NMR(CDCl3)δ:3.89(3H,s),3.93(3H,s),5.34(2H,s),7.32-7.40(3H,m),7.45-7.49(2H,m),8.50(1H,s).
实施例2
[化学式65]
步骤1
在氮气氛下、室温下,在1.67g叔戊醇钠(15.2mmol)的4ml DMI悬浮液中加入0.66g苄基醇(6.1mmol)的3ml DMI溶液,在40℃下搅拌2小时。将该反应液在冰浴中冷却,在0~10℃下滴加1.10g化合物2A(6.68mmol)的3ml DMI溶液。将反应液在0~5℃下搅拌2小时、在室温下搅拌3小时搅拌,然后加入15ml 2N盐酸,用乙酸乙酯萃取2次。将合并的萃取液用水、饱和碳酸氢钠水、水、饱和盐水依次洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得的油状物用硅胶柱层析(正己烷-乙酸乙酯4∶1,v/v)纯化,得到1.29g为油状物的化合物2B(收率90%)。
1H-NMR(CDCl3)δ:1.25(3H,t,J=7.2Hz),3.54(2H,s),4.14(2H,s),4.17(2H,q,J=7.2Hz),4.59(2H,s),7.28-7.40(5H,m).
步骤2
将9.73g化合物2B(41.2mmol)溶解于45mL甲苯中,加入7.36g的N,N-二甲基甲酰胺二甲基缩醛(61.8mmol),在室温下搅拌5小时。在反应液中加入水,用乙酸乙酯萃取2次。将合并的萃取液用水、饱和盐水依次洗涤,然后用无水硫酸镁干燥。馏去溶剂,将所得的油状物用硅胶柱层析(正己烷-乙酸乙酯1∶1至3∶7,v/v)纯化,得到7.90g为油状物的化合物2C(收率66%)。
1H-NMR(CDCl3)δ:1.25(3H,t,J=7.2Hz),2.95(3H,br),3.22(3H,br),4.15(2H,q,J=7.2Hz),4.45(2H,s),4.59(2H,s),7.22-7.40(5H,m),7.73(1H,s).
步骤3
在氮气氛下,在三颈烧瓶中加入495mg叔丁醇钠(5.15mmol)、2ml DMI,在25~30℃下向其中滴加608mg草酸二甲酯(5.15mmol)、0.50g化合物2C(1.72mmol)的3ml DMI溶液。在室温下搅拌4小时,然后加入10ml 2N盐酸,在室温下搅拌15小时。用甲苯萃取2次,将合并的萃取液用水、饱和碳酸氢钠水、水、饱和盐水依次洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得残余物用硅胶柱层析(正己烷-乙酸乙酯2∶1,v/v)纯化,得到420mg为白色晶体的化合物2D(收率74%)。
1H-NMR(CDCl3)δ:1.39(3H,t,J=7.2Hz),3.88(3H,s),4.39(2H,q,J=7.2Hz),5.34(2H,s),7.30-7.41(3H,m),7.45-7.50(2H,m),8.48(1H,s).
实施例3
[化学式66]
步骤1
在0℃、冷却下,在5.0g化合物3A(30.4mmol)中滴加4.9ml N,N-二甲基甲酰胺二甲基缩醛(36.5mmol)。在0℃下搅拌1小时,然后在反应液中加入100ml乙酸乙酯,用50ml的0.5N盐酸水洗涤。分取水层,用50ml乙酸乙酯萃取。合并有机层,用饱和碳酸氢钠水、饱和盐水依次洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得残余物用硅胶柱层析(正己烷-乙酸乙酯1∶1(v/v)→乙酸乙酯)纯化,得到4.49g为油状物的化合物3B(收率67%)。
1H-NMR(CDCl3)δ:1.32(3H,t,J=7.1Hz),2.90(3H,br s),3.29(3H,br s),4.23(2H,q,J=7.1Hz),4.54(2H,s),7.81(1H,s).
步骤2
将49ml六甲基二硅基氨基锂(1.0M甲苯溶液,49.0mmol)用44ml四氢呋喃稀释,在-78℃、冷却下,向其中滴加4.49g化合物3B(20.4mmol)的10ml四氢呋喃溶液,然后滴加3.35g乙基草酰氯(24.5mmol)的10ml四氢呋喃溶液。在-78℃下搅拌2小时,然后升温至0℃。在反应液中加入2N盐酸,搅拌20分钟,然后用乙酸乙酯萃取(200ml x2),将有机层用饱和碳酸氢钠水、饱和盐水洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得残余物用硅胶柱层析(正己烷-乙酸乙酯7∶3→5∶5→0∶10(v/v))纯化,得到1.77g为白色固体的化合物3C(收率31%)。
1H-NMR(CDCl3)δ:1.36-1.46(6H,m),4.35-4.52(8H,m),8.53(1H,s).
步骤3
在0℃下,在300mg化合物3C(1.09mmol)的6ml乙醇溶液中加入0.13ml氨基乙醛二甲基缩醛(1.20mmol),在0℃下搅拌1小时30分钟、在室温下搅拌18小时、接着在60℃下搅拌4小时。将反应液减压馏去溶剂,然后将所得残余物用硅胶柱层析(正己烷-乙酸乙酯5∶5→0∶10(v/v))纯化,得到252mg为油状物的化合物3D(收率64%)。
1H-NMR(CDCl3)δ:1.36-1.47(6H,m),3.42(6H,s),3.90(2H,d,J=5.2Hz),4.37(3H,q,J=7.2Hz),4.50(2H,q,J=7.2Hz),8.16(1H,s).
步骤4
在1.02g化合物3D(2.82mmol)的10ml甲酸溶液中加入892mg62%-H2SO4(5.64mmol),在室温下搅拌16小时。减压馏去甲酸,在残余物中加入二氯甲烷,加入饱和碳酸氢钠水,调节为pH=6.6。分取二氯甲烷层,将水层用二氯甲烷萃取。合并二氯甲烷层,用无水硫酸钠干燥。馏去溶剂,得到531.8mg为黄色油状物的化合物3E。
1H-NMR(CDCl3)δ:1.28-1.49(6H,m),4.27-4.56(4H,m),4.84(2H,s),8.10(1H,s),9.72(1H,s).
步骤5
在531mg化合物3E(1.68mmol)的5ml甲苯溶液中加入0.20ml甲醇(5.0mmol)、179mg的(R)-3-氨基-丁烷-1-醇(2.0mmol)、0.096ml乙酸(1.70mmol),加热回流4小时。将反应液冷却至室温,然后用氯仿稀释,然后用饱和碳酸氢钠水洗涤,用氯仿萃取水层。合并氯仿层,用饱和盐水洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得残余物用硅胶柱层析(氯仿-甲醇100∶0→90∶10)纯化,得到309.4mg为褐色油状物的化合物3F。
1H-NMR(CDCl3)δ:1.40(3H,t,J=7.1Hz),1.40(3H,d,J=7.1Hz),1.55-1.61(1H,m),2.19-2.27(1H,m),4.00(1H,d,J=1.5Hz),4.03(1H,d,J=2.5Hz),4.10(1H,dd,J=13.2,6.3Hz),4.26(1H,dd,J=13.2,3.8Hz),4.38(2H,q,J=7.1Hz),5.00-5.05(1H,m),5.31(1H,dd,J=6.4,3.9Hz),8.10(1H,s).
步骤6
在159mg化合物3F(0.47mmol)的2ml 1,2-二甲氧基乙烷溶液中加入333mg三甲基硅烷醇酸钾(2.34mmol),在室温下搅拌7小时。在反应液中加入1N-盐酸和饱和盐水,用氯仿萃取。合并氯仿层,用无水硫酸钠干燥。馏去溶剂,得到34.4mg为橙色粉末的化合物3G(收率25%)。
1H-NMR(CDCl3)δ:1.46(3H,d,J=3.5Hz),1.58-1.65(1H,m),2.26-2.30(1H,m),4.06-4.10(2H,m),4.31(1H,dd,J=13.8,5.6Hz),4.48(1H,dd,J=13.6,3.9Hz),5.03(1H,t,J=6.4Hz),5.36(1H,dd,J=5.5,4.0Hz),8.44(1H,s),12.80(1H,s),14.90(1H,s).
实施例4
[化学式67]
步骤1
在0℃、冷却下,在10.0g化合物4A(76.8mmol)中滴加12.2ml的N,N-二甲基甲酰胺二甲基缩醛(92.2mmol)。在0℃下搅拌1小时30分钟、接着在室温下搅拌2小时30分钟,然后在反应液中加入100ml乙酸乙酯,馏去溶剂。将所得残余物用硅胶柱层析(正己烷-乙酸乙酯5∶5→0∶10(v/v))纯化,得到12.45g为油状物的化合物4B(收率88%)。
1H-NMR(CDCl3)δ:1.32(3H,t,J=7.1Hz),2.33(3H,s),3.04(6H,br s),4.23(2H,q,J=7.2Hz),7.68(1H,s).
步骤2
将24ml六甲基二硅基氨基锂(1.0M甲苯溶液,24.0mmol)用20ml四氢呋喃稀释,在-78℃、冷却下,向其中滴加1.85g化合物4B(10.0mmol)的5ml四氢呋喃溶液,然后滴加1.34ml乙基草酰氯(12.0mmol)的5ml四氢呋喃溶液。在-78℃下搅拌2小时,然后向反应液中加入2N-盐酸,在室温下搅拌20分钟。用乙酸乙酯萃取,将有机层用饱和碳酸氢钠水、饱和盐水依次洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得残余物用硅胶柱层析(正己烷-乙酸乙酯75∶25→455∶5(v/v))纯化,得到1.03g为褐色油状物的化合物4C(收率43%)。
1H-NMR(CDCl3)δ:1.38(3H,t,J=7.1Hz),1.42(3H,t,J=7.4Hz),4.33-4.47(4H,m),7.19(1H,s),8.54(1H,s).
步骤3
在0℃下,在680mg化合物4C(2.83mmol)的6.8ml乙醇溶液中加入0.34ml氨基乙醛二甲基缩醛(3.11mmol),在室温下静置16小时。将反应液减压馏去溶剂,然后将所得残余物用硅胶柱层析(正己烷-乙酸乙酯90∶10(v/v))纯化,得到875mg为油状物的化合物4D(收率94%)。
1H-NMR(CDCl3)δ:1.38(3H,t,J=7.1Hz),1.39(3H,t,J=7.1Hz),3.40(6H,s),4.33(2H,d,J=4.7Hz),4.37(4H,q,J=7.1Hz),4.49(1H,t,J=4.7Hz),7.06(1H,s),8.17(1H,s).
步骤4
在2.68g化合物4D(8.18mmol)的10ml N,N-二甲基甲酰胺溶液中加入1.46g的N-溴琥珀酰亚胺(8.18mmol),在室温下搅拌48小时。在反应液中加入饱和碳酸氢钠水,然后用乙酸乙酯萃取,将有机层用水、饱和盐水依次洗涤,然后用无水硫酸钠干燥。馏去溶剂后,将所得残余物用硅胶柱层析(正己烷-乙酸乙酯90∶10(v/v))纯化,得到2.83g为油状物的化合物4E(收率85%)。
1H-NMR(CDCl3)δ:1.41(3H,t,J=7.1Hz),1.48(3H,t,J=7.1Hz),3.42(6H,s),3.90(2H,d,J=5.0Hz),4.39(2H,q,J=7.1Hz),4.53(3H,q,J=14.3Hz),4.54(3H,s),4.57(3H,t,J=5.4Hz),8.19(1H,s).
步骤5
在2.23g化合物4E(5.49mmol)的15ml甲酸溶液中加入1.74g62%-H2SO4(10.98mmol),在室温下搅拌8小时。加入120ml 0.5N-氢氧化钠水溶液,用二氯甲烷萃取。合并二氯甲烷层,用饱和盐水洗涤,然后用无水硫酸钠干燥。馏去溶剂,得到1.31g为白色粉末的化合物4F。
1H-NMR(CDCl3)δ:1.31-1.46(6H,m),4.33-4.48(4H,m),4.82(2H,s),8.11(1H,s),9.71(1H,s).
步骤6
在1.31g化合物4F(3.64mmol)的13ml甲苯溶液中加入0.44ml甲醇(10.9mmol)、389mg的(R)-3-氨基-丁烷-1-醇(4.36mmol)、0.21ml乙酸(3.64mmol),加热回流3小时。将反应液冷却至室温,然后用氯仿稀释,然后用饱和碳酸氢钠水洗涤,用氯仿萃取水层。合并氯仿层,用饱和盐水洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得残余物用硅胶柱层析(氯仿-甲醇100∶0→90∶10)纯化,得到1.58g为油状物的化合物4G。
1H-NMR(CDCl3)δ:1.40(3H,d,J=5.7Hz),1.56-1.60(1H,m),2.19-2.24(1H,m),3.99(1H,d,J=2.0Hz),4.02(1H,d,J=2.4Hz),4.11(1H,dd,J=13.3,6.7Hz),4.28(1H,dd,J=13.3,3.9Hz),4.36(3H,q,J=7.1Hz),4.49-4.56(1H,m),4.98-5.03(1H,m),5.34(1H,dd,J=6.6,3.8Hz),8.07(1H,s).
步骤7
在300mg化合物4G(0.78mmol)的3ml 1,2-二甲氧基乙烷溶液中加入249mg三甲基硅烷醇酸钾(1.95mmol),在室温下搅拌1小时。追加249mg三甲基硅烷醇酸钾(1.95mmol),进一步在60℃下搅拌1小时。在反应液中加入1N-盐酸和饱和盐水,用氯仿萃取。合并氯仿层,用无水硫酸钠干燥。馏去溶剂,得到100.3mg为黄色粉末的化合物3G(收率43%)。
1H-NMR(CDCl3)δ:1.46(3H,d,J=3.5Hz),1.58-1.65(1H,m),2.26-2.30(1H,m),4.06-4.10(2H,m),4.31(1H,dd,J=13.8,5.6Hz),4.48(1H,dd,J=13.6,3.9Hz),5.03(1H,t,J=6.4Hz),5.36(1H,dd,J=5.5,4.0Hz),8.44(1H,s),12.80(1H,s),14.90(1H,s).
实施例5
[化学式68]
步骤1
将598mg化合物5A(4.09mmol)和488mg的N,N-二甲基甲酰胺二甲基缩醛(4.09mmol)溶解于1ml甲苯中,在室温下搅拌11小时。将反应液减压馏去溶剂,所得残余物(含有化合物5B)无需纯化,用于步骤2。
步骤2
将400mg叔丁醇钠(4.16mmol)悬浮于5ml二甲基咪唑啉酮,向其中加入5ml步骤1中得到的粗产物二甲基咪唑啉酮溶液,然后滴加983mg草酸二甲酯(8.32mmol)的10ml THF溶液,在室温下搅拌45分钟。将反应液倒入到20ml的2N盐酸-甲醇中,在0℃下搅拌20分钟。加入水,然后用乙酸乙酯萃取,将有机层用水、饱和碳酸氢钠水、饱和盐水依次洗涤,用无水硫酸钠干燥。馏去溶剂后,将所得残余物用硅胶柱层析纯化,得到222mg化合物5C(收率:自5A至此为22%)。
1H-NMR(CDCl3)δ:3.91(3H,s),3.97(3H,s),4.05(3H,s),8.50(1H,s).
实施例6
[化学式69]
步骤1
将12ml六甲基二硅基氨基锂(1.0M甲苯溶液,12.0mmol)用11ml四氢呋喃稀释,在-78℃、冷却下,向其中滴加1.46g化合物6A(5.0mmol)的2ml四氢呋喃溶液,然后滴加0.67ml乙基草酰氯(6.0mmol)的2ml四氢呋喃溶液。在-78℃下搅拌2小时,然后在反应液中加入500mg乙酸铵和10ml乙酸,在65℃下搅拌1小时30分钟。在反应液中加入水,用乙酸乙酯萃取,将有机层用水、饱和碳酸氢钠水依次洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得残余物用硅胶柱层析(正己烷-乙酸乙酯55∶45→45∶55(v/v))纯化,得到505.1mg为黄色固体的化合物6B。将其用异丙基醚-己烷(1∶2)洗涤,减压干燥,得到416.8mg为黄色晶体的化合物6B(收率24%)。
1H-NMR(CDCl3)δ:1.35(3H,t,J=7.1Hz),1.46(3H,t,J=7.1Hz),4.40(2H,q,J=7.2Hz),4.50(2H,q,J=7.1Hz),5.20(2H,s),7.33-7.41(3H,m),7.49-7.52(2H,m),8.76(1H,s),11.61(1H,br s).
步骤2
在51.8mg化合物6B(0.15mmol)的1ml N,N-二甲基甲酰胺溶液中加入73.3mg碳酸铯(0.23mmol)和38.0mg溴乙醛二甲基缩醛(0.23mmol),在室温下搅拌过夜。追加73.3mg碳酸铯(0.23mmol)和38.0mg溴乙醛二甲基缩醛(0.23mmol),进一步在100℃下搅拌20分钟。在反应液中加入水,然后用乙酸乙酯萃取,将有机层用水、饱和盐水依次洗涤,然后用无水硫酸钠干燥。馏去溶剂,将所得残余物用硅胶柱层析(正己烷-乙酸乙酯50∶50→30∶70(v/v))纯化,得到35.3mg为无色油状物的化合物6C(收率54%)。
1H-NMR(CDCl3)δ:1.26(3H,t,J=7.1Hz),1.40(3H,t,J=7.1Hz),3.39(6H,s),3.91(2H,d,J=5.0Hz),4.29(2H,q,J=7.1Hz),4.40(2H,q,J=7.2Hz),4.50(1H,t,J=5.0Hz),5.30(2H,s),7.31-7.37(3H,m),7.43-7.46(2H,m),8.12(1H,s).
实施例7
[化学式70]
步骤1
将291mg化合物6A(1.0mmol)和354mg草酸二甲酯(3.0mmol)溶解于1.4ml二甲基咪唑啉酮中,向其中加入0.30ml甲醇钠(28%-甲醇溶液,1.5mmol),在室温下搅拌2小时。向其中加入154mg的1,3-二氧戊环-2-基-甲胺(1.5mmol)和0.29ml乙酸(5.0mmol),在室温下搅拌38小时。在反应液中加入饱和碳酸氢钠水,用乙酸乙酯萃取。合并乙酸乙酯层,用水、饱和盐水依次洗涤,用无水硫酸钠干燥。馏去溶剂,然后将所得残余物用硅胶柱层析(己烷-乙酸乙酯33∶67→15∶85)纯化,得到294.8mg为淡黄色油状物的化合物6C’(收率70%)。
1H-NMR(CDCl3)δ:1.43(3H,t,J=7.1Hz),3.73-3.75(2H,m),3.81(3H,s),3.82-3.85(2H,m),4.21(2H,d,J=2.2Hz),4.42(2H,q,J=7.1Hz),5.14(1H,t,J=2.3Hz),5.32(2H,s),7.34-7.37(3H,m),7.44-7.46(2H,m),8.14(1H,s).
实施例8
[化学式71]
步骤1
在900mg化合物8A(2.60mmol)的5ml乙醇溶液中加入氨基乙醛二甲基缩醛(7.80mmol),在室温下搅拌22小时。在反应液中加入5ml乙酸乙酯和5ml水,用5ml乙酸乙酯萃取。将有机层用10ml水洗涤,然后馏去溶剂,将所得残余物用硅胶柱层析(正己烷-乙酸乙酯2∶1)纯化,得到0.37g为无色油状物的化合物6C(收率33%)。
1H-NMR(CDCl3)δ:7.90(1H,s),7.45-7.43(5H,m),5.30(2H,s),4.51(1H,t,J=5.1Hz),4.40(2H,q,J=7.1Hz),4.30(2H,q,J=7.1Hz),3.91(2H,d,J=5.1Hz),3.46(6H,s),1.40(3H,t,J=7.1Hz),1.26(3H,t,J=7.1Hz).
步骤2
在433.5mg化合物6C(1.0mmol)的4ml甲酸溶液中加入316mg的62%-H2SO4(2.0mmol),在室温下搅拌3小时。在反应液中加入二氯甲烷,用12ml 0.5N-氢氧化钠水溶液洗涤,将水层用二氯甲烷萃取。合并二氯甲烷层,用饱和盐水洗涤,然后用无水硫酸钠干燥。馏去溶剂,得到207.6mg为黄色泡沫状物的化合物8C(收率51%)。
1H-NMR(CDCl3)δ:1.23(3H,t,J=7.1Hz),1.42(3H,t,J=7.1Hz),4.25(2H,q,J=7.2Hz),4.42(2H,q,J=7.1Hz),4.79(2H,s),5.34(2H,s),7.31-7.53(5H,m),8.05(1H,s),9.67(1H,s).
实施例9
[化学式72]
步骤1
在氮气氛下,在双颈烧瓶中,将291.3mg化合物9C(10mmol)溶解于1.4mL DMI中,加入354.3mg草酸二甲酯(3.0mmol)、0.3mL甲醇钠(28%-甲醇溶液,1.5mmol),在室温下搅拌2小时。向其中加入154.7mg的2-(氨基甲基)-1,3-二烷(1.5mmol)和0.29mL乙酸(5.0mmol),在室温下搅拌5小时。在反应液中加入50mL乙酸乙酯,用20mL水、20mL 10%-氯化铵水溶液、20mL水、20mL饱和盐水依次洗涤,用无水硫酸镁干燥。馏去溶剂,将所得残余物用硅胶柱层析(正己烷-乙酸乙酯1∶1→1∶3,v/v)纯化,得到99.0mg为白色晶体的化合物9C’(收率25%)。
1H-NMR(CDCl3)δ:8.14(1H,s),7.44-7.42(5H,m),5.29(2H,s),5.12(1H,s),4.19(2H,s),3.93(3H,s),3.83-3.70(2H,m),3.83(2H,s).
实施例10
[化学式73]
步骤1
将318.3mg化合物1D(1.0mmol)和0.023mL乙酸(0.4mmol)溶解于2mL甲苯中,在65℃下滴加132.2mg肼基甲酸叔丁酯(1.0mmol)的2mL甲苯溶液中,在65℃下搅拌5小时。在反应液中加入饱和碳酸氢钠水,用乙酸乙酯萃取。将有机层用饱和盐水洗涤,用无水硫酸镁干燥。馏去溶剂后,将所得残余物用硅胶柱层析(己烷∶乙酸乙酯=50∶50→33∶67)纯化,得到315.3mg化合物10B(收率72.9%)。
1H-NMR(DMSO-d6)δ:1.36(9H,s),3.84(6H,s),5.11(2H,s),7.34-7.38(5H,m),8.33(1H,s),11.11(1H,br s).
步骤2
在310.3mg化合物10B(0.72mmol)的四氢呋喃-甲醇(2mL-1mL)中加入1.44mL的1N氢氧化锂水溶液(1.44mmol),在室温下搅拌2小时。在冰水浴中冷却,加入2N盐酸,然后加入乙酸乙酯和水。分取乙酸乙酯层,将水层用乙酸乙酯萃取。合并乙酸乙酯层,用饱和盐水洗涤,用无水硫酸钠干燥。馏去溶剂,得到284.1mg化合物10C(收率94.3%)。
1H-NMR(CDCl3)δ:1.43(9H,s),3.98(3H,s),5.34(2H,s),7.36-7.37(5H,m),8.44(1H,s),14.53(1H,br s).
实施例11
[化学式74]
步骤1
将12.8g化合物11A(89.4mmol)和8.50g吡啶(107mmol)的90mL二氯甲烷溶液冷却至1~3℃,一边保持该温度一边用50分钟滴加19.8g苄氧基乙酰氯(107mmol)的90mL二氯甲烷溶液。将反应液在该温度下搅拌30分钟,然后用60分钟缓慢升高至15℃,加入冰水。分离二氯甲烷层,将水层用二氯甲烷萃取1次。将合并的萃取液洗涤3次,用饱和盐水洗涤,然后干燥。馏去溶剂,将所得的油状物过硅胶柱层析进行纯化。先用正己烷洗脱,接着用正己烷-乙酸乙酯(1∶1,v/v)洗脱。浓缩目标组分,则得到22.2g为油状物的化合物11B。
1H-NMR(CDCl3)δ:1.25(3H,t,J=7.2Hz),2.90(3H,brs),3.24(3H,brs),4.15(2H,q,J=7.2Hz),4.45(2H,s),4.58(2H,s),7.25-7.38(5H,m),7.72(1H,s).
步骤2
将4.29ml 1当量的六甲基二硅氮烷锂的THF溶液(4.29mmol)冷却至-78℃,一边保持该温度一边用3分钟滴加500mg化合物11B(1.72mmol)和343.2mg肉桂酰氯(2.06mmol)的4ml THF溶液。将反应液在该温度下搅拌25分钟,然后加入10ml 2当量盐酸,进一步在室温下搅拌10分钟。在反应溶液中加入乙酸乙酯,分离有机层,将水层用乙酸乙酯萃取3次。将合并的萃取液用硫酸钠干燥。馏去溶剂,将所得的油状物过硅胶柱层析进行纯化。由用正己烷-乙酸乙酯(1∶1,v/v)洗脱的组分得到364.3mg为固体的化合物11C(收率56%)。
1H-NMR(CDCl3)δ:1.40(3H,t,J=7.2Hz),4.39(2H,q,J=7.2Hz),5.27(2H,s),6.99(1H,d,J=16.2Hz),7.23(1H,d,J=16.2),7.26-7.48(10H,m),8.45(1H,s).
步骤3
在氮气流下、室温下,用10分钟向化合物11C和2.76mg氯化钌(0.0133mmol)的5ml MeCN溶液中滴加625.8mg高碘酸钠(2.93mmol)和287.4mg 96%硫酸(2.93mmol)的8ml水溶液。将反应液在该温度下搅拌5分钟,然后加入乙酸乙酯,分离有机层,将水层用乙酸乙酯萃取2次。将合并的萃取液用硫酸钠干燥。馏去溶剂,将所得的油状物过硅胶柱层析进行纯化。从用正己烷-乙酸乙酯(1∶1,v/v)洗脱的组分中得到303.2mg为油状物的化合物11D(收率75%)。
1H-NMR(CDCl3)δ:1.39(3H,t,J=6.9Hz),4.40(2H,q,J=6.9Hz),5.54(2H,s),7.37(5H,s),8.48(1H,s),9.85(1H,s).
步骤4
在室温下,在1.00g化合物11D(3.31mmol)的15ml MeCN溶液中加入421.7mg 96%硫酸(4.30mmol)和642.7mg amidosululic acid(6.62mmol)的10ml水溶液,搅拌,一边保持该温度一边用5分钟滴加388.9mg次氯酸钠(4.30mmol)的10ml水溶液。将反应液在该温度下搅拌5分钟,然后加入饱和盐水,用乙酸乙酯萃取3次。将合并的萃取液用硫酸钠干燥。馏去溶剂,将所得的油状物过硅胶柱层析进行纯化。先用氯仿洗脱,接着用氯仿-MeOH(7∶3,v/v)洗脱。浓缩目标组分,得到748.8mg为油状物的化合物11E(收率71%)。
1H-NMR(CDCl3)δ:1.40(3H,t,J=7.2Hz),3.93(1H,br s),4.40(2H,q,J=7.2Hz),5.61(2H,s),7.38-7.44(10H,m),8.52(1H,s).
步骤5
在室温下,在1.00g化合物11E(3.14mmol)的10ml DMF溶液中加入1.20g WSC HCl(6.28mmol)和551.6mg HOBt(4.08mmol),在该温度下搅拌90分钟。将反应液冷却至0℃,用3分钟滴加236.0mg 2-甲氧基乙胺(3.14mmol)的2ml DMF溶液。将反应液在该温度下搅拌1小时,加入水,用乙酸乙酯萃取3次。将萃取液水洗3次,用硫酸钠干燥。馏去溶剂,将所得的油状物过硅胶层析进行纯化。先用正己烷-乙酸乙酯(1∶1,v/v)洗脱,接着用正己烷-乙酸乙酯(1∶9,v/v)洗脱。浓缩目标组分,得到928.5mg为油状物的化合物11F(收率79%)。
1H-NMR(CDCl3)δ:1.39(3H,t,J=7.2Hz),3.29(3H,s),3.41(2H,t,J=5.4Hz),3.47-3.53(2H,m),4.39(2H,q,J=7.2Hz),5.44(2H,s),7.36(3H,m),7.44-7.47(2H,m),8.07(1H,br s),8.54(1H,s).
步骤6
将500mg化合物11F(1.33mmol)和604.2mg(S)-2-氨基-3-苯基丙烷-1-醇(4.0mmol)的2ml二甲苯溶液加热至120℃,搅拌30分钟。将反应溶液冷却至室温,馏去溶剂,然后将所得的油状物过硅胶层析进行纯化。先用氯仿洗脱,接着用氯仿-MeOH(9∶1,v/v)洗脱。浓缩目标组分,得到487mg为油状物的化合物11G(收率72%)。
1H-NMR(CDCl3)δ:1.41(3H,t,J=6.9Hz),2.24-2.34(1H,m),2.24-3.00(1H,m),3.03-3.16(1H,m),3.05(3H,m),3.25-3.32(2H,m),4.13-4.19(1H,m),4.17-4.30(1H,m),4.36-4.47(1H,m),4.51-4.54(1H,m),4.55(1H,d,J=10.5Hz),5.78(1H,t,J=6.9Hz),7.17-7.26(4H,m),7.28-7.35(5H,m),7.49(1H,t,J=5.4Hz),6.32(1H,s).
步骤7
在室温下,用3分钟向2.86g化合物11G(5.63mmol)和2.21g三苯膦(8.45mmol)的6ml THF溶液中滴加3.68g的DEAD 40%wt甲苯溶液(8.45mmol)。将反应液在该温度下搅拌30分钟,馏去溶剂,然后将所得的油状物过硅胶层析进行纯化。从用乙酸乙酯-MeOH(9∶1,v/v)洗脱的组分中得到1.37g为油状物的化合物11H(收率50%)。
1H-NMR(CDCl3)δ:1.31(3H,t,J=7.2Hz),3.07(2H,d,J=6.9Hz),3.33(3H,s),3.57-3.80(4H,m),3.95(1H,dd,J=3.0Hz,6.6Hz),4.01-4.14(1H,m),4.16-4.34(2H,m),5.24(1H,d,J=9.9Hz),5.51(1H,d,J=9.9Hz),7.01-7.03(2H,m),7.21-7.37(5H,m),7.41-7.58(1H,m),7.64-7.69(2H,m).
步骤8
在1.0g化合物11H(2.04mmol)的6ml EtOH溶液中加入6ml的2当量氢氧化钠水溶液,在室温下搅拌30分钟。将反应液用2当量盐酸中和,滤取析出的固体,干燥,得到754mg化合物11I(收率80%)。
1H-NMR(CDCl3)δ:3.10(2H,d,J=7.8Hz),3.33(3H,s),3.57-3.69(4H,m),3.82-3.90(1H,m),3.95(1H,dd,J=3.3Hz,13.8Hz),4.36(1H,dd,J=6.3Hz,7.5Hz),5.36(1H,d,J=10.2Hz),5.45(1H,d,J=10.2Hz),6.98-7.01(2H,m),7.28-7.39(6H,m),7.59(2H,dd,J=1.8Hz,8.1Hz),7.87(1H,s).
步骤9
将1.0g化合物11I(2.16mmol)溶解于10ml THF中,加入200mg10%Pd-C,在氢气流下进行催化还原反应。过滤除去催化剂,浓缩滤液。将所得残余物用醚洗涤,得到512mg化合物11(收率64%)。
1H-NMR(CDCl3)δ:6.24(2H,d,J=6.3Hz),3.36(3H,s),3.60-3.86(5H,m),4.14(1H,d,J=12.9Hz),4.47(1H,s),7.03-7.05(2H,m),7.30-7.35(3H,m),7.88(1H,s),12.68(1H,s),14.83(1H,s).
实施例12
[化学式75]
步骤1
将1.53g化合物12A(5.80mmol)溶解于6ml THF和6ml水中,加入2.41g碳酸钾(17.4mmol),搅拌,在0℃下滴加1.09g氯甲酸苄基酯(6.38mmol)。在0℃下搅拌10分钟,然后在室温下搅拌2小时。将反应液倒入到碳酸氢钠水中,用乙酸乙酯萃取。将萃取液用1当量盐酸和饱和盐水洗涤,然后用硫酸钠干燥。馏去溶剂,得到2.32g为无色胶状物质的化合物12B。
1H-NMR(CDCl3)δ:1.98(1H,brs),3.55(1H,m),3.75(1H,m),4.20(1H,d,J=10.5Hz),4.58(1H,m),4.83(1H,brs),5.07(2H,s),7.16-7.39(15H,m).
步骤2
将1.94g化合物12B(5.37mmol)和2.11g三苯膦(8.05mmol)和948mg邻苯二甲酰亚胺(6.44mmol)加入到20ml THF中,在室温下滴加3.66ml偶氮二甲酸二异丙酯(2.2M甲苯,8.05mmol)。在室温下搅拌4小时,然后减压馏去溶剂。将所得的粗产物用硅胶柱层析(正己烷-乙酸乙酯,1∶1,v/v)纯化,得到2.39g为无色固体的化合物12C。
1H-NMR(CDCl3)δ:3.73(2H,m),4.05(1H,d,J=10.1Hz),4.70(1H,d,J=9.6Hz),4.77(2H,d,J=7.2Hz)5.02(1H,m),7.03-7.42(15H,m),7.68(2H,dd,J=5.7,2.1Hz),7.78(2H,dd,J=5.7,2.1Hz).
步骤3
将2.39g化合物12C(4.87mmol)加入到20ml THF和20ml甲醇中,加入4.88g水合肼(97.4mmol),在50℃下搅拌4小时。滤除白色沉淀物,用甲醇洗涤。减压馏去滤液,然后将所得的粗产物用氨基柱层析(氯仿-甲醇,99∶1,v/v)纯化,得到1.41g为无色固体的化合物12D。
1H-NMR(CDCl3)δ:2.63(1H,dd,J=13.2,5.8Hz),2.86(1H,d,J=9.9Hz),4.07(1H,d,J=10.4Hz),4.53(1H,m),4.81(1H,m),5.00(2H,d,8.4Hz),7.20-7.36(10H,m).
步骤4
将1.41g化合物12D(3.9l mmol)溶解于15ml THF中,在室温下加入896mg Boc2O(4.11mmol)。搅拌1.5小时,然后减压浓缩溶剂。将所得的粗产物用硅胶柱层析(正己烷-乙酸乙酯,1∶1,v/v)纯化,得到1.77g为无色固体的化合物12E。
1H-NMR(CDCl3)δ:1.41(9H,s),3.23(2H,brm),3.97(1H,d,J=9.8Hz),4.58-4.80(3H,m),5.00(2H,d,J=9.8Hz),7.15-7.29(10H,m).
步骤5
将1.73g化合物12E(3.76mmol)和200mg钯-活性炭(10%,湿法)加入到20ml甲醇中,在氢气氛下、在室温下搅拌1小时。Celite过滤,然后减压浓缩溶剂,得到1.01g无色油状物质12F。
1H-NMR(CDCl3)δ:1.44(9H,s),2.82(1H,m),3.31(1H,m),3.73(2H,d,J=6.9Hz),4.98(1H,s),7.18-7.39(10H,m).
步骤6
将974mg 3-(苄氧基)-4-氧代-4H-吡喃-2,5-二甲酸二甲酯(3.06mmol)和999mg的12F(3.06mmol)加入到10ml甲苯中,在110℃下搅拌5小时。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,98∶2,v/v)纯化,得到1.51g为淡黄色固体的化合物12G。
1H-NMR(CDCl3)δ:1.36(9H,s),3.40(1H,m),3.53(1H,m),3.82(3H,s),3.91(3H,s),4.29(1H,d,J=11.3Hz),4.78(1H,m),4.82(1H,m),5.11(1.9H,d,J=7.5Hz),7.10-7.38(10H,m),8.27(1H,s).
步骤7
在1.45g化合物12G(2.31mmol)中加入20ml的4当量HCl(乙酸乙酯溶液),在室温下搅拌1.5小时。减压馏去溶剂,然后加入饱和碳酸氢钠水,在室温下搅拌1.5小时。用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,95∶5,v/v)纯化,得到1.01g为无色固体的化合物12H。
1H-NMR(CDCl3)δ:3.40(1H,dd,J=13.6,6.6Hz),3.78(3H,s),3.80(1H,m),4.37(1H,d,J=11.6Hz),4.59(1H,d,J=11.0Hz),5.43(2H,d,J=10.2Hz),5.93(1H,d,J=5.8Hz),7.03-7.21(5H,m),7.37(9H,m),7.63(2H,m).
步骤8
将50mg化合物12H(0.10mmol)溶解于1ml DMF中,加入165mg碳酸铯(0.50mmol)。在室温下搅拌30分钟,然后加入0.032ml碘甲烷(0.50mmol)。在室温下搅拌3.5小时。将反应液倒入到水中,用乙酸乙酯萃取,然后用硫酸钠干燥。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,95∶5,v/v)纯化,得到49mg为无色固体的化合物12I。
步骤9
将49mg化合物12I(0.096mmol)溶解于0.5ml THF和0.5ml甲醇中,在室温下加入0.24ml 2当量氢氧化钠水溶液(0.48mmol),直接搅拌1.5小时。加入1当量盐酸后用乙酸乙酯萃取,然后用硫酸钠干燥。减压馏去溶剂后,得到54mg为无色固体的化合物12J。
MS:m/z=481[M+H]+.
步骤10
在步骤9得到的化合物12J中加入1ml三氟乙酸,在室温下搅拌1小时。减压浓缩,然后用碳酸氢钠水和2当量盐酸将pH调节为3,用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后加入氯仿-甲醇-乙醚,滤取析出的固体,得到26mg为无色固体的化合物12。
1H-NMR(DMSO-d6)δ:3.01(3H,s),3.26(1H,t,J=14.4Hz),4.23(1H,dd,J=13.5,3.8Hz),4.57(1H,d,J=11.6Hz),5.78(1H,d,J=11.3Hz),7.16-7.70(10H,m),8.00(1H,s),13.00(1H,s),15.10(1H,s).
MS:m/z=405[M+H]+.
实施例13
[化学式76]
步骤1
将3.20g化合物28A(17.1mmol)加入到20ml THF中,加入2.60ml三乙胺(18.8mmol),在室温下搅拌10分钟。在室温下加入4.09g Boc2O(18.8mmol),然后直接搅拌2小时。减压馏去溶剂,加入水,用乙酸乙酯萃取。用饱和盐水洗涤有机层,用硫酸钠干燥。减压馏去溶剂,得到5.17g为无色固体的化合物28B。
1H-NMR(CDCl3)δ:1.52(9H,s),2.77(2H,m),3.03-3.12(1H,m),3.38(1H,m),3.90-3.98(1H,m),4.93(1H,brs),7.20-7.35(5H,m).
步骤2
将4.29g化合物28B(17.1mmol)和5.37g三苯膦(20.5mmol)和2.76g邻苯二甲酰亚胺(18.8mmol)加入到60ml THF中,在室温下滴加11.6ml偶氮二甲酸二乙酯(2.2M甲苯,25.6mmol)。在室温下搅拌1小时,然后减压馏去溶剂。将所得的粗产物用硅胶柱层析(正己烷-乙酸乙酯,2∶1,v/v)纯化,得到6.13g为无色固体的化合物28C。
1H-NMR(CDCl3)δ:1.30(9H,s),3.14(1H,dd,J=13.8,6.2Hz),3.39(2H,m),3.87(1H,m),4.67(1H,m),4.81(1H,brs),7.16-7.19(5H,m),7.66(2H,dd,J=5.3,3.1Hz),7.75(2H,dd,J=5.7,3.0Hz).
步骤3
将1.00g化合物28C(2.63mmol)加入到7ml THF和7ml甲醇中,加入2.63g水合肼(52.6mmol),在50℃下搅拌2小时。滤除白色沉淀物,用甲醇洗涤。减压馏去滤液,然后将所得的粗产物用氨基柱层析(氯仿-甲醇,99∶1,v/v)纯化,得到249mg为无色固体的化合物28D。
1H-NMR(CDCl3)δ:1.44(9H,s),1.95(2H,brs),2.55-3.31(5H,m),5.06(1H,brs),7.18-7.33(5H,m).
步骤4
将313mg 3-(苄氧基)-4-氧代-4H-吡喃-2,5-二甲酸二甲酯(0.983mmol)和246mg 28D(0.983mmol)加入到3ml甲苯中,在100℃下搅拌2.5小时。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,98∶2,v/v)纯化,得到320mg为淡黄色胶状物质的化合物28E。
1H-NMR(CDCl3)δ:1.42(9H,s),3.07(2H,m),3.56(2H,m),3.68(3H,s),3.95(3H,s),4.26(1H,s),4.86(1H,s),5.18(1H,d,J=10.8Hz),5.22(1H,d,J=10.8Hz),7.01(2H,m),7.24-7.38(8H,m),8.22(1H,s).
MS:m/z=551[M+H]+.
步骤5
在315mg化合物28E(0.572mmol)中加入5ml的4当量HCl(乙酸乙酯溶液),在室温下搅拌30分钟。减压馏去溶剂,然后加入饱和碳酸氢钠水,用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,95∶5,v/v)纯化,得到210mg为无色固体的化合物28F。
1H-NMR(CDCl3)δ:3.07-3.15(2H,m),3.34(1H,dd,J=13.2,6.0Hz),3.74(2H,m),3.86(3H,s),4.12(1H,m),5.27(1H,d,J=10.1Hz),5.47(1H,d,J=10.1Hz),6.76(1H,d,J=6.4Hz),7.04(2H,m),7.32(6H,m),7.62(2H,dd,J=7.7,l.4Hz),7.70(1H,s).
MS:m/z=419[M+H]+.
步骤6
将50mg化合物28F(0.12mmol)溶解于1ml DMF中,加入195mg碳酸铯(0.597mmol)。在室温下搅拌30分钟,然后加入0.048ml碘乙烷(0.60mmol),在室温下搅拌3.5小时。将反应液倒入到水中,用乙酸乙酯萃取,然后用硫酸钠干燥。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,95∶5,v/v)纯化,得到47mg为无色固体的化合物28G。
1H-NMR(CDCl3)δ:1.22(3H,t,J=7.2Hz),3.00-3.15(2H,m),3.28(1H,dd,J=13.6,1.6Hz),3.48(1H,m),3.75(1H,m),3.85(3H,s),3.88(1H,dd,J=13.3,3.2Hz),4.15(1H,m),5.25(1H,d,J=9.9Hz),5.50(1H,d,J=9.9Hz),7.04(2H,m),7.29-7.38(6H,m),7.60(1H,s),7.68(2H,m).
MS:m/z=447[M+H]+.
步骤7
将47mg化合物28G(0.11mmol)溶解于0.5ml THF和0.5ml甲醇中,在室温下加入0.26ml的2当量氢氧化钠水溶液(0.53mmol),直接搅拌1小时。加入1当量盐酸后用乙酸乙酯萃取,然后用硫酸钠干燥。减压馏去溶剂后,得到40mg为无色固体的化合物28H。
MS:m/z=433[M+H]+.
步骤8
在步骤7得到的化合物28H中加入1ml三氟乙酸,在室温下搅拌1小时。减压浓缩,然后用碳酸氢钠水和2当量盐酸将pH调节为3,用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后加入氯仿-甲醇-乙醚,滤取析出的固体,得到17mg为无色固体的化合物28。
1H-NMR(DMSO-d6)δ:1.17(3H,t,J=7.2Hz),3.08(2H,m),3.51-3.63(3H,m),4.08(1H,dd,J=13.6,3.9Hz),5.03(1H,brs),7.21(5H,m),8.07(1H,s),12.98(1H,s),15.07(1H,brs).
MS:m/z=343[M+H]+.
实施例14
[化学式77]
步骤1
将2.00g化合物43A(6.11mmol)和2.40g三苯膦(9.16mmol)和1.08g邻苯二甲酰亚胺(7.33mmol)加入到20ml THF中,在室温下滴加4.16ml偶氮二甲酸二乙酯(2.2M甲苯,9.16mmol)。室温下搅拌3小时,然后减压馏去溶剂。将所得的粗产物用硅胶柱层析(正己烷-乙酸乙酯,1∶1,v/v)纯化,得到2.39g为无色固体的化合物43B。
1H-NMR(DMSO-d6)δ:1.00(9H,s),3.30(1H,m),3.61(1H,dd,J=13.4,10.2Hz),4.15(1H,d,J=12.2Hz),4.75(1H,m),6.79(1H,d,J=9.5Hz),7.25(15H,m),7.76-7.89(4H,m).
步骤2
将2.06g化合物43B(4.51mmol)加入到20ml THF和20ml甲醇中,加入4.52g水合肼(90.2mmol),在60℃下搅拌5小时。滤除白色沉淀物,用甲醇洗涤。减压馏去滤液,然后将所得的粗产物用氨基柱层析(氯仿-甲醇,99∶1,v/v)纯化,加入正己烷,滤取析出的固体,得到1.25g为无色固体的化合物43C。
1H-NMR(CDCl3)δ:1.32(9H,s),2.55(1H,dd,J=13.3,6.0Hz),2.80(1H,dd,J=13.3,3.5Hz),3.99(1H,d,J=10.1Hz),4.47(2H,m),7.13-7.33(10H,m).
步骤3
将488mg 3-(苄氧基)-4-氧代-4H-吡喃-2,5-二甲酸二甲酯(1.53mmol)和500mg 43C(1.53mmol)加入到8ml甲苯中,在110℃下搅拌1小时。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,97∶3→96∶4→94∶6,v/v)纯化,得到667mg为淡黄色胶状物质的化合物43D。
1H-NMR(CDCl3)δ:1.28(9H,s),3.63(3H,s),3.80(1H,m),3.87(3H,s),4.02(1H,dd,J=14.5,10.1Hz),4.21(1H,d,J=10.4Hz),4.47(2H,m),5.20(1H,d,J=10.8Hz),5.26(1H,d,J=10.7Hz),7.30(15H,m),8.05(1H,s).
MS:m/z=627[M+H]+.
步骤4
在664mg化合物43D(1.06mmol)中加入10ml的4当量HCl(乙酸乙酯溶液),在室温下搅拌1小时。减压馏去溶剂,然后加入THF和饱和碳酸氢钠水,搅拌2.5小时。用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后加入二氯甲烷-乙醚,滤取析出的固体,得到458mg为无色固体的化合物43E。
1H-NMR(CDCl3)δ:3.86(3H,m),3.92(3H,s),4.41-4.48(1H,m),5.32(1H,d,J=10.8Hz),5.42(1H,d,J=10.1Hz),5.92(1H,s),7.21-7.39(13H,m),7.59(2H,m),7.89(1H,s).
MS:m/z=495[M+H]+.
步骤5
将50mg化合物43E(0.10mmol)溶解于1ml DMF中,加入165mg碳酸铯(0.51mmol)。在室温下搅拌30分钟,然后加入0.025ml碘甲烷(0.40mmol),在室温下搅拌1小时。将反应液倒入到水中,用乙酸乙酯萃取,然后用硫酸钠干燥。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,97∶3→95∶5,v/v)纯化,得到60mg为无色固体的化合物43F。
1H-NMR(CDCl3)δ∶2.57(3H,s),3.75(2H,d,J=11.3Hz),3.93(3H,s),4.20-4.29(2H,m),5.25(1H,d,J=9.9Hz),5.57(1H,d,J=9.9Hz),7.15-7.41(13H,m),7.63(1H,s),7.72-7.76(2H,m).
步骤6
将步骤5中得到的化合物43F溶解于0.5ml THF和0.5ml甲醇中,在室温下加入0.25ml的2当量氢氧化钠水溶液(0.50mmol),直接搅拌1小时。加入1当量盐酸后用乙酸乙酯萃取,然后用硫酸钠干燥。减压馏去溶剂后,得到无色胶状的化合物43G。
步骤7
在步骤6得到的化合物43G中加入2ml三氟乙酸,在室温下搅拌1小时。减压浓缩,然后用碳酸氢钠水和2当量盐酸将pH调节为3,用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后加入氯仿-乙醚,滤取析出的固体,得到27mg为无色固体的化合物43。
1H-NMR(DMSO-d6)δ:2.53(3H,s),4.26(1H,d,J=10.9Hz),4.35(1H,d,J=13.3Hz),4.58(1H,dd,J=13.8,3.5Hz),5.06(1H,d,J=10.9Hz),7.36(10H,m),8.36(1H,s),12.58(1H,s),15.62(1H,s).
MS:m/z=405[M+H]+.
实施例15
[化学式78]
步骤1
在0℃下,向52.0ml戴斯-马丁氧化剂(0.3M,二氯甲烷溶液,15.6mmol)中滴加2.97g化合物49A(10.4mmol)的20ml二氯甲烷溶液。室温下搅拌3小时,然后倒入到1当量氢氧化钠水溶液中,用乙醚萃取。将有机层用1当量氢氧化钠水溶液和饱和盐水洗涤,用硫酸镁干燥。减压馏去溶剂,得到2.08g为白色固体的化合物49B。
1H-NMR(CDCl3)δ:3.13(2H,d,J=6.6Hz),4.53(1H,q,J=6.7Hz),5.12(2H,s),5.28(1H,brs),7.26(10H,m),9.64(1H,s).
步骤2
将700mg化合物49B(2.47mmol)和166mg的2-氨基乙醇(2.72mmol)和1.76g硫酸钠(12.4mmol)加入到20ml甲苯中,在室温下搅拌1小时。在室温下加入0.631ml的Boc2O(2.72mmol),直接搅拌18小时。过滤反应液,减压浓缩滤液。将所得的粗产物用硅胶柱层析(正己烷-乙酸乙酯,1∶1,v/v)纯化,得到893mg为无色胶状物质的49C。
步骤3
将890mg化合物49C(2.09mmol)和200mg钯-活性炭(10%,湿法)加入到20ml乙醇中,在氢气氛下、室温下搅拌2小时。Celite过滤,然后减压浓缩溶剂,得到656mg为无色油状物质的49D。
1H-NMR(CDCl3)δ:1.40(9H,s),2.65-2.86(2H,m),3.32(2H,m),3.80(2H,m),4.03-4.12(1H,m),4.86(1H,brs),7.22(5H,m).
步骤4
将610mg 3-(苄氧基)-4-氧代-4H-吡喃-2,5-二甲酸二甲酯(2.09mmol)和664mg的49D(2.09mmol)加入到6ml甲苯中,在100℃下搅拌4小时。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(正己烷-乙酸乙酯,1∶1,v/v)纯化,得到884mg为淡黄色胶状物质的化合物49E。
MS:m/z=593[M+H]+.
步骤5
在860mg化合物49E(1.45mmol)中加入10ml的4当量HCl(乙酸乙酯溶液)。在室温下搅拌30分钟,然后减压馏去溶剂。接着,加入10ml甲苯和0.175ml的2-氨基乙醇(2.90mmol),在80℃下搅拌30分钟。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,99∶1→95∶5→90∶10,v/v)纯化,得到157mg为无色胶状物质的化合物49F和217mg为黄色固体的化合物49G。
49F:1H-NMR(CDCl3)δ:2.48(1H,dd,J=14.0,11.4Hz),3.22(1H,dd,J=14.1,3.3Hz),3.69(1H,m),3.77(3H,s),3.83-3.95(1H,m),4.08(1H,m),4.29(1H,m),4.41(1H,m),5.34(2H,m),5.48(1H,d,J=10.1Hz),6.86(2H,m),7.20-7.39(7H,m),7.64(2H,m)
49G:1H-NMR(DMSO-d6)δ:3.70(2H,t,J=5.3Hz),3.73(3H,s),3.86(2H,t,J=5.3Hz),4.14(2H,s),4.98(1H,t,J=5.0Hz),5.06(2H,s),6.98(1H,s),7.35(8H,m),7.62(2H,d,J=7.1Hz),8.34(1H,d,J=0.8Hz).
步骤6
将214mg化合物49G(0.465mmol)溶解于4ml THF和2ml乙醇和2ml二氯甲烷中,在室温下加入1.16ml的2当量氢氧化钠水溶液(2.32mmol),直接搅拌2.5小时。加入1当量盐酸后用氯仿萃取,然后用硫酸钠干燥。减压馏去溶剂后,得到158mg为黄色固体的化合物49H。
1H-NMR(DMSO-d6)δ:3.70(2H,q,J=5.2Hz),3.89(2H,t,J=5.3Hz),4.22(2H,s),4.97(1H,t,J=5.6Hz),5.12(2H,s),7.23-7.41(9H,m),7.60(2H,m),8.54(1H,s).
步骤7
将50.0mg化合物49H(0.112mmol)和12mg钯-活性炭(10%,湿法)加入到1ml甲醇和3ml DMF中,在氢气氛下、室温下搅拌5小时。Celite过滤,然后减压浓缩溶剂,加入氯仿-甲醇-乙醚,滤取析出的固体,得到9.0mg为无色固体的化合物49。
1H-NMR(DMSO-d6)δ:3.10(2H,m),3.51-3.69(4H,m),4.10(1H,d,J=10.7Hz),4.94(2H,m),7.11-7.26(5H,m),8.03(1H,s),12.94(1H,brs),15.30(1H,brs).
MS:m/z=359[M+H]+.
实施例16
[化学式79]
步骤1
将1.00g化合物50A(3.98mmol)和1.15g三苯膦(4.48mmol)和860mg的N-甲基-2-硝基苯磺酰胺(3.98mmol)加入到10ml THF中,在室温下滴加1.99ml偶氮二甲酸二乙酯(2.2M甲苯,4.38mmol)。在室温下搅拌3小时,然后减压馏去溶剂。将所得的粗产物用硅胶柱层析(正己烷-乙酸乙酯,1∶1,v/v)纯化,得到710mg为无色胶状物质的化合物50B。
步骤2
将458mg化合物50B(1.02mmol)溶解于乙腈中,加入422mg碳酸钾(3.06mmol)和0.126ml苯硫醇(1.22mmol),在室温下搅拌5小时。将反应液倒入到1当量氢氧化钠水溶液中,用二氯甲烷萃取,用硫酸钠干燥。将所得的粗产物用氨基柱层析(氯仿-甲醇,95∶5,v/v)纯化,得到147mg为无色油状物质的化合物50C。
1H-NMR(CDCl3)δ:1.36(9H,s),2.40(3H,s),2.51-2.89(4H,m),3.90(1H,s),4.69(1H,s),7.17-7.31(5H,m).
步骤3
将140mg化合物50C(0.530mmol)和119mg的3-(苄氧基)-4-氧代-4H-吡喃-2-甲酸(WO2006/116764,0.482mmol)加入到3ml THF中,加入111mg的1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(0.578mmol)和65.1mg的1-羟基苯并三唑(0.482mmol),在室温下搅拌18小时。将反应液倒入到碳酸氢钠水中,用乙酸乙酯萃取,用硫酸钠干燥。将所得的粗产物用硅胶柱层析(氯仿-甲醇,97∶3,v/v)纯化,得到219mg为无色固体的化合物50D。
MS:m/z=493[M+H]+.
步骤4
在216mg化合物50D(0.439mmol)中加入3ml的4当量HCl(乙酸乙酯溶液)。在室温下搅拌1小时,然后减压馏去溶剂。接着,加入4ml乙醇和3ml饱和碳酸钠水溶液,在60℃下搅拌2小时。加入水,用乙酸乙酯萃取,然后用硫酸钠干燥。将所得的粗产物用氨基柱层析(氯仿-甲醇,95∶5,v/v)纯化,得到108mg为淡黄色胶状物质的化合物50E。
1H-NMR(CDCl3)δ:3.00(2H,m),3.13(3H,s),3.18(1H,m),3.88(1H,dd,J=13.5,3.4Hz),4.00-4.07(1H,m),5.26(1H,d,J=10.2Hz),5.46(1H,d,J=10.1Hz),6.25(1H,d,J=7.5Hz),6.73(1H,d,J=7.5Hz),6.99-7.02(2H,m),7.28-7.37(6H,m),7.63-7.67(2H,m).
步骤5
在105mg化合物50E(0.280mmol)中加入2ml三氟乙酸,在室温下搅拌30分钟。减压浓缩,然后用碳酸氢钠水和2当量盐酸将pH调节为6,用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后加入二氯甲烷-甲醇-乙醚,滤取析出的固体,得到29mg为无色固体的化合物50。
1H-NMR(DMSO-d6)δ:2.99(3H,s),3.26-3.47(3H,m),4.07(1H,d,J=11.1Hz),4.80(1H,m),6.43(1H,d,J=6.9Hz),7.11-7.29(5H,m),7.50(1H,d,J=6.9Hz).
MS:m/z=285[M+H]+.
实施例17
[化学式80]
步骤1
将20.0g化合物65A(WO2006/088173,69.6mmol)的1.1L THF溶液在水浴上保持25℃,用30分钟滴加25.2g次氯酸钠(278mmol)、27.0g氨基硫酸(278mmol)的378mL水溶液。将反应液在该温度下搅拌1小时,然后减压浓缩。在残余物中加入100mL冰水、100mL二乙醚,过滤析出的固体。将所得粗纯化物用水和二乙醚洗涤,得到20.3g为白色固体的化合物65B。
1H-NMR(DMSO-d6)δ:3.74(3H,s),5.11(2H,s),7.31-7.38(3H,m),7.48(2H,d,J=7.2Hz),8.11(1H,s),12.07(1H,brs).
步骤2
将2.0g化合物65B(6.59mmol)溶解于340mL DMF中,加入2.76g的HATU(7.25mmol)、3.63mL甲基胺(2mol/L THF溶液,7.25mmol)、三乙胺(9.89mmol),在室温下搅拌5小时。将反应液用乙酸乙酯-水分配。分离乙酸乙酯层,将水层用乙酸乙酯萃取1次。将合并的萃取液用水、饱和盐水洗涤,然后干燥。馏去溶剂,得到1.66g为白色固体的化合物65C的粗纯化物。
1H-NMR(DMSO-d6)δ:3.38(3H,brs),3.75(3H,s),5.37(2H,s),7.34-7.44(5H,m),8.10(1H,s),8.38(1H,s),11.84(1H,brs).
步骤3
在1.2g化合物65C(3.79mmol)的20mL DMF溶液中加入1.04g碳酸钾(7.59mmol)、831mg的O-(2,4-二硝基苯基)羟胺(4.17mmol),室温下搅拌3小时。在反应液中加入水,滤取析出的固体,用水洗涤,由此得到1.0g化合物65D的粗纯化物。
1H-NMR(DMSO-d6)δ:3.74(3H,s),3.83(3H,brs),5.05(2H,s),6.46(2H,brs),7.31-7.38(5H,m),8.20(1H,s),8.52(1H,brs).
步骤4
在室温下,在1.0g化合物65D(3.02mmol)的10mL DMF溶液中加入109mg多聚甲醛(3.62mmol)、0.017ml乙酸(0.302mmol),在105℃下搅拌2小时。将反应液冷却至0℃,加入3.44g碳酸铯(10.6mmol),在室温下搅拌1小时。在反应液中加入水,用乙酸乙酯-水分配。将有机层用饱和盐水洗涤、干燥。馏去溶剂,得到120mg化合物65E。
MS:m/z=344[M+H]+.
步骤5
在17.0mg化合物65E(0.05mmol)的1mL DMF溶液中加入81.4mg碳酸铯(0.25mmol)、0.125ml甲基胺(2mol/L THF溶液,0.25mmol),在室温下搅拌5小时。过滤反应液,将滤液用LCMS分取纯化,得到化合物65F。
MS:m/z=358[M+H]+.
步骤6
在化合物65F的0.5mL DMF溶液中加入0.2mL的2N氢氧化钠水溶液,在室温下搅拌2小时。在反应液中加入离子交换树脂DOWEX(50W-X8),过滤,用DMF洗涤。浓缩滤液,然后加入0.5mL三氟乙酸,在80℃下搅拌4小时。浓缩反应液,然后加入水、氯仿,分离有机层。浓缩有机层,然后用LCMS分取纯化,得到6.47mg化合物65。
MS:m/z=254[M+H]+.
实施例18
[化学式81]
步骤1
使1g化合物95A(WO2006/116764,4.06mmol)溶解于28%氨水中,在室温下搅拌12小时。浓缩反应液,然后将所得残余物用2当量盐酸中和,将析出的固体悬浮于乙酸乙酯,滤取、干燥,得到1.14g化合物95B(收率100%)。
1H-NMR(DMSO-d6)δ:5.14(2H,s),7.31(1H,d,J=6.6Hz),7.34-7.41(3H,m),7.45-7.51(2H,m),8.17(1H,d,J=6.6Hz).
步骤2
在室温下,在3.00g上述化合物95B(10.65mmol)的10ml DMF溶液中加入3.06g的WSC HCl(15.98mmol)和1.58g的HOBt(11.7mmol),搅拌10分钟,滴加1.50g甲基胺33%wt乙醇溶液(15.98mmol)。将反应液在该温度下搅拌2小时,然后加入水,用氯仿萃取5次。将萃取液用硫酸钠干燥,馏去溶剂,然后将所得的油状物过硅胶层析进行纯化。从用乙酸乙酯-MeOH(6∶4,v/v)洗脱的组分中得到2.62g为固体的化合物95C(收率95%)。
1H-NMR(CDCl3)δ:2.77(3H,d,J=4.8Hz),5.49(2H,s),6.57(1H,d,J=6.9Hz),7.25-7.43(5H,m),7.48(1H,t,J=6.0Hz),8.23(1H,brs),9.77(1H,brs).
步骤3
在室温下,使4.20g碳酸钾(30.42mmol)悬浮于2.62g上述化合物95C(10.14mmol)的10ml DMF溶液中,搅拌5分钟,然后加入3.03g的O-(2,4-二硝基苯基)羟胺(15.21mmol),在该温度下搅拌3小时。在反应液中加入水,用氯仿萃取5次,将萃取液用硫酸钠干燥。馏去溶剂,然后将所得的油状物过硅胶层析进行纯化。从用乙酸乙酯-MeOH(6∶4,v/v)洗脱的组分中得到1.41g为固体的化合物95D(收率51%)。
1H-NMR(CDCl3)δ:2.62(3H,d,J=5.1Hz),5.06(2H,s),5.22(2H,s),6.18(1H,d,J=7.8Hz),7.25-7.36(5H,m),5.89(1H,d,J=7.8Hz),7.57(1H,q,J=5.1Hz).
步骤4
在1.0g上述化合物95D(3.66mmol)的10ml甲苯溶液中加入109.9mg多聚甲醛(3.66mmol)和22mg乙酸(0.37mmol),在100℃下加热搅拌40分钟。冷却后馏去溶剂,无需纯化残留物即溶解于10ml DMF中,冰冷却下加入3.58g碳酸铯(10.98mmol),搅拌10分钟。向反应液中加入1.36g二苯甲基溴(5.49mmol),在室温下搅拌3小时,然后加入水,用乙酸乙酯萃取3次。将萃取液水洗3次,然后用硫酸钠干燥。馏去溶剂,将所得的油状物过硅胶层析进行纯化。从用乙酸乙酯-MeOH(9∶1,v/v)洗脱的组分中得到1.26g为固体的化合物95E(收率71%)。
1H-NMR(CDCl3)δ:2.91(3H,s),4.26(1H,d,J=13.2Hz),4.77(1H,d,J=13.2Hz),5.12(1H,s),5.42(1H,J=13.2Hz),5.45(1H,d,J=13.2Hz),5.82(1H,J=7.5Hz),6.71(1H,d,J=7.5Hz),7.10-7.23(5H,m),7.27-7.46(6H,m),7.52(2H,d,J=6.9Hz),7.60-7.64(2H,m).
步骤5
将100mg上述化合物95E(0.221mmol)溶解于2ml三氟乙酸中,在室温下搅拌1小时。馏去溶剂,使残余物溶解于2ml二氯甲烷中,用饱和碳酸氢钠水中和。将所得溶液用柠檬酸水溶液制成酸性,分离有机层。将水层用二氯甲烷萃取1次,水洗合并的有机层,然后用硫酸钠干燥。馏去溶剂,然后将所得固体用二异丙基醚洗涤,得到50mg化合物95(收率63%)。
1H-NMR(CDCl3)δ:2.95(3H,s),4.36(1H,d,J=13.2Hz),4.95(1H,d,J=13.2Hz),5.22(1H,s),5.71(1H,d,J=7.8Hz),6.75(1H,d,J=7.8Hz),7.21(5H,br s),7.33-7.47(4H,m),7.55(2H,d,J=6.6Hz).
实施例19
[化学式82]
步骤1
在3.0g按照化合物95D的合成方法合成的化合物107A(9.96mmol)的30ml DMF溶液中加入299mg多聚甲醛(9.96mmol)和1ml乙酸,在120℃下加热搅拌4小时。馏去溶剂,然后在残余物中加入乙酸乙酯-二异丙基醚,滤取析出的固体,得到2.85g化合物107B(收率91%)。
1H-NMR(CDCl3)δ:1.19(6H,J=6.6Hz),4.34(2H,J=7.5Hz),4.72-4.86(1H,m),5.30(2H,s),5.49(1H,t,J=7.5Hz),6.36(1H,d,J=7.8Hz),7.26-7.35(4H,m),7.37(1H,d,J=7.8Hz),7.55-7.58(2H,m).
步骤2
在室温下,在100mg化合物107B(0.319mmol)的2ml乙酸溶液中加入0.5ml 96%硫酸和242.3mg双(3-氯苯基)甲醇(0.957mmol),在80℃下搅拌2小时。将反应液冷却至室温,然后加入水,用乙酸乙酯萃取3次。将有机层水洗1次,然后用硫酸钠干燥。馏去溶剂,然后在残余物中加入二异丙基醚,滤取析出的固体,得到42mg化合物107(收率29%)。
1H-NMR(CDCl3)δ:0.953(3H,d,J=3.9Hz),1.12(3H,d,J=4.2Hz),4.51(1H,13.5Hz),4.83(1H,d,J=13.5Hz),4.83-4.92(1H,m),5.18(1H,s),5.74(1H,d,J=7.8Hz),6.73(1H,d,J=7.8Hz),6.90(1H,d,J=7.5Hz),7.12(2H,dd,J=7.2Hz,8.1Hz),7.19-7.22(1H,m),7.37-7.41(3H,m),7.55(1H,s).
实施例20
[化学式83]
步骤1
将1.00g化合物95B(3.55mmol)和0.492ml环丙胺(7.10mmol)加入到20ml吡啶中,依次加入544mg的1-羟基苯并三唑(3.55mmol)和1.36g的1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(7.10mmol),在室温下搅拌18小时。减压馏去溶剂,将所得的粗产物用硅胶柱层析(氯仿-甲醇,95∶5,v/v)、接着用氨基柱层析(氯仿-甲醇,99∶1,v/v)纯化,得到1.19g为无色固体的化合物126A。
1H-NMR(CDCl3)δ:0.22(1H,m),0.70(2H,m),2.76-2.83(1H,m),5.50(2H,s),6.59(1H,dd,J=7.0,1.9Hz),7.44(5H,d,J=0.7Hz),7.53(1H,dd,J=6.9,6.2Hz),8.30(1H,brs),9.71(1H,brs).
步骤2
将1.19g化合物126A(4.19mmol)溶解于15ml DMF中,加入2.90g碳酸钾(20.1mmol),在室温下搅拌30分钟。加入1.67g的O-(2,4-二硝基苯基)羟胺(8.38mmol),在室温下搅拌18小时。在反应液中加入氯仿,滤除析出的黄色沉淀物,减压浓缩滤液。将所得的粗产物用氨基柱层析(氯仿-甲醇,97∶3→95∶5,v/v)纯化,得到851mg为黄色固体的化合物126B。
1H-NMR(CDCl3)δ:0.41-0.46(2H,m),0.76(2H,m),2.73-2.81(1H,m),5.19(2H,s),5.61(2H,s),6.26(1H,d,J=7.2Hz),7.38(5H,s),7.44(1H,d,J=7.8Hz),7.70(1H,s).
步骤3
将847mg化合物126B(2.83mmol)和255mg多聚甲醛(8.49mmol)加入到12ml乙醇中,在微波照射下、在140℃下搅拌30分钟。减压浓缩反应液,将所得的粗产物用硅胶柱层析(氯仿-甲醇,97∶3→95∶5→90∶10,v/v)、接着用氨基柱层析(氯仿-甲醇,97∶3,v/v)纯化,加入二氯甲烷-乙醚,滤取析出的固体,得到665mg为无色固体的化合物126C。
1H-NMR(CDCl3)δ:0.61-0.66(2H,m),0.87(2H,m),2.68-2.76(1H,m),4.32(2H,d,J=7.9Hz),5.28(2H,s),6.33(1H,d,J=7.7Hz),6.45(1H,t,J=7.7Hz),7.33(3H,m),7.38(1H,d,J=7.7Hz),7.52(2H,m).
步骤4
将100mg化合物126C(0.321mmol)溶解于0.5ml DMF中,在0℃下加入314mg碳酸铯(0.964mmol)和119mg(溴亚甲基)二苯(0.482mmol),在室温下搅拌2小时。将反应液倒入到水中,用乙酸乙酯萃取,将有机层用水洗涤,用硫酸钠干燥。减压馏去溶剂,将所得的粗产物用硅胶柱层析(氯仿-甲醇,97∶3→95∶5,v/v)纯化,得到124mg为无色胶状物质的化合物126D。
1H-NMR(CDCl3)δ:0.37-0.47(2H,m),0.74(2H,m),2.63-2.68(1H,m),4.35(1H,d,J=13.4Hz),4.65(1H,d,J=13.4Hz),5.07(1H,s),5.40(1H,d,J=10.7Hz),5.47(1H,d,J=10.5Hz),5.79(1H,d,J=7.6Hz),6.67(1H,d,J=7.8Hz),7.04-7.62(15H,m).
步骤5
在步骤4得到的化合物126D中加入2ml三氟乙酸,在室温下搅拌1.5小时。减压浓缩,然后用碳酸氢钠水和2当量盐酸将pH调节为6,用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后加入二氯甲烷-乙醚,滤取析出的固体,得到52mg为无色固体的化合物126。
1H-NMR(DMSO-d6)δ:-0.19--0.06(1H,m),0.44-0.54(1H,m),0.82(2H,m),2.62-2.69(1H,m),4.21(1H,d,J=13.3Hz),5.11(1H,d,J=13.1Hz),5.32(1H,s),5.47(1H,t,J=11.1Hz),7.13(1H,d,J=7.6Hz),7.23(3H,m),7.28-7.47(8H,m),7.69(2H,t,J=8.5Hz).
MS:m/z=388[M+H]+.
实施例21
[化学式84]
步骤1
将2.40g化合物95B(8.52mmol)和2.62g的3-氨基丙酸乙酯盐酸盐(17.0mmol)加入到30ml吡啶中,依次加入1.31g的1-羟基苯并三唑(8.52mmol)和3.27g的1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(17.0mmol),在室温下搅拌2小时。减压馏去溶剂,将所得的粗产物用氨基柱层析(氯仿-甲醇,95∶5,v/v)纯化,得到1.90g为无色固体的化合物128A。
1H-NMR(CDCl3)δ:1.29(3H,t,J=7.1Hz),2.48(2H,t,J=6.4Hz),3.58(2H,q,J=6.3Hz),4.17(2H,q,J=7.1Hz),5.59(2H,s),6.57(1H,dd,J=7.1,1.6Hz),7.37-7.52(6H,m),8.73(1H,brs),9.72(1H,brs).
步骤2
将2.58g化合物128A(7.49mmol)溶解于30ml DMF中,加入5.18g碳酸钾(37.5mmol),在室温下搅拌30分钟。加入2.98g的O-(2,4-二硝基苯基)羟胺(15.0mmol),在室温下搅拌20小时。在反应液中加入氯仿,滤除析出的黄色沉淀物,减压浓缩滤液。将所得的粗产物用氨基柱层析(氯仿-甲醇,97∶3→95∶5,v/v)、接着用硅胶柱层析(氯仿-甲醇,95∶5→92∶8,v/v)纯化,得到1.67g为黄色固体的化合物128B。
1H-NMR(CDCl3)δ:1.26(3H,t,J=7.2Hz),2.42(2H,t,J=6.6Hz),3.43(2H,q,J=6.4Hz),4.12(2H,q,J=7.1Hz),5.13(2H,s),5.53(2H,s),6.21(1H,d,J=7.6Hz),7.33(5H,s),7.39(1H,d,J=7.6Hz),7.85(1H,t,J=5.6Hz).
步骤3
将1.66g化合物128B(4.62mmol)和416mg多聚甲醛(13.9mmol)加入到20ml乙醇中,在微波照射下、在140℃下搅拌30分钟。减压浓缩反应液,将所得的粗产物用氨基柱层析(氯仿-甲醇,99∶1→95∶5,v/v)纯化,得到1.57g为无色固体的化合物128C。
1H-NMR(CDCl3)δ:1.27(3H,t,J=7.2Hz),2.70(2H,t,J=5.7Hz),3.57(2H,t,J=5.8Hz),4.13(2H,q,J=7.1Hz),4.50(2H,d,J=7.9Hz),5.27(2H,s),5.87(1H,t,J=7.8Hz),6.32(1H,d,J=7.6Hz),7.31(4H,m),7.54(2H,m).
步骤4
将1.00g化合物128C(2.69mmol)溶解于10ml DMF中,在0℃下加入2.63g碳酸铯(8.08mmol)和998mg(溴亚甲基)二苯(4.04mmol),在室温下搅拌18小时。将反应液倒入到水中,用乙酸乙酯萃取,将有机层用水洗涤,用硫酸钠干燥。减压馏去溶剂,将所得的粗产物用硅胶柱层析(氯仿-甲醇,98∶2,v/v)纯化,得到500mg为无色胶状物质的化合物128D。
1H-NMR(CDCl3)δ:1.25(3H,t,J=7.3Hz),2.46(1H,m),2.70-2.80(1H,m),2.87-2.96(1H,m),4.11(2H,q,J=7.3Hz),4.12(1H,m),4.48(1H,d,J=13.7Hz),4.85(1H,d,J=13.7Hz),5.10(1H,s),5.47(2H,s),5.83(1H,d,J=8.0Hz),6.73(1H,d,J=8.0Hz),7.37(15H,m).
步骤5
在40mg化合物128D(0.074mmol)中加入1ml三氟乙酸,在室温下搅拌1小时。减压浓缩,然后用碳酸氢钠水和2当量盐酸将pH调节为6,用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后加入二氯甲烷-乙醚,滤取析出的固体,得到20mg为无色固体的化合物128。
1H-NMR(DMSO-d6)δ:1.16(3H,t,J=7.1Hz),2.45-2.58(3H,m),3.70(1H,m),4.02(2H,q,J=7.1Hz),4.39(1H,d,J=13.4Hz),5.09(1H,d,J=13.3Hz),5.48(1H,d,J=3.2Hz),5.51(1H,s),7.19-7.38(7H,m),7.45(2H,t,J=7.3Hz),7.69(2H,d,J=7.2Hz).
MS:m/z=448[M+H]+.
实施例22
[化学式85]
步骤1
将1.50g化合物95B(5.32mmol)和1.86g的2-氨基乙基(甲基)氨基甲酸叔丁酯(10.7mmol)加入到20ml吡啶中,依次加入815mg的1-羟基苯并三唑(5.32mmol)和2.04g的1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(10.7mmol),在室温下搅拌2小时。将反应液倒入到1当量盐酸中,用乙酸乙酯萃取,用硫酸钠干燥。减压馏去溶剂,将所得的粗产物用氨基柱层析(氯仿-甲醇,95∶5,v/v)纯化、接着用硅胶柱层析(氯仿-甲醇,95∶5,v/v)纯化,得到1.63g为无色胶状物质的化合物135A。
1H-NMR(CDCl3)δ:1.44(9H,s),2.82(3H,s),3.28(4H,m),5.59(2H,s),6.57(1H,d,J=6.0Hz),7.46(6H,m),8.46(1H,m),9.68(1H,brs).
步骤2
将1.05g化合物135A(2.62mmol)溶解于15ml DMF中,加入1.81g碳酸钾(13.1mmol),在室温下搅拌30分钟。加入1.04g的O-(2,4-二硝基苯基)羟胺(5.23mmol),在室温下搅拌18小时。在反应液中加入氯仿,滤除析出的黄色沉淀物,减压浓缩滤液。将所得的粗产物用氨基柱层析(氯仿-甲醇,97∶3→95∶5,v/v)纯化,得到887mg为淡黄色固体的化合物135B。
1H-NMR(CDCl3)δ:1.44(9H,s),2.84(3H,s),3.38(4H,m),5.33(2H,s),5.68(1H,brs),5.80(1H,brs),6.35(1H,d,J=7.6Hz),6.74(1H,brs),7.39(5H,brm),7.52(1H,t,J=9.5Hz).
步骤3
将880mg化合物135B(2.11mmol)和190mg多聚甲醛(6.34mmol)加入到18ml乙醇中,在微波照射下、在140℃下搅拌30分钟。减压浓缩反应液,将所得的粗产物用硅胶柱层析(氯仿-甲醇,97∶3→95∶5→90∶10,v/v)、接着用氨基柱层析(氯仿-甲醇,97∶3,v/v)纯化,得到721mg为无色固体的化合物135C。
1H-NMR(CDCl3)δ:1.29(9H,s),2.95(3H,s),4.38(2H,brs),5.33(2H,brs),6.36(1H,d,J=7.6Hz),6.85(1H,t,J=7.4Hz),7.33(4H,m),7.55(2H,m).
MS:m/z=429[M+H]+.
步骤4
将720mg化合物135C(1.68mmol)溶解于3.5ml DMF中,在0℃下加入1.64g碳酸铯(5.04mmol)和623mg(溴亚甲基)二苯(2.52mmol),在室温下搅拌18小时。将反应液倒入到水中,用乙酸乙酯萃取,将有机层用水洗涤,用硫酸钠干燥。减压馏去溶剂,将所得的粗产物用硅胶柱层析(氯仿-甲醇,97∶3→95∶5,v/v)纯化,得到732mg化合物135D。
步骤5
在727mg化合物135D(1.22mmol)中加入10ml的4当量HCl(乙酸乙酯溶液)。在室温下搅拌1小时,然后减压馏去溶剂。加入饱和碳酸氢钠水,用氯仿萃取,然后用硫酸钠干燥。减压馏去溶剂,在所得的粗产物中加入二氯甲烷-乙醚,滤取析出的固体,得到575mg为无色固体的化合物135E。
步骤6
在50mg化合物135E(0.10mmol)中加入2ml三氟乙酸,在室温下搅拌1.5小时。减压浓缩,然后用碳酸氢钠水和氯化铵水溶液将pH调节为6,用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后加入二氯甲烷-乙醚,滤取析出的固体,得到15mg为无色固体的化合物135。
1H-NMR(DMSO-d6)δ:2.40(3H,s),2.80(1H,s),3.12(3H,m),3.87(1H,m),4.37(1H,d,J=13.6Hz),5.10(1H,d,J=13.4Hz),5.52(1H,s),5.53(1H,d,J=5.5Hz),7.15-7.70(11H,m).
MS:m/z=405[M+H]+.
实施例23
[化学式86]
步骤1
在室温下,在37.0g化合物165A(WO2006/088173,108mmol)的370mL DMF溶液中依次加入17.9g碳酸钾(129mmol)和8.03mL甲基碘(129mmol),然后搅拌1.5小时。冰冷却下,将反应液加入到20.8g氯化铵(390mmol)的1110mL水溶液中,滤取析出的固体,水洗,由此得到33g粗产物。将水层用盐进行盐析,然后用乙酸乙酯萃取,用硫酸钠干燥。减压馏去溶剂,从得到的残余物中得到9g粗产物。合并粗产物,用硅胶柱层析(乙酸乙酯/正己烷=50%→100%)纯化,得到36.5g为白色固体的化合物165B(95%)。
步骤2
在室温下,在36.5g化合物165B(102mmol)的548mL 1,4-二烷溶液中依次加入1.13g二水合锇酸钾(3.06mmol)、87.3g高碘酸钠(408mmol)和水(365mmol),然后搅拌6小时。将反应液用二氯甲烷萃取,用硫酸钠干燥。减压馏去溶剂,将所得残余物用硅胶柱层析(乙酸乙酯/正己烷=50%→100%)纯化,得到33.0g为褐色泡沫的化合物165C(90%)。
步骤3
在室温下,在1.38g化合物165C(3.66mmol)的25mL甲苯悬浮液中依次加入0.247mL乙二胺(3.66mmol)和0.0210mL乙酸(0.366mmol),然后搅拌1小时,进一步在50℃下搅拌17小时。滤取析出的固体,然后用醚洗涤,得到1.11g为浅黄色固体的化合物165D(100%)。
1HNMR(DMSO-d6)δ:3.05(2H,m),3.26(1H,m),3.63(2H,m),3.75(3H,s),3.87(1H,m),4.52(1H,dd,J=3.3,12.6Hz),4.69(1H,m),4.99(1H,d,J=10.4Hz),5.15(1H,d,J=10.4Hz),7.35(3H,m),7.54(2H,m),8.41(1H,s).
步骤4
在室温下,在2.77g化合物165D(7.50mmol)、2.23g碳酸钾(16.1mmol)和102mg碘化钠(0.680mmol)的30mL乙腈悬浮液中加入2.26g溴二苯基甲烷(9.14mmol),在90℃下搅拌7小时。将反应液倒入到10mL盐酸(2N)和20g冰中,用氯仿(100mL x 2)萃取,用硫酸钠干燥。减压馏去溶剂,将所得残余物用硅胶柱层析(氯仿/甲醇=0%→5%)纯化,得到2.72g为浅黄色固体的化合物165E(68%)。
步骤5
在室温下,在2.72g化合物165E(5.08mmol)的30mL乙醇溶液中加入10mL氢氧化钠水溶液(2N),搅拌3天。在室温下,在反应液中加入20mL盐酸(1N)(pH=1),用氯仿(100mL x 2)萃取,用硫酸钠干燥。减压馏去溶剂,将所得残余物用硅胶柱层析(氯仿/甲醇=0%→10%)纯化,得到1.77g为浅黄色固体的化合物165F(67%)。
1HNMR(DMSO-d6)δ:2.63(1H,m),3.16(1H,m),3.49(1H,m),3.73(1H,m),4.12(2H,m),4.56(1H,m),5.04(1H,s),5.09(1H,d,J=10.7Hz),5.19(1H,d,J=10.7Hz),7.28-7.53(15H,m),8.32(1H,s),8.39(1H,s).
步骤6
在90℃下,将1.77g化合物165F(3.39mmol)和0.515g氯化锂(12.2mmol)的20mL N,N’-二甲基咪唑啉酮溶液搅拌1小时。在室温下,在反应液中依次加入10mL水、10mL盐酸(2N)和10mL水。滤取析出的固体,用醚洗涤,然后加入DMF-水,滤取析出的固体,得到599mg为白色固体的化合物165(41%)。
1HNMR(DMSO-d6)δ:2.60(1H,m),3.20(1H,m),3.64(2H,m),4.00(2H,m),4.55(1H,m),5.01(1H,s),7.28-7.47(10H,m),8.16(1H,s),11.97(1H,brs).
MS:m/z=432[M+H]+.
实施例24
[化学式87]
步骤1
在3.58g化合物167A(WO2006/11674,7.61mmol)的30ml二甲苯溶液中加入1.83g的(S)-N1-苄基-3-苯基丙烷-1,2-二胺(Journal of the American Chemical Society;English;127;30;2005;10504,7.61mmol)和0.5ml乙酸,回流2小时。冷却至室温,然后馏去溶剂,将所得的油状物过硅胶层析进行纯化。先用正己烷-乙酸乙酯(9∶1,v/v)洗脱,接着用正己烷-乙酸乙酯(1∶1,v/v)洗脱。浓缩目标组分,得到349mg为油状物的化合物167B(收率7%)。
1HNMR(CDCl3)δ:2.54(1H,t,J=9.6Hz),2.77(1H,dd,J=9.0Hz,13.2Hz),3.31(1H,dd,J=6.9Hz,9.6Hz),3.43-3.78(5H,m),4.04-4.15(1H,m),4.42-4.48(1H,m),4.62(2H,d,J=6.0Hz),5.29(1H,d,J=10.5Hz),5.43(1H,d,J=10.5Hz),6.77-6.85(2H,m),7.19-7.39(14H,m),7.60(2H,d,J=6.3Hz),8.05(1H,s).
步骤2
在968mg化合物167B(1.47mmol)的10ml MeCN溶液中加入3ml的Boc2O和180mg的DMAP(1.47mmol),加热回流5小时。在反应液中加入2当量氢氧化钠水溶液,中止反应,用2当量盐酸中和,然后用乙酸乙酯萃取3次。将萃取液用饱和盐水洗涤,然后馏去溶剂,将所得的油状物过硅胶层析进行纯化。先用正己烷-乙酸乙酯(6∶4,v/v)洗脱,接着只用乙酸乙酯洗脱。浓缩目标组分,得到349mg为固体的167C(收率45%)。
1HNMR(CDCl3)δ:2.54(1H,t=9.0Hz),2.76(1H,dd,J=9.3Hz,16.5Hz),3.31(1H,dd,J=6.9Hz,9.6Hz),3.45(1H,dd,J=3.3Hz,12.6Hz),3.51-3.78(4H,m),4.04-4.13(1H,m),4.42-4.52(1H,m),4.61(2H,d,J=6.0Hz),2.79(1H,d,J=10.2Hz),5.29(1H,d,J=10.2Hz),5.43(1H,d,J=10.2Hz),6.76-7.39(11H,m),7.60(2H,d,J=6.6Hz),8.05(1H,s),10.42(1H,t,J=5.7Hz).
步骤3
使150mg上述化合物167C(0.280mmol)溶解于2ml三氟乙酸中,在室温下搅拌1小时。馏去溶剂,使残余物溶解于2ml二氯甲烷中,用饱和碳酸氢钠水中和。将所得溶液用柠檬酸水溶液制成酸性,分离有机层。将水层用二氯甲烷萃取1次,水洗合并的有机层,然后用硫酸钠干燥。馏去溶剂后,将所得固体用二异丙基醚洗涤,得到71mg化合物167(收率57%)。
1HNMR(CDCl3)δ:2.65(1H,dd,J=8.4Hz,9.6Hz),2.97(1H,dd,J=9Hz,13.5Hz),3.43(1J,dd,J=7.2Hz,9.6Hz),3.55(1H,dd,J=3.0Hz,13.2Hz),3.61-3.80(4H,m),4.15(1H,dd,J=4.2Hz,9.9Hz),4.51-4.60(1H,m),7.15-7.18(2H,m),7.28-7.38(8H,m),8.02(1H,s),12.04(1H,s).
实施例25
[化学式88]
步骤1
在500mg化合物95A(WO2006/116764,2.03mmol)的5mL乙醇溶液中加入0.49ml的2,2-二甲氧基乙胺(4.47mmol),在80℃下搅拌3小时。将反应液放置冷却,然后在室温下加入0.27ml乙酸(4.69mmol),减压浓缩。将所得残余物溶解于5mL DMF中,在氮气氛下加入0.66mL DBU(4.4mmol),接着加入1.02mL甲基碘(16.2mmol),在室温下搅拌3小时。在反应液中加入饱和碳酸氢钠水溶液、乙酸乙酯,分离乙酸乙酯层,将水层用乙酸乙酯萃取。在合并的萃取液中加入硫酸钠,过滤、浓缩,将所得残余物过硅胶层析进行纯化。用氯仿-甲醇(9∶1)洗脱,浓缩目标组分,得到258mg为茶色油的化合物169A。
1H-NMR(CDCl3)δ:3.37(6H,s),3.80(3H,s),3.87(2H,d,J=4.8Hz),4.46(1H,t,J=4.8Hz),5.30(2H,s),6.75(1H,d,J=6.0Hz),7.30-7.41(6H,m).
步骤2
在1.00g化合物169A(2.88mmol)中加入31mL甲酸、接着加入5mL水,在70℃下搅拌6.5小时。在反应混合物中加入水、乙酸乙酯,分离乙酸乙酯层,将水层用乙酸乙酯萃取。将合并的萃取液用饱和碳酸氢钠水溶液洗涤,然后加入硫酸钠,过滤、浓缩,将所得残余物过硅胶层析进行纯化。用乙酸乙酯-甲醇洗脱,浓缩目标组分,得到为无色透明油状物的醛水合物和甲基缩醛的混合物。将所得的油状物溶解于5mL二氯甲烷中,加入354mg的1,3-二氨基丙烷二盐酸盐(2.41mmol)、接着加入0.069ml乙酸(1.2mmol),在室温下搅拌6小时。将反应液用二氯甲烷稀释,过滤不溶物,然后减压浓缩,得到化合物169B的粗纯化物。
MS:m/z=326.20[M+H]+.
步骤3
在391mg化合物169B(1.20mmol)的4mL乙腈溶液中加入498mg碳酸钾(3.61mmol)、接着加入890mg溴亚甲基二苯(3.61mmol)。将反应液在90℃下搅拌2小时,然后在反应液中加入水、乙酸乙酯、盐水,分离乙酸乙酯层,将水层用乙酸乙酯萃取1次。将合并的萃取液用硫酸镁干燥,然后过滤、浓缩。将所得残余物过硅胶柱层析进行纯化。用乙酸乙酯-甲醇洗脱,浓缩目标组分,得到106mg为橙色固体的化合物169C。
MS:m/z=492.15[M+H]+.
步骤4
在105mg化合物169C(0.214mmol)的2mL DMI溶液中加入27.2mg氯化锂(0.641mmol),在90℃下搅拌3小时。进一步加入27.2mg氯化锂(0.641mmol),在90℃下搅拌1小时。减压浓缩反应液,使用LCMS分取装置纯化所得残余物。馏去洗脱溶剂,在残余物中加入二乙醚,滤取析出的固体。用二乙醚洗涤、干燥,由此得到27mg化合物169。
1H-NMR(CD3OD)δ:1.63(1H,dd,J=13.4,2.8Hz),1.84(1H,br s),2.55-2.64(1H,m),2.90-3.10(2H,m),4.30(1H,dd,J=14.5,4.0Hz),4.52(4H,dd,J=14.5,3.8Hz),4.63-4.75(4H,m),5.16(1H,s),6.16(1H,d,J=7.2Hz),6.78(1H,d,J=7.2Hz),7.16-7.32(10H,m).
MS:m/z=402.10[M+H]+.
实施例26
[化学式89]
步骤1
将950mg化合物49B(3.35mmol)和277mg的3-氨基丙烷-1-醇(3.69mmol)和1.91g硫酸钠(13.4mmol)加入到25ml甲苯中,在室温下搅拌1小时。室温下加入0.856ml的Boc2O(3.69mmol),直接搅拌18小时。进一步在室温下加入0.400ml的Boc2O(1.72mmol),直接搅拌60小时。过滤反应液,减压浓缩滤液。将所得的粗产物用硅胶柱层析(正己烷-乙酸乙酯,1∶1,v/v)纯化,得到1.02g为无色胶状物质的171A。
步骤2
将1.01g化合物171A(2.29mmol)和200mg钯-活性炭(10%,湿法)加入到20ml乙醇中,在氢气氛下、室温下搅拌1.5小时。Celite过滤,然后减压浓缩溶剂,得到755mg无色油状物质171B。
1H-NMR(CDCl3)δ:1.42(5H,s),1.49(4H,s),1.56-1.92(2H,m),2.49(0.4H,dd,J=13.6,9.8Hz),2.62(0.6H,dd,J=13.6,8.5Hz),2.81(0.4H,dd,J=13.5,3.6Hz),3.16(1.6H,m),3.60-4.14(4H,m),5.13(0.6H,d,J=8.8Hz),5.19(0.4H,d,J=8.5Hz),7.22-7.37(5H,m).
步骤3
将660mg的3-(苄氧基)-4-氧代-4H-吡喃-2,5-二甲酸二甲酯(1.99mmol)和609mg的171B(1.99mmol)加入到8ml甲苯中,在100℃下搅拌1.5小时。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,99∶1,v/v)纯化,得到1.02g为淡黄色胶状物质的化合物171C。
步骤4
在991mg化合物171C(1.60mmol)中加入12ml的4当量HCl(乙酸乙酯溶液)。在室温下搅拌1小时,然后减压馏去溶剂。接着加入12ml甲苯和0.244ml的3-氨基丙烷-1-醇(3.19mmol),在80℃下搅拌10分钟。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,99∶1→95∶5→90∶10,v/v)纯化,得到341mg黄色胶状物质的化合物171D和338mg无色固体的化合物171E。
171D:1H-NMR(CDCl3)δ:1.29(3H,t,J=7.1Hz),1.51(1H,d,J=13.7Hz),1.97(1H,m),2.91(1H,dd,J=13.8,9.8Hz),2.99-3.10(2H,m),3.90(1H,td,J=12.1,2.5Hz),4.12(2H,m),4.25(2H,m),4.83(2H,m),5.33(1H,d,J=10.1Hz),5.51(1H,d,J=10.1Hz),6.88(2H,m),7.23-7.40(7H,m),7.68(2H,m)
171E:1H-NMR(CDCl3)δ:1.19(3H,t,J=7.2Hz),1.82-1.99(2H,m),2.73(1H,dd,J=14.0,11.3Hz),3.13(1H,m),3.35(1H,dd,J=14.0,3.4Hz),3.63(1H,m),3.90-4.26(4H,m),4.43(1H,d,J=13.6Hz),5.27(1H,t,J=3.5Hz),5.31(2H,s),6.78(2H,dd,J=6.3,3.2Hz),7.01(1H,d,J=7.0Hz),7.18(3H,t,J=3.1Hz),7.28-7.39(3H,m),7.67(2H,m).
步骤5
将329mg化合物171D(0.673mmol)溶解于2ml乙醇和4ml THF中,加入1.69ml的2当量氢氧化钠水溶液(3.38mmol),在室温下搅拌1小时。在反应液中加入2当量盐酸,用乙酸乙酯萃取,用硫酸钠干燥。减压浓缩溶剂,由此得到215mg为无色固体的化合物171F。
MS:m/z=461[M+H]+.
步骤6
在50mg化合物171F(0.11mmol)中加入2ml三氟乙酸,在室温下搅拌1小时。减压浓缩,然后用碳酸氢钠水和2当量盐酸将pH调节为6,用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后加入氯仿-甲醇-乙醚,滤取析出的固体,得到24mg为无色固体的化合物171。
1H-NMR(DMSO-d6)δ:1.63(1H,d,J=12.6Hz),1.83(1H,m),2.96-3.29(3H,m),4.05(2H,m),4.55(1H,dd,J=13.2,4.4Hz),5.08(1H,dd,J=9.2,5.4Hz),5.30(1H,s),7.19(5H,m),8.09(1H,s),12.84(1H,brs).
MS:m/z=371[M+H]+.
实施例27
[化学式90]
步骤1
在0℃下,向25.0ml戴斯-马丁氧化剂(0.3M,二氯甲烷溶液,7.50mmol)中滴加1.98g化合物2b(5.48mmol)的10ml二氯甲烷溶液。室温下搅拌3小时,然后倒入到1当量氢氧化钠水溶液中,用乙醚萃取。将有机层用1当量氢氧化钠水溶液和饱和盐水洗涤,用硫酸镁干燥。减压馏去溶剂,然后用硅胶柱层析(正己烷-乙酸乙酯,2∶1,v/v)纯化,得到1.73g为白色固体的化合物175A。
1H-NMR(CDCl3)δ:4.55(1H,d,J=7.3Hz),5.09(2H,s),5.14(2H,m),7.22-7.35(15H,m),9.62(1H,s).
步骤2
将1.30g化合物175A(4.59mmol)和379mg的3-氨基丙烷-1-醇(5.05mmol)和3.26g硫酸钠(22.4mmol)加入到40ml甲苯中,在室温下搅拌1小时。室温下加入1.17ml的Boc2O(5.05mmol),直接搅拌18小时。加入1.17ml的Boc2O(5.05mmol)和3.26g硫酸钠(22.4mmol),搅拌60小时。过滤反应液,减压浓缩滤液。将所得的粗产物用硅胶柱层析(正己烷-乙酸乙酯,1∶1,v/v)纯化,得到635mg为无色固体的175B。
步骤3
将632mg化合物175B(1.22mmol)和100mg钯-活性炭(10%,湿法)加入到10ml乙醇和5ml THF中,在氢气氛下、在室温下搅拌3小时。Celite过滤,然后减压浓缩溶剂,得到502mg无色油状物质175C。
1H-NMR(CDCl3)δ:1.45(9H,s),1.77(2H,m),3.18-3.27(1H,m),3.43-3.51(1H,m),4.04(4H,m),4.92(1H,d,J=4.7Hz),7.28(10H,m).
步骤4
将390mg的3-(苄氧基)-4-氧代-4H-吡喃-2,5-二甲酸二甲酯(1.22mmol)和468mg的175C(1.22mmol)加入到5ml甲苯中,在100℃下搅拌2小时。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(正己烷-乙酸乙酯,1∶1,v/v)纯化,得到391mg为淡黄色胶状物质的化合物175D。
步骤5
在388mg化合物175D(0.568mmol)中加入4ml的4当量HCl(乙酸乙酯溶液)。在室温下搅拌1小时,然后减压馏去溶剂。接着加入4ml甲苯和0.0870ml的3-氨基丙烷-1-醇(1.14mmol),在80℃下搅拌5小时。减压馏去溶剂,然后将所得的粗产物用硅胶柱层析(氯仿-甲醇,98∶2,v/v)纯化,得到57mg黄色胶状物质的化合物175E和44mg茶色胶状物质的化合物175F。
175E:1H-NMR(CDCl3)δ:1.91-2.00(2H,m),2.87(1H,m),3.78(3H,s),3.87-4.15(3H,m),4.61(1H,d,J=12.1Hz),4.78(2H,m),5.33(1H,d,J=10.2Hz),5.63(1H,d,J=10.2Hz),6.95(2H,m),7.13-7.53(12H,m),7.76(2H,m)
175F:1H-NMR(CDCl3)δ:1.83-1.97(2H,m),3.12-3.22(1H,m),3.50(1H,m),3.85(3H,s),3.90(1H,m),4.34-4.40(1H,m),4.74(1H,d,J=8.6Hz),4.84-4.89(1H,m),5.09(1H,d,J=3.3Hz),5.15(1H,d,J=9.9Hz),5.26(1H,d,J=9.6Hz),7.08-7.50(13H,m),7.65-7.77(3H,m).
步骤6
将57mg化合物175E(0.10mmol)溶解于0.5ml THF和0.5ml乙醇中,在室温下加入0.25ml的2当量氢氧化钠水溶液(0.50mmol),直接搅拌1小时。加入1当量盐酸,然后用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,将所得的粗产物用硅胶柱层析(氯仿-甲醇,98∶2,v/v)纯化,得到化合物175G。
步骤7
在步骤6得到的化合物175G中加入1ml三氟乙酸,在室温下搅拌1小时。减压浓缩,然后用碳酸氢钠水和2当量盐酸将pH调节为3,用氯仿萃取,用硫酸钠干燥。减压馏去溶剂,然后加入氯仿-甲醇-乙醚,滤取析出的固体,得到11mg为无色固体的化合物175。
1H-NMR(DMSO-d6)δ:1.50(1H,d,J=13.1Hz),1.79(1H,m),3.17(1H,m),3.86(1H,t,J=11.0Hz),4.03(1H,dd,J=10.8,4.1Hz),4.46(1H,d,J=12.0Hz),4.53(1H,dd,J=12.7,4.2Hz),4.84(1H,s),5.85(1H,d,J=11.7Hz),7.22(7H,m),7.44(2H,t,J=7.6Hz),7.65(2H,d,J=7.3Hz),8.14(1H,s),12.75(1H,s),15.33(1H,brs).
MS:m/z=447[M+H]+.
实施例28
粉末X射线衍射谱的测定
各实施例中得到的晶体的粉末X射线衍射测定是按照日本药局方的一般试验法中记载的粉末X射线衍射测定法,在以下的测定条件下进行。
(装置)
Bruker公司制造的D-8Discover
(操作方法)
试样是在以下的条件下进行测定。
测定法:反射法
光源的种类:Cu管球
使用波长:CuKα线
管电流:40mA
管电压:40Kv
试样板:玻璃
X射线的入射角:3°和12°
试验例1:帽依赖性内切核酸酶(CEN)抑制活性的测定
1)底物的制备
购入5′末端的G用二磷酸化修饰、且2′位的羟基用甲氧基化修饰、自5′末端第6位的U进行Cy3标记、3′末端进行BHQ2标记的30mer RNA(5′-pp-[m2′-O]GAA UAU(-Cy3)GCA UCA CUA GUA AGC UUU GCU CUA-BHQ2-3′:日本Bioservice公司制造),使用EPICENTRE公司制造的ScriptCap系统,附加帽结构(产物为m7G[5’]-ppp-[5’][m2’-O]GAA UAU(-Cy3)GCA UCA CUA GUA AGC UUU GCU CUA(-BHQ2)-3’)。将其通过改性聚丙烯酰胺凝胶电泳法进行分离、纯化,作为底物使用。
2)酶的制备
RNP是按照规定方法,由病毒颗粒制备(参考文献:VIROLOGY(1976)73,327-338页OLGA M.ROCHOVANSKY)。具体来说,将200μL 1x103PFU/mL A/WSN/33病毒接种于10日龄发育鸡卵中,在37℃下培养2天,然后回收鸡卵的尿囊液。通过使用20%蔗糖的超离心来纯化病毒颗粒,使用TritonX-100和溶血卵磷脂,使病毒颗粒溶解,然后通过使用30~70%甘油密度梯度的超离心,收集RNP组分(50~70%甘油组分),作为酶液(含有约1nM的PB1·PB2·PA复合物)使用。
3)酶促反应
在聚丙烯制的384孔板上分注2.5μL酶促反应液(组成:53mM Tris-盐酸盐(pH7.8)、1mM MgCl2、1.25mM二硫苏糖醇、80mM NaCl、12.5%甘油、0.15μL酶液)。接着在0.5μL用二甲基亚砜(DMSO)阶段稀释的被检化合物溶液、正对照(PC)和负对照(NC)中加入0.5μL DMSO,充分混合。接着加入2μL底物溶液(1.4nM底物RNA、0.05%Tween20),起始反应,在室温下温育60分钟,然后将1μL反应液加入到10μL高纯甲酰胺(Hi-Di Formamide)溶液(含有GeneScan120Liz Size Standard作为尺寸标记(Sizing marker):Applied Biosystem(ABI)公司制造)中,中止反应。NC是在反应开始前,通过加入EDTA(4.5mM)来预先中止反应(标记浓度全部为终浓度)。
4)抑制率(IC50值)的测定
将反应中止后的溶液在85℃下加热5分钟,在冰上骤冷2分钟,然后用ABI PRIZM 3730 Genetic Analyzer(基因分析仪)进行分析。通过分析软件ABI Genemapper对帽依赖性内切核酸酶产物的峰进行定量,分别以PC、NC的荧光强度作为0%抑制、100%抑制,求出被检化合物的CEN反应抑制率(%),然后使用曲线拟合软件(curve fitting software)(XLfit2.0:型号205(IDBS公司制造)等)求出IC50值。被检物质的IC50值如表1所示。
试验例2:CPE抑制效果确认试验
<材料>
·2%FCS E-MEM(在MEM(极限必需培养基)(Invitrogen)中添加卡那霉素和FCS进行调整)
·0.5%BSA E-MEM(在MEM(极限必需培养基)(Invitrogen)中添加卡那霉素和BSA进行调整)
·HBSS(Hanks平衡盐溶液)
·MDBK细胞
用2%FCS E-MEM调整为适当的细胞数(3×105/mL)。
·MDCK细胞
用HBSS清洗2次,然后用0.5%BSA E-MEM调整为适当的细胞数(5×105/mL)。
·胰蛋白酶溶液
将来自猪胰腺的胰蛋白酶(SIGMA)用PBS(-)溶解,用0.45μm的滤器过滤。
·EnVision(酶标仪)(PerkinElmer)
·WST-8试剂盒(Kishida化学)
·10%SDS溶液
<操作顺序>
·被验试样的稀释、分注
作为培养液,使用MDBK细胞时是使用2%FCS E-MEM,使用MDCK细胞时是使用0.5%BSA E-MEM。以下,对病毒·细胞·被验试样的稀释使用同样的培养液。
预先将被验试样用培养液稀释为适当的浓度,在96孔板上制作2~5倍阶段稀释系列(50μL/孔)。制作抗流感活性测定用、细胞毒性测定用两片。对于各药物实施一式三份测定。
使用MDCK细胞时,只在抗流感活性测定用时,向细胞中添加胰蛋白酶,使终浓度为3μg/mL。
·流感病毒的稀释、分注
预先将流感病毒用培养液稀释为适当的浓度,以50μL/孔分别分注到加入了被验试样的96孔板中。以50μL/孔将培养液分注到细胞毒性测定用板中。
·细胞的稀释、分注
以100μL/孔将调整为适当的细胞数目的细胞分别分注到加入了被验试样的96孔板中。
用孔板混合器(plate mixer)混合,在CO2温育箱中培养。抗流感活性测定用、细胞毒性测定用均培养3天。
·WST-8的分注
将培养了3天的96孔板在肉眼、显微镜下观察,确认细胞的形态、晶体的有无等。从板上清除上清,注意不要吸走细胞。
将WST-8试剂盒用培养液稀释10倍,以各100μL将该WST-8溶液分注到各孔中。用孔板混合器混合,然后在CO2温育箱中培养1~3小时。
对于抗流感活性测定用板,培养后,在各孔中分别分注10μL 10%SDS溶液,使病毒失活。
·吸光度的测定
对于混合的96孔板,用EnVision、以450nm/620nm的双波长测定吸光度。
<各测定项目值的计算>
按照以下的计算式,使用Microsoft Excel或具有同等计算处理能力的程序进行计算。
·抑制50%流感感染细胞死亡的浓度(EC50)的计算
EC50=10^Z
Z=(50%-High%)/(High%-Low%)×{log(High conc.)-log(Low conc.)}+log(High conc.)
被检物质的IC50值如表1所示。
表1
被检化合物显示高的帽依赖性内切核酸酶(CEN)抑制活性,显示高的CPE抑制效果。这些化合物可以制成药物,可用作由于感染流感病毒而诱发的症状和/或疾病的治疗和/或预防药。
因此可以说本发明涉及的化合物和制备方法是用于高效率地制备可用作药物的化合物的有用的中间体化合物和制备方法。
- 还没有人留言评论。精彩留言会获得点赞!