一株过表达3‑磷酸甘油脱氢酶基因的高山被孢霉、其构建方法及应用与流程
一株过表达3-磷酸甘油脱氢酶基因的高山被孢霉、其构建方法及应用【技术领域】本发明涉及一种在高山被孢霉中过表达3-磷酸甘油脱氢酶基因的工程菌株及其构建方法,属于生物工程技术领域。
背景技术:
多不饱和脂肪酸(PUFAs)是指含有两个或两个以上双键、碳原子数为16-26的直链脂肪酸。PUFAs是人体所必需的脂肪酸,对人类和动物的营养与健康具有十分重要的意义,具有调节血脂,清理血栓,调节免疫功能,健脑补脑等作用。由于传统的PUFAs来源已经无法满足日益增长的市场需求,所以能够积累多不饱和脂肪酸的微生物日渐成为食品、医药、化工和养殖领域研究的热点。高山被孢霉(Mortierellaalpina,M.alpina)是一种工业化生产花生四烯酸(Arachidonicacid,ARA)的产油真菌,可以以甘油三酯形式积累多种多不饱和脂肪酸,已经通过美国农业部(FDA)的安全性评估,同时也是脂质生物化学基础研究的重要模式菌。甘油三酯是脂质积累的主要形式,其合成主要遵循kennedy途径:游离脂肪酸首先被活化形成脂酰辅酶A,随后在不同酶的催化作用下与3-磷酸甘油进行酯化反应生成甘油一酯,进而合成甘油二酯,最终合成甘油三酯并结合蛋白形成脂肪颗粒。可见,3-磷酸甘油作为合成甘油三酯的骨架,有可能对产油微生物的脂质积累具有重要的意义。以往对于产油微生物脂质积累的研究多集中于脂肪酸的合成途径,期待通过过表达这些途径中的基因(例如乙酰辅酶A羧化酶和脂肪酸合成酶)以增加脂质产量,而有关3-磷酸甘油对甘油三酯合成影响的研究没有大规模深入展开,3-磷酸甘油脱氢酶是广泛存在于微生物、动植物细胞中的一类代谢调控酶,有多种同工酶形式,分别参与能量代谢、磷脂合成以及细胞内氧化还原反应的调节。NAD+依赖型的3-磷酸甘油脱氢酶可催化磷酸二羟丙酮生成3-磷酸甘油,是甘油合成途径中的关键酶。酿酒酵母(Saccharomycescerevisiae)中存在两种NAD+依赖型3-磷酸甘油脱氢酶同工酶(G3PD1和G3PD2):一种参与渗透压的调节;另一种与厌氧环境下的能量代谢有关。Nguyen等研究者发现在酿酒酵母中过表达G3PD1使3-磷酸甘油脱氢酶的活性提高了4倍左右,并导致菌株中3-磷酸甘油的含量升高了20倍,但是其脂肪酸含量与野生型没有区别,这就意味着3-磷酸甘油并没有影响到酿酒酵母的甘三酯积累。但是,随后的研究发现,将酿酒酵母的3-磷酸甘油脱氢酶基因在欧洲油菜(Brassicanapus)中表达,两倍酶活性的提高直接导致油菜种子的3-磷酸甘油含量提高了3~4倍,最终使油菜种子脂质产量提高了40%,这表明在种子中,3-磷酸甘油能调控甘三酯的合成。此外,在耶氏解脂酵母中过表达自身的G3PD1后,甘油三酯总量也有所提高。所以,3-磷酸甘油很有可能在脂质合成过程中发挥着重要的作用,提高细胞内3-磷酸甘油的供给将有助于提高产油真菌的脂质产量。高山被孢霉中存在3-磷酸甘油脱氢酶同工酶,通过转录组数据分析,选取在脂质代谢中发生明显变化的G3PD1基因为研究对象,以中国专利申请CN201310347934.8中公开的高山被孢霉尿嘧啶营养缺陷型菌株MAU1为宿主菌株,以中国专利申请号CN201310524221.4中公开的高山被孢霉(M.alpina)重组基因表达系统为基础,通过根癌土壤杆菌介导的方法过表达G3PD1基因,使得重组菌株具有高产脂质的能力,对于产油真菌高山被孢霉的基础理论研究及产品开发均具有重要的意义。
技术实现要素:
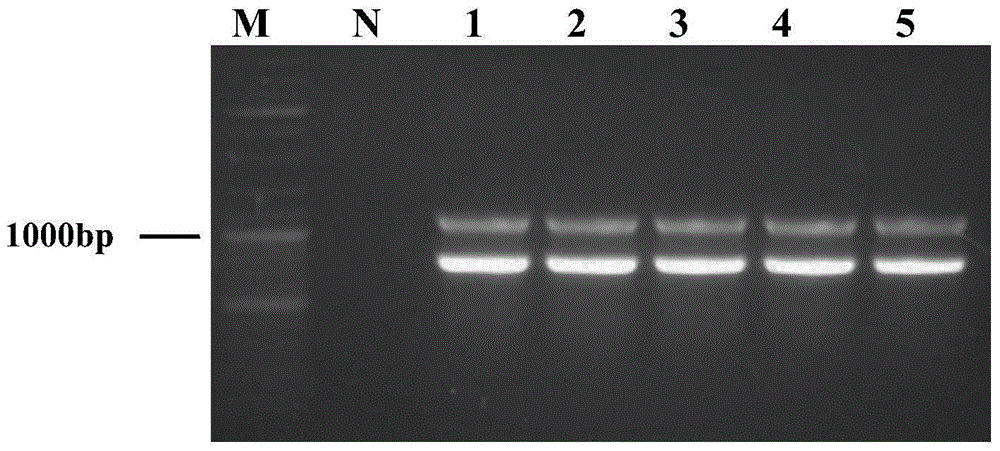
本发明的目的是通过根癌土壤杆菌介导的方法提供一株过表达G3PD1基因的重组高山被孢霉工程菌株,以及在高山被孢霉(M.alpina)中过表达G3PD1基因的方法。本发明的另一个目的是提供一株含有质粒pBIG2-ura5s-G3PD1的根癌土壤杆菌。本发明的再一个目的是将所述重组高山被孢霉工程菌株用于工业生产油脂。一方面,本发明提供了一株过表达G3PD1基因的高山被孢霉工程菌株,该菌株是以含G3PD1基因的根癌土壤杆菌转化高山被孢霉尿嘧啶营养缺陷型菌株构建而成的。特别地,该高山被孢霉工程菌株是用含有3-磷酸甘油脱氢酶基因的重组质粒pBIG2-ura5s-G3PD1转化根癌土壤杆菌后,再以含转化质粒pBIG2-ura5s-G3PD1的根癌土壤杆菌转化高山被孢霉尿嘧啶营养缺陷型菌株构建而成的。在本发明中,重组质粒pBIG2-ura5s-G3PD1的构建可参考中国专利申请CN201310524221.4中公开的内容。根据该申请的记载,首先用PCR的方法从pD4质粒上获得HPH表达单元,将HPH表达单元用限制性内切酶EcoRI和XbaI酶切,插入到EcoRI和XbaI酶切过的pET28a(+)的多克隆位点(MCS)中,得到质粒pET28a-HPHs。利用PCR从高山被孢霉cDNA中获得ura5(乳清酸磷酸核糖转移酶;OPRTase)基因,并利用限制性内切酶BspHI和BamHI酶切ura5基因,将酶切过的ura5基因插入到NcoI和BamHI酶切过的质粒pET28a-HPHs中,以替换的hpt基因,构建质粒pET28a-ura5s。用限制性内切酶EcoRI和XbaI酶切质粒pET28a-ura5s得到ura5s表达单元。将ura5s表达单元替换质粒pBIG2RHPH2中的HPH表达单元,进一步构建质粒转化质粒pBIG2-ura5s。更进一步地在质粒pBIG2-ura5s和质粒pET28a-HPHs的基础上,构建高山被孢霉基因操作通用载体。用PCR的方法从高山被孢霉基因组中获得非编码的内含子DNA片段IT。用限制性内切酶NcoI和BamHI分别对IT基因片段和质粒pET28a-HPHs进行酶切,并通过连接反应将IT片段取代质粒pET28a-HPHs的hpt基因,得到质粒pET28a-ITs。用限制性内切酶SpeI和XbaI双酶切质粒pET28a-ITs得到ITs表达单元。将ITs表达单元插入到XbaI酶切过的质粒pBIG2-ura5s中,得到高山被孢霉基因操作通用载体pBIG2-ura5s-ITs。然后通过基因工程技术将3-磷酸甘油脱氢酶基因插入高山被孢霉通用载体pBIG2-ura5s-ITs中,构建二元表达载体pBIG2-ura5s-G3PD1。在本发明中,所述高山被孢霉尿嘧啶营养缺陷型菌株是已公开的重组高山被孢霉MAU1,其保藏编号为CGMCCNo.8414,该菌株已在中国专利申请CN201310347934.8中公开。在本发明中,重组高山被孢霉MAU1(CGMCCNo.8414)被命名为重组高山被孢霉CCFM501,为同一株工程菌株。根据CN201310347934.8说明书记载,重组高山被孢霉MAU1是通过失活高山被孢霉(Mortierellaalpine)ATCC32222基因组中编码乳清酸磷酸核糖转移酶OPRTase的ura5基因构建而成的。其中,ura5基因的失活是通过缺失654bp的ura5基因中的213bp-230bp共18bp的序列而实现的,所使用的同源臂分别是ura5基因上游-1180至+212的1393bp和下游+231至+1592的1362bp的片段,具体步骤为:首先获得ura5敲除基因片段,并进一步构建敲除质粒pBIG4KOura5,然后用重组质粒pBIG4KOura5转化根癌土壤杆菌,最后用经转化的含质粒pBIG4KOura5的根癌土壤杆菌转化高山被孢霉并对转化后的高山被孢霉进行筛选和鉴定,获得尿嘧啶营养缺陷型高山被孢霉MAU1菌株。另一方面,本发明提供了一种构建过表达3-磷酸甘油脱氢酶基因的重组高山被孢霉菌株的方法,该方法包括如下步骤:克隆来源于高山被孢霉(M.alpina)ATCC#32222的3-磷酸甘油脱氢酶基因,然后通过基因工程技术将其插入高山被孢霉通用载体pBIG2-ura5s-ITs中,构建二元表达载体pBIG2-ura5s-G3PD1,再用含重组质粒pBIG2-ura5s-G3PD1的根癌土壤杆菌转化高山被孢霉尿嘧啶缺陷型菌株CCFM501,通过筛选和鉴定,获得过表达3-磷酸甘油脱氢酶的高山被孢霉工程菌株。在本发明中,应用于转化高山被孢霉的根癌土壤杆菌为:根癌土壤杆菌AgrobacteriumtumefaciensC58C1(TsujiG,FujiiS,FujiharaN,etal.Agrobacteriumtumefaciens-mediatedtransformationforrandominsertionalmutagenesisinColletotrichumlagenarium[J].JournalofGeneralPlantPathology,2003,69(4):230-239.),为本领域技术人员可以公开获得的菌株。本发明以中国发明专利申请CN201310347934.8公开的高山被孢霉尿嘧啶营养缺陷型菌株MAU1(CGMCCNo.8414)作为转化宿主菌株,以中国发明专利申请CN201310524221.4公开的高山被孢霉重组基因表达系统为基础,在其基础上通过进一步的基因重组方法构建一株新的能够高表达3-磷酸甘油脱氢酶基因的重组高山被孢霉菌株。本发明所涉及的Broth培养基,其组成为:20g/L葡萄糖,5g/L酵母提取物,1g/L磷酸二氢钾,0.25g/L七水硫酸镁,10g/L硝酸钾,余量为水,pH6.0。本发明所涉及的MM固体培养基,其组成为:1.74g/L磷酸氢二钾,1.37g/L磷酸二氢钾,0.146g/L氯化钠,0.49g/L七水硫酸镁,0.078g/L氯化钙,0.0025g/L七水硫酸亚铁,0.53g/L硫酸铵,1.8g/L葡萄糖,0.5wt%甘油,20g/L琼脂,余量为水,pH6.8。本发明所涉及的IM培养基是在MM培养基的基础上添加了200μM的乙酰丁香酮(AS)构成的。本发明所涉及的SC-CS培养基是添加了浓度为100μg/mL壮观霉素奇霉素(spectinomycin)和浓度为100μg/mL头孢噻肟抗生素(CefotaximeSodium)的SC固体培养基。SC固体培养基组成为:20g/L葡萄糖,5g/L酵母氮源无氨基酸和硫酸铵,1.7g/L硫酸铵,60mg/L异亮氨酸,60mg/L亮氨酸,60mg/L苯丙氨酸,50mg/L苏氨酸,40mg/L赖氨酸,30mg/L酪氨酸,20mg/L腺嘌呤,20mg/L精氨酸,20mg/L组氨酸,10mg/L甲硫氨酸,20g/L琼脂,余量为水,pH6.8。本发明所涉及的GY-CS培养基是添加了浓度为100μg/mL壮观霉素奇霉素(spectinomycin)和浓度为100μg/mL头孢噻肟抗生素(CefotaximeSodium)的GY固体培养基。GY固体培养基组成为:20g/L葡萄糖,10g/L酵母提取物,2g/L硝酸钾,1g/L磷酸二氢钠,3g/L七水硫酸镁,20g/L琼脂,余量为水,pH6.8。本发明在现有的高山被孢霉转化系统的基础上,采用根癌土壤杆菌介导的基因转化方法,构建了在高山被孢霉中过表达3-磷酸甘油脱氢酶基因(G3PD1)的工程菌株高山被孢霉GPD-1。获得的基因工程菌株经过多次传代,G3PD1片段仍稳定存在基因组中,且生长特性与原养型菌株无明显差别,但总脂产量相对于原始菌株提高了50%左右,这为该基因工程菌株工业化生产油脂提供了基础。本发明的重组高山被孢霉菌株(Mortierellaalpina)GPD-1于2015年7月2日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,保藏编号为CGMCCNo.11001高山被孢霉尿嘧啶营养缺陷型菌株(Mortierellaalpina)MAU1于2013年11月01日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,其保藏编号为CGMCCNo.8414。【附图说明】图1为二元表达载体pBIG2-ura5s-G3PD1的构建示意图;图2为过表达G3PD1基因的高山被孢霉重组菌株鉴定的琼脂糖凝胶电泳图;其中,M为marker,N为高山被孢霉野生型对照菌株,1、2、3、4、5分别为pBIG2-ura5s-G3PD1转化的重组菌株:MA-G3PD1-1,MA-G3PD1-2,MA-G3PD1-3,MA-G3PD1-4,MA-G3PD1-5;图3为高山被孢霉野生型菌株与5株基因工程菌株3-磷酸甘油脱氢酶基因(G3PD1)RT-qPCR的结果分析图;其中,M.alpina为野生型对照;MA-G3PD1-1,MA-G3PD1-2,MA-G3PD1-3,MA-G3PD1-4,MA-G3PD1-5为重组菌株。图4为高山被孢霉野生型菌株与5株基因工程菌株3-磷酸甘油脱氢酶活性的测定结果分析图;其中,M.alpina为野生型对照;MA-G3PD1-1,MA-G3PD1-2,MA-G3PD1-3,MA-G3PD1-4,MA-G3PD1-5为重组菌株。【具体实施方式】以下实施例用于非限制性地解释本发明的技术方案。实施例1过表达3-磷酸甘油脱氢酶基因的重组高山被孢霉菌株的构建一、高山被孢霉G3PD1的克隆根据高山被孢霉(M.alpina)ATCC#32222G3PD1基因(GeneBankKT344118)的序列信息,设计引物P1、P2,下划线部分分别为酶切位点KpnI和XmaI,以高山被孢霉cDNA为模板,用引物P1/P2、KOD高保真聚合酶,通过PCR对G3PD1基因进行扩增,得到目的片段。PCR程序为:94℃3min,94℃30s,58℃30s,68℃1.5min,30个循环,68℃5min;得到PCR产物,再对PCR产物进行纯化,纯化产物用1.2%的琼脂糖凝胶电泳验证。P1(sense):CGGGGTACCCCATGTCTGAAAAAGTAGCACTAATCGP2(antisense):TCCCCCCGGGTTAGATATCCTCGACAATCCTGATG二、二元表达载体的构建1.酶切反应在37℃条件下,先用限制性内切酶KpnI过夜酶切步骤(一)的PCR纯化产物及载体pBIG2-ura5s-ITs。KpnI酶切体系(100μL)为:2μLKpnI-HF,30μL质粒或PCR产物,10μLcutmartBuffer,58μL去离子水,37℃水浴酶切12h。其中,载体pBIG2-ura5s-Its是中国专利申请CN201310524221.4中已经公开的内容。酶切产物回收纯化后,再用内切酶XmaI单酶切,酶切体系为(100μL):2μLXmaI,30μL质粒或PCR产物,10μLcutmartBuffer,58μL去离子水,37℃水浴酶切12h。本发明涉及的内切酶缓冲液cutsmartbuffer:50mM乙酸钾(Potassiumacetate),20mM(Tris-乙酸)Tris-acetate,10mM乙酸镁(Magnesiumacetate),100μg/mlBSA,余量为水,pH7.9。2.连接反应用T4连接酶将酶切纯化后的片段G3PD1与载体pBIG2-ura5s-ITs连接,4℃连接12h,得到重组表达载体为pBIG2-ura5s-G3PD1。连接体系为(10μL):2μL目的基因酶切后片段,3μL载体酶切后片段,1μL连接酶buffer,1μLT4连接酶,3μL无菌水,4℃连接12h。连接产物转化大肠杆菌TOP10感受态细胞,转化方法如下:⑴无菌状态下取100μL感受态细胞,加入1-2μL连接产物,吹吸混匀。⑵将混匀的感受态细胞移入预冷过的电转杯中,避免产生气泡。⑶将电转杯放入Bio-Rad电转仪,调到合适预设程序档位,电转。电压条件为1.8kv。⑷加入1mlSOC复苏培养基于电转后的感受态细胞中,混匀转移至1.5ml离心管中,37℃,150rpm孵育1小时。⑸取200μL涂布含有100μg/mL卡那霉素的LB固体培养基平板。倒置37℃培养过夜。挑取阳性转化子,提取质粒,测序验证结果表明连接成功,获得二元表达载体pBIG2-ura5s-G3PD1。其中,SOC复苏培养基的组成为:20g/L胰蛋白胨,5g/L酵母粉,0.5g/L氯化钠,2.5mM氯化钾,10mM氯化镁,20mM葡萄糖,余量为水;LB固体培养基的组成是:10g/L胰蛋白胨,5g/L酵母粉,10g/L氯化钠,20g/L琼脂,余量为水。二元表达载体pBIG2-ura5s-G3PD1电击转化根癌土壤杆菌的方法参照转化大肠杆菌TOP10的方法,得到含有质粒pBIG2-ura5s-G3PD1的根癌土壤杆菌C58C1。三、根癌土壤杆菌介导转化高山被孢霉MAU1(即高山被孢霉CCFM501)在已有的国内外文献有关根癌土壤杆菌转化方法报道的基础上,做了适当的优化调整,具体如下:⑴将保存于-80℃的含有质粒pBIG2-ura5s-G3PD1的根癌土壤杆菌C58C1在含有100μg/mL利福平和100μg/mL卡那霉素的YEP固体培养基平板上划线。28℃倒置避光培养48小时;⑵挑取单克隆接种至20mL含有100μg/mL利福平和100μg/mL卡那霉素的液体YEP培养基中28℃,200rpm避光培养24-48小时;⑶4000g离心5分钟收集菌体,倒掉上清。加5mLIM培养基重悬菌体,4000g离心5分钟,倒掉上清。加2mLIM培养基重悬菌体;⑷用IM培养基调整菌浓度至OD600为0.3。置于28℃,200rpm摇床避光培养至OD600到1.0;⑸用500μL灭菌的生理盐水冲刷在GY-U斜面培养1个月以上的高山被孢霉尿嘧啶营养缺陷型菌株CCFM501(申请号为201310347934.8的专利申请中公开的M.alpina尿嘧啶营养缺陷型菌株),收集孢子,用血球计数器计数,调整孢子浓度到107个每100μL;⑹取100μL根癌土壤杆菌与100μL孢子混合,均匀涂布于铺有玻璃纸的IM固体培养基上。23℃避光培养36-48小时;⑺将玻璃纸转移到含有100μg/mL壮观霉素和100μg/mL头孢噻肟抗生素的SC平板(SC-CS)上。18℃避光培养12h,随后转移至25℃培养;⑻持续观察菌落在SC-CS平板上的生长情况,若长出明显菌落,及时用尖头镊子将菌落外沿挖出(大约2mm2),接种于SC-CS平板上,继续正置于25℃培养箱中培养;⑼待SC-CS平板上的转化子长出后,挑菌丝转接于SC-CS平板,重复筛选3次,排除阴性转化子;⑽将筛选3次后生长的菌落接种至GY平板,28℃培养至产生大量孢子,保藏在4℃。其中,MM培养基成分是:1.74g/L磷酸氢二钾,1.37g/L磷酸二氢钾,0.146g/L氯化钠,0.49g/L七水硫酸镁,0.078g/L氯化钙,0.0025g/L七水硫酸亚铁,0.53g/L硫酸铵,1.8g/L葡萄糖,0.5wt%甘油,pH6.8,余量为水。IM培养基是在MM培养基的基础上添加了200μM的乙酰丁香酮(AS)构成的。SC培养基的组分是:5g/L酵母氮源(无氨基酸与硫酸铵),1.7g/L硫酸铵,20g/L葡萄糖,20mg/L腺嘌呤,30mg/L络氨酸,1mg/L甲硫氨酸,2mg/L组氨酸,4mg/L赖氨酸,4mg/L色氨酸,5mg/L苏氨酸,6mg/L异亮氨酸,6mg/L亮氨酸,6mg/L苯丙氨酸,2mg/L精氨酸,余量为水。GY固体培养基的组分是:20g/L葡萄糖,10g/L酵母提取物,2g/L硝酸钾,1g/L磷酸二氢钠,3g/L七水硫酸镁,20g/L琼脂,余量为水。YEP培养基的组分是:10g/L酵母提取物,10g/L胰蛋白胨,5g/L氯化钠,余量为水。涉及到固体培养基时添加20g/L琼脂。四、高山被孢霉过表达G3PD1工程菌株筛选和鉴定1)用3mL生理盐水冲刷GY表面,收集液体于一个无菌1.5mL离心管中,过25μm滤膜;2)用血球计数器计数,调整为三种孢子浓度梯度108个每100μL、106个每100μL、104个每100μL,分别取200μL涂布于含有100μg/mL壮观霉素和100μg/mL头孢噻肟的GY-CS平板上,25℃避光培养2-3天;3)随时用无菌镊子挑出生长的真菌菌丝SC-CS平板上,25℃培养2-3天;4)观察高山被孢霉在平板上的生长情况,挑出在SC-CS平板上生长的菌丝接种于GY斜面上;5)将上述步骤4)中平板上的高山被孢霉菌株孢子在GY斜面上传代三次;6)将稳定遗传的菌株鉴定为过表达G3PD1基因的重组高山被孢霉菌株,保藏于GY斜面上;7)提取鉴定正确的重组高山被孢霉菌株的基因组DNA,用一对与启动子和终止子特异性结合的引物进行PCR验证:P3(sense):CACACACAAACCTCTCTCCCACTP4(antisense):CAAATGAACGTATCTTATCGAGATCC;重组菌株鉴定的琼脂糖凝胶电泳分析结果见图2,M为marker,N为高山被孢霉野生型对照,1、2、3、4、5:MA-G3PD1-1,MA-G3PD1-2,MA-G3PD1-3,MA-G3PD1-4,MA-G3PD1-5为pBIG2-ura5s-G3PD1转化的重组菌株,可扩增出两条大小分别为818bp和1187bp的产物条带,电泳结果说明二元表达载体成功整合到高山被孢霉基因组中,其中MA-G3PD1-1即为本发明的高山被孢霉(Mortierellaalpina)GPD-1。8)所述重组菌株保藏于GY斜面上。实施例2高山被孢霉脂肪酸提取与检测⑴将高山被孢霉原养型菌株与实施例1筛选获得的高山被孢霉过表达G3PD1基因的工程菌株MA-G3PD1-1(即本发明的高山被孢霉GPD-1),MA-G3PD1-2,MA-G3PD1-3,MA-G3PD1-4和MA-G3PD1-5接种于broth培养基中,28℃,200r/min摇床培养7天;⑵收集菌体,真空冷冻干燥至恒重,称量菌体重量,计算生物量;⑶将菌体研磨成粉末,称取50mg,加入2mL4mol/L盐酸;⑷80℃水浴1h,-80℃放置15分钟。重复一次。80℃水浴1h;⑸冷却至室温,加入1mL甲醇,混匀;⑹加入1mL氯仿,震荡10min。6000g离心3min。收集氯仿;⑺重复⑹两次;⑻合并氯仿(3mL),加入1mL饱和氯化钠,混匀,3000g离心3分钟。收集氯仿层于新瓶。剩余液体继续加入1mL氯仿,3000g离心3分钟。合并氯仿(4mL);⑼氮吹干燥,加入1mL乙醚,转移至洁净的已经称重的瓶中。氮吹干燥。脂肪酸组成及含量的测定方法:①向上述粗脂中分别加入100μL2.02mg/ml内标C15:0的正己烷和1mL10wt%盐酸的甲醇,60℃水浴3h,每隔30min振荡1min;②冷却至室温后加入1mL正己烷和1mL饱和NaCl溶液,震荡混匀,3000rpm离心3min,吸出正己烷层,再加入1mL正己烷,震荡混匀,3000rpm离心3min,吸出并合并正己烷;③37℃氮气吹干后,加入1mL正己烷,混匀,转入气相瓶,得到脂肪酸甲酯溶液;④脂肪酸甲酯分析采用GC-2010(ShimadzuCo.,Japan),色谱柱为DB-Waxetr(30m×0.32mm,0.22μm)。氢火焰离子检测器检测,汽化室和检测器温度分别为240℃和260℃,分流方式进样1μL,分流比10:1,载气为氮气。程序升温:初始温度120℃保持3min,以5℃/min升到190℃,再以4℃/min升到220℃,保持20min。通过与商业化的脂肪酸甲酯标准品(37种脂肪酸甲酯混标,Supelco,USA)和加入内标C15:0的质量比较,定性、定量分析样品中脂肪酸组分,其中总脂肪酸含量用单位菌体中总脂肪酸的质量表示。表1高山被孢霉野生型菌株与五株基因工程菌株脂肪酸产量的比较表1结果显示各转化子的产脂率相比野生型高山被孢霉产量有明显提高,其中MA-G3PD1-1(高山被孢霉GPD-1)的总脂含量由野生型的27.71wt%提高到42.74wt%,提高了50%左右。各转化子总脂含量的差异可能是由G3PD1基因整合到高山被孢霉染色体的位点不同造成的。实施例3阳性转化子中G3PD1转录水平的RT-qPCR检测根据G3PD1序列和内参18SrDNA序列设计引物:P5(sense):TACGCCAACCTTCAGAGTCAAP6(antisense):TGAGACCATCAACCAATCCACCP7(sense):CGTACTACCGATTGAATGGCTTAGP8(antisense):CCTACGGAAACCTTGTTACGACT高山被孢霉总RNA提取:1.取出适量在液氮中冻存的菌体,于预冷的无菌无酶研钵中加入液氮充分研磨;2.加入1mLTRIzol(Invitrogen,Carlsbad,CA,USA)继续研磨至粉末,室温放置至溶解;3.用无酶枪头吸取1mL上述步骤中液体于无酶离心管中,加入200μL三氯甲烷混匀;4.12000rpm,4℃,离心15min吸上清于新的无酶离心管中;5.加入200μL三氯甲烷混匀,12000rpm,4℃,离心15min吸上清于新的无酶离心管中;6.加入等体积的异丙醇,静置15min,12000rpm,4℃,离心15min。弃上清,室温晾干;7.加入1ml的70vol%乙醇,12000rpm,4℃,离心15min。用无酶枪头吸去乙醇,室温放置干燥;8.加入50μL无酶水溶解RNA,-80℃储存;9.浓度测定:取1μLRNA用Nanodrop2000测定浓度;10.变性胶电泳检测RNA完整性:取1μgRNA在1.2%的变性胶中电泳,观察RNA完整性。取0.5-1μg总RNA为模板,根据PrimeScriptRTreagentkit(TaKaRa,Otsu,Shiga,Japan)试剂盒说明进行操作,获得重组菌株的cDNA。使用ABI-Prism7900sequencedetectionsystem(AppliedBiosystems,CA)按照SYBRGreenPCRMasterMix(AppliedBiosystems,CA)的说明进行RT-qPCR反应。反应体系为:10μlSYBRGreenPCRMasterMix,两种引物各0.5μl,8μl无酶水,1μl模板。PCR循环设置为50℃2min,95℃10min,95℃15s,60℃30s,40个循环。18SrDNA作为内参基因,各转化子取三个平行。结果如图3所示,M.alpina为野生型对照;MA-G3PD1-1,MA-G3PD1-2,MA-G3PD1-3,MA-G3PD1-4,MA-G3PD1-5为重组菌株,5株基因工程菌G3PD1的转录量均明显高于对照菌株,提高2倍左右,其中MA-G3PD1-1表达量为M.alpina野生型对照2.3倍,说明通过使用根癌土壤杆菌介导转化高山被孢霉的方法可以明显提高3-磷酸甘油脱氢酶基因的转录。实施例4阳性转化子中3-磷酸甘油脱氢酶活性测定取0.2g菌体用液氮充分研磨至粉末,加入2mL酶提取缓冲液(含有100mM磷酸二氢钾/氢氧化钾缓冲液(pH7.5),1mM苯甲脒盐酸,1mM二硫苏糖醇和20wt%甘油),转移到1.5mL离心管中,4℃,10000g,离心5min,吸取上清液到新的1.5mL离心管中即粗蛋白提取液。3-磷酸甘油脱氢酶活性测定反应体系各组分浓度为:20mM咪唑盐酸缓冲液(pH7.0),1mM氯化镁,0.09mM还原态烟酰胺腺嘌呤二核苷酸,0.67mM磷酸二羟丙酮,粗蛋白约0.1mg/mL。测定方法:迅速混匀除磷酸二羟丙酮外的其他试剂,30℃保温2min;340nm处测定3min,待数值基本稳定后,加入磷酸二羟丙酮,于340nm处测定3min,根据单位时间内吸光值的变化计算酶活。3-磷酸甘油脱氢酶酶活以每mg蛋白每分钟产物的增加量或底物的减少量表示。结果如图4所示。M.alpina为野生型对照;MA-G3PD1-1,MA-G3PD1-2,MA-G3PD1-3,MA-G3PD1-4,MA-G3PD1-5为重组菌株,5株基因工程菌3-磷酸甘油脱氢酶活性均明显高于对照菌株,均提高2倍左右,说明过表达G3PD1提高了3-磷酸甘油脱氢酶的活性。结果表明,本发明获得的高山被孢霉过表达3-磷酸甘油脱氢酶工程菌株经过多次传代后,G3PD1片段仍稳定存在基因组中,且脂肪酸分析结果显示所得到的基因工程菌株中脂质产量均有明显提高,挑选脂质产量提高达50%的菌株MA-G3PD1-1保藏为本发明的高山被孢霉GPD-1,用此方法构建的基因工程菌株及构建方法为后续工业化奠定了理论及应用基础。虽然本发明专利已以较佳实施例公开如上,但其并非用以限定本发明。任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种改动与修饰。因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 甘油醛-3-磷酸脱氢酶及胞质雄性不育的核恢复的制作方法
- 盐藻nadp-甘油醛-3-磷酸脱氢酶基因克隆和蛋白表达方法
- 产甘油假丝酵母NAD<sup>+</sup>依赖-甘油3-磷酸脱氢酶基因及其克隆的制作方法
- 3-磷酸甘油脱氢酶基因及其用途的制作方法
- 甘油三磷酸脱氢酶基因与原发性高血压的相关性的制作方法
- 来自 C a n d i d a A l bi c a n s的甘油-3-磷酸磷酸酶和甘油-3-磷酸脱氢酶 ...的制作方法
- 一种d-3-磷酸甘油酸脱氢酶及其编码基因及构建方法
- 一种甘油三磷酸脱氢酶活性检测试剂盒的制作方法
- 一种植物三磷酸甘油醛脱氢酶基因及制备方法和应用的制作方法
- 盐生杜氏藻3-磷酸甘油脱氢酶及其编码序列的制作方法