木聚糖酶的用途的制作方法
技术领域:
本发明涉及具有改进的性质的酶和涉及包含适用于例如在酿造工艺中生产食品、饮料(例如啤酒)、饲料或者生物燃料的这些酶的组合物。
背景技术:
:在啤酒生产中使用酶是众所周知的。WO97/42302中描述了将酶应用于糖化醪制备(mashing)步骤以改进糖化醪(mash)可过滤性和提高浸出物产率。WO2005118769和WO2005059084涉及啤酒生产工艺中的糖化醪制备和过滤步骤和涉及用于这种工艺的酶组合物。WO1999057325涉及绳状青霉菌(Penicilliumfuniculosum)的菌株,涉及从其中获得的新的酶混合物以及所述酶的核酸序列。但是,仍需要可用于食品和饮料产品的生产的改进的酶及酶组合,如用于酒精饮料如啤酒和威士忌的生产中的糖化醪制备、蒸煮和过滤步骤中。本发明的目的本发明的实施方案的目的是提供适合于食品和饮料产品的生产的酶,如在酒精饮料或者非酒精饮料(例如基于谷物或者麦芽的饮料如啤酒或者威士忌)的生产中。所提供的酶可具有与在酿造中的使用相关的改进的性质。这些广泛种类的改进的性质包括例如最佳温度改进、对可溶性阿拉伯木聚糖(WE-AX)底物的活性与对不溶性阿拉伯木聚糖(WU-AX)底物的活性之比改进、在酿造工艺的滤清(lautering)和/或过滤(filtration)步骤中总压力升高减少、以及经酶处理的材料的可过滤性提高。技术实现要素:本发明人已发现,一种或者多种酶以及某些酶组合相对于已知的酶和酶组合具有改进的性质,所述改进的性质尤其与在这样的酿造工艺中的使用相关,即在酿造工艺用该一种或者多种酶处理含淀粉材料以生产酿造用糖化醪。因此,在第一方面,本发明涉及显示内切-1,4-β-木聚糖酶活性的酶,该酶包含与选自SEQIDNO:1、SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:5、SEQIDNO:6、SEQIDNO:17和SEQIDNO:18的任一者或者它们的任何功能片段具有至少80%同一性的氨基酸序列。本文所用的“功能片段”指酶的截短版本,其与非截短的参比酶具有实质上相同的酶活性或者至少显著程度的酶活性。因此,在第二方面,本发明涉及显示内切-1,3(4)-β-葡聚糖酶活性的酶,该酶包含与选自SEQIDNO:7、SEQIDNO:8、SEQIDNO:9、SEQIDNO:10和SEQIDNO:11、SEQIDNO:12、SEQIDNO:13、SEQIDNO:14、SEQIDNO:15、SEQIDNO:16的任一者或者它们的任何功能片段具有至少80%同一性的氨基酸序列。在第三方面,本发明涉及一种包含编码根据本发明的酶的DNA序列的DNA构建体。在又一方面,本发明涉及一种重组表达载体,其包含有包含编码根据本发明的酶的DNA序列的DNA构建体。在又一方面,本发明涉及一种细胞,其已用包含编码根据本发明的酶的DNA序列的DNA构建体转化。在又一方面,本发明涉及包含根据本发明的酶或者DNA构建体或者载体或者细胞的制剂。在又一方面,本发明涉及包含根据本发明的显示内切-1,4-β-木聚糖酶活性的酶与任何一种或者多种β-葡聚糖酶的组合的组合物。在又一方面,本发明涉及包含根据本发明的显示内切-1,3(4)-β-葡聚糖酶活性的酶与任何一种或者多种木聚糖酶的组合的组合物。在又一方面,本发明涉及根据本发明的酶或者根据本发明的制剂或者根据本发明的组合物在生产食品、饲料或者麦芽饮料产品如啤酒和威士忌中的用途。在又一方面,本发明涉及根据本发明的酶或者根据本发明的制剂或者根据本发明的组合物在生产面团或者培烤产品中的用途。在又一方面,本发明涉及根据本发明的酶或者根据本发明的制剂或者根据本发明的组合物在制备纸浆或者纸张中的用途。在又一方面,本发明涉及根据本发明的酶或者根据本发明的制剂或者根据本发明的组合物用于制备谷物成分的用途。在一些实施方案中,谷物是黑麦、小麦或者大麦。在又一方面,本发明涉及根据本发明的酶或者根据本发明的制剂或者根据本发明的组合物在生产啤酒或者对酿造工艺副产物进行改性中的用途。在又一方面,本发明涉及根据本发明的酶或者根据本发明的制剂或者根据本发明的组合物在生产果汁酒(wine)或者果汁中的用途。在又一方面,本发明涉及根据本发明的酶或者根据本发明的制剂或者根据本发明的组合物在生产第一代或者第二代生物燃料如生物乙醇中的用途。在又一方面,本发明涉及一种改变含淀粉材料的可过滤性的方法,所述方法包括用根据本发明的酶或者制剂或者组合物处理所述含淀粉材料的步骤。在又一方面,本发明涉及一种在酿造应用中减少滤清过程中压力升高的方法,所述方法包括用根据本发明的酶或者制剂或者组合物处理酿造用糖化醪的步骤。在又一方面,本发明涉及一种用于生产食品、饲料或者饮料产品如酒精饮料或者非酒精饮料例如基于谷物或者麦芽的饮料如啤酒或者威士忌的方法,所述方法包括用根据本发明的酶或者制剂或者组合物处理含淀粉材料的步骤。在又一方面,本发明涉及一种用于生产酿造用糖化醪的方法,所述方法包括用根据本发明的酶或者制剂或者组合物处理含淀粉材料的步骤。在又一方面,本发明涉及一种用于生产第一代或者第二代生物燃料如生物乙醇的方法,所述方法包括用根据本发明的酶或者制剂或者组合物处理含淀粉材料的步骤。在又一方面,本发明涉及一种通过根据本发明的方法获得的产品。在又一方面,本发明涉及一种包含通过根据本发明的方法获得的产品的组合物,如其中所述产品在0.1%-99.9%的范围内。附图说明图1:实验室规模和中试规模酿造中使用的糖化醪制备进程(profile)。通过10分钟的混料(mashing-in)时间开始糖化醪制备,然后添加酶。图2:得自对葡聚糖酶和木聚糖酶筛选的验证的中试规模酿造应用结果。对比空白和Max测试了枯草芽孢杆菌(B.sub)葡聚糖酶S与塔宾曲霉(A.tub)木聚糖酶的组合。所收集的数据为平均流速(L/h)、滤清期间的总压力升高(mmWC,其中1mmWC=9.80665Pa)和滤清过程中记录的最大压力(mmWC)。图3:木聚糖酶在酿造中的功能性图4:应用各种木聚糖酶候选物的流速-滤清图5:啤酒过滤-多次过滤的平均值图6:啤酒过滤-多次过滤的平均值图7:实施例3的糖化醪制备图解。具体实施方式啤酒在传统上是指衍自麦芽(如衍自大麦谷粒的麦芽)和任选的辅料(如含淀粉植物材料(例如谷物谷粒))并任选调味(例如用啤酒花调味)的酒精饮料。在本发明的上下文中,术语“啤酒”意在包括任何通过含淀粉植物材料的发酵/酿造生产的发酵麦芽汁,因此具体而言还包括专门从辅料生产或者从麦芽和辅料的任何组合生产的啤酒。术语“发酵”在本发明的上下文中意指通过在培养物中生长微生物产生某种物质如乙醇。通常,使用微生物如酵母进行发酵。本文所用的术语“麦芽”被理解为任何发芽的谷物谷粒,如发芽的大麦。“辅料”可定义为任何非麦芽或者大麦麦芽的含淀粉植物材料。“含淀粉植物材料”可例如为一种或者多种谷物,如大麦、小麦、玉蜀黍、黑麦、高粱、稷或者大米以及它们的任何组合。含淀粉植物材料可进行加工,例如研磨、发芽、部分发芽或者不发芽。不发芽的谷物也称“原粮”。非谷物含淀粉植物材料的例子包括例如块茎如马铃薯和木薯。本文所用的术语“饮料”和“饮料产品”包括诸如以下的会形成泡沫的发酵饮料:全麦芽啤酒(fullmaltedbeer)、以“《德国啤酒纯净法》”(“Reinheitsgebot”)酿造的啤酒、高酒度啤酒、干啤酒、低酒度啤酒、轻淡啤酒、低醇啤酒、低卡路里啤酒、波特黑啤酒、博克啤酒、司陶特黑啤酒、麦芽酒、无醇啤酒、无醇麦芽酒等。术语“饮料”或者“饮料产品”还包括无泡啤酒和另类麦芽饮料,如水果调味的麦芽饮料,例如柑橘类水果调味的(例如柠檬调味的、橙子调味的、酸橙调味的或浆果调味的)麦芽饮料,酒调味的麦芽饮料(例如伏特加酒调味的、朗姆酒调味的或龙舌兰酒调味的麦芽酒),或咖啡调味的麦芽饮料(例如咖啡因风味的麦芽酒)等等。啤酒可通过实质上相同的工艺从多种含淀粉植物材料制造,其中淀粉主要由葡萄糖均聚物组成,其中葡萄糖残基以α-1,4-或者α-1,6-键连接,多为前一种键。制造发酵饮料如啤酒的工艺通常称为酿造。制造这些饮料所使用的传统原材料为水、啤酒花和麦芽。除了麦芽之外或者作为麦芽的替代,诸如以下的辅料可用作淀粉的来源:普通粗磨玉米粉、细磨玉米粉、制啤酒用研磨酵母、大米、高粱、精制玉米淀粉、大麦、大麦淀粉、去壳大麦、小麦、小麦淀粉、烘培的谷物、谷物片、黑麦、燕麦、马铃薯、木薯和糖浆(如玉米糖浆、甘蔗糖浆、转化糖糖浆、大麦和/或小麦糖浆)等等。淀粉将最终被酶促转化为可发酵糖。就主要从麦芽(例如辅料至多为15-20%)制造的啤酒而言,由于多种原因,麦芽(其主要从选定的大麦品种生产)对啤酒的总体特征和质量具有最大的影响。第一,麦芽是啤酒中主要的风味剂。第二,麦芽提供可发酵糖的主要部分。第三,麦芽提供蛋白质,其将贡献啤酒的酒体和泡沫特征。第四,麦芽提供糖化醪制备期间必需的酶活性。啤酒花也对啤酒的品质(包括风味)有很大贡献。具体地讲,啤酒花(或啤酒花成分)给啤酒中加入想要的苦味化物质。此外,啤酒花可起到蛋白质沉淀剂作用、建立防腐剂并帮助泡沫形成和稳定化。并非所有的啤酒都使用啤酒花生产。也可使用其他的稳定剂如蛋白酶(例如木瓜蛋白酶)。常规的酿造工艺可描述如下,但不想让其被解释为对本发明的限制:制造啤酒的工艺是本领域所熟知的,但简而言之,其涉及五个步骤:(a)糖化醪制备和/或辅料的蒸煮(b)麦芽汁分离和提取(c)煮沸麦芽汁并加入啤酒花(d)冷却、发酵和储存,以及(e)成熟、加工和包装。通常,在第一步中,将研磨或压碎的麦芽与水相混合并在受控的温度下保持一段时间以让麦芽中存在的酶将麦芽中存在的淀粉转化为可发酵糖。在第二步中,将糖化醪转移至“过滤槽”或糖化醪过滤器,在其中液体与谷粒残余物分离。这个甜味液体称为“麦芽汁”,剩余的谷粒残余物称为“麦糟”。通常将糖化醪进行提取,这涉及向糖化醪加水以从麦糟回收残余的可溶性浸出物。在第三步中,将麦芽汁剧烈煮沸。这将麦芽汁灭菌并有助于发展色度、风味和气味。在煮沸过程中的某个时刻加入啤酒花。在第四步中,将麦芽汁冷却并转移至发酵罐,所述发酵罐装有酵母或向其中加入酵母。酵母通过发酵将糖转化为醇和二氧化碳气体;在发酵的最后,使发酵罐变冷或可使发酵罐变冷以停止发酵。除去酵母絮凝物。在最后一步中,将啤酒冷却并储存一段时间,在所述时间段中,啤酒变澄清且其风味发展,并且任何可能损害啤酒的外观、风味和货架期的物质都沉淀出来。在包装之前,对啤酒充二氧化碳气体并任选将其过滤和巴氏灭菌。发酵之后,可获得通常含有约2重量%至约10重量%的醇的饮料。不可发酵的碳水化合物在发酵过程中不被转化并且形成最终啤酒中所溶解的固形物的大部分。这种残余物的存留是因为麦芽淀粉酶不能够水解淀粉的α-1,6-键。不可发酵的碳水化合物贡献约50卡路里/12盎司啤酒。最近,称为轻啤酒、卡路里减少的啤酒或低卡路里啤酒的酿造饮料被广泛普及,特别是在美国市场中。如在美国所定义,这些啤酒的卡路里比生产商的“正常”啤酒低大约30%。关于常规酿造工艺的更多信息以及要应用于本发明的酿造
技术领域:
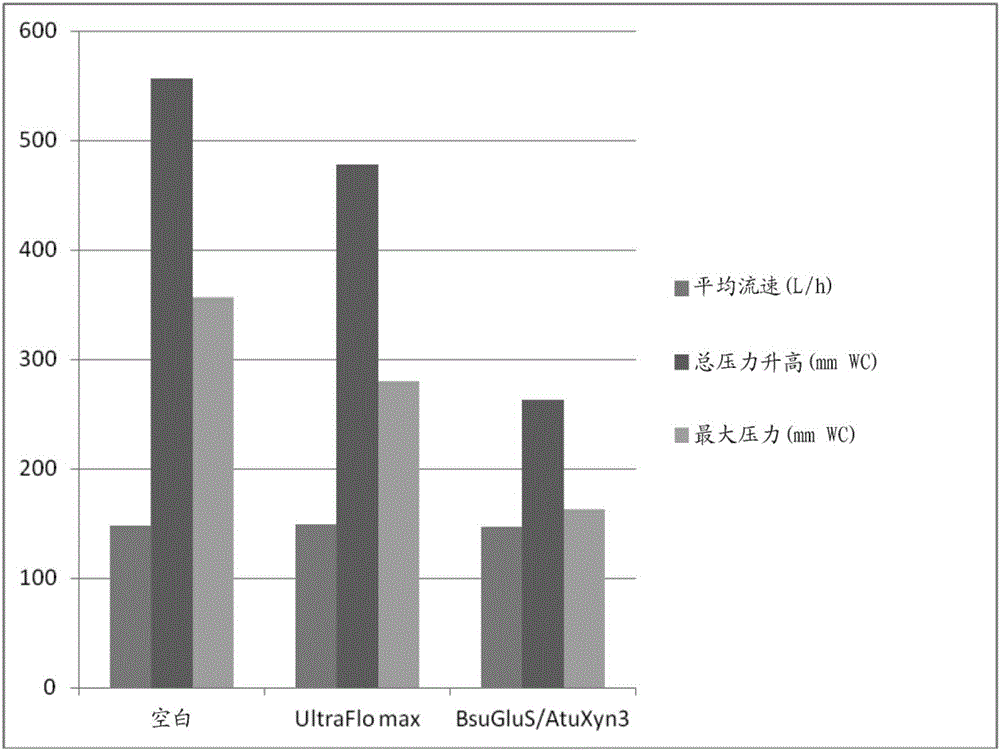
中所使用的术语的定义,可在以下文献中找到:柏林酿造学院(ResearchandTeachingInstituteofBrewing,Berlin(VLB))的WolfgangKunze所著的“TechnologyBrewingandMalting(《酿造和制麦技术》)”,第二版修订版1999,ISBN3-921690-39-0,第3版(2004):ISBN3-921690-49-8,第4版最新版2010(ISBN978-3-921690-64-2)。木聚糖酶被分类于EC3.2.1.8、EC3.2.1.32、EC3.2.1.136和EC3.2.1.156;它们的活性可例如如实施例中所描述进行测量。要与根据本发明的显示内切-1,3(4)-β-葡聚糖酶活性的酶组合使用的合适木聚糖酶包括分类于EC3.2.1.8、EC3.2.1.32、EC3.2.1.136和EC3.2.1.156的任何木聚糖酶,如WO2010072226、WO2010072225、WO2010072224、WO2005059084、WO2007056321、WO2008023060A、WO9421785、WO2006114095、WO2006066582、US2008233175和WO10059424中公开的任何一种。内切-1,4-β木聚糖酶被分类为EC3.2.1.8。该酶造成木聚糖中的1,4-β-D-木糖苷键的内切式水解(endohydrolysis)。本文所用的术语“家族11木聚糖酶”、“糖苷水解酶(GH)家族11”或者简单地“GH11木聚糖酶”指分类为EC3.2.1.8的内切-1,4-β木聚糖酶,其造成木聚糖中的1,4-β-D-木糖苷键的内切式水解,并且其根据以下文献被分类为家族11木聚糖酶:B.Henrissat,Aclassificationofglycosylhydrolasesbasedonaminoacidsequencesimilarities(基于氨基酸序列相似性对糖基水解酶进行分类),Biochem.J.(《生物化学杂志》),280(1991),第309-316页。术语“家族10木聚糖酶”、“糖苷水解酶(GH)家族10”或者简单地“GH10木聚糖酶”包括具有多种已知活性的酶,如木聚糖酶(EC:3.2.1.8);内切-1,3-β-木聚糖酶(EC:3.2.1.32);纤维二糖水解酶(EC:3.2.1.91)。这些酶以前称为纤维素酶家族F。在一些实施方案中,显示内切-1,4-β-木聚糖酶活性的酶是家族11木聚糖酶。在一些实施方案中,显示内切-1,4-β-木聚糖酶活性的酶是家族10木聚糖酶。在一个方面,根据本发明的酶组合物具有如通过实施例中描述的测定法所测量的内切-1,4-β木聚糖酶活性。测量木聚糖酶活性的测定法可用木聚糖作为底物在pH3.5或者pH5并且50℃下进行,或者它可在不同的pH和温度数值下进行以对酶进行另外的表征和说明。从木糖每单位时间造成的540nm处吸光度增加量计算酶活性。在一些实施方案中,如通过实施例中描述的测定法所测量,根据本发明的酶组合物包含至少约5000U/g、如至少约6000U/g、如至少约7000U/g、如至少约8000U/g、如至少约8500U/g的木聚糖酶活性。根据本发明的酶组合物可具有纤维素水解活性。纤维素酶的系统名称为4-(1,3;1,4)-β-D-葡聚糖,4-葡聚糖水解酶和纤维素水解酶或者纤维素酶被分类于EC3.2.1.4。纤维素酶将例如纤维素、地衣淀粉和谷物β-D-葡聚糖中的(1→4)-β-D-葡糖苷键进行内切式水解,并且还会水解还含有1,3-键的β-D-葡聚糖中的1,4-键。纤维素酶还具有其他名称,如内切-1,4-β-D-葡聚糖酶、β-1,4-葡聚糖酶、β-1,4-内切葡聚糖水解酶、纤维素酶A、cellulosinAP、内切葡聚糖酶D、碱性纤维素酶、纤维素酶A3、纤维素糊精酶、9.5纤维素酶、微晶纤维素酶、pancellaseSS和1,4-(1,3;1,4)-β-D-葡聚糖4-葡聚糖水解酶。在本发明的一个方面,根据本发明的酶组合物的纤维素酶活性通过下文中标题“测定法”下所描述的“纤维素酶活性方法”进行测量。在另外的方面,本发明涉及如通过实施例中描述的测定法所测定具有内切-1,3(4)-β-葡聚糖酶活性的酶。本文所用的“β-葡聚糖酶”或者“beta-葡聚糖酶”指EC3.2.1.6的内切-1,3(4)-β-葡聚糖酶,该酶在如下情况下催化β-D-葡聚糖的(1->3)-键或者(1->4)-键的内切式水解:当其还原性基团参与待水解的键的葡萄糖残基本身在C-3处被取代时。将要与根据本发明的显示内切-1,4-β-木聚糖酶活性的酶组合使用的合适β-葡聚糖酶包括WO2004087889、WO2005059084、WO9414953、WO2007056321、WO9531533、WO08023060、WO2005100582、WO9828410、WO9742301、WO2006066582、WO05118769、WO2005003319和WO10059424中描述的任何一种β-葡聚糖酶。标准的测定法在pH5.0下进行,或者它可在不同的pH值下进行以对酶进行另外的表征和说明。一个单位的内切-1,3(4)-β-葡聚糖酶活性定义为在该测定法的条件下(pH5.0(或者如所指定)和50℃)每分钟产生1微摩尔葡萄糖当量的酶量。在一些实施方案中,根据本发明的酶组合物具有如通过实施例中描述的测定法所测量至少约10000U/g、如至少约12000U/g、如至少约14000U/g、如至少约15000U/g、如至少约18000U/g的β-葡聚糖酶活性。在另外的方面,根据本发明的酶组合物具有昆布多糖酶活性或者包含任何一种或者多种另外的具有昆布多糖酶活性的酶。昆布多糖酶活性如“测定法”一节中描述的昆布多糖酶测定法所描述进行测定。昆布多糖酶可为分类于E.C.3.2.1.6的内切-1,3(4)-β-葡聚糖酶或者分类于E.C.3.2.1.39的葡聚糖内切-1,3-β-D-葡糖苷酶。内切-1,3(4)-β-葡聚糖酶,又名昆布多糖酶、内切-1,3-β-葡聚糖酶、内切-1,4-β-葡聚糖酶,被分类于E.C.3.2.1.6。底物包括昆布多糖、地衣淀粉和谷物D-葡聚糖,该酶在如下情况下催化β-D-葡聚糖的(1->3)-键或者(1->4)-键的内切式水解:当其还原性基团参与待水解的键的葡萄糖残基本身在C-3处被取代时。葡聚糖内切-1,3-β-D-葡糖苷酶,又名(1->3)-β-葡聚糖内切式水解酶、内切-1,3-β-葡聚糖酶和昆布多糖酶,被分类于E.C.3.2.1.39,其水解例如昆布多糖、副淀粉和茯苓聚糖的底物中的(1->3)-β-D-葡聚糖中的(1->3)-β-D-葡糖苷键。在一些方面,根据本发明的酶组合物具有阿拉伯聚糖酶活性或者包含另一具有阿拉伯聚糖酶活性的酶。阿拉伯聚糖酶被分类为EC3.2.1.99。系统名称为5-α-L-阿拉伯聚糖5-α-L-阿拉伯聚糖水解酶,但它具有几种其他名称,如阿拉伯聚糖内切-1,5-α-L-阿拉伯糖苷酶和内切-1,5-α-L-阿拉伯聚糖酶、内切-α-1,5-阿拉伯聚糖酶、内切-阿拉伯聚糖酶、1,5-α-L-阿拉伯聚糖和1,5-α-L-阿拉伯聚糖水解酶。阿拉伯糖酶将(1→5)-阿拉伯聚糖中的(1→5)-α-阿拉伯呋喃糖苷键进行内切式水解。阿拉伯聚糖酶也作用于阿拉伯聚糖。在本发明的一个方面,根据本发明的酶组合物的阿拉伯糖酶活性通过下文标题“测定法”下所描述的阿拉伯糖酶测定法进行测量。该测定法可在pH3.5和50℃下使用糖用甜菜阿拉伯聚糖作为底物进行,并且它可在不同的pH和温度数值下进行以对酶进行另外的表征和说明。从每单位时间的540nm处吸光度增加量计算酶活性。一个单位的阿拉伯糖酶活性定义为在该测定法的条件下(pH3.5和50℃)产生ΔOD540nm.min-1的增加的酶量(相对于总测定体积进行归一化)。在一些方面,根据本发明的酶组合物具有β-D-葡糖苷葡糖水解酶活性或者包含另一具有β-D-葡糖苷葡糖水解酶活性的酶。β-D-葡糖苷葡糖水解酶指E.C3.2.1.21的酶。在一些方面,根据本发明的酶组合物具有β-木糖苷酶活性或者包含另一具有β-木糖苷酶活性的酶。“β-木糖苷酶”或者“木聚糖1,4-β-木糖苷酶”指E.C3.2.1.37的酶。β-木糖苷酶催化(1->4)-β-D-木聚糖的水解,以从非还原末端依次去除D-木糖残基。在本发明的一些方面,根据本发明的酶组合物具有纤维二糖水解酶活性或者包含另一具有纤维二糖水解酶活性的酶。“纤维二糖水解酶”或者“纤维素1,4-β-纤维二糖苷酶”指EC3.2.1.91的酶。纤维素1,4-β-纤维二糖苷酶催化纤维素和纤维四糖中的1,4-β-D-葡糖苷键的水解,从糖链的非还原末端释放纤维二糖。根据本发明的酶组合物的纤维二糖酶活性通过下文标题“测定法”下所描述的纤维二糖酶测定法进行测量。标准的测定法在pH5.0下进行,并且它可在不同的pH值下进行以对酶进行另外的表征和说明。一个单位的纤维二糖水解酶活性定义为在该测定法的条件下(pH5.0(或者如所指定)和50℃)每分钟从对硝基苯基β-D-吡喃纤维二糖苷产生1微摩尔的对硝基苯酚的酶量。在一些方面,根据本发明的酶组合物具有α-N-阿拉伯呋喃糖苷酶活性或者包含另一具有阿拉伯呋喃糖苷酶活性的酶。“α-N-阿拉伯呋喃糖苷酶”或者“alpha-N-阿拉伯呋喃糖苷酶”指EC3.2.1.55的酶。α-N-阿拉伯呋喃糖苷酶催化α-L-阿拉伯糖苷中的末端非还原性α-L-阿拉伯呋喃糖苷残基的水解。在本发明的一个方面,根据本发明的酶组合物的阿拉伯呋喃糖苷酶活性通过下文标题“测定法”下所描述的阿拉伯呋喃糖苷酶测定法进行测量。该标准测定法可在pH5.0和50℃下进行,并且它可在不同的pH和温度数值下进行以对酶进行另外的表征和说明。一个单位的α-N-阿拉伯呋喃糖苷酶活性定义为在该测定法的条件下(pH5.0和50℃(或者如所指定))每分钟从对硝基苯基α-L-阿拉伯呋喃糖苷产生1微摩尔的对硝基苯酚的酶量。在一些方面,根据本发明的酶组合物具有葡聚糖1,4-β-葡糖苷酶活性或者包含另一具有葡聚糖1,4-β-葡糖苷酶活性的酶。“葡聚糖1,4-β-葡糖苷酶”或者“葡聚糖1,4-β-葡糖苷酶”指E.C3.2.1.74的酶。葡聚糖1,4-β-葡糖苷酶催化(1->4)-β-D-葡聚糖中的(1->4)-键的水解以依次去除葡萄糖单元。在一些方面,根据本发明的酶组合物具有木糖葡聚糖特异性外切-β-1,4-葡聚糖酶活性或者包含另一木葡聚糖特异性外切-β-1,4-葡聚糖酶活性的酶。“木糖葡聚糖特异性外切-β-1,4-葡聚糖酶”指E.C3.2.1.155的酶。木糖葡聚糖特异性外切-β-1,4-葡聚糖酶催化木糖葡聚糖中的(1->4)-β-D-葡糖苷键的外切式水解。根据前述各方面的酶和酶组合物可在包括降低包含淀粉水解物的水溶液的粘度的工艺中使用。所述酶和酶组合物还可在包括过滤包含淀粉水解物的水溶液的工艺中使用。在一些实施方案中,包含淀粉水解物的水溶液是用于制造啤酒的糖化醪,在其他实施方案中,包含淀粉水解物的水溶液是食品组合物。作为另一种选择,根据本发明的酶组合物可用于生产果汁、果汁酒、谷粒加工、燃料醇、第一代或者第二代生物燃料如生物乙醇以及饮用醇。在一些实施方案中,第一代或者第二代生物燃料如生物乙醇从农业原料如甘蔗、马铃薯、玉米、小麦、高粱等生产,或者从纤维质材料如玉米秸秆、柳枝稷或者其他植物材料生产。在两种情况中,从原料提取可发酵糖并由微生物发酵成醇,醇被蒸馏出来,并可用作运输燃料。根据本发明的酶组合物可用于生物燃料的这种生产。可加入酶复合物以增强从原料提取多糖,帮助将多糖降解成可发酵糖和/或增强加工参数如液体从固形物的分离、流动特性和可泵送性。本发明的方法可应用于任何谷粉(grist)的糖化醪制备。根据本发明,谷粉可包含任何含淀粉和/或糖的植物材料,所述植物材料可源自任何植物和植物部分,包括块茎、根、茎、叶和种子。在一些实施方案中,谷粉包含谷粒,如来自大麦、小麦、黑麦、燕麦、玉米、水稻、买罗高梁、稷和高粱的谷粒,并且更优选地,至少10%、或更优选至少15%、甚至更优选至少25%、或最优选至少35%、如至少50%、至少75%、至少90%或甚至100%(重量/重量)的麦芽汁的谷粉源自谷粒。在一些实施方案中,谷粉包含发芽的谷粒,如大麦麦芽。优选地,至少10%、或更优选至少15%、甚至更优选至少25%、或最优选至少35%、如至少50%、至少75%、至少90%或甚至100%(重量/重量))的麦芽汁的谷粉源自发芽的谷粒。术语“糖化醪”被理解为含水的淀粉浆料,例如包含压碎的大麦麦芽、压碎的大麦和/或其它辅料或者它们的组合,随后将其与水混合以待分离成麦芽汁+麦糟。术语“糖化醪分离”被理解为例如通过滤清(lautering)或者糖化醪过滤(filtration)将麦芽汁与麦糟分离。术语“啤酒过滤”被理解为这样的分离工艺,即仍存在于啤酒中的酵母细胞和其他引起浊度的物质例如通过微滤或膜工艺去除。酶制剂,如根据本发明制备的食品成分形式的酶制剂,可以为溶液的形式或者作为固体,这取决于用途和/或应用模式和/或施用模式。固体形式可作为干燥酶粉末或者作为颗粒化酶。在一个方面,本发明提供包含根据本发明的酶或者酶组合物、酶载体和任选的稳定剂和/或防腐剂的酶组合物制剂。在本发明的又一个方面,酶载体选自甘油或者水。在又一个方面,制剂包含稳定剂。在一个方面,稳定剂选自无机盐类、多元醇类、糖类和它们的组合。在一个方面,稳定剂是无机盐如氯化钾。在另一个方面,多元醇是甘油、丙二醇或者山梨糖醇。在又另一个方面,糖是小分子碳水化合物,具体而言是几种有甜味的小分子碳水化合物如葡萄糖、果糖和蔗糖中的任何一种。在还又一个方面,制剂包含防腐剂。在一个方面,防腐剂是对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、苯甲酸盐、山梨酸盐或者其他食品批准的防腐剂或者它们的混合物。本发明的具体实施方案。在一些实施方案中,显示内切-1,4-β-木聚糖酶活性的酶,任选地与任何一种或者多种根据本发明的β-葡聚糖酶组合,能提供酿造应用中显著降低的粘度,从而有助于改进糖化醪和啤酒分离。酿造应用的理想木聚糖酶特性包括以下方面中的一项或者多项:a)酶底物特异性οWE-AX/WU-AX比例对粘度具有影响。在一些实施方案中,这个比例小于约7.0、如小于约6.5、如小于约6.0、如小于约5.5、如小于约5.0、如小于约4.5。b)酶底物选择性ο与酶所切割的分支点有多近据认为对功能性具有影响。c)酶热稳定性ο糖化醪制备过程中AX(阿拉伯木聚糖)的连续溶解-热稳定性关键特征。因此,在一些实施例中,根据本发明的显示内切-1,4-β-木聚糖酶活性的酶在65-78℃的温度范围内是热稳定的。d)酶最适pH。因此,在一些实施例中,显示内切-1,4-β-木聚糖酶活性的酶具有在pH5.4-5.6范围内的最适pH。e)酶抑制(例如对于木聚糖酶而言为已知的关键因素)所述酿造应用中显著降低的粘度,可测量为与在相同条件和数量下使用的具有已知酶或者酶组合活性的对照(如Max)相比在酿造应用中降低的粘度。在一些实施方案中,根据本发明的显示内切-1,4-β-木聚糖酶活性的酶,任选地与任何一种或者多种根据本发明的β-葡聚糖酶组合,能在酿造应用中改进糖化醪和啤酒分离。在一些实施例中,根据本发明的显示内切-1,4-β-木聚糖酶活性的酶,任选地与根据本发明的任何一种或者多种β-葡聚糖酶组合,能使异味形成如与阿拉伯木聚糖分解相关的异味形成的潜在可能性低。在一些实施例中,根据本发明的显示内切-1,4-β-木聚糖酶活性的酶,任选与任何一种或者多种根据本发明的β-葡聚糖酶组合,能使滤床崩溃(如在滤清时)的风险降低。在一些实施例中,根据本发明的显示内切-1,4-β-木聚糖酶活性的酶,任选与任何一种或者多种根据本发明的β-葡聚糖酶组合,能使异味的潜在可能性减少和/或异味的形成减少。本发明的一个方面涉及显示内切-1,4-β-木聚糖酶活性的酶,该酶包含与选自SEQIDNO:1、SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:5、SEQIDNO:6、SEQIDNO:17和SEQIDNO:18的任一者或者它们的任何功能片段有至少80%同一性的氨基酸序列。另一个方面涉及显示内切-1,3(4)-β-葡聚糖酶活性的酶,该酶包含与选自SEQIDNO:7、SEQIDNO:8、SEQIDNO:9、SEQIDNO:10和SEQIDNO:11、SEQIDNO:12、SEQIDNO:13、SEQIDNO:14、SEQIDNO:15、SEQIDNO:16的任一者或者它们的任何功能片段有至少80%同一性的氨基酸序列。在本发明的一些实施方案中,显示内切-1,4-β-木聚糖酶活性的酶对可溶性阿拉伯木聚糖底物(WE-AX)的活性与对不溶性阿拉伯木聚糖底物(WU-AX)阿拉伯木聚糖底物的活性之比小于约7.0、如小于约6.5、如小于约6.0、如小于约5.5、如小于约5.0、如小于约4.5。在一些实施方案中,根据本发明的酶的最适温度在40-70℃的范围内,如在45-65℃的范围内,如在50-65℃的范围内,如在55-65℃的范围。在一些实施方案中,根据本发明的酶与选自SEQIDNO:1-18的任一氨基酸序列或者它们的任何功能片段具有至少81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98或者99%同一性。在一些实施方案中,根据本发明的酶的氨基酸总数小于350、如小于340、如小于330、如小于320、如小于310、如小于300个氨基酸,如在200-350个氨基酸的范围内,如在220-345个氨基酸的范围内。在一些实施方案中,根据本发明的所述酶的氨基酸序列与选自SEQIDNO:1-18的任一氨基酸序列或者它们的任何功能片段相比具有至少一个、两个、三个、四个、五个、六个、七个、八个、九个或者十个氨基酸取代。在一些实施方案中,根据本发明的所述酶的氨基酸序列与选自SEQIDNO:1-18的任一氨基酸序列或者它们的任何功能片段相比具有最多一个、两个、三个、四个、五个、六个、七个、八个、九个或者十个氨基酸取代。在一些实施方案中,根据本发明的酶包含SEQIDNO:1-18的任一者或者它们的任何功能片段所确定的氨基酸序列。在一些实施方案中,根据本发明的酶由SEQIDNO:1-18的任一者或者它们的任何功能片段所确定的氨基酸序列组成。本发明的又一个重要方面涉及包含根据本发明的显示内切-1,4-β-木聚糖酶活性的酶与任何一种或者多种β-葡聚糖酶的组合的组合物。在一些实施方案中,这一种或者多种β-葡聚糖酶是根据本发明的。本发明的又一个重要方面是包含根据本发明的显示内切-1,3(4)-β-葡聚糖酶活性的酶与任何一种或者多种木聚糖酶的组合的组合物。在一些实施方案中,这一种或者多种木聚糖酶是根据本发明的显示内切-1,4-β-木聚糖酶活性的酶。在一些实施方案中,这一种或者多种木聚糖酶是根据SEQIDNO:17和/或SEQIDNO:18或者它们的任何功能片段的酶。在一些实施方案中,显示内切-1,4-β-木聚糖酶活性的酶与显示内切-1,3(4)-β-葡聚糖酶活性的酶的组合是根据下表:应理解,任何一个上述组合中第一种酶为显示内切-1,4-β-木聚糖酶活性的酶可与一种显示内切-1,3(4)-β-葡聚糖酶活性的酶进行组合,两种酶之间的比例为1∶10、2∶10、3∶10、4∶10、5∶10、6∶10、7∶10、8∶10、9∶10、10∶10、10∶9、10∶8、10∶7、10∶6、10∶5、10∶4、10∶3、10∶2或者10∶1,如在1∶10-10∶1的范围内,如2∶10-10∶2,如3∶10-10∶3,如4∶10-10∶4,如5∶10-10∶5,如6∶10-10∶6,如7∶10-10∶7,如8∶10-10∶8,或者在9∶10-10∶9的范围内。在一些实施方案中,根据本发明的组合物包含选自以下所列的至少两种酶的组合,或者包含其氨基酸序列与相应的SEQID或者它们的任何功能片段具有至少80%序列同一性的至少两种酶的组合:SEQIDNO:1和SEQIDNO:7;SEQIDNO:2和SEQIDNO:7;SEQIDNO:3和SEQIDNO:7;SEQIDNO:4和SEQIDNO:7;SEQIDNO:5和SEQIDNO:7;SEQIDNO:6和SEQIDNO:7;SEQIDNO:17和SEQIDNO:7;SEQIDNO:18和SEQIDNO:7;SEQIDNO:1和SEQIDNO:8;SEQIDNO:2和SEQIDNO:8;SEQIDNO:3和SEQIDNO:8;SEQIDNO:4和SEQIDNO:8;SEQIDNO:5和SEQIDNO:8;SEQIDNO:6和SEQIDNO:8;SEQIDNO:17和SEQIDNO:8;SEQIDNO:18和SEQIDNO:8;SEQIDNO:1和SEQIDNO:9;SEQIDNO:2和SEQIDNO:9;SEQIDNO:3和SEQIDNO:9;SEQIDNO:4和SEQIDNO:9;SEQIDNO:5和SEQIDNO:9;SEQIDNO:6和SEQIDNO:9;SEQIDNO:17和SEQIDNO:9;SEQIDNO:18和SEQIDNO:9;SEQIDNO:1和SEQIDNO:10;SEQIDNO:2和SEQIDNO:10;SEQIDNO:3和SEQIDNO:10;SEQIDNO:4和SEQIDNO:10;SEQIDNO:5和SEQIDNO:10;SEQIDNO:6和SEQIDNO:10;SEQIDNO:17和SEQIDNO:10;SEQIDNO:18和SEQIDNO:10;SEQIDNO:1和SEQIDNO:11;SEQIDNO:2和SEQIDNO:11;SEQIDNO:3和SEQIDNO:11;SEQIDNO:4和SEQIDNO:11;SEQIDNO:5和SEQIDNO:11;SEQIDNO:6和SEQIDNO:11;SEQIDNO:17和SEQIDNO:11;SEQIDNO:18和SEQIDNO:11;SEQIDNO:1和SEQIDNO:12;SEQIDNO:2和SEQIDNO:12;SEQIDNO:3和SEQIDNO:12;SEQIDNO:4和SEQIDNO:12;SEQIDNO:5和SEQIDNO:12;SEQIDNO:6和SEQIDNO:12;SEQIDNO:17和SEQIDNO:12;SEQIDNO:18和SEQIDNO:12;SEQIDNO:1和SEQIDNO:13;SEQIDNO:2和SEQIDNO:13;SEQIDNO:3和SEQIDNO:13;SEQIDNO:4和SEQIDNO:13;SEQIDNO:5和SEQIDNO:13;SEQIDNO:6和SEQIDNO:13;SEQIDNO:17和SEQIDNO:13;SEQIDNO:18和SEQIDNO:13;SEQIDNO:1和SEQIDNO:14;SEQIDNO:2和SEQIDNO:14;SEQIDNO:3和SEQIDNO:14;SEQIDNO:4和SEQIDNO:14;SEQIDNO:5和SEQIDNO:14;SEQIDNO:6和SEQIDNO:14;SEQIDNO:17和SEQIDNO:14;SEQIDNO:18和SEQIDNO:14;SEQIDNO:1和SEQIDNO:15;SEQIDNO:2和SEQIDNO:15;SEQIDNO:3和SEQIDNO:15;SEQIDNO:4和SEQIDNO:15;SEQIDNO:5和SEQIDNO:15;SEQIDNO:6和SEQIDNO:15;SEQIDNO:17和SEQIDNO:15;SEQIDNO:18和SEQIDNO:15;SEQIDNO:1和SEQIDNO:16;SEQIDNO:2和SEQIDNO:16;SEQIDNO:3和SEQIDNO:16;SEQIDNO:4和SEQIDNO:16;SEQIDNO:5和SEQIDNO:16;SEQIDNO:6和SEQIDNO:16;SEQIDNO:17和SEQIDNO:16;和SEQIDNO:18和SEQIDNO:16。在一些实施方案中,内切-1,3(4)-β-葡聚糖酶活性和内切-1,4-β-木聚糖酶活性衍自至少两种不同的酶,如来自两种不同物种的至少两种不同的酶。在一些实施方案中,当在酿造应用中进行滤清之前使用根据本发明的组合物时,总压力升高减少至小于470mmWC、如小于450mmWC、如小于430mmWC、如小于410mmWC、如小于390mmWC、如小于370mmWC、如小于350mmWC、如小于330mmWC、如小于310mmWC、如小于300mmWC、如小于290mmWC的数值。在一些实施方案中,当在酿造应用中进行滤清之前使用所述组合物时,与使用没有所述组合物的阴性对照相比,总压力升高减少至少5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93或者95%。在一些实施方案中,当在酿造应用中进行麦芽汁分离之前使用根据本发明的组合物时,相对于没有酶的对照,麦芽汁可过滤性(通过过滤5分钟后收集的麦芽汁体积测量)提高至超过1.5、如超过1.6、如超过1.7、如超过1.8、如超过1.9、如超过2.0、如超过2.1、如超过2.2、如超过2.3、如超过2.4、如超过2.5。在一些实施方案中,与使用没有所述组合物的阴性对照相比,麦芽汁可过滤性(通过过滤5分钟后收集的麦芽汁体积测量)提高至少5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97、99、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290或者300%。在一些实施方案中,根据本发明的组合物包含任何一种或者多种另外的酶。在一些实施方案中,该一种或者多种另外的酶选自以下所列:分类于EC3.2.1.32、EC3.2.1.136或者EC3.2.1.156的木聚糖酶、纤维素酶、昆布多糖酶、内切-1,5-α-L-阿拉伯聚糖酶、β-D-葡糖苷葡糖水解酶、β-木糖苷酶、纤维二糖水解酶、葡聚糖1,4-β-葡糖苷酶、木葡聚糖特异性外切-β-1,4-葡聚糖酶和α-N-阿拉伯呋喃糖苷酶。由本文所述的序列所示并且根据本发明单独使用或者与其他酶或化合物组合使用的序列和酶,可以有或者没有信号肽。测定法DNS纤维素酶活性方法(DNSCMC方法)系统名称:1,4-(1,3;1,4)-β-D-葡聚糖4-葡聚糖水解酶IUB编号:EC3.2.1.4原理纤维素酶的测定法是基于对羧甲基纤维素(CMC)(一种β-1,4-葡聚糖)中的1,4-β-D-糖苷键的酶促内切式水解。该反应的产物(β-1,4葡聚糖寡糖)通过使用3,5-二硝基水杨酸试剂测量还原性基团的相应升高而进行比色测定。通过还原性基团的浓度(以葡萄糖当量计)与540nm处的吸光度之间的关系计算酶活性。该测定法在pH5.0下进行,但它可在不同的pH值下进行以对酶进行另外的表征和说明。单位定义一个单位的纤维素酶活性定义为在该测定法的条件下(pH5.0(或者如所指定)和50℃)下每分钟产生1微摩尔的葡萄糖当量的酶量。材料羧甲基纤维素。供应商:Megazyme有限公司。产品编号:CM-Cellulose4MD-葡萄糖‘AnalaR’。供应商:Merck有限公司(BDH)。产品编号:10117。分子量:180.16无水乙酸钠‘AnalaR’。供应商:Merck有限公司(BDH)。产品编号:10236。分子量:82.03乙酸(“冰乙酸”)‘AnalaR’。供应商:Merck有限公司(BDH)。产品编号:10001。分子量:60.053,5-二硝基水杨酸GPR(3,5-二硝基-2-羟基苯甲酸)。供应商:Merck有限公司(BDH)。产品编号:28235氢氧化钠颗粒‘AnalaR’。供应商:Merck有限公司(BDH)。产品编号:10252。分子量:40.00(+)-酒石酸钾钠‘AnalaR’。供应商:Merck有限公司(BDH)。产品编号:10219。分子量:282.221.5%(重量/体积溶液)羧甲基纤维素(CMC)于0.1M乙酸钠缓冲液中的溶液,pH5.0(底物溶液)。3,5-二硝基水杨酸(DNS)溶液。20g/L的DNS于含有32g/L氢氧化钠颗粒和600g/L(+)-酒石酸钾钠的缓冲液中。葡萄糖标准溶液(0.50mg/ml)程序将酶组合物稀释到样品中,使用0、0.125、0.25、0.375和0.5mg/ml的葡萄糖浓度制作图2所示的葡萄糖标准曲线。将0.25ml的酶溶液与1.75ml的底物溶液(1.5%重量/体积)在50℃下混合,10分钟后通过加入DNS溶液停止反应。接着加热到95℃保持5分钟。测量不同样品在540nm处的光密度(OD540nm)。计算从图2所示的标准曲线测定酶活性。活性如下计算:其中:T=ΔOD540nm测试=OD540nm测试-OD540nm空白m=标准曲线的斜率(大约1.0)c=标准曲线的y轴截距(总是负数,大约-0.02)180.16≡葡萄糖的分子量103≡换算为微摩尔A≡测定体积(ml)V≡酶体积(ml)t≡测定时间(分钟)D=实际酶稀释倍数(例如对于1.000g稀释到1升,D=1000)昆布多糖酶(DNS昆布多糖方法)原理由昆布多糖酶催化的该反应涉及1,3-β-D-葡聚糖中的1,3-糖苷键的内切式水解。底物包括昆布多糖、副淀粉和茯苓聚糖。该反应的产物(β-1,3-葡聚糖寡糖)通过使用3,5-二硝基水杨酸试剂测量还原性基团的相应升高而进行比色测定。通过还原性基团的浓度(以葡萄糖当量计)与540nm处的吸光度之间的关系计算酶活性。该测定法在pH5.0和50℃下进行,但它可在不同的pH和温度数值下进行以对酶进行另外的表征和说明。单位定义一个单位的昆布多糖酶活性定义为在该测定法的条件下(pH5.0和50℃(或者如所指定))下每分钟产生1微摩尔的葡萄糖当量的酶量。材料参见上文对纤维素酶活性测定法给出的材料。昆布多糖(来自掌状海带(Laminariadigitata))。供应商:Sigma-Aldrich有限责任公司。产品号:L96341.00%(重量/体积溶液)昆布多糖溶液(底物溶液0.1M乙酸钠缓冲液,pH5.0)将1.75ml昆布多糖溶液与0.25ml稀释的酶溶液在50℃下混合10分钟,通过加入2mlDNS溶液停止反应。使用0、0.125、0.25、0.5和0.75mg/ml葡萄糖溶液制作标准曲线。测量540nm处的光密度(OD540nm)。计算活性如下计算:其中:T=ΔOD540nm测试=OD540nm测试-OD540nm空白M=标准曲线的斜率(大约1.0)C=标准曲线的y轴截距(总是负数,大约-0.03)180.16≡葡萄糖的分子量103≡换算为微摩尔A≡测定体积(ml)V≡酶体积(ml)t≡测定时间(分钟)D=酶稀释倍数(例如对于1g稀释到1升,D=1000)阿拉伯糖酶测定。原理阿拉伯糖酶活性的测定法是基于通过用3,5-二硝基水杨酸试剂测量还原性基团的相应增加而进行比色测定。由还原性基团的浓度(以阿拉伯糖当量计)与540nm处的吸光度之间的关系计算酶活性。该测定法在pH3.5下进行,但它可在不同的pH值下进行以对酶进行另外的表征和说明。单位定义一个单位的阿拉伯糖酶(阿拉伯聚糖酶(内切-1,5-α-L-阿拉伯聚糖酶))活性定义为在该测定法的条件下(pH3.5(或者如所指定)和50℃)下每分钟产生1微摩尔的阿拉伯糖当量的酶量。材料Megazyme糖用甜菜阿拉伯聚糖阿拉伯糖SigmaA3131分子量:150.1无水乙酸钠‘AnalaR’。供应商:Merck有限公司(BDH)。产品编号:10236。分子量:82.03乙酸(“冰乙酸”)‘AnalaR’。供应商:Merck有限公司(BDH)。产品编号:10001。分子量:60.053,5-二硝基水杨酸GPR(3,5-二硝基-2-羟基苯甲酸)。供应商:Merck有限公司(BDH)。产品编号:28235氢氧化钠颗粒‘AnalaR’。供应商:Merck有限公司(BDH)。产品编号:10252。分子量:40.00(+)-酒石酸钾钠‘AnalaR’。供应商:Merck有限公司(BDH)。产品编号:10219。分子量:282.221.5%(重量/体积溶液)阿拉伯聚糖于0.1M乙酸钠缓冲液中的溶液,pH3.5(底物溶液)。3,5-二硝基水杨酸(DNS)溶液。20g/L的DNS于含有32g/L氢氧化钠颗粒和600g/L(+)-酒石酸钾钠的缓冲液中。阿拉伯糖标准溶液(0.50mg/ml)程序将酶组合物稀释到样品中,使用0、0.125、0.25、0.375和0.5mg/ml的阿拉伯糖浓度制作阿拉伯糖标准曲线。将0.25ml的酶溶液与1.75ml的底物溶液(1.5%重量/体积)在50℃下混合,10分钟后通过加入DNS溶液停止反应。接着加热到95℃保持5分钟。测量不同样品在540nm处的光密度(OD540nm)。计算从标准曲线测定酶活性。活性如下计算:其中:T=ΔOD540nm测试=OD540nm测试-OD540nm空白m=标准曲线的斜率(大约1.0)c=标准曲线的y轴截距(总是负数,大约-0.02)150.13≡阿拉伯糖的分子量103≡换算为微摩尔A≡测定体积(ml)V≡酶体积(ml)t≡测定时间(分钟)D=实际酶稀释倍数(例如对于1.000g稀释到1升,D=1000)阿拉伯呋喃糖苷酶测定法。由α-N-阿拉伯呋喃糖苷酶催化的反应涉及α-L-阿拉伯糖苷的非还原性α-L-阿拉伯呋喃糖苷残基处的末端键的水解。该酶作用于α-L-阿拉伯呋喃糖苷、含有(1,3)-键和/或(1,5)-键的α-L-阿拉伯聚糖、阿拉伯木聚糖和阿拉伯半乳聚糖。α-N-阿拉伯呋喃糖苷酶的测定法是基于对硝基苯基α-L-阿拉伯呋喃糖苷的酶促水解。该测定法是“两点”法,而非“连续监测”法。酶活性的计算是基于仅在温育期间开始和结束时获取的测量值。反应产物对硝基苯酚通过比色法测定(在调整pH后)。由对硝基苯酚的浓度与400nm处的吸光度之间的关系计算酶活性。稀释的酶溶液的制备:用玻璃蒸馏水从粉末或者液体酶制剂制备全部的酶溶液。通过避免涉及小体积或者重量的大稀释步骤使测定法稀释误差减至最低。在制备酶稀释液时,更准确的是称出初始酶样品,即使是对于液体样品也是如此。如果这样做,在液体样品的情况下,因此有必要测量该液体在20℃下的比重。由于该测定法是“两点”法而不是“连续监测”法,重要的是确保不同酶系统和条件的温育期间内的线性。在底物浓度、pH、温度和测定时间的标准测定条件下,已证明该测定法在ΔOD540nm测试(T)=0.20-1.50的范围内是线性的。但是,为了良好地实施,该测定法在ΔOD540nm测试(T)=0.400-0.800的限定范围内操作。程序每个酶样品测定涉及三个分析:重复测试(“测试”)分析和空白(“空白”)分析。所给出的程序描述单个酶样品的分析。向50℃下的各溶液加入0.25ml稀释的酶溶液,10分钟后通过加入4ml的0.4M甘氨酸溶液pH10.8(终止试剂)终止反应。在25℃下于400nm处以水为空白测量吸光度。·测定所测量的重复测试的OD400nm测试;·测定OD400nm空白。计算ΔOD400nm测试(T)=OD400nm测试-0D400nm空白其中:T=OD400nm测试-OD400nm空白18300=对硝基苯酚的摩尔消光系数(1cm光程长度)V=7.25(测试中的总液体体积(ml))t=10(分钟)1u=1μmol.min-1E=0.25(稀释的酶样品的体积(ml))D=酶稀释倍数(例如对于1ml稀释到1升,D=1000)纤维二糖水解酶测定法。原理由纤维二糖水解酶催化的反应涉及纤维素和纤维四糖中的1,4-β-D-葡糖苷键的水解,从糖链的非还原性末端释放纤维二糖。纤维二糖水解酶的测定法是基于对硝基苯基β-D-吡喃纤维二糖苷的酶促水解。反应产物对硝基苯酚通过比色法测定(在调整pH后)。由对硝基苯酚的浓度与400nm处的吸光度之间的关系计算酶活性。该测定法在ΔOD540nm测试(T)=0.400-0.800的线性限定范围内操作。程序每个酶样品测定涉及三个分析:重复测试(测试)分析和空白(空白)分析。所给出的程序描述单个酶样品的分析。向50℃下的测试溶液加入0.25ml稀释的酶溶液,30分钟后向每个管加入4ml的0.4M甘氨酸溶液pH10.8(终止试剂)。在1cm玻璃比色管中,以水为空白,在20℃下于400nm处测量吸光度。·测定所测量的重复测试的OD400nm测试;·测定OD400nm空白。计算ΔOD400nm测试(T)=OD400nm测试-OD400nm空白其中:T=OD400nm测试-OD400nm空白18300=对硝基苯酚的摩尔消光系数(1cm光程长度)V=7.25(测试中的总液体体积(ml))1000=换算为升106=换算为微摩尔t=30(分钟)1u=1μmol.min-1E=0.25(稀释的酶样品的体积(ml))D=酶稀释倍数(例如对于1ml稀释到1升,D=1000)编号的根据本发明的实施方案:1.一种显示内切-1,4-β-木聚糖酶活性的酶,该酶包含与选自SEQIDNO:1、SEQIDNO:2、SEQIDNO:3、SEQIDNO:4、SEQIDNO:5、SEQIDNO:6、SEQIDNO:17和SEQIDNO:18的任一者或者它们的任何功能片段具有至少80%同一性的氨基酸序列。2.根据实施方案1所述的酶,该酶对可溶性阿拉伯木聚糖底物(WE-AX)的活性与对不溶性阿拉伯木聚糖底物(WU-AX)阿拉伯木聚糖底物的活性之比小于约7.0、如小于约6.5、如小于约6.0、如小于约5.5、如小于约5.0、如小于约4.5。3.一种显示内切-1,3(4)-β-葡聚糖酶活性的酶,该酶包含与选自SEQIDNO:7、SEQIDNO:8、SEQIDNO:9、SEQIDNO:10和SEQIDNO:11、SEQIDNO:12、SEQIDNO:13、SEQIDNO:14、SEQIDNO:15、SEQIDNO:16的任一者或者它们的任何功能片段具有至少80%同一性的氨基酸序列。4.根据实施方案1-3中任一项所述的酶,该酶的最适温度在40-70℃的范围内,如在45-65℃的范围内,如在50-65℃的范围内,如在55-65℃的范围内。5.根据实施方案1-4中任一项所述的酶,其中所述酶与选自SEQIDNO:1-18的任一氨基酸序列或者它们的任何功能片段具有至少81、82、83、84、85、86、87、88、89、90、91、92、93、94、95、96、97、98或者99%同一性。6.根据实施方案1-5中任一项所述的酶,其总氨基酸数目小于350、如小于340、如小于330、如小于320、如小于310、如小于300个氨基酸、如在200-350个氨基酸的范围内、如在220-345个氨基酸的范围内。7.根据实施方案1-6中任一项所述的酶,所述酶的氨基酸序列与选自SEQIDNO:1-18的任一氨基酸序列或者它们的任何功能片段相比具有至少一个、两个、三个、四个、五个、六个、七个、八个、九个或者十个氨基酸取代。8.根据实施方案1-7中任一项所述的酶,所述酶的氨基酸序列与选自SEQIDNO:1-18的任一氨基酸序列或者它们的任何功能片段相比具有最多一个、两个、三个、四个、五个、六个、七个、八个、九个或者十个氨基酸取代。9.根据实施方案1-8中任一项所述的酶,该酶包含SEQIDNO:1-18的任一者或者它们的任何功能片段所确定的氨基酸序列。10.根据实施方案1或者3中任一项所述的酶,该酶由SEQIDNO:1-18的任一者或者它们的任何功能片段所确定的氨基酸序列组成。11.一种DNA构建体,其包含编码根据实施方案1-10中任一项所述的酶的DNA序列。12.一种表达载体,其包含根据实施方案11所述的DNA构建体。13.一种细胞,其已用实施方案11的DNA构建体或者实施方案12的载体转化。14.一种制剂,其包含根据实施方案1-10中任一项所述的酶、或者根据实施方案11所述的DNA构建体、或者根据实施方案12所述的载体、或者根据实施方案13所述的细胞。15.一种组合物,其包含根据实施方案1、2、4-10中任一项所述的显示内切-1,4-β-木聚糖酶活性的酶与任何一种或者多种β-葡聚糖酶的组合。16.根据实施方案15所述的组合物,其中所述一种或者多种β-葡聚糖酶是根据实施方案3-10中任一项所述的显示内切-1,3(4)-β-葡聚糖酶活性的酶。17.一种组合物,其包含根据实施方案3-10中任一项所述的显示内切-1,3(4)-β-葡聚糖酶活性的酶与任何一种或者多种木聚糖酶的组合。18.根据权利要求17所述的组合物,其中所述一种或者多种木聚糖酶是根据实施方案1、2、4-10中任一项所述的显示内切-1,4-β-木聚糖酶活性的酶。19.根据实施方案15-18中任一项所述的组合物,其中所述内切-1,3(4)-β-葡聚糖酶活性和所述内切-1,4-β-木聚糖酶活性衍自至少两种不同的酶,如来自两种不同物种的至少两种不同的酶。20.根据实施方案15-19中任一项所述的组合物,所述组合物包含选自以下所列的至少两种酶的组合,或者包含其氨基酸序列与相应的SEQID或者它们的任何功能片段具有至少80%序列同一性的至少两种酶的组合:SEQIDNO:1和SEQIDNO:7;SEQIDNO:2和SEQIDNO:7;SEQIDNO:3和SEQIDNO:7;SEQIDNO:4和SEQIDNO:7;SEQIDNO:5和SEQIDNO:7;SEQIDNO:6和SEQIDNO:7;SEQIDNO:17和SEQIDNO:7;SEQIDNO:18和SEQIDNO:7;SEQIDNO:1和SEQIDNO:8;SEQIDNO:2和SEQIDNO:8;SEQIDNO:3和SEQIDNO:8;SEQIDNO:4和SEQIDNO:8;SEQIDNO:5和SEQIDNO:8;SEQIDNO:6和SEQIDNO:8;SEQIDNO:17和SEQIDNO:8;SEQIDNO:18和SEQIDNO:8;SEQIDNO:1和SEQIDNO:9;SEQIDNO:2和SEQIDNO:9;SEQIDNO:3和SEQIDNO:9;SEQIDNO:4和SEQIDNO:9;SEQIDNO:5和SEQIDNO:9;SEQIDNO:6和SEQIDNO:9;SEQIDNO:17和SEQIDNO:9;SEQIDNO:18和SEQIDNO:9;SEQIDNO:1和SEQIDNO:10;SEQIDNO:2和SEQIDNO:10;SEQIDNO:3和SEQIDNO:10;SEQIDNO:4和SEQIDNO:10;SEQIDNO:5和SEQIDNO:10;SEQIDNO:6和SEQIDNO:10;SEQIDNO:17和SEQIDNO:10;SEQIDNO:18和SEQIDNO:10;SEQIDNO:1和SEQIDNO:11;SEQIDNO:2和SEQIDNO:11;SEQIDNO:3和SEQIDNO:11;SEQIDNO:4和SEQIDNO:11;SEQIDNO:5和SEQIDNO:11;SEQIDNO:6和SEQIDNO:11;SEQIDNO:17和SEQIDNO:11;SEQIDNO:18和SEQIDNO:11;SEQIDNO:1和SEQIDNO:12;SEQIDNO:2和SEQIDNO:12;SEQIDNO:3和SEQIDNO:12;SEQIDNO:4和SEQIDNO:12;SEQIDNO:5和SEQIDNO:12;SEQIDNO:6和SEQIDNO:12;SEQIDNO:17和SEQIDNO:12;SEQIDNO:18和SEQIDNO:12;SEQIDNO:1和SEQIDNO:13;SEQIDNO:2和SEQIDNO:13;SEQIDNO:3和SEQIDNO:13;SEQIDNO:4和SEQIDNO:13;SEQIDNO:5和SEQIDNO:13;SEQIDNO:6和SEQIDNO:13;SEQIDNO:17和SEQIDNO:13;SEQIDNO:18和SEQIDNO:13;SEQIDNO:1和SEQIDNO:14;SEQIDNO:2和SEQIDNO:14;SEQIDNO:3和SEQIDNO:14;SEQIDNO:4和SEQIDNO:14;SEQIDNO:5和SEQIDNO:14;SEQIDNO:6和SEQIDNO:14;SEQIDNO:17和SEQIDNO:14;SEQIDNO:18和SEQIDNO:14;SEQIDNO:1和SEQIDNO:15;SEQIDNO:2和SEQIDNO:15;SEQIDNO:3和SEQIDNO:15;SEQIDNO:4和SEQIDNO:15;SEQIDNO:5和SEQIDNO:15;SEQIDNO:6和SEQIDNO:15;SEQIDNO:17和SEQIDNO:15;SEQIDNO:18和SEQIDNO:15;SEQIDNO:1和SEQIDNO:16;SEQIDNO:2和SEQIDNO:16;SEQIDNO:3和SEQIDNO:16;SEQIDNO:4和SEQIDNO:16;SEQIDNO:5和SEQIDNO:16;SEQIDNO:6和SEQIDNO:16;SEQIDNO:17和SEQIDNO:16;和SEQIDNO:18和SEQIDNO:16。21.根据实施方案15-20中任一项所述的组合物,其中当在酿造应用中进行滤清之前使用所述组合物时,总压力升高减少至小于470mmWC、如小于450mmWC、如小于430mmWC、如小于410mmWC、如小于390mmWC、如小于370mmWC、如小于350mmWC、如小于330mmWC、如小于310mmWC、如小于300mmWC、如小于290mmWC的数值。22.根据实施方案15-21中任一项所述的组合物,其中当在酿造应用中进行滤清之前使用所述组合物时,与使用没有所述组合物的阴性对照相比,总压力升高减少至少5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93或者95%。23.根据实施方案15-22中任一项所述的组合物,其中当在酿造应用中进行麦芽汁分离之前使用所述组合物时,相对于没有酶的对照,通过过滤5分钟后收集的麦芽汁体积所测量的麦芽汁可过滤性提高至超过1.5、如超过1.6、如超过1.7、如超过1.8、如超过1.9、如超过2.0、如超过2.1、如超过2.2、如超过2.3、如超过2.4、如超过2.5。24.根据实施方案15-23中任一项所述的组合物,其中当在酿造应用中进行麦芽汁分离之前使用所述组合物时,与使用没有所述组合物的阴性对照相比,通过过滤5分钟后收集的麦芽汁体积所测量的麦芽汁可过滤性提高至少5、7、9、11、13、15、17、19、21、23、25、27、29、31、33、35、37、39、41、43、45、47、49、51、53、55、57、59、61、63、65、67、69、71、73、75、77、79、81、83、85、87、89、91、93、95、97、99、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290或者300%。25.根据实施方案15-24中任一项所述的组合物,其包含任何一种或者多种另外的酶。26.根据实施方案25所述的组合物,其中所述一种或者多种另外的酶选自以下所列:分类于EC3.2.1.32、EC3.2.1.136或者EC3.2.1.156的木聚糖酶、纤维素酶、昆布多糖酶、内切-1,5-α-L-阿拉伯聚糖酶、β-D-葡糖苷葡糖水解酶、β-木糖苷酶、纤维二糖水解酶、葡聚糖1,4-β-葡糖苷酶、木葡聚糖特异性外切-β-1,4-葡聚糖酶和α-N-阿拉伯呋喃糖苷酶。27.根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物在生产食品、饲料或者麦芽饮料产品中的用途。28.根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物在生产面团或者培烤产品中的用途。29.根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物在制备纸浆或者纸张中的用途。30.根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物用于制备谷物成分的用途。31.根据实施方案29所述的用途,其中实施谷物是黑麦、小麦或者大麦。32.根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物在生产啤酒或者对酿造工艺副产物进行改性中的用途。33.根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物在生产果汁酒或者果汁中的用途。34.根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物在生产第一代或者第二代生物燃料如生物乙醇中的用途。35.一种改变含淀粉材料的可过滤性的方法,所述方法包括用根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物处理所述含淀粉材料的步骤。36.一种在酿造应用中减少滤清过程中压力升高的方法,所述方法包括用根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物处理酿造用糖化醪的步骤。37.一种用于生产食品、饲料或者饮料产品如酒精饮料或者非酒精饮料例如基于谷物或者麦芽的饮料如啤酒或者威士忌的方法,所述方法包括用根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物处理含淀粉材料的步骤。38.一种用于生产酿造用糖化醪的方法,所述方法包括用根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物处理含淀粉材料的步骤。39.一种用于生产第一代或者第二代生物燃料如生物乙醇的方法,所述方法包括用根据实施方案1-10所述的酶、或者根据实施方案14所述的制剂、或者根据实施方案15-26中任一项所述的组合物处理含淀粉材料的步骤。40.通过根据实施方案38-39中任一项所述的方法获得的产品。41.一种组合物,其包含根据实施方案40所述的产品,如其中该产品在0.1%-99.9%的范围内。实施例实施例1与申请用于(filingfor)酿造应用的木聚糖酶/葡聚糖酶相关的方法和结果。以下方法已用于筛选在酿造中应用的木聚糖酶和葡聚糖酶。方法:水可提取的阿拉伯木聚糖(WE-AX)木聚糖酶方法:在蒸馏水中制备样品(以在本测定中获得大约OD540=0.25-0.30)和木糖标准物(0、0.125、0.250、0.375和0.500mg/ml蒸馏水)。在时间t=0分钟,将1.75ml可溶性小麦阿拉伯木聚糖(0.5%小麦阿拉伯木聚糖(PWAXYH,Megazyme,爱尔兰布瑞(Bray,Ireland))于0.1M乙酸钠/乙酸中,pH5)置于50℃下的试管中。在t=5分钟,将250μl酶溶液加到50℃下的该底物,然后混合。用蒸馏水作为空白。在时间t=15分钟,将2mlDNS溶液(1%3,5-二硝基水杨酸(DNS)、1.6%氢氧化钠、30%酒石酸钾钠于蒸馏水中)加到酶-底物溶液和2.0ml标准溶液。将加入了DNS的样品、空白和标准物置于沸水浴(95℃)中5分钟。然后,将样品、空白和标准品置于25℃水浴中20分钟进行冷却。使用分光光度计读取所有样品的光密度OD540。根据样品稀释度、所用(takingintowork)样品量和标准品,可计算出样品的木聚糖酶活性。一个单位的内切-1,4-β-木聚糖酶WE-AX活性定义为在上述条件下(水可提取的阿拉伯木聚糖(WE-AX)木聚糖酶方法)每分钟产生1微摩尔的木糖当量的酶量。水不可提取的阿拉伯木聚糖(WU-AX)木聚糖酶方法:在蒸馏水中制备样品。在时间t=0分钟,将1.75ml不溶性小麦阿拉伯木聚糖(0.5%小麦阿拉伯木聚糖(PWAXYI,Megazyme,爱尔兰布瑞(Bray,Ireland))于0.1M乙酸钠/乙酸中,pH5)置于50℃下的试管中。在t=5分钟,将250μl酶溶液加到50℃下的该底物,然后混合。用蒸馏水作为空白。在时间t=15分钟,将样品和空白置于沸水浴(95℃)中5分钟。然后将样品和空白离心以使残余的不溶性底物沉淀下来。使用Rouau,X.和Surget,A.(1994),CarbohydratePolymers(《碳水化合物聚合物》),24,123-132描述的方法,测定进入溶液中的阿拉伯聚糖的量。WU-AX内切-1,4-β-木聚糖酶活性定义为在上述条件下溶解的戊糖的量(μg戊糖),单位定义为μg戊糖/g木聚糖酶样品。木聚糖酶活性测定法在蒸馏水中制备样品(以在本测定中获得大约OD540=0.25-0.30)和木糖标准物(0、0.125、0.250、0.375和0.500mg/ml蒸馏水)。在时间t=0分钟,将1.75ml可溶性小麦阿拉伯木聚糖(0.5%小麦阿拉伯木聚糖(PWAXYH,Megazyme,爱尔兰布瑞(Bray,Ireland))于0.1M乙酸钠/乙酸中,pH5)置于50℃下的试管中。在t=5分钟,将250μl酶溶液加到50℃下的该底物,然后混合。用蒸馏水作为空白。在时间t=15分钟,将2mlDNS溶液(1%3,5-二硝基水杨酸(DNS)、1.6%氢氧化钠、30%酒石酸钾钠于蒸馏水中)加到酶-底物溶液和2.0ml标准溶液。将加入了DNS的样品、空白和标准物置于沸水浴(95℃)中5分钟。然后,将样品、空白和标准品置于25℃水浴中20分钟进行冷却。使用分光光度计读取所有样品的光密度OD540。根据样品稀释度、所用(takingintowork)样品量和标准品,可计算出样品的木聚糖酶活性。一个单位的内切-1,4-β-木聚糖酶WE-AX活性定义为在上述条件下每分钟产生1微摩尔木糖当量的酶量。葡聚糖酶活性测定法在蒸馏水中制备样品(以在本测定中获得标准曲线内的OD540)和葡萄糖标准物(0、0.125、0.250、0.500和0.750mg/ml蒸馏水)。在时间t=0分钟,将1.75ml大麦β-葡聚糖(1.5%大麦β-葡聚糖(P-BGBM,Megazyme,爱尔兰布瑞(Bray,Ireland))于1M乙酸钠/乙酸中,pH5)置于50℃下的试管中。在t=5分钟,将250μl酶溶液加到50℃下的该底物,然后混合。用蒸馏水作为空白。在时间t=15分钟,将2mlDNS溶液(1%3,5-二硝基水杨酸(DNS)、1.6%氢氧化钠、30%酒石酸钾钠于蒸馏水中)加到酶-底物溶液和2.0ml标准溶液。将加入了DNS的样品、空白和标准物置于沸水浴(95℃)中15分钟。然后,将样品、空白和标准品置于25℃水浴中20分钟进行冷却。使用分光光度计读取所有样品的光密度OD540。根据样品稀释度,所用(takingintowork)样品量和标准品,可计算出样品的葡聚糖酶活性。一个单位的内切-1,3(4)-β-葡聚糖酶活性定义为在该测定法的条件下(pH5.0(或者如所指定)和50℃)每分钟产生1微摩尔葡萄糖当量的酶量。实验室规模的酿造应用方法:使用75∶25的比尔森(Pilsner)麦芽-大麦比和3∶1的水-谷粉比(150ml∶50g谷粉)进行实验室规模的酿造应用研究。首先,在混料(mashingin)和pH调节(5.4,2MH2SO4)之前,将水预热到53℃。在重到初始温度(10分钟时间)后,开始糖化醪制备进程(参见图1)并加入酶。在煮浆(mashingoff)后,使用常规的塑料漏斗和滤纸(1号滤纸,直径24cm,英国沃特曼(Whatman,England))进行麦芽汁分离。评估过滤性能以及几种其他的麦芽汁参数,比如,即,粘度、β-葡聚糖和戊聚糖。对麦芽汁过滤进行测量30分钟,然后结束过滤。在进行任何进一步的分析之前,将收集的麦芽汁冷却。过滤过滤数据以5、10、15和30分钟后相对于空白(酿造时不加入外源酶)而言收集到的麦芽汁体积表示。中试规模酿造在中试规模酿造设施(2HL容量)中进行试验。通过滤清进行麦芽汁分离,并通过水平式硅藻土过滤进行啤酒过滤。为阐释在“挑战性的”酿造条件下葡聚糖酶和木聚糖酶的组合对过滤的优化作用,使用包含75%麦芽和25%大麦的混合谷粉进行中试规模酿造试验。首先,将水:谷粉比设定为2.8∶1(糖化醪制备开始),在滤清开始时增加到3.1∶1。相比之下,在工业规模酿造厂滤清中,水∶谷粉比通常在3.2-3.8左右。因此,目前中试试验设定为3.1∶1水∶谷粉比据认为偏于具有挑战性。使用两辊磨机干法研磨麦芽和大麦。大麦和麦芽都用大约0.7mm的辊距研磨两次。以53℃的初始糖化醪温度进行混料。在混料后,进行如下的小调整:调整糖化醪体积使水∶谷粉比为2.8∶1,并将pH调整至大约5.56(乳酸)。在微调了糖化醪后,加入酶,然后执行图1所示的糖化醪制备进程。在70℃下的糖化休止按程序为15分钟,但是将休止时间延长5分钟,直到碘试验表明无淀粉存在。(LudwigNarziss和WernerBack,慕尼黑工业大学(酿造系,维森啤酒厂(Weihenstephan)),《啤酒酿造厂概述》(AbrissderBierbrauerei),WILEY-VCHVerlagsGmbH出版公司,德国韦因海姆(Weinheim),2005)。休止5分钟后开始进行78℃下的煮浆。将糖化醪转移到过滤槽,该槽事先预装入水至正好在“假底”以下的高度。让糖化醪静置5分钟使滤饼沉淀。接着进行15分钟的循环(140L/h),以确保滤饼沉淀和麦芽汁澄清。通常在工业规模的酿造中,过滤将在达到给定的麦芽汁浊度时开始,但是在本试验中将循环保持恒定为15分钟,以便能够对各个试验进行比较。在滤清过程中收集以下数据,包括时间(min)、收集的麦芽汁体积(L)、滤饼的过滤压差(mmWC,mm水柱)、泵流量(%)、麦芽汁浊度(EBC)和糖化醪温度(℃)。过滤过程中滤饼的压力升高据认为是一个有助于设定麦芽汁滤清性能的标准的因素。达到非常高的压差-在初麦芽汁收集过程中例如为250mmWC并且在其余的滤清过程中例如为450mmWC-则引起滤饼破坏(racking)(也称深切(deepcut))。滤饼破坏是这样一个过程,即滤饼崩溃,或者通过用特别设计的刀慢切滤饼解除过滤通道的形成。在滤饼破坏后,引入6分钟的麦芽汁循环(流速:120l/h),使得滤饼准备好继续进行过滤。滤饼破坏使得本来会受削弱的过滤性能得到解除,若过滤性能受削弱也会导致麦芽汁质量差。如果到第3次淋洗开始为止还未引入压力所导致的破坏,则在第3次和第4次淋洗开始时进行自动破坏,以确保正好在完成麦芽汁分离之前不会出现完全的过滤阻塞。用表1中所示的设置进行滤清。表1:滤清设置。收集的体积(L)、过滤流速(L/h)和淋洗体积(L)。麦芽汁收集的体积,L过滤流速,L/h淋洗体积,L初麦芽汁0-60130第1次淋洗60-7814018第2次淋洗78-9616018第3次淋洗96-11418018第4次淋洗114-14018026滤清结束后,将甜麦芽汁返回糖化醪槽,加热至沸,加入啤酒花。连续加啤酒花80分钟,结束加啤酒花时将pH调整至5.10±0.05。采用漩涡将啤酒花从苦麦芽汁中清除,接着将麦芽汁冷却到大约8℃。为进行发酵,选择来自Fermentis公司的底部发酵干酵母(酿酒酵母(Saccharomycescerevisiae))W34/70。将酵母复水30分钟,以100g/HL进行接种。主发酵在10℃下保持5-6天,然后在15℃成熟,直到消糖且双乙酰在80ppb以下。将啤酒在1℃和0.7巴下另外保藏2-3个星期后再过滤。使用1.2μmPP烛形板和硅藻土将啤酒进行水平式过滤。在过滤单元中最多可放8块板,得到大约0.5m2的总过滤面积。在本研究中放3块板,在130L/h的流速下进行过滤,得到6.9HL/(h·m2)的过滤速度。在工业规模的酿造厂中,过滤速度通常设定在5-7HL/(h·m2)之间。由此可见,目前的设定处于高端-这是有意选择的,旨在挑战啤酒过滤条件,以验证在酿造工艺中选择使用酶所带来的潜在好处。在啤酒过滤过程中,监测流速(L/h)以及压力值(进口压力和出口压力)以验证啤酒过滤性能。还进行了多个啤酒分析,如原浓度(OG)、表观浸出物(AE)、酒精体积(ABV)、表观发酵度(ADF)、实际发酵度(RDF)、pH、色度和苦味,以评估啤酒质量。结果:木聚糖酶:针对木聚糖酶对可溶性底物和不溶性底物的活性、木聚糖酶的pH和温度特性筛选木聚糖酶。结果在表2中显示。表2.所筛选的木聚糖酶,它们对可溶性(WE-AX)和不溶性(WU-AX)阿拉伯木聚糖底物的活性以及它们在温度和pH方面的生化特性。WE-AX和WU-AX酶活性(U)如“水可提取的阿拉伯木聚糖(WE-AX)木聚糖酶方法”和“水不可提取的阿拉伯木聚糖(WU-AX)木聚糖酶方法”章节中所描述进行测量。根据生化筛选的结果,选择出对可溶性阿拉伯木聚糖的活性与对不溶性阿拉伯木聚糖的活性之比适当的木聚糖酶,以供在应用试验中进行进一步的测试。结果在表3中显示。表3:所筛选的木聚糖酶以及使用木聚糖酶对比空白(无木聚糖酶)所获得的相对浸出物收率。最后,以木聚糖酶对不溶性阿拉伯木聚糖的活性与对可溶性阿拉伯木聚糖的活性之比(WU-AX/WE-AX)表示木聚糖酶底物特异性。按前面的描述(“过滤”)测量过滤性能,并以在不同时间点相对于阴性对照(空白)的滤液体积表示。WE-AX和WU-AX酶活性(U)如“水可提取的阿拉伯木聚糖(WE-AX)木聚糖酶方法”和“水不可提取的阿拉伯木聚糖(WU-AX)木聚糖酶方法”章节中所描述进行测量。葡聚糖酶:针对葡聚糖酶的活性和温度特性筛选葡聚糖酶,结果在表4中显示。表4:所筛选的葡聚糖酶,它们的活性和在温度方面的生化特性n.d.=未测定葡聚糖酶活性/单位如上文描述的葡聚糖酶活性测定法中所描述进行测定。根据生化筛选的结果,选择具有合适的特性的葡聚糖酶以供在应用试验中进行进一步的测试。结果在表5中显示。表5:所筛选的葡聚糖酶的名称和来源以及使用葡聚糖酶对比空白(无酶)所获得的相对浸出物收率。按前面的描述(“过滤”)测量过滤性能,并以在不同时间点相对于阴性对照(空白)的滤液体积表示。根据对木聚糖酶和葡聚糖酶的单独筛选,进行组合实验,结果在表6中显示。表6:木聚糖酶和葡聚糖酶对比空白和对比Max的组合实验所得到的酿造应用结果。250真菌木聚糖酶单位FXU-S/g、700纤维素酶单位EGU/g(丹麦Novozymes公司)结果以所获得的相对浸出物收率表示。(Max的来源可包括棘孢曲霉(A.aculeatus)以外的其他微生物,如WO05059084中所描述)按前面的描述(“过滤”)测量过滤性能,并以在不同时间点相对于阴性对照(空白)的滤液体积表示。在2HL中试规模的设施中对合适的组合进行进一步的测试以作验证,结果在表7和图3中显示。表7:葡聚糖酶和木聚糖酶筛选的验证所得到的中试规模酿造应用结果。对比空白和Max测试了枯草芽孢杆菌(B.sub)葡聚糖酶S与塔宾曲霉(A.tub)木聚糖酶的组合。所收集的数据为平均流速(L/h)、滤清期间的总压力升高(mmWC)和滤清过程中记录的最大压力(mmWC)。实施例2在本实施例中,试图证实用于酿造应用的木聚糖酶可对高分子量可溶性阿拉伯木聚糖(HMWS-AX)和水可提取的阿拉伯木聚糖(WE-AX)具有非常高的选择性。据认为由此仅有限数量的阿拉伯木聚糖需要被溶解。因此,相关的异味潜在可能性大大减少。显著降低的粘度有利于糖化醪和啤酒分离。对于酿造应用而言理想的木聚糖酶特性可包括下表8的各方面中的一个或者多个方面:如图3中所示,谷物中的水不溶性阿拉伯木聚糖(WU-AX)与酿造厂中的滤饼稳定性有关联。谷物中的阿魏酸(FA)浓度非常取决于组织。在果皮材料中发现最高的浓度,而在胚乳中的浓度低得多。报道了不同的浓度。2700μg/g不溶性纤维、185μg/g可溶性纤维的浓度是可能的(Bunzel等人,2001,JournalofSc.offoodandagriculture(《食品与农业杂志》),第81卷,第653-60页)。直观地说,它意味着在不溶性纤维(WU-AX)中的阿拉伯木聚糖中每200个木糖分子仅发现一个FA,而在可溶性纤维(WE-AX)中则是每2500个木糖仅发现一个FA。已知的事实是,木聚糖酶可在啤酒中导致异味形成,如游离阿魏酸和4-VG。方法:根据表8+9中提到的标准,发现了15种得自杜邦工业生物科学公司(DuPontIndustrialBiosciences)的木聚糖酶是潜在候选物。这些木聚糖酶是在实验室糖化醪制备应用中采用最多30%大麦与麦芽组合而筛选的。监测了糖化醪分离速度、戊聚糖/阿拉伯木聚糖水平和麦芽汁粘度等。在几项中试酿造厂研究中测试了最佳的几个候选物,以检验我们的假设并将木聚糖酶特性与在酿造中的功能性建立关联。将选定的木聚糖酶候选物与β-葡聚糖酶相组合,测试选定的木聚糖酶的最佳剂量。结果与讨论:中试厂酿造中酶剂量为唯一变量。施加WU-AX选择性木聚糖酶(X1)导致滤床崩溃。WE-AX选择性木聚糖酶候选物(参比物、X2、X3)导致低的压力升高。参比物为木聚糖酶+β-葡聚糖酶的共混物。表11:麦芽汁分析-中试厂研究样品编号参比物X+BXh+B浸出物(°Plato)15.7016.0015.95麦芽汁中β葡聚糖(mg/1)443525在12°Plato下的动态粘度(mPa.s)1.651.681.68总戊聚糖(mg/l)354029703010表12:陈化啤酒的斯特雷克(Strecker)醛分析以中等剂量(X)和高剂量(Xh)施加的WE-AX选择性木聚糖酶与β-葡聚糖酶(B)相组合的优化共混物,作用于20%大麦/80%麦芽。结果表明糖化醪和啤酒分离性能良好,异味形成和滤床崩溃的风险低。结论本研究证明了在糖化醪制备过程中施加对WE-AX具有高度选择性的酿造用木聚糖酶的重要性。获得了以下有益效果:·糖化醪分离和啤酒过滤性能良好·滤清时滤床崩溃的风险减至最低·与阿拉伯木聚糖分解相关的异味形成的潜在可能性减低·耐受木聚糖酶过量木聚糖酶常常可与β-葡聚糖酶组合在一起施加,有益效果明显,便于控制分离过程。实施例3:在2HL中试酿造试验中评估X3/BglS(也称AtuXyn3/BsuGluS)组合材料与方法:实验:酶:AtuXyn3(X3)/BsuGluS(Bgls)(a):BglS(芽孢杆菌葡聚糖酶)和X3(曲霉菌木聚糖酶:BgLS:0.50mg蛋白/kg谷粉,X3:1.50mg蛋白/kg谷粉)的组合。AtuXyn3(X3)/BsuGluS(Bgls)(b):如AtuXyn3(X3)/BsuGluS(Bgls)(a),但X3剂量增加20%以测试稳固性(robustness)。参比物:Benchmark酶产品(Max),剂量为0.20kg/T谷粉。原料:辅料:大麦22%重量/重量。麦芽:比尔森(Pilsner)麦芽Chiraz42.6%重量/重量,比尔森麦芽QuenchDMG35.4%重量/重量(w/w)。所有用于pH、钙、锌和苦味水平的酸调节的材料均为食品级,并被认为是标准的酿造材料。酿造配方旨在酿造出国际贮藏啤酒的啤酒风格。磨粉:Künzel2辊中试磨。研磨的材料通过辊两次以模拟4辊磨。麦芽谷粉:磨机运转,第一次通过辊时为1.5mm,第二次通过辊时为0.7mm。大麦谷粉:磨机运转,第一次通过辊时为1.5mm,第二次通过辊时为0.4mm。酿造厂2HL:所有酿造均基于190L麦芽汁的HGB(高浓度酿造)浸出糖化醪制备和标准滤清,目标是16°Plato。在以固定流速进行的滤清过程中,记录差压(用作评估滤清性能的参数)。所有酿造材料均提早(24h)研磨并在与水接触之前保持在密封桶中。所有材料均在糖化醪制备开始后的前3分钟内投入糖化醪制备罐中。在加入酶之前进行钙和pH调整。pH(20℃)在52℃中断时进行再检查。10分钟后在72℃下确认碘当量浓度。在78℃下进行滤清。在初麦芽汁收集过程中以90l/H的固定流速评估滤清性能。在淋洗和稀麦芽汁收集过程中将流速提高到110L/小时和130L/小时。对冷麦芽汁进行化学分析。麦芽汁煮沸:使用蒸发率为4-5%外部锅炉进行煮沸。从开始麦芽汁煮沸时加入酒花浸膏,目标是最终啤酒达20BU。发酵50L:所有发酵均在50L圆锥形罐中进行。根据标准的操作程序进行发酵。以15×106个活酵母细胞/ml进行接种。使用Nucleo计数器进行酵母计数并计算存活率。啤酒加工:以恒定压力操作板框过滤机。通过重量进行流速评估。从1个和3个过滤板收集数据。脱酿(debrewing):所有啤酒进行脱酿至5.0%ABV酒精体积,这被认为是国际贮藏啤酒标准。装瓶:将CO2调整至5.0g/L。所有啤酒样品均在McLennon自动灌装机上使用单次抽空装入33cl标准瓶中。啤酒分析:使用GC-MS分析新鲜啤酒。使用GC-MS测定化学陈化进程。结果与观察:糖化醪制备。用以下条件进行糖化醪制备:52℃10分钟模拟使用运转磨机(runningmill)进行的15-20分钟糖化醪制备。65℃40分钟。72℃30分钟。78℃10分钟。所有升温步骤均以1℃执行。图7给出示意图。所有试验均以这个糖化醪制备方案进行,目标是16°Plato酿造。对这个工艺步骤没有评论。结果与观察:滤清。在2hl酿造厂中进行滤清,装载量为150kg/m2。这代表标准的酿造厂操作。控制滤清过程在固定流速平均为100升/小时。初始流速为90升/小时,在稀麦芽汁收集过程中提高到130升/小时。对四个酿造记录了差压和在线浊度测量。在大约2小时里进行全部滤清和麦芽汁收集。X3/BglS(b)和X3/BglS(a)试验被表明是具有最佳滤清性能的试验,其次是X3/BglS(a)试验,而UFmax试验的性能最差。表13:从四个试验的糖化醪滤清过程中收集的数据。UFmaxX3/BglS(a)X3/BglS(b)X3/BglS(a)过滤槽装载量(kg/m3)153153153153过滤槽时间(分钟)154164170154差压(cm)40303030破坏(#深切)1111浊度(EBC)10151010初麦芽汁压力升高(cm/h)40333130第一次深切时间(分钟)4560120115标准的“差压”和“初麦芽汁压力升高”以cmWC(cm水柱)测量,而不是分别以(cm)和(cm/h)测量。结果与观察:煮沸后的麦芽汁分析。冷麦芽汁的分析显示相似的结果。β-葡聚糖分析表明样品间稍有差异。表14:冷麦芽汁的化学分析。麦芽汁UFmaxX3/BglS(a)X3/BglS(b)X3/BglS(a)浸出物(%plato)16.0916.0515.9916.1色度(EBC)9.79.39.39.3pH55.25.25.2碘(Y/N)NNNN苦味(BU,EBC)52514650表15:冷麦芽汁的分析数据。UFmaxX3/BglS(a)X3/BglS(b)X3/BglS(a)麦芽汁中的β-葡聚糖(mg/L)49402530在12℃下的动态粘度(mPa.s)1,8881,6851,6791,686戊聚糖(mg/L)3365297530142964阿魏酸(ug/mL)4,33,93,83,94-VG(ug/ml)<0,49<0,49<0,49<0,49(12℃为12°Plato);(%Plato可与°Plato互换使用)结果与观察:发酵。表16中给出生啤酒的分析。表16:生啤酒分析。生啤酒UFmaxX3/BglS(a)X3/BglS(b)X3/BglS(a)酒精(%vol)6.796.796.76.86真实浸出物(%P)6.28666RDF(%)63.563.763.564.4原始浸出物(%P)16.2916.2516.0916.24色度(EBC)8.38.5--pH4.44.44.44.4S02(ppm)791110苦味(BU,EBC)29282727生啤酒分析显示各试验之间具有高度的相似性。所有试验均具有相对较低的RDF(实际发酵度),但这通常是按重量/重量(w/w)计算加入22%大麦所看到的。结果与观察:啤酒过滤。使用板框过滤机用固定压力对啤酒样品进行过滤。过滤了大约15kg的两小桶,每个小桶的过滤数据在表17中给出。第一小桶用1个滤片过滤,第二小桶用3个滤片过滤。差压总是0.5巴。过滤板为来自Begerow公司的KD7(20cm×20cm)。1个过滤板过滤或者3个过滤板过滤的过滤曲线总体图像是相同的。我们认为1个过滤板记录可能过于灵敏而不能显示真实的比率差。表17:四个试验的小桶过滤数据过滤UFmaxX3/BglS(a)X3/BglS(b)X3/BglS(a)过滤速度-1个滤片(L/h)4.85.69.911.8过滤速度-3个滤片(L/h)77.259.670.6105.4结果与观察:最终啤酒分析。试验啤酒根据标准的操作程序(EBC)进行分析并在表18中显示。表18:最终啤酒分析。成品啤酒UFmaxX3/BglS(a)X3/BglS(b)X3/BglS(a)酒精(%)4.824.895.014.92真实浸出物(%P)4.54.64.64.4RDF(%)63.263.463.864.3原始浸出物(%P)11.8511.9912.1911.89色度(EBC)4.84.955pH4.44.44.44.4S02(ppm)1313106苦味(BU,EBC)22222018浊度(EBC)0.430.40.380.4总浊度-5天-60℃(EBC)8.612.97.36.2C02(g/L)4.95.35.15.2双乙酰(ppb)1211810泡持力(S)107111119108泡沫体积(mL)452476460470结果与观察:最终啤酒中的Strecker醛和“陈化标志物”。对生啤酒和陈化啤酒都进行了分析。通过GC-MS对生啤酒和陈化啤酒分析了Strecker醛和“陈化和热标志物”(2-Me-Pr(2-甲基丙醛)、2-Me-Bu(2-甲基丁醛)、3-Me-Bu(3-甲基丁醛)、糠醛、3-甲硫基丙醛、PheAcal(苯基乙醛)和T2N(反式-2-壬烯醛))。生啤酒分析数据在表19中给出。表19:生啤酒的Strecker醛分析。热和陈化标志物(糠醛和反式-2-壬烯醛)用作样品对照。陈化标志物(生啤酒)UFmaxX3/BglS(a)X3/BglS(b)X3/BglS(a)2-ME-Pr(ppb)55562-ME-Bu(ppb)22223-ME-Bu(ppb)6666糠醛(ppb)101111103-甲硫基丙醛(ppb)4444PheAcal(ppb)6667T2N(ppb)0.00110.0050.0040.006将试验啤酒在37℃下温育2个星期后进行Strecker醛分析。陈化啤酒样品的数据在表20中给出。表20:陈化啤酒的Strecker醛分析。热和陈化标志物(糠醛和反式-2-壬烯醛)用作样品对照。陈化标志物(强迫陈化啤酒)UFmaxX3/BglS(a)X3/BglS(b)X3/BglS(a)2-ME-Pr(ppb)252322262-ME-Bu(ppb)33323-ME-Bu(ppb)9778糠醛(ppb)1119293783-甲硫基丙醛(ppb)6566PheAcal(ppb)109910T2N(ppb)0.0170.0220.0220.022表20中给出的数据显示出Strecker醛水平如所预期那样提高。糠醛和反式-2-壬烯醛的提高达到预期水平。结论:根据中试规模的实验,我们可得出结论,本实验中测试的BglS与X3的比例表现得比中试规模酿造中的参比物UltraFloMax一样好或者甚至更好。由所使用的挑战性原材料即加入22%大麦并与含300mg/lβ-葡聚糖的麦芽组合来看,结果是出乎意料的。该表现不仅在糖化醪分离结果中看到,也在啤酒过滤中看到。由于当使用BREW2(戊聚糖数据)时细胞壁材料的溶解度低,可记录到可能会造成与异味和稳定性相关的质量问题的细胞壁材料的程度较低。最后可得出结论,X3/Bgls(b)中的木聚糖酶成分的剂量提高20%似乎不对任何所评估的参数具有任何影响,这表明X3/Bgls(a)是一个稳固的酶组合。序列:AtuXyn3,塔宾曲霉(Aspergillustubigensis)(SEQIDNO:1),302个氨基酸QASVSIDTKFKAHGKKYLGNIGDQYTLTKNSKTPAIIKADFGALTPENSMKWDATEPSRGQFSFSGSDYLVNFAQSNNKLIRGHTLVWHSQLPSWVQAITDKNTLIEVMKNHITTVMQHYKGKIYAWDVVNEIFNEDGSLRDSVFYQVIGEDYVRIAFETARAADPNAKLYINDYNLDSASYPKLTGMVSHVKKWIEAGIPIDGIGSQTHLSAGGGAGISGALNALAGAGTKEIAVTELDIAGASSTDYVEVVEACLDQPKCIGITVWGVADPDSWRSSSTPLLFDSNYNPKPAYTAIANALTerXyn1,埃默森疣青霉(埃默森篮状菌)(Geosmithiaemersonii(Taleromycesemersonii))(SEQIDNO:2)AGLNTAAKAIGLKYFGTATDNPELSDTAYETQLNNTQDFGQLTPANSMKWDATEPEQNVFTFSAGDQIANLAKANGQMLRCHNLVWYNQLPSWVTSGSWTNETLLAAMKNHITNVVTHYKGQCYAWDVVNEALNDDGTYRSNVFYQYIGEAYIPIAFATAAAADPNAKLYYNDYNIEYPGAKATAAQNLVKLVQSYGARIDGVGLQSHFIVGETPSTSSQQQNMAAFTALGVEVAITELDIRMQLPETEALLTQQATDYQSTVQACANTKGCVGITVWDWTDKYSWVPSTFSGYGDACPWDANYQKKPAYEGILTGLGQTVTSTTYIISPTTSVGTGTTTSSGGSGGTTGVAQHWEQCGGLGWTGPTVCASGYTCTVINEYYSQCLAtuXyn4,塔宾曲霉(Aspergillustubigensis)(SEQIDNO:3)EPIEPRQASVSIDTKFKAHGKKYLGNIGDQYTLTKNSKTPAIIKADFGALTPENSMKWDATEPSRGQFSFSGSDYLVNFAQSNNKLIRGHTLVWHSQLPSWVQSITDKNTLIEVMKNHITTVMQHYKGKIYAWDVVNEIFNEDGSLRDSVFYKVIGEDYVRIAFETARAADPNAKLYINDYNLDSASYPKLTGMVSHVKKWIAAGIPIDGIGSQTHLSAGGGAGISGALNALAGAGTKEIAVTELDIAGASSTDYVEVVEACLNQPKCIGITVWGVADPDSWRSSSTPLLFDSNYNPKPAYTAIANALAacXyn2,棘孢曲霉(Aspergillusaculeatus)(SEQIDNO:4)MVGLLSITAALAATVLPNIVSAVGLDQAAVAKGLQYFGTATDNPELTDIPYVTQLNNTADFGQITPGNSMKWDATEPSQGTFTFTKGDVIADLAEGNGQYLRCHTLVWYNQLPSWVTSGTWTNATLTAALKNHITNVVSHYKGKCLHWDVVNEALNDDGTYRTNIFYTTIGEAYIPIAFAAAAAADPDAKLFYNDYNLEYGGAKAASARAIVQLVKNAGAKIDGVGLQAHFSVGTVPSTSSLVSVLQSFTALGVEVAYTEADVRILLPTTATTLAQQSSDFQALVQSCVQTTGCVGFTIWDWTDKYSWVPSTFSGYGAALPWDENLVKKPAYNGLLAGMGVTVTTTTTTTTATATGKTTTTTTGATSTGTTAAHWGQCGGLNWSGPTACATGYTCTYVNDYYSQCLTreXyn3,里氏木霉(Trichodermareesei)(SEQIDNO:5)MKANVILCLLAPLVAALPTETIHLDPELAALRANLTERTADLWDRQASQSIDQLIKRKGKLYFGTATDRGLLQREKNAAIIQADLGQVTPENSMKWQSLENNQGQLNWGDADYLVNFAQQNGKSIRGHTLIWHSQLPAWVNNINNADTLRQVIRTHVSTVVGRYKGKIRAWDVVNEIFNEDGTLRSSVFSRLLGEEFVSIAFRAARDADPSARLYINDYNLDRANYGKVNGLKTYVSKWISQGVPIDGIGSQSHLSGGGGSGTLGALQQLATVPVTELAITELDIQGAPTTDYTQVVQACLSVSKCVGITVWGISDKDSWRASTNPLLFDANFNPKPAYNSIVGILQTreXyn5,里氏木霉(Trichodermareesei)(SEQIDNO:6)QCIQPGTGYNNGYFYSYWNDGHGGVTYCNGPGGQFSVNWSNSGNFVGGKGWQPGTKNRVINFSGSYNPNGNSYLSVYGWSRNPLIEYYIVENFGTYNPSTGATKLGEVTSDGSVYDIYRTQRVNQPSIIGTATFYQYWSVRRNHRSSGSVNTANHFNAWAQQGLTLGTMDYQIVAVEGYFSSGSASITVSDBsuGluS,枯草芽孢杆菌(Bacillussubtilis)(SEQIDNO:7),214个氨基酸QTGGSFFDPFNGYNSGFWQKADGYSNGNMFNCTWRANNVSMTSLGEMRLALTSPAYNKFDCGENRSVQTYGYGLYEVRMKPAKNTGIVSSFFTYTGPTDGTPWDEIDIEFLGKDTTKVQFNYYTNGAGNHEKIVDLGFDAANAYHTYAFDWQPNSIKWYVDGQLKHTATNQIPTTPGKIMMNLWNGTGVDEWLGSYNGVNPLYAHYDWVRYTKKTerGlu1,埃默森疣青霉(埃默森篮状菌)(Geosmithiaemersonii(Taleromycesemersonii))(SEQIDNO:8)APVKEKGIKKRASPFQWFGSNESGAEFGNNNIPGVEGTDYTFPNTSAIQILIDQGMNIFRVPFLMERMVPNQMTGPVDSAYFQGYSQVINYITSHGASAVIDPHNFGRYYNNIISSPSDFQTFWHTIASNFADNDNVIFDTNNEYHDMDESLVVQLNQAAIDGIRAAGATSQYIFVEGNSWTGAWTWTQVNDAMANLTDPQNKIVYEMHQYLDSDGSGTSDQCVNSTIGQDRVESATAWLKQNGKKAILGEYAGGANSVCETAVTGMLDYLANNTDVWTGAIWWAAGPWWGDYIFSMEPPSGIAYEQVLPLLQPYLBsuGlu103FULL,枯草芽孢杆菌(Bacillussubtilis)(SEQIDNO:9)DDYSVVEEHGQLSISNGELVNERGEQVQLKGMSSHGLQWYGQFVNYESMKWLRDDWGITVFRAAMYTSSGGYIDDPSVKEKVKETVEAAIDLGIYVIIDWHILSDNDPNIYKEEAKDFFDEMSELYGDYPNVIYEIANEPNGSDVTWDNQIKPYAEEVIPVIRDNDPNNIVIVGTGTWSQDVHHAADNQLADPNVMYAFHFYAGTHGQNLRDQVDYALDQGAAIFVSEWGTSAATGDGGVFLDEAQVWIDFMDERNLSWANWSLTHKDESSAALMPGANPTGGWTEAELSPSGTFVREKIRESASIPPSDPTPPSDPGEPDPGEPDPTPPSDPGEYPAWDSNQIYTNEIVYHNGQLWQAKWWTQNQEPGDPYGPWEPLKSDPDSGEPDPTPPSDPGEYPAWDSNQIYTNEIVYHNGQLWQAKWWTQNQEPGDPYGPWEPLNTreGlu2,里氏木霉(Trichodermareesei)(SEQIDNO:10)QQTVWGQCGGIGWSGPTNCAPGSACSTLNPYYAQCIPGATTITTSTRPPSGPTTTTRATSTSSSTPPTSSGVRFAGVNIAGFDFGCTTDGTCVTSKVYPPLKNFTGSNNYPDGIGQMQHFVNDDGMTIFRLPVGWQYLVNNNLGGNLDSTSISKYDQLVQGCLSLGAYCIVDIHNYARWNGGIIGQGGPTNAQFTSLWSQLASKYASQSRVWFGIMNEPHDVNINTWAATVQEVVTAIRNAGATSQFISLPGNDWQSAGAFISDGSAAALSQVTNPDGSTTNLIFDVHKYLDSDNSGTHAECTTNNIDGAFSPLATWLRQNNRQAILTETGGGNVQSCIQDMCQQIQYLNQNSDVYLGYVGWGAGSFDSTYVLTETPTGSGNSWTDTSLVSSCLARKTreGlu3,里氏木霉(Trichodermareesei)(SEQIDNO:11)QTSCDQWATFTGNGYTVSNNLWGASAGSGFGCVTAVSLSGGASWHADWQWSGGQNNVKSYQNSQIAIPQKRTVNSISSMPTTASWSYSGSNIRANVAYDLFTAANPNHVTYSGDYELMIWLGKYGDIGPIGSSQGTVNVGGQSWTLYYGYNGAMQVYSFVAQTNTTNYSGDVKNFFNYLRDNKGYNAAGQYVLSYQFGTEPFTGSGTLNVASWTASINTreGlu4,里氏木霉(Trichodermareesei)(SEQIDNO:12)HGHINDIVINGVWYQAYDPTTFPYESNPPIVVGWTAADLDNGFVSPDAYQNPDIICHKNATNAKGHASVKAGDTILFQWVPVPWPHPGPIVDYLANCNGDCETVDKTTLEFFKIDGVGLLSGGDPGTWASDVLISNNNTWVVKIPDNLAPGNYVLRHEIIALHSAGQANGAQNYPQCFNIAVSGSGSLQPSGVLGTDLYHATDPGVLINIYTSPLNYIIPGPTVVSGLPTSVAQGSSAATATASATVPGGGSGPTSRTTTTARTTQASSRPSSTPPATTSAPAGGPTQTLYGQCGGSGYSGPTRCAPPATCSTNPYYAQCLNTreGlu6,里氏木霉(Trichodermareesei)(SEQIDNO:13)AFSWKNVKLGGGGGFVPGIIFHPKTKGVAYARTDIGGLYRLNADDSWTAVTDGIADNAGWHNWGIDAVALDPQDDQKVYAAVGMYTNSWDPSNGAIIRSSDRGATWSFTNLPFKVGGNMPGRGAGERLAVDPANSNIIYFGARSGNGLWKSTDGGVTFSKVSSFTATGTYIPDPSDSNGYNSDKQGLMWVTFDSTSSTTGGATSRIFVGTADNITASVYVSTNAGSTWSAVPGQPGKYFPHKAKLQPAEKALYLTYSWWPDAQLFRSTDSGTTWSPIWAWASYPTETYYYSISTPKAPWIKNNFIDVTSESPSDGLIKRLGWMIESLEIDPTDSNHWLYGTGMTIFGGHDLTNWDTRHNVSIQSLADGIEEFSVQDLASAPGGSELLAAVGDDNGFTFASRNDLGTSPQTVWATPTWATSTSVDYAGNSVKSVVRVGNTAGTQQVAISSDGGATWSIDYAADTSMNGGTVAYSADGDTILWSTASSGVQRSQFQGSFASVSSLPAGAVIASDKKTNSVFYAGSGSTFYVSKDTGSSFTRGPKLGSAGTIRDIAAHPTTAGTLYVSTDVGIFRSTDSGTTFGQVSTALTNTYQIALGVGSGSNWNLYAFGTGPSGARLYASGDSGASWTDIQGSQGFGSIDSTKVAGSGSTAGQVYVGTNGRGVFYAQGTVGGGTGGTSSSTKQSSSSTSSASSSTTLRSSVVSTTRASTVTSSRTSSAAGPTGSGVAGHYAQCGGIGWTGPTQCVAPYVCQKQNDYYYQCVTreGlu7,里氏木霉(Trichodermareesei)(SEQIDNO:14)HGQVQNFTINGQYNQGFILDYYYQKQNTGHFPNVAGWYAEDLDLGFISPDQYTTPDIVCHKNAAPGAISATAAAGSNIVFQWGPGVWPHPYGPIVTYVVECSGSCTTVNKNNLRWVKIQEAGINYNTQVWAQQDLINQGNKWTVKIPSSLRPGNYVFRHELLAAHGASSANGMQNYPQCVNIAVTGSGTKALPAGTPATQLYKPTDPGILFNPYTTITSYTIPGPALWQGTreGlu8,里氏木霉(Trichodermareesei)(SEQIDNO:15)GKIKYLGVAIPGIDFGCDIDGSCPTDTSSVPLLSYKGGDGAGQMKHFAEDDGLNVFRISATWQFVLNNTVDGKLDELNWGSYNKVVNACLETGAYCMIDMHNFARYNGGIIGQGGVSDDIFVDLWVQIAKYYEDNDKIIFGLMNEPHDLDIEIWAQTCQKVVTAIRKAGATSQMILLPGTNFASVETYVSTGSAEALGKITNPDGSTDLLYFDVHKYLDINNSGSHAECTTDNVDAFNDFADWLRQNKRQAIISETGASMEPSCMTAFCAQNKAISENSDVYIGFVGWGAGSFDTSYILTLTPLGKPGNYTDNKLMNECILDQFTLDEKYRPTPTSISTAAEETATATATSDGDAPSTTKPIFREETASPTPNAVTKPSPDTSDSSDDDKDSAASMSAQGLTGTVLFTVAALGYMLVAFBsuGluCCBD,枯草芽孢杆菌(Bacillussubtilis)(SEQIDNO:16)MKRSISIFITCLLITLLTMGGMIASPASAAGTKTPVAKNGQLSIKGTQLVNRDGKAVQLKGISSHGLQWYGEYVNKDSLKWLRDDWGITVFRAAMYTADGGYIDNPSVKNKVKEAVEAAKELGIYVIIDWHILNDGNPNQNKEKAKEFFKEMSSLYGNTPNVIYEIANEPNGDVNWKRDIKPYAEEVISVIRKNDPDNIIIVGTGTWSQDVNDAADDQLKDANVMYALHFYAGTHGQFLRDKANYALSKGAPIFVTEWGTSDASGNGGVFLDQSREWLKYLDSKTISWVNWNLSDKQESSSALKPGASKTGGWRLSDLSASGTFVRENILGTKDSTKDIPETPSKDKPTQENGISVQYRAGDGSMNSNQIRPQLQIKNNGNTTVDLKDVTARYWYKAKNKGQNFDCDYAQIGCGNVTHKFVTLHKPKQGADTYLELGFKNGTLAPGASTGNIQLRLHNDDWSNYAQSGDYSFFKSNTFKTTKKITLYDQGKLIWGTEPNBsuXyn3,枯草芽孢杆菌(Bacillussubtilis)木聚糖酶变体(SEQIDNO:17)ASTDYWQNWTFGGGIVNAVNGSGGNYSVNWSNTGNFVVGKGWTTGSPFRTINYNAGVWAPNGNGYLTLYGWTRSPLIEYYVVDSWGTYRPTGTYKGTVKSDGGTYDIYTTTRYNAPSIDGDDTTFTQYWSVRQSKRPTGSNATITFSNHVNAWKSHGMNLGSNWAYQVMATEGYQSSGSSNVTVWBsuXyn4,枯草芽孢杆菌(Bacillussubtilis)木聚糖酶变体(SEQIDNO:18)ASTDYWQNWTDGYGIVNAVNGSGGNYSVNWSNTGNFVVGKGWTTGSPFRTINYNAGVWAPNGNGYLTLYGWTRSPLIEYYVVDSWGTYRPTGTYKGTVYSDGGWYDIYTATRDNAPSIDGDFTTFTQYWSVRQSKRPTGSNATITFSNHVNAWRSHGMDLGSNWAYQVMATEGYLSSGSSNVTVW当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1