一种用于纯化凝血酶原复合物的工艺的制作方法
本发明涉及生物医药技术领域,更具体地,涉及一种用于纯化凝血酶原复合物的工艺。
背景技术:
人凝血酶原复合物(prothrombin complex concentrates,PCC)是从人健康混合血浆分离制备的血液制品,主要含依赖维生素K合成的凝血因子(Coagulation factor,F)II、VII、IX、X。PCC制品在20世纪70年代用于临床,广泛用于治疗乙型血友病、有抗凝血因子VIII的甲型血友病、维生素K缺乏引起的凝血因子水平低下导致的出血症、以及替代新鲜冰冻血浆逆转维生素拮抗剂或香豆素类抗凝剂过量导致的各种出血性疾病。目前国内外生产PCC主要采用DEAE-SephadexA-50吸附进行大规模制备。我国现生产PCC的传统工艺采用DEAE-SephadexA-50凝胶进行两步批式吸附,该方法使用的吸附介质DEAE-SephadexA-50凝胶经平衡后,机械强度差、易破碎,不适用于柱层析技术;另外DEAE-SephadexA-50凝胶在重复应用中存在补加量难估计、不易控制等一系列问题,导致制品质量不稳定。
目前国内外用DEAE-SephadexA-50凝胶两步批式吸附法制备的PCC,FII、X含量相对很高,纯度相对较低。过高的FII、X含量,尤其是过高的FII及较低的纯度增加了制品的致栓性。随着血浆蛋白分离技术的发展,近几年也有利用扩张床吸附技术制备PCC的报道,但仍处于实验室探索阶段。因此,在上万种凝胶中急需寻找一种能够适宜于工业化大生产的、能够利用柱层析技术的、制备PCC的凝胶,以增强PCC工艺可控性;同时急需开发出高纯度、较高FII、IX、X因子均衡度的PCC制备工艺,增强PCC临床使用的安全性。
技术实现要素:
针对现有技术中存在的问题,本发明提供一种可以实现PCC纯度较高且FII、IX、X均衡度较好的纯化方法。
根据本发明的一个方面,提供了一种用于纯化PCC的工艺,其特征在于,包括:将检测合格的健康人血浆通过离心去除沉淀以得到血浆原料;采用DEAE-Sephadex A-50凝胶对所述血浆原料进行吸附,经洗涤、洗脱以得到凝血酶原复合物粗提液;以及通过Capto DEAE凝胶柱对所述PCC粗提液进行进一步吸附,经洗涤、洗脱,从而制得PCC液体。
在上述方法中,在将所述PCC粗提液用去离子水稀释16-18倍,以使得稀释后的所述PCC粗提液的电导率为13.5-14.68ms/cm后,再通入所述Capto DEAE凝胶柱。
在上述方法中,在通过所述DEAE-Sephadex A-50凝胶对所述血浆原料进行吸附之前,用平衡液预平衡所述DEAE-Sephadex A-50凝胶;并且在通过所述Capto DEAE凝胶柱对所述PCC粗提液进行进一步吸附之前,用平衡液预平衡所述Capto DEAE凝胶柱。
在上述方法中,采用DEAE-Sephadex A-50凝胶对所述血浆原料进行吸附、洗涤、洗脱过程中:所用平衡液含0.02mol/L柠檬酸钠和0.1mol/L NaCl,余量为水,PH为7.0;所用洗涤液含0.015-0.02mol/L柠檬酸钠和0.15mol/L NaCl,余量为水,PH为6.8-7.2;并且所用洗脱液含0.0075-0.015mol/L柠檬酸钠和2.4mol/L NaCl,余量为水,PH为6.6-7.2。
在上述方法中,通过Capto DEAE凝胶柱对所述PCC粗提液进行吸附、洗涤、洗脱过程中:所用平衡液含0.02mol/L柠檬酸钠和0.075-0.1mol/LNaCl,余量为水,PH为6.8-7.0;所用洗涤液含0.015mol/L柠檬酸钠和0.15mol/L NaCl,余量为水,PH为7.2;并且所用洗脱液含0.0075-0.015mol/L柠檬酸钠和2.4mol/L NaCl,余量为水,PH为6.6-7.2。
在上述方法中,采用DEAE-Sephadex A-50凝胶对所述血浆原料进行吸附、洗涤、洗脱过程中:所用平衡液含0.02mol/L柠檬酸钠和0.1mol/L NaCl,余量为水,PH为7.0;所用洗涤液含0.015mol/L柠檬酸钠和0.15mol/L NaCl,余量为水,PH为7.2;所用洗脱液含0.015mol/L柠檬酸钠和2.4mol/L NaCl,余量为水,PH为6.6;其中,通过Capto DEAE凝胶柱对所述PCC粗提液进行吸附、洗涤、洗脱过程中:所用平衡液含0.02mol/L柠檬酸钠和0.1mol/L NaCl,余量为水,PH为7.0;所用洗涤液含0.015柠檬酸钠和0.15mol/L NaCl,余量为水,PH为7.2;并且所用洗脱液含0.0075mol/L柠檬酸钠和2.4mol/L NaCl,余量为水,PH为7.2。
在上述方法中,采用DEAE-Sephadex A-50凝胶对所述血浆原料进行吸附,经洗涤、洗脱以得到PCC粗提液的步骤进一步包括:将符合药典要求的去除冷沉淀的血浆在4-6℃条件下,按该血浆重量的2.0-2.2%加入用所述平衡液预平衡的DEAE-Sephadex A-50凝胶,搅拌吸附50-60分钟,收集所述DEAE-Sephadex A-50凝胶;用13-15倍的所述DEAE-Sephadex A-50凝胶的干粉重量的所述洗涤液洗涤所述DEAE-Sephadex A-50凝胶1-3次,优选地,洗涤2次,每次搅拌10-20分钟;以及用17-18倍的所述DEAE-Sephadex A-50凝胶的干粉重量的所述洗脱液洗脱所述DEAE-Sephadex A-50凝胶1-3次,优选地,洗脱2次,每次搅拌10-20分钟放干,收集洗脱后的蛋白洗脱液。
在上述方法中,通过Capto DEAE凝胶柱对所述PCC粗提液进行进一步吸附,经洗涤、洗脱的步骤进一步包括:将所述蛋白洗脱液稀释后,在4-6℃条件下,按9-10倍Capto DEAE凝胶柱体积的量进行上样,上样流速为1-3cm/分钟,优选地上样流速为1.5cm/分钟;用5-6倍Capto DEAE凝胶柱体积的所述洗涤液洗涤所述Capto DEAE凝胶,洗涤流速为2-3cm/分钟,优选地洗涤流速为2.5cm/分钟;用2-4倍的Capto DEAE凝胶柱体积的所述洗脱液洗脱所述Capto DEAE凝胶,洗脱流速为1-3cm/分钟,收集洗脱液。优选地,用3倍的Capto DEAE凝胶柱体积的所述洗脱液洗脱所述Capto DEAE凝胶,洗脱流速为1.5cm/分钟,收集洗脱液。
在上述方法中,在通过所述DEAE-Sephadex A-50凝胶对所述血浆原料进行吸附之前,用平衡液预平衡所述DEAE-Sephadex A-50凝胶的步骤进一步包括:按所述DEAE-Sephadex A-50凝胶的干粉重量的80-82倍加入平衡液,混合均匀后加热至90-95℃,维持2.5小时,放置4-5℃条件冷却沉淀,6-8小时后弃去上清液;按所述DEAE-Sephadex A-50凝胶的干粉重量的80-82倍再次加入所述平衡液,放置4-5℃条件预平衡24小时,弃去上清液,多次重复此操作,直至上清液电导率与平衡液一致为止。
在上述方法中,在通过所述Capto DEAE凝胶柱对所述PCC粗提液进行进一步吸附之前,用平衡液预平衡所述Capto DEAE凝胶柱的步骤进一步包括:在4-6℃条件下,按13-14倍Capto DEAE凝胶柱体积的平衡液量对所述Capto DEAE凝胶进行平衡,平衡流速为3-4cm/分钟。
在本发明中,通过采用DEAE-Sephadex A-50凝胶和CaptoDEAE凝胶两步法制备PCC,所设计的工艺条件下制品纯度(中国药典2015年版规定按FIX计算)远高于传统工艺制备的PCC,且FII、IX、X三种因子均衡度好。
附图说明
图1为4种工艺条件下Capto DEAE凝胶柱层析紫外检测图谱。
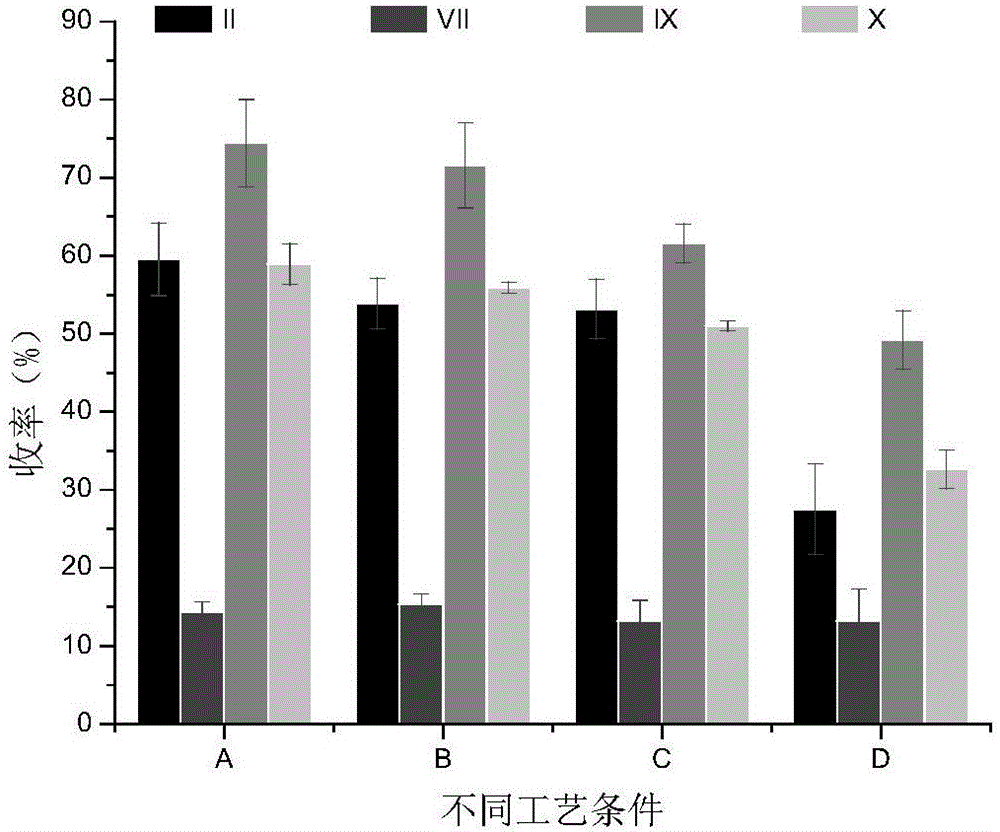
图2为4种工艺条件下凝血因子的收率。
图3为4种工艺条件下凝血因子的比活。
图4为4种工艺条件下蛋白C收率。
图5为4种工艺条件下蛋白C比活。
图6为4种工艺条件下所制备PCC及与已上市制品SDS-PAGE,其中,条带1:蛋白marker;条带2-5:A、B、C、D四种工艺条件下制备出的PCC;条带6:已上市PCC制品。(注备:电泳上样前,4种工艺条件制备的PCC与已上市PCC制品经稀释处理且稀释后所有PCC所含FIX单位活性均一致)。
具体实施方式
下面将结合附图对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员所获得的所有其他实施例,都属于本发明保护的范围。
1材料与方法
1.1材料与仪器健康人血浆(三台县单采血浆站);DEAE-SephadexA-50凝胶(GE公司,批号:10091423);Capto DEAE离子交换介质(GE公司);凝血因子II、VII、IX、X活性检测试剂盒(SIEMENS公司,批号:503630C、500749B、504107D、504009A);Super-Bradford蛋白定量试剂盒(北京康为世纪生物科技有限公司,批号:00111510);正常质控血浆(SIEMENS公司,批号:507704A);蛋白C缺乏浆(HYPHEM BioMed公司,批号:31302-1PK:2);蛋白C检测试剂盒(HYPHEM BioMed公司,批号:32901-PK:2);蛋白Marker(Fermentas公司);其余试剂均为国产分析纯。精密天平(XS205,METTLER TOLEDO公司);大容量高速低温冷冻离心机(RC3BP+,Thermo公司);pH仪(FE20,METTLER TOLEDO公司);电导仪(FE30,METTLER TOLEDO公司);AKTA explorer 100层析系统(GE公司);全自动凝血仪(CA-1500,Sysmex公司);蛋白垂直电泳仪(Mini-Protean,Bio-Rad公司);酶标仪(SpectraMax M2e,Molecular Devices公司);凝胶成像仪(ImageQuant 350,GE公司);纯水仪(Milli-Q Advantage,Millipore公司);恒温水浴箱(HH-W600,金坛市医疗仪器厂)。
1.2 PCC的初步纯化按传统批式吸附方法,使用DEAE-SephadexA-50凝胶吸附去冷沉淀血浆制备出PCC粗液。设定DEAE-SephadexA-50凝胶平衡体系中柠檬酸钠、氯化钠、pH 3个可变因素分别为0.02mol/L;0.10mol/L;7.0;设定洗涤体系中柠檬酸钠、氯化钠、pH 3个可变因素分别为0.015-0.02mol/L、0.15mol/L;6.8-7.2;设定洗脱体系中柠檬酸钠、氯化钠、pH 3个可变因素分别为0.0075-0.015mol/L;2.4mol/L;6.6-7.2。
具体操作包括以下步骤:
用平衡液预平衡DEAE-Sephadex A-50凝胶,所用平衡液含0.02mol/L柠檬酸钠和0.1mol/L NaCl,余量为水,pH为7.0;
具体平衡过程为:按DEAE-Sephadex A-50凝胶干粉重量80-82倍加入平衡液,混合均匀后加热至90-95℃,维持2.5小时,放置4-5℃条件冷却自然沉淀,6-8小时后弃去上清液。按DEAE-Sephadex A-50凝胶干粉重量80-82倍再次加入平衡液,放置4-5℃条件预平衡24小时,弃去上清液,多次重复此操作,直至上清液电导率与平衡液一致为止。
然后,将符合药典要求的去除冷沉淀的血浆在4-6℃条件下,按该血浆重量的2.0-2.2%加入用平衡液预平衡的DEAE-Sephadex A-50凝胶,搅拌吸附50-60分钟,收集DEAE-Sephadex A-50凝胶;用13-15倍的DEAE-Sephadex A-50凝胶的干粉重量的洗涤液洗涤DEAE-Sephadex A-50凝胶1-3次,优选地,洗涤2次,每次搅拌10-20分钟;以及用17-18倍的DEAE-Sephadex A-50凝胶的干粉重量的洗脱液洗脱DEAE-Sephadex A-50凝胶1-3次,优选地,洗脱2次,每次搅拌10-20分钟放干,收集洗脱后的蛋白洗脱液。
在上述操作中,凝胶量采用血浆重量的2.0-2.2%时,各种凝血因子有较高的吸附率。凝胶的用量低于血浆重量的2.0%时,会造成对凝血因子吸附率的降低,而凝胶的用量高于血浆重量的2.2%时,会吸附过多的杂蛋白,影响最终产品的比活和纯度。
洗涤液选用柠檬酸钠和氯化钠的混合液时,洗涤液的浓度、洗涤体积和pH以及洗涤的次数控制的好坏直接影响吸附在凝胶上的因子的效价和比活,14倍的DEAE-Sephadex A-50凝胶的干粉重量的洗涤液洗涤DEAE-Sephadex A-50凝胶2次,每次搅拌15分钟洗涤效果较佳,可以最大程度地去除杂质蛋白,同时最大程度地保留有效因子。
洗脱条件也直接影响到吸附在凝胶上各因子的回收率,用17倍的DEAE-Sephadex A-50凝胶干粉重量的洗脱液洗脱DEAE-Sephadex A-50凝胶2次,每次搅拌15分钟放干时,能达到理想的回收率。
1.3Capto DEAE凝胶柱层析纯化采用AKTA explorer100层析系统,使用Capto DEAE进行柱层析,进一步纯化上述制备出的PCC粗提液。设置Capto DEAE凝胶的平衡体系中柠檬酸钠、氯化钠、pH 3个因素分别为0.02mol/L;0.075-0.1mol/L;6.8-7.0;洗涤体系中柠檬酸钠、氯化钠、pH 3个可变因素分别为0.015mol/L;0.15mol/L;7.2;设定洗脱体系中柠檬酸钠、氯化钠、pH 3个可变因素分别为0.0075-0.015mol/L;2.4mol/L;6.6-7.2。批式吸附获得的PCC粗提液去离子水稀释16-18倍(电导率为13.5-14.68ms/cm)后,再通入Capto DEAE层析柱。
具体操作包括以下步骤:
用平衡液预平衡所述Capto DEAE凝胶,所用平衡液含0.02mol/L柠檬酸钠和0.1mol/L NaCl,余量为水,PH为6.8-7.0;
具体平衡过程为:在4-6℃条件下,按13-14倍Capto DEAE凝胶柱体积的平衡液量对Capto DEAE凝胶进行平衡,平衡流速为3-4cm/min。
然后,将PCC的初步纯化步骤中得到的蛋白洗脱液稀释后,在4-6℃条件下,按9-10倍Capto DEAE凝胶柱体积的量进行上样,上样流速为1-3cm/分钟,优选地上样流速为1.5cm/分钟;用5-6倍Capto DEAE凝胶柱体积的洗涤液洗涤Capto DEAE凝胶,洗涤流速为2-3cm/分钟,优选地洗涤流速为2.5cm/分钟;用2-4倍的Capto DEAE凝胶柱体积的洗脱涤液洗脱Capto DEAE凝胶,洗脱流速为1-3cm/分钟,收集洗脱液。优选地,用3倍的Capto DEAE凝胶柱体积的洗脱液洗脱Capto DEAE凝胶,洗脱流速为1.5cm/分钟,收集洗脱液。
进一步地,当在5℃条件下,按10倍Capto DEAE凝胶柱体积的量进行上样,上样流速为1.5cm/分钟;用5倍Capto DEAE凝胶柱体积的洗涤液洗涤Capto DEAE凝胶,洗涤流速为2.5cm/分钟;用3倍的Capto DEAE凝胶柱体积的洗脱涤液洗脱Capto DEAE凝胶,洗脱流速为1.5cm/分钟,收集洗脱液时,此时各凝血因子的纯化效果最佳。
当采用以上所述的最佳参数(包括温度、上样量、流速等)的情况下,在DEAE-SephadexA-50凝胶纯化和Capto DEAE凝胶柱层析过程中,分别采用了不同条件的平衡液、洗涤液和洗脱液,具体工艺条件表1。
表1 4种工艺条件
1.4凝血因子活性测定凝固法(一期法)测定FII、VII、IX、X活性,正常参比血浆做1/5-1/80梯度稀释;洗脱液1/12稀释;具体操作见FII、VII、IX、X活性检测试剂盒说明书。
1.5蛋白C活性测定发色底物法测定蛋白C活性,正常参比血浆1/5-1/80梯度稀释;去冷沉淀原料血浆1/3稀释;洗脱液1/10稀释;操作见蛋白C检测试剂盒说明书。
1.6总蛋白含量测定考马斯亮蓝法检测PCC总蛋白含量,牛血清白蛋白为标准蛋白,洗脱液1/3稀释,原料血浆1/60稀释,操作见Super-Bradford蛋白定量试剂盒说明书。
1.7SDS-PAGE电泳非还原性SDS-PAGE电泳分析制备出的PCC的纯度,并与国内某公司生产的PCC产品进行对比。四种工艺条件制备PCC与国内PCC产品(300IU)电泳前均进行稀释,稀释后所有PCC所含FIX单位活性均一致。浓缩胶4%、分离胶10%;电泳过程中,条带在浓缩胶时电压设置为80V,当电泳条带进入分离胶后,调整电压为120V。
1.8不同实验条件对凝血因子收率及比活影响分析依据1.4和1.6测定结果,计算上述4种凝血因子的收率及比活。统计多次试验结果,依据平均值直接分析不同实验条件4种凝血因子收率及比活水平。
1.9统计学方法采用SPSS 19.0进行统计学分析,对4种工艺条件下的FIX因子和蛋白C数据进行单因素方差分析。
2结果
2.1 Capto DEAE柱层析纯化Capto DEAE凝胶柱层析,280nm检测图谱如图1所示。4种工艺条件下,层析图谱均相似,三个峰依次为背景杂质峰、洗涤峰及洗脱峰(目标蛋白峰)。从图1看出,洗涤过程中洗去了杂蛋白;洗脱峰均为单一峰。
2.2不同工艺条件对FII、VII、IX、X收率及比活的影响不同工艺条件下,4种凝血因子收率变化有明显规律,从工艺A至D,4种凝血因子的收率都呈递减的趋势;FII、VII、IX、X比活在A、B、C工艺条件下依次递减,D条件下,FII比活最低,而FVII、IX、X的比活要高于C条件。同一工艺条件,FIX收率和比活都较高,4种条件下,FIX的收率和比活均无统计学意义(p>0.05);FVII收率和比活均最低;收率与比活间无明显比例关系,见图2(表2)、图3。
表2 4种工艺条件下四种凝血因子收率及标准差
表3 4种工艺条件下四种凝血因子比活及标准差
2.3不同工艺条件对蛋白C活性的影响从图4(表4)和图5(表5)可以看出,A-C条件下,蛋白C的收率和比活较高,而且基本持平;D条件,蛋白C收率和比活相对较低;4种条件下蛋白C的收率和比活均无统计学意义(p>0.05);同一条件下,蛋白C的收率和比活存在较明显的正比例关系。
表4 4种工艺条件下蛋白C收率及标准差
表5 4种工艺条件下蛋白C比活及标准差
2.4 SDS-PAGE不同的工艺条件下,PCC所含蛋白种类基本一致(图6);与国内某公司生产的PCC比较,经过该发明方法制备的PCC纯度明显提高,小于45kD分子量的杂蛋白大幅度减少,而50-70kD分子量的有效蛋白增多。
在通过DEAE-SephadexA-50凝胶纯化以及进一步的Capto DEAE凝胶柱层析过程中,针对纯化过程中所用的平衡液、洗涤液和洗脱液,本发明具体提供了4种工艺条件,其所制备的PCC纯度(按FIX计算)平均值均大于2.1IU/mg蛋白,远高于我国目前PCC平均纯度约0.75IU/mg蛋白的水平,同时也远高于最新《中国药典》(2015年版)中不低于0.5IU/mg蛋白的要求;4种工艺条件,FIX平均收率均大于49%且FII、IX、X均有较好均衡度。此外,采用本发明制备PCC,多次重复实验4种凝血因子收率标准差均较小,说明工艺可控性强。本发明所制备PCC,其中,FIX比活远高于传统工艺制品,且FII、IX、X三因子均衡度好,降低了致栓性风险。
通过大量实验,还发现本发明工艺条件A(表1所示)所制备PCC,FIX的平均比活可高达3.31IU/mL,平均收率大于74%,极明显优于传统工艺。另外,对本发明具体4种工艺条件下制备的PCC中抗凝类蛋白——蛋白C进行检测,发现蛋白C的收率和比活均较高,PCC中较高的蛋白C含量,进一步降低了其诱发血栓栓塞的风险。
综上所述,本发明提供的以上工艺,多次重复收率稳定且提高了PCC的纯度,同时,实现了良好的FII、IX、X均衡度以及较高的FIX比活,相比于传统工艺制备的PCC,显著降低了致栓性风险,由此,本发明提供了一种工艺可控性强的用于纯化高质量PCC的方法。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!