一种精准Fc位点共价偶联标记的生物素化抗体的制作方法
本发明涉及基因工程及免疫分析领域,具体的说是涉及一种生物素精准共价偶联抗体Fc位点的标记技术,该发明提供的精准Fc位点的生物素化抗体可在包被亲和素的载体表面实现牢固的定向固定,不影响抗体Fab段的抗原结合位点,且不受待测样品中内源性抗体的干扰。
背景技术:
生物素亲合素系统(biotin-avidin system,BAS),是70年代后期应用于免疫学,并得到迅速发展的一种新型生物反应放大系统。亲合素与生物素之间的亲和力极强,二者结合的亲和常数(Ka)为1015mol-1,亲合素与生物素一经结合,不受pH、温度、有机溶剂及变性剂的影响(使用变性剂且在>90℃的情况下才能解离)。由于它具有生物素与亲合素之间高度亲和力及多级放大效应,并与荧光素、酶、同位素等免疫标记技术有机地结合,使各种免疫分析的特异性和灵敏度进一步提高。生物素偶联标记抗体即生物素化抗体是BAS体系的应用前提,目前所采用的生物素化抗体制备技术是基于各种生物素衍生物(活化生物素)与抗体分子内的氨基酸残基(氨基、羰基)之间的共价偶联技术,一个抗体分子可连接多个生物素分子,由于抗体分子内活性氨基酸残基的数量、位置的不唯一性,生物素分子不能特异性地偶联在抗体的Fc段,当生物素分子随机地偶联于抗体Fab段,则会阻碍抗体的抗原结合而导致抗体结合抗原活性下降。
利用某些抗体亲和蛋白可实现抗体Fc端的间接标记,如葡萄球菌蛋白A(SpA)及其衍生蛋白(ZZ亲和肽),能通过疏水作用结合多种动物IgG的Fc段,且这种结合不影响IgG的Fab段与抗原特异性结合的免疫活性。ZZ亲和肽是源自葡萄球菌蛋白A的B结构域的重复序列,每个ZZ亲和肽分子可结合两个IgG分子,而单个的Z序列(Z亲和肽)可结合IgG分子的一条重链,因而一个IgG分子可结合两个单个的Z序列。我们曾利用定点生物素化的ZZ亲和肽实现了抗体Fc端的生物素亲和偶联(发明专利CN103694358B《位点特异性生物素标记重组及其在三维定向固定IgG抗体中的应用》)。然而,亲和肽与IgG之间的结合是一种可逆的生物结合,该抗体定向固定技术应用于基于芯片技术的免疫分析中,在芯片的再生过程中亲和肽-IgG的结合物会解离,需重复结合捕获抗体;更为重要的是,在临床样品分析中如果含有与亲和肽结合的IgG类物质,则会严重干扰分析结果,继而限制了这种由亲和肽介导的抗体定向固定技术的应用范围。
技术实现要素:
针对上述现有技术,本发明以基因工程技术表达带有光敏基团(4-苯甲酰基-L-苯丙氨酸,p-benzoylphenylalanine,简称Bpa)的Z亲和肽-Avitag融合蛋白并以BirA酶催化完成其生物素共价定点偶联,获得一种精准Fc位点偶联的生物试剂ZBpa-Biotin,由Z亲和肽导向Fc位点亲和偶联后,继而在365nm紫外光激发光敏基团与抗体生产共价键,实现Fc位点的生物素共价偶联标记的生物素化抗体。因一个IgG分子可结合两个单个的Z序列,本发明所提供的精准Fc位点的生物素化抗体,是每个IgG分子可定量结合两个Biotin分子,且是一种不可逆的共价偶联生物素抗体,不受pH、温度、有机溶剂及变性剂的影响,可实现固相载体表面所固定的IgG抗体是均一、Fab段充分暴露及保持高抗原结合活性的三维定向IgG抗体,且在实际应用中突破了被分析物中不能有结合Z亲和肽物质的限制。
本发明利用氨酰tRNA合成酶/抑制琥珀tRNA(aminoacyl-tRNA synthetase/amber suppressor tRNA,aaRS/suppressor tRNA)技术实现在蛋白质的翻译过程中即生物合成含光敏基团的目的蛋白质。
本发明采用的技术方案如下:
本发明的第一个目的是提供一种精准导向Fc位点偶联的生物试剂(简称ZBpa-Biotin),该生物试剂包括一Z亲和肽,其特点是:所述Z亲和肽的α1结构域处连接有4-苯甲酰基-L-苯丙氨酸,所述Z亲和肽的羧基末端残基处依次连接Avi-tag标签蛋白和多聚组氨酸纯化标签蛋白,其中所述Avi-tag标签蛋白上的赖氨酸残基上连接生物素或其衍生物。
优选的,从光照后与IgG抗体偶联效果来讲,所述α1结构域处连接有4-苯甲酰基-L-苯丙氨酸的部位为氨基酸的第17位置。第17位置是指在Z亲和肽的第16个氨基酸之后第17个氨基酸前的位置。
优选的,所述多聚组氨酸纯化标签蛋白为为6聚组氨酸(6×His)。
本发明的第二个目的是提供上述精准Fc位点偶联的生物试剂的制备方法,包括以下步骤:
(1)首先构建重组质粒pZTAG–Avitag表达载体:其中,目的基因的合成为:首先根据Z亲和肽基因序列,在Z亲和肽基因序列的α1结构域序列所需位点处插入琥珀密码子(TAG),然后在Z亲和肽基因序列下游末端、多聚组氨酸纯化标签基因序列置入Avitag基因序列,最后在上述基因序列的5'端和3'端分别设置限制性内切酶酶切位点,化学合成得到目的基因序列;
(2)然后利用原核微生物表达出重组蛋白ZBpa–Avitag;
(3)最后利用生物素连接酶(BirA酶)对重组蛋白ZBpa–Avitag生物素化,得到生物素化的重组蛋白ZBpa–Avitag,即为该生物试剂(ZBpa-Biotin)。
步骤(1)中,重组质粒表达载体的制备为本领域技术人员知晓的常规技术手段。基本步骤是:化学合成目的基因序列后,将其克隆至质粒中,即可获得相应的质粒表达载体。在本发明优选的一个具体实施例中,将目的基因序列亚克隆至pTBX1质粒中,获得重组质粒pZTAG–Avitag表达载体。
优选的,所述多聚组氨酸纯化标签基因序列为6聚组氨酸基因序列。
所述限制性内切酶并没有特别限定,可以根据需求进行设定。在本发明优选的一个具体实施例中,所述目的基因的5'端设置NdeI限制性内切酶酶切位点,所述目的基因的3'端设置XhoI限制性内切酶酶切位点;在本发明优选的一个具体实施例中,所述目的基因的序列为:
5’-CATATGGTAGACAACAAATTCAACAAAGAACAACAAAACGCGTTCTATGAGATCTAGCATTTACCTAACTTAAACGAAGAACAACGAAACGCCTTCATCCAAAGTTTAAAAGATGACCCAAGCCAAAGCGCTAACCTTTTAGCAGAAGCTAAAAAGCTAAATGATGCTCAGGCGCCGAAAGGTCTGAACGATATCTTCGAAGCTCAGAAAATCGAATGGCACGAACATCATCATCATCATCATTAACTCGAG-3’,如SEQIDNO.1所示。其中,双下划线表示的碱基是琥珀密码子,单下划线表示的序列是限制性内切酶酶切位点,粗体序列表示的是6聚组氨酸基因序列,斜体序列表示Avi-tag的氨基酸基因序列。
步骤(2)中,重组蛋白ZBpa–Avitag包括Z亲和肽,所述Z亲和肽的α1结构域处连接有4-苯甲酰基-L-苯丙氨酸,所述Z亲和肽的羧基末端残基处依次连接Avi-tag标签蛋白和多聚组氨酸纯化标签蛋白。
为实现目的蛋白在蛋白质的翻译过程中即生物合成含光敏基团的目的蛋白质,步骤(1)中的表达载体与含有氨酰tRNA合成酶编码基因的pEVOL-pBpF共转化至原核生物中,获得基因工程菌。利用该基因工程即可顺利表达出含有光敏基团的重组蛋白ZBpa–Avitag。为顺利合成含光敏基团的目的蛋白质,氨酰tRNA合成酶/抑制琥珀tRNA(aminoacyl-tRNA synthetase/amber suppressor tRNA,aaRS/suppressor tRNA)技术已经是比较常规的技术。利用aaRS/suppressor tRNA技术在蛋白质的翻译过程中在琥珀密码子(TAG)处翻译不会终止且翻译成非天然氨基酸(一般是含有特殊基团的非天然氨基酸,如Bpa含光敏基团),肽链继续翻译至目的蛋白。
本发明中pEVOL-pBpF质粒为本领域技术人员可以常规得到的,例如可通过商业途径得到。
将上述基因工程菌30~37℃经过12~18h培养、活化后,转接到2×YT培养基中,37℃培养至OD600为0.6–0.8;然后加入4-苯甲酰基-L-苯丙氨酸,继续培养0.5~2h;再加入IPTG(异丙基-β-D-硫代半乳糖苷)和阿拉伯糖,30~37℃诱导培养5~7h;经过上述培养的工程菌离心收集菌体,采用缓冲液重悬,冻融裂解菌体;离心去除菌体碎片后,采用层析柱纯化目的蛋白。
其中,所述2×YT培养基为本领域常规知晓的培养基。
步骤(3)中,利用BirA酶体外反应体系对重组蛋白ZBpa–Avitag进行生物素化,再通过层析柱和超滤离心管获得生物素化的重组蛋白,即ZBpa-Biotin。
所述BirA酶体外反应体系如下:buffer A,buffer B,ZBpa–Avitag,生物素连接酶,25~35℃反应5~7h;所述buffer A为0.5M的N-二(羟乙基)甘氨酸,pH 8.3;所述buffer B为pH 8.0的溶液中,含有100mM ATP,100mM乙酸镁,200mM生物素。
优选的,所述buffer A,buffer B和ZBpa–Avitag的体积比为1:1:4,所述BirA酶添加量为40~50U/μL。
本发明的第三个目的是提供一种精准导向Fc位点偶联的生物素化抗体,该抗体是由所述生物试剂中Z亲和肽导向的4-苯甲酰基-L-苯丙氨酸通过共价键与IgG抗体Fc段相连接。
本发明的第四个目的是所述精准导向Fc位点偶联的生物素化抗体的制备方法,包括以下步骤:将IgG抗体与所述生物试剂混合,先导向Fc位点的生物亲和偶联,继而在365nm紫外光照射下激发光敏基团与IgG抗体的Fc段的氨基产生共价键,即可得到精准导向Fc位点偶联的生物素化抗体。
本发明的第五个目的是提供上述生物试剂在三维定向固定IgG抗体中的应用。该应用方法是:所述生物试剂中的4-苯甲酰基-L-苯丙氨酸通过共价键与IgG抗体Fc段相连接,通过生物素-亲和素作用,从而实现三维定向固定IgG抗体。
具体步骤如下:
IgG抗体与所述生物试剂按照1:4~6分子数比例混合,室温振荡20~40min后,将上述反应体系置于冰上,365nm紫外照射2~4h,照射后产物用超滤离心管除去多余的ZBpa–Biotin分子,即可得到精准导向Fc位点偶联的生物素化抗体。
所述室温是指18~37℃。
本发明的第六个目的是提供一种免疫传感芯片,该免疫芯片包括一基底片,所述基底片上固定有亲和素,亲和素与所述生物素化抗体中的生物素相结合。
其中,基底片上固定有亲和素为本领域的公知常识,在此不再赘述。所述基底片并没有特别限定,本发明中的一个具体实施方式为CM5芯片,该芯片可常规得到。在本发明中的一个具体实施方式中,所述亲和素为链霉亲和素(SA)。
该芯片可用于生物样本的分析测定,主要是指检测相关抗原,所述相关抗原是指能够与IgG抗体特异性结合的物质,比如:癌胚抗原(CEA)、甲胎蛋白(AFP)等疾病标记物。
由背景技术可知,基于各种生物素衍生物(活化生物素)与抗体分子内的氨基酸残基(氨基、羰基)之间的共价偶联技术,一个抗体分子可连接多个生物素分子,但生物素与抗体分子内的活性基团是一种随机结合方式,当反应基团的氨基酸残基位于抗体Fab或附近时,导致固相化的生物素化抗体的Fc端向外而掩盖Fab段,仍不能保证所吸附的抗体是定向固定的抗体。
本发明以基因工程技术表达带有光敏基团的Z亲和肽-Avitag融合蛋白并BirA酶催化完成ZBpa-Avitag融合蛋白自身的生物素共价定点偶联,获得一种可精准导向Fc位点偶联的ZBpa-Biotin,继而在365nm紫外光激发下实现Fc位点的生物素共价标记的抗体。本发明所提供的精准Fc位点的生物素化抗体,是一种Fc位点不可逆的共价偶联,不受pH、温度、有机溶剂及变性剂的影响,可实现在亲和素包被的载体表面所固定的IgG抗体是均一、Fab段充分暴露及保持高抗原结合活性的三维定向IgG抗体,且在实际应用中突破了被分析物中不能有结合Z亲和肽物质的限制。
附图说明
图1 ZBpa–Biotin介导的精准Fc位点生物素化抗体示意图。
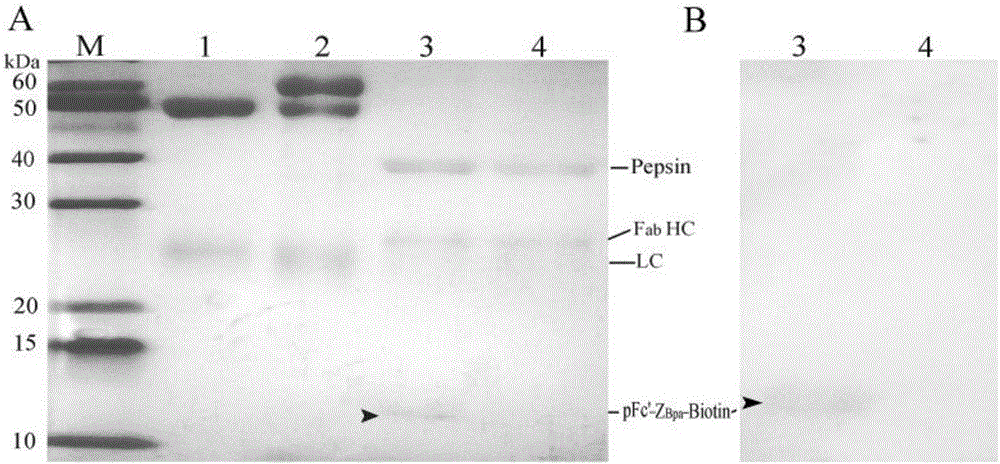
图2 ZBpa–Biotin精准偶联抗体Fc位点电泳及Western分析。
图3 photo-biotinylated IgG的三维定向固定及应用示意图。
图4 NHS-biotinylated IgG的三维定向固定及应用示意图。
图5固相化的photo-biotinylated IgG及NHS-biotinylated IgG分析效能比较。
具体实施方式
若无特别说明,所涉及的试剂、试验方法均为常规法试剂、常规方法。
本发明中的术语解释:
Fab段:抗原结合片段(fragment of antigen binding,Fab),相当于抗体分子的两个臂,由一个完整的轻链和重链的VH和CH1结构域组成。
Fc段/Fc:可结晶段(fragment crystallizable,Fc)相当于Ig的CH2和CH3结构域,是Ig与效应分子或者细胞相互作用的部位。
ZZ亲和肽:是源于葡萄球菌蛋白A的人工合成的两个重复序列,能结合IgG抗体Fc段。
Z亲和肽:是源于葡萄球菌蛋白A的人工合成的单序列,能结合IgG抗体Fc段。
Z亲和肽的α1结构域是指:Z亲和肽氨基酸序列的第4–18位。
Avi-tag是一个由15个氨基酸残基组成的短肽标签,在体内或体外都能被生物素连接酶在赖氨酸残基连接上一个生物素,从而实现蛋白的生物素化。
下面结合实施例对本发明进一步说明。
如图1所示,一种精准导向Fc位点偶联的生物试剂(简称ZBpa-Biotin),该生物试剂包括一Z亲和肽,其特点是:所述Z亲和肽的α1结构域处连接有4-苯甲酰基-L-苯丙氨酸,所述Z亲和肽的羧基末端残基处依次连接Avi-tag标签蛋白和多聚组氨酸纯化标签蛋白,其中所述Avi-tag标签蛋白上的赖氨酸残基上连接生物素或其衍生物(其衍生物也指活化生物素)。
实施例1重组质粒pZTAG–Avitag表达载体的构建
为实现利用aaRS/suppressor tRNA技术实现在蛋白质的翻译过程中即生物合成含光敏基团的目的蛋白质,及利用BirA/Avitag技术实现生物素在目的蛋白特定位点的共价偶联:
首先根据Z亲和肽基因序列,通过分析优化设计,在Z亲和肽的α1结构域序列适宜位点置换插入琥珀密码子(TAG)。
本发明利用BirA/Avitag技术实现生物素在目的蛋白特定位点的共价偶联,在Z亲和肽基因序列下游、6×His纯化标签上游置入Avitag基因序列。
上述目的基因序列的5'端设置NdeI限制性内切酶酶切位点,3'端设置XhoI限制性内切酶酶切位点,化学合成法合成含有6×His纯化标签的ZTAG-Avitag基因序列(如SEQIDNO.1所示),目的基因序列亚克隆至pTBX1质粒的NdeI/XhoI位置中,获得重组pZTAG-Avitag质粒表达载体。
实施例2重组蛋白ZBpa–Avitag的表达与纯化
(1)重组表达质粒pZTAG–Avitag和质粒pEVOL-pBpF氯化钙法共转化感受态菌E.coli BL21(DE3),涂布于含氨苄(100μg/mL)和氯霉素(50μg/mL)的LB固体培养平板,37℃过夜培养,筛选阳性克隆,获得基因工程菌;
(2)挑取单克隆菌落至10mL液体LB培养基(氨苄100μg/mL,氯霉素50μg/mL),37℃过夜培养、活化;
(3)活化的细胞转接到50mL 2×YT培养基中,37℃培养至OD600为0.6–0.8;加入终浓度为300μM的Bpa,继续培养1h;再加入终浓度分别为0.5mM的IPTG和0.2%的阿拉伯糖,37℃诱导培养6h;
(4)上述培养的基因工程菌经4℃,6000rpm离心15min后,收集菌体,以5mL 20mM PBS(含20mM咪唑,150mM NaCl,pH 8.0)缓冲液重悬,-70℃冰箱反复冻融5次以裂解细胞;8000rpm离心15min去除菌体碎片;0.45μm滤膜过滤上清后,以HisTrap层析柱纯化目的蛋白。20mM PBS(含250mM咪唑,150mM NaCl,pH 8.0)缓冲液洗脱并收集洗脱组分。
(5)Millipore超滤离心管(截留分子量为10kDa)8000rpm离心脱盐浓缩至合适体积,冷冻干燥,称重,可从1L菌体发酵液纯化得到约10mg目的蛋白。
实施例3重组蛋白ZBpa–Avitag体外生物素化的制备
本实施例中利用BirA酶体外反应体系对重组蛋白ZBpa–Avitag进行生物素化,再通过HisTrap层析柱和Millipore超滤离心管获得生物素化的重组蛋白ZBpa–Avitag。
步骤如下:
(1)采用BirA酶反应体系如下:25μL buffer A,25μL buffer B,100μL ZBpa–Avitag,45U/μL BirA,250μL反应体积30℃反应6h;
(2)将上述反应后的混合液依据实施例2步骤(4)和(5),利用HisTrap层析柱和Ultra-4(NMWL:10kDa)超滤离心管即可获得生物素化的重组蛋白ZBpa–Avitag即ZBpa–Biotin,并且去除了多余的生物素和BirA酶;
(3)生物素化产物ZBpa–Biotin经15%SDS-PAGE分离后,移至NC膜,转膜结束后,经5%BSA溶液封闭30min,TBST(含0.1M Tris pH 7.5,0.05%Tween20)洗涤后,膜浸入SA-HRP(辣根过氧化物酶标记链霉亲和素,1:1000)溶液中,37℃温育结合30min,TBST洗涤3次,每次5min,加入显色底物TMB(TMB为常规显色液)显色。
(4)重组蛋白ZBpa–Avitag的生物素化效率测定:利用HABA法检测生物素标记效果,检测结果显示通过BirA酶在体外进行生物素化后,有98%的蛋白ZBpa–Avitag结合了生物素,即ZBpa–Biotin。
所述buffer A为0.5M的N-二(羟乙基)甘氨酸(pH 8.3);所述buffer B为pH 8.0的溶液中,含有100mM ATP,100mM乙酸镁,200mM biotin。
实施例4ZBpa–Biotin介导的精准Fc位点生物素化抗体
本实施例基于ZBpa–Biotin通过生物亲和性的特性可以与IgG定向结合,由于Bpa是光敏基团,在365nm紫外照射条件下,促使活化的Bpa与邻近的IgG的氨基形成共价键,可实现生物素精准共价偶联抗体的Fc位点(图1所示)。
步骤如下:
(1)IgG抗体与ZBpa–Biotin按照1:5分子数比例混合于石英比色皿,室温轻轻振荡30min。
(2)将上述石英皿置于冰上,365nm紫外照射3h,照射后产物用Ultra-0.5(NMWL:100kDa)超滤离心管除去多余的ZBpa–Biotin分子,将最终产物即生物素化抗体命名为photo-biotinylated IgG。
(3)photo-biotinylated IgG首先12%非变性SDS-PAGE和变性SDS-PAGE分析,然后进行Fc位点偶联确证:胃蛋白酶溶解于水解(50mM醋酸钠,10mM EDTA,pH 3.3)缓冲液中,使其终浓度为100μg/mL;100μL胃蛋白酶溶液与100μL photo-biotinylated IgG混合,37℃反应2h;15%SDS-PAGE分离后移至NC膜,转膜结束后,经5%BSA溶液封闭30min,TBST(含0.1M Tris pH 7.5,0.05%Tween20)洗涤后,膜浸入SA-HRP(1:1000)溶液中,37℃温育结合30min,TBST洗涤3次,每次5min,加入显色底物TMB显色。实验结果表明,photo-biotinylated IgG水后的12KD条带明显着色,表明ZBpa–Biotin不与重链的VH,CH1和铰链区结合,而与IgG的Fc段结合,且90%的IgG分子共价偶联了ZBpa–Biotin(图2所示)。
实施例6ZBpa–Biotin介导的精准Fc位点生物素化抗体的应用
本实施例是基于CEA(癌胚抗原)作为临床多种癌症诊断的生物标记物,通过对CEA的检测来间接评估定向固定photo-biotinylated IgG在生物传感方面的应用,并以随机偶联生物素化的抗体为对照(NHS-biotinylated-兔抗CEA IgG)。
步骤如下:
(1)兔抗CEA IgG与过量的ZBpa–Biotin室温孵育30min,紫外照射3h,得到产物photo-biotinylated-兔抗CEA IgG,Ultra-0.5超滤离心管离心,醋酸缓(10mM,pH 3.2)冲液作为离心时的洗涤液,分离除去多余的ZBpa–Biotin和非共价结合的兔抗CEA IgG。
(2)5μM of photo-biotinylated-兔抗CEA IgG以30μL/min流速,PBS(10mM,pH 8.0)缓冲液作为流动相,通过链霉亲和素(SA)-生物素相互作用结合到固定有SA的CM5芯片,产生定向固定的photo-biotinylated IgG免疫传感芯片,如图3所示。
(3)以化学共价偶联法的NHS-biotinylated IgG为对照,即5μM of NHS-biotinylated-兔抗CEA IgG以30μL/min流速,PBS(10mM,pH 8.0)缓冲液作为流动相,通过链霉亲和素(SA)-生物素相互作用结合到固定有SA的CM5芯片,产生定向固定的NHS-biotinylated IgG免疫传感芯片,如图4所示。
(5)稀释0至200ng/mL不同系列浓度的鼠抗CEA做为测试样品,以PBS(10mM,pH8.0)缓冲液作分流动相,醋酸缓(10mM,pH 3.2)冲液用于重生芯片表面。结果显示photo-biotinylated IgG免疫传感芯片的线性检测范围为2–100ng/mL,LOD值2ng/mL;NHS-biotinylated IgG免疫传感芯片的线性检测范围为10–80ng/mL,LOD值为10ng/mL,如图5所示。
(6)以PBS(10mM,0.05%Tween20,pH 8.0)稀释人血清100倍,加入不同量的CEA,使其终浓度分别为10ng/mL、20ng/mL、40ng/mL、80ng/mL,photo-biotinylated IgG免疫传感芯片分析上述样品,回收率为103.40%–109.53%,RSD为4.51%–13.50%,结果显示血清内的内源性抗体不干扰photo-biotinylated IgG免疫传感芯片对CEA测定,表明该免疫传感芯片可以用于生物样本的分析测定。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!