1,3‑二氮杂环并吡啶季铵盐类化合物及其中间体化合物、制备方法和应用与流程
本发明属于有机化学技术领域,具体涉及1,3-二氮杂环并吡啶季铵盐类化合物及其中间体化合物、制备方法和应用。
背景技术:
化学合成丰富了人们物质世界的同时,不可避免地带来诸多问题,包括资源和能源的浪费、环境的污染。而如何应对化学合成带来的污染已成为现代化学工作者急需思考的问题。理想的化学合成应该是一个绿色环保和高效低碳的过程,美国环境保护组织(U.S.EPA)提出了“绿色化学”概念,认为在设计合成产物和路线时候,应该尽可能的消除或者减少有害物质的产生,遵循原子经济性和过程绿色性等原则。
很多药物属于含氮杂环化合物,氮杂环在药物中扮演着十分重要的角色。氮杂环化合物具有丰富多样的生物活性,如抗癌,抗病毒,治疗心脑血管疾病,镇静安眠等等。咪唑并吡啶作为含氮杂环化合物家族中较为重要的一员,已经在很多临床药物中发挥着重要的作用,已经商品化的药物包括法倔唑(fadrozole),唑吡旦(zolpidem)、莫沙帕明(mosapramine)、奥普力农(olprinone)、佐利咪啶(zolimidine)等。
另外,自从吡虫啉(imidacloprid)在1980s年因其杀虫活性被报道以来,新烟碱型类似物因其良好的杀虫活性以及较低的哺乳动物毒性,迅速发展并成为继有机磷农药、氨基甲酸盐及除虫菊酯之后的第四代新型农药。其中N-苄基的硝基烯酮缩胺(NBNKAs),作为新烟碱中的一类,可以用于具有潜在生物活性产物的合成。
季铵盐类化合物由于其特殊的结构,使得溶解性与无机盐性质相似,自然界中存在的季铵盐,不少具有一定的生物活性,有些季铵盐可用作药物、农药以及化学反应中的相转移催化剂等。例如,矮壮素是一种植物生长调节剂,氯化苄基三乙基铵和硫酸氢四丁基铵都是优良的相转移催化剂。将本身就具有活性的色酮类化合物与N-苄基硝基烯酮缩胺进行拼合而合成季铵盐类化合物。可使产物获得更为丰富的性能。目前国内外均有吡啶类抗癌药物的文献及专利报道,如:
CN201480033183.5(程炳善)公开了一种氨基吡啶衍生物或其药用可接受盐和包括相同活性成分的药物组合物。
CN201410158407.7(郑辉)公开了一种糖基吡啶类化合物及其制备和应用。
CN201510152615.0(江岳恒)公开了一种嘧啶或吡啶类化合物、其制备方法和医药用途。
CN201410664267.0(兰清源)公开了一种咪唑并吡啶类化合物的用途。
CN201280064532.0(李庚翊)公开了一种作为酪氨酸激酶抑制剂的新咪唑并吡啶衍生物。
技术实现要素:
本发明的目的是为了解决现有技术的不足,提供1,3-二氮杂环并吡啶季铵盐类化合物及其中间体化合物、制备方法和应用,该类化合物及其中间体具有良好的抗肿瘤活性,极具应用前景。
为实现上述目的,本发明采用的技术方案如下:
1,3-二氮杂环并吡啶季铵盐类化合物,该化合物的结构如式(Ⅳ)所示:
式(Ⅳ)中,R为卤素原子、氢原子、烷基、烷氧基、芳基、稠芳基、三氟甲基、硝基、氰基或胺基;
Ar为苯基、吡啶基、噻唑基的多取代或单取代基团,取代基为卤素原子、氢原子、烷基、烷氧基、胺基、氰基、硝基、芳基或稠芳基;
X-为氯离子、溴离子、碘离子、高氯酸根、硫酸根、苯甲酸根、枸橼酸根、乳酸根、苹果酸根、硝酸根、碳酸根、磷酸根、醋酸根、甲磺酸根、三氟甲磺酸根、对甲苯磺酸根、苯磺酸根。
本发明还提供一种上述1,3-二氮杂环并吡啶季铵盐类化合物的制备方法,包括如下步骤:
在室温或加热条件下,在溶剂中,将如式(I)所示的色酮-3-甲醛类化合物与如式(II)所示的N-苄基硝基烯酮缩胺类化合物进行迈克尔(Michael)加成环化反应至沉淀的量不再增加,然后保持温度不变,加入酸进行开环反应,制得如式(Ⅳ)所示1,3-二氮杂环并吡啶季铵盐类化合物;
其中,式(I)中,R为卤素原子、氢原子、烷基、烷氧基、芳基、稠芳基、三氟甲基、硝基、氰基或胺基;
式(II)中,Ar为苯基、吡啶基、噻唑基的多取代或单取代基团,取代基为卤素原子、氢原子、烷基、烷氧基、胺基、氰基、硝基、芳基或稠芳基;
所述的溶剂为有机溶剂和/或无机溶剂;
所述的酸为有机酸或无机酸。
本发明另外提供一种上述1,3-二氮杂环并吡啶季铵盐类化合物的制备方法,包括如下步骤:
步骤(1),用如式(I)所示的色酮-3-甲醛类化合物与式(II)结构的如式(II)所示的N-苄基硝基烯酮缩胺类化合物在溶剂中,室温或加热,在碱性催化剂或无催化剂条件下进行迈克尔(Michael)加成环化反应,得到如式(III)所示的色酮并吡啶类中间体化合物;
步骤(2),将步骤(1)得到的如式(III)所示的色酮并吡啶类中间体化合物与酸在溶剂中,在室温或加热条件下进行开环反应,制得如式(Ⅳ)所示1,3-二氮杂环并吡啶季铵盐类化合物;
其中,式(I)中,R为卤素原子、氢原子、烷基、烷氧基、芳基、稠芳基、三氟甲基、硝基、氰基或胺基;
式(II)中,Ar为苯基、吡啶基、噻唑基的多取代或单取代基团,取代基为卤素原子、氢原子、烷基、烷氧基、胺基、氰基、硝基、芳基或稠芳基;
式(III)中,R为卤素原子、氢原子、烷基、烷氧基、芳基、稠芳基、三氟甲基、硝基、氰基或胺基;Ar为苯基、吡啶基、噻唑基的多取代或单取代基团,取代基为卤素原子、氢原子、烷基、烷氧基、胺基、氰基、硝基、芳基或稠芳基;
步骤(1)所述的溶剂为有机溶剂和/或无机溶剂;
步骤(2)所述的溶剂为有机溶剂和/或无机溶剂;
所述的酸为有机酸或无机酸。
本发明还提供1,3-二氮杂环并吡啶季铵盐类化合物的中间体化合物,该化合物的结构如式(Ⅲ)所示:
式(Ⅲ)中,R为卤素原子、氢原子、烷基、烷氧基、芳基、稠芳基、三氟甲基、硝基、氰基或胺基;
Ar为苯基、吡啶基、噻唑基的多取代或单取代基团,取代基为卤素原子、氢原子、烷基、烷氧基、胺基、氰基、硝基、芳基或稠芳基。
本发明同时提供1,3-二氮杂环并吡啶季铵盐类化合物的中间体化合物的制备方法,包括如下步骤:
用如式(I)所示的色酮-3-甲醛类化合物与式(II)结构的如式(II)所示的N-苄基硝基烯酮缩胺类化合物在溶剂中,室温或加热,在碱性催化剂或无催化剂条件下进行迈克尔(Michael)加成环化反应,得到如式(III)所示的色酮并吡啶类中间体化合物,即1,3-二氮杂环并吡啶季铵盐类化合物的中间体化合物;
其中,式(I)中,R为卤素原子、氢原子、烷基、烷氧基、芳基、稠芳基、三氟甲基、硝基、氰基或胺基;
式(II)中,Ar为苯基、吡啶基、噻唑基的多取代或单取代基团,取代基为卤素原子、氢原子、烷基、烷氧基、胺基、氰基、硝基、芳基或稠芳基;
步骤(1)所述的溶剂为有机溶剂和/或无机溶剂。
本发明还提供上述1,3-二氮杂环并吡啶季铵盐类化合物作为制备抗肿瘤药物的应用。
本发明还同时提供上述1,3-二氮杂环并吡啶季铵盐类化合物的中间体化合物作为制备抗肿瘤药物的应用。
本发明中室温为20-25℃。
本发明中的有机溶剂可以为单一的有机溶剂,也可以为混合的有机溶剂。
本明与现有技术相比,其有益效果为:
本发明利用简单易得的原料(I)与(II)出发,通过一步或分步反应得到一系列结构新颖的1,3-二氮杂环并吡啶季铵盐类化合物(IV)以及色酮并吡啶类中间体化合物(III)。本发明的合成工艺简单绿色环保、高效,条件温和,产率高,且满足原子经济原则。本发明1,3-二氮杂环并吡啶季铵盐类化合物及其中间体化合物均具有良好的抗肿瘤活性,应用前景显著。
附图说明
图1为化合物19的高分辨质谱;
图2为化合物58的单晶结构图。
具体实施方式
下面结合实施例对本发明作进一步的详细描述。
本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂、仪器等未注明生产厂商者,均为可以通过购买获得的常规产品。
本发明原料可通过本领域的公知的方法来制备或通过市售产品获得。
以下进一步解释本发明的1,3-二氮杂环并吡啶季铵盐类化合物合成的一般方法,但本发明1,3-二氮杂环并吡啶季铵盐类化合物的制备方法不局限于此。
合成本发明的1,3-二氮杂环并吡啶季铵盐类化合物的两种方法如下:
第一种方法,用式(I)结构的色酮-3-甲醛类化合物与式(II)结构的N-苄基硝基烯酮缩胺类化合物在适当溶剂中,有/无催化剂条件,室温/加热反应。TLC检测反应完全后,用适当溶剂洗涤或重结晶制备出色酮并吡啶类中间体化合物(III),然后再将中间体在酸作用下转化为1,3-二氮杂环并吡啶季铵盐类化合物(IV),具体反应如下:
在式(I)中,R为卤素原子、氢原子、烷基、烷氧基、芳基、稠芳基、三氟甲基、硝基、氰基或胺基。
在式(II)中,Ar为苯基、吡啶基、噻唑基的多取代或单取代基团,取代基为卤素原子、氢原子、烷基、烷氧基、胺基、氰基、硝基、芳基或稠芳基。
在式(IV)中,X-为氯离子、溴离子、碘离子、高氯酸根、硫酸根、苯甲酸根、枸橼酸根、乳酸根、苹果酸根、硝酸根、碳酸根、磷酸根、醋酸根、甲磺酸根、三氟甲磺酸根、对甲苯磺酸根或苯磺酸根。
其中第一步,先由化合物(I)与化合物(II)合成色酮并吡啶类中间体化合物(III)。
反应中,溶剂不作具体规定,常为乙醇、丙酮、甲醇、水、乙酸乙酯、氯仿、二氯甲烷、N,N-二甲基甲酰胺、四氢呋喃、甲苯、1,4-二氧六环、乙腈中的一种或几种溶剂的混合溶剂;催化剂不作具体规定,常为无催化剂或碱性催化剂(哌啶、三乙胺、碳酸铯、碳酸钾、碳酸钠、碳酸氢钠、氢氧化钠),催化剂的用量没有具体要求;反应温度不作具体规定,常为20-150℃;反应时间不作具体规定,常为10分钟至12小时。反应过程采用TLC检测跟踪,反应完全后过滤取固体。产物重结晶或洗涤分离用溶剂不作具体规定,常为乙醇和水的混合溶剂、乙醇、乙醚。
反应中,对于1摩尔的式(II)化合物,式(I)化合物用量优选为1.2–2摩尔,催化剂的用量优选为0.01-0.5摩尔。反应的收率一般在90–98%。
式(I)的化合物是公知的,是可商购或者可按公知的方法制备。
式(II)的化合物是公知的,或者可按照公知的方法制备。
第二步,通过色酮并吡啶类中间体化合物(III)与酸反应合成1,3-二氮杂环并吡啶季铵盐类化合物(IV)
反应中,溶剂不作具体规定,常为水、乙醇、丙酮、甲醇、乙酸乙酯、氯仿、二氯甲烷、N,N-二甲基甲酰胺、四氢呋喃、甲苯、1,4-二氧六环、乙腈中的一种或几种溶剂的混合溶剂;反应所用酸可为无机酸或有机酸,常为盐酸、氢溴酸、氢碘酸、高氯酸、硫酸、苯甲酸、枸橼酸、乳酸、苹果酸、硝酸、碳酸、磷酸、醋酸、甲磺酸、三氟甲磺酸、对甲苯磺酸、苯磺酸;加入酸后反应液pH值维持酸性,反应酸性不作具体规定,常为pH=2–4;反应温度不作具体规定,常为20–150℃;反应时间不作具体规定,常为10分钟至6小时。反应过程采用TLC检测跟踪,反应完全后过滤取固体。产物重结晶或洗涤用溶剂不作具体规定,常为乙醇和水的混合溶剂、乙醇、乙醚。
反应中,对于1摩尔的式(III)化合物,酸的用量优选为1.2–2摩尔。反应的收率常大于99%。
第二种方法,用式(I)结构的色酮-3-甲醛类化合物与式(II)结构的N-苄基硝基烯酮缩胺类化合物在一定溶剂中反应至沉淀的量不再增加,后加酸直接得到化合物(IV),反应式如下:
在式(I)中,R为卤素原子、氢原子、烷基、烷氧基、芳基、稠芳基、三氟甲基、硝基、氰基或胺基。
在式(II)中,Ar为苯基、吡啶基、噻唑基的多取代或单取代基团,取代基为卤素原子、氢原子、烷基、烷氧基、胺基、氰基、硝基、芳基或稠芳基。
在式(IV)中,X-为氯离子、溴离子、碘离子、高氯酸根、硫酸根、苯甲酸根、枸橼酸根、乳酸根、苹果酸根、硝酸根、碳酸根、磷酸根、醋酸根、甲磺酸根、三氟甲磺酸根、对甲苯磺酸根或苯磺酸根。
反应中,溶剂不作具体规定,常为水、乙醇、丙酮、甲醇、乙酸乙酯、氯仿、二氯甲烷、N,N-二甲基甲酰胺、四氢呋喃、甲苯、1,4-二氧六环、乙腈中的一种或几种溶剂的混合溶剂;反应无需催化剂;反应温度不作具体规定,常为20–150℃;反应时间不作具体规定,常为20分钟至12小时;反应至有大量沉淀生成后,冷却至室温后再加入酸或者不冷却直接加入酸,反应所用酸可为无机酸以及有机酸,常为盐酸、高氯酸、氢溴酸、氢氟酸、氢碘酸、硫酸、硝酸、磷酸、碳酸、乙酸、苯甲酸;加入酸后反应液pH值维持酸性,常为pH=2–4。反应过程采用TLC检测跟踪,反应完全后过滤取固体。产物重结晶或洗涤分离用溶剂不作具体规定,常为乙醇和水的混合溶剂、乙醇、酸性乙醇、酸的水溶液、乙醚。
反应中,对于1摩尔的式(II)化合物,式(I)化合物用量为1.2–2摩尔,酸的用量为1.2–2摩尔。
反应的收率一般在90–98%。
式(I)的化合物是公知的,可商购或者可按公知的方法制备。
式(II)的化合物是公知的,或者可按照公知的方法制备。
对于本发明产品的干燥方法本发明没有具体要求,可采用烘干、自然干燥、红外灯下干燥等干燥方法。
下面结合部分具体实施方案对本发明进行详述。这些实施例仅用于说明本发明,而不用于限制本发明的范围。实施例中的制备方案仅为优选方案,但本发明并不局限于优选制备方案。
第一部分合成实施例
一、式(III)色酮并吡啶类中间体化合物的合成
实施例1:合成3-(4-甲氧基苄基)-4-硝基-1,2,3,11a-四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物1)
在25毫升圆底烧瓶中加入1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷(1mmol,249mg)和 色酮-3-甲醛(2mmol,348mg)后,加入乙醇(17mL)磁力搅拌下加热至75℃下,反应20分钟。TLC监测反应,待原料点完全消失后,过滤后用少量乙醇洗涤沉淀,得黄色固体,红外灯下干燥产品3-(4-甲氧基苄基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物1),产率96%。熔点:229–230℃。
波谱数据为:1H NMR(600MHz,DMSO-d6):δ=7.91(s,1H,CH),7.82–7.83(m,1H,ArH),7.60–7.63(m,1H,ArH),7.31(d,J=8.3Hz,2H,ArH),7.16–7.19(m,1H,ArH),7.08–7.10(m,1H,ArH),6.95(d,J=8.5Hz,2H,ArH),6.42(s,1H,CH),4.68–4.80(m,2H,CH2),4.11–4.15(m,1H,CH2),3.85–3.89(m,2H,CH2),3.78–3.79(m,1H,CH2),3.75(s,3H,CH3);13C HMR(150MHz,DMSO-d6):δ=179.3,159.4,156.6,154.8,136.5,130.6,129.7,127.7,127.3,123.5,123.2,118.6,114.5,112.2,110.5,85.9,55.6,54.1,50.6,45.4;HRMS(TOF ES+):m/z calcd for C22H20N3O5+[M+H]+,406.1397;found,406.1398.
实施例2:合成3-(4-氯苄基)-9-氟-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物2)
在25毫升圆底烧瓶中加入1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷(1mmol,254mg)和6-氟色酮-3-甲醛(1.5mmol,288mg)后,加入乙醇和水=5:1的混合溶剂(17毫升)磁力搅拌下加热至75℃下,反应30分钟。TLC监测反应,待原料点完全消失后,过滤后用少量乙醇和水=10:1的混合溶剂洗涤沉淀,得黄色固体,红外灯下干燥后得到产品3-(4-氯苄基)-9-氟-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物2),产率96%。熔点:236–237℃。
波谱数据为:1H NMR(500MHz,DMSO-d6):δ=7.93(s,1H,CH),7.48–7.53(m,2H,ArH),7.41–7.46(m,4H,ArH),7.15–7.17(m,1H,ArH),6.42(s,1H,CH),4.70–4.88(m,2H,CH2),4.12–4.16(m,1H,CH2),3.88–3.92(m,2H,CH2),3.79–3.83(m,1H,CH2);13C HMR(125MHz,DMSO-d6):δ=178.5,157.8(d,1JC–F=240.0Hz),155.1,152.8,135.2,132.7,131.1,129.9,128.9,124.4(d,3JC–F=6.3Hz),123.7(d,2JC–F=23.8Hz),120.8(d,3JC–F=7.5Hz),112.3(d,2JC–F=23.8Hz),111.4,110.6,86.0,54.4,51.0,45.6;HRMS(TOF ES+):m/z calcd for C21H16ClFN3O4+[M+H]+,428.0808;found,428.0809.
实施例3:合成9-氯-4-硝基-3-(4-(三氟甲基)苄基)-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物3)
在25毫升圆底烧瓶中加入2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷(1mmol,479mg)和6-氯-3-甲酰基色酮(1.2mmol,250mg)后,加入乙腈(17毫升)磁力搅拌下加热至80℃下,反应10分钟。TLC监测反应,待原料点完全消失后,过滤后用少量乙醇洗涤沉淀,得黄色固体,红外灯下干燥得产品9-氯-4-硝基-3-(4-(三氟甲基)苄基)-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物3),产率95%。熔点:243–244℃。
波谱数据为:1H NMR(500MHz,DMSO-d6):δ=7.94(s,1H,CH),7.75–7.77(m,3H,ArH),7.62–7.65(m,3H,ArH),7.16(d,J=8.5Hz,1H,ArH),6.48(s,1H,CH),4.79–4.99(m,2H,CH2),4.17–4.18(m,1H,CH2),3.92–3.95(m,2H,CH2),3.83–3.87(m,1H,CH2);13C HMR(125MHz, DMSO-d6):δ=178.5,155.3,155.2,141.3,136.0,131.3,128.5(d,3JC–F=31.3Hz),128.5,127.3,125.8(m),123.7–125.8(m),124.7,121.0,111.2,110.6,86.2,55.0,51.2,45.7;HRMS(TOF ES+):m/z calcd for C22H16ClF3N3O4+[M+H]+,478.0776;found,478.0776.
实施例4:合成4-硝基-3-(4-硝基苄基)-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物4)
在25毫升圆底烧瓶中加入1-(4-硝基苄基)-2-(硝基亚甲基)咪唑烷(1mmol,264mg)和色酮-3-甲醛(2mmol,348mg)后,加入丙酮(17mL)磁力搅拌下室温(20-25℃)反应12小时。TLC监测反应,待原料点完全消失后,过滤后用少量丙酮洗涤沉淀,得黄色固体,红外灯下干燥产品4-硝基-3-(4-硝基苄基)-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物4),产率96%。熔点:258–259℃。
高分辨质谱C21H17N4O6+[M+H]+,理论值421.1143;实测值,421.1140。
实施例5:合成4-硝基-3-(4-(三氟甲基)苄基)-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物5)
在25毫升圆底烧瓶中加入2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷(1mmol,479mg)和色酮-3-甲醛(2mmol,348mg)后,然后依次加入哌啶(0.1mmol,85mg)加入DMF(17毫升)磁力搅拌下加热至150℃下,反应10分钟。TLC监测反应,待原料点完全消失后,过滤后用少量乙醇洗涤沉淀,得黄色固体,红外灯下干燥得产品4-硝基-3-(4-(三氟甲基)苄基)-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物5),产率98%。熔点:240–241℃。
高分辨质谱C22H17F3N3O4+[M+H]+,理论值444.1166;实测值,444.1167。
实施例6:合成4-((4-硝基-6-氧代-1,2-二氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-3(11aH)-基)甲基)苯甲腈(化合物6)
用4-((2-(硝基亚甲基)咪唑烷-1-基)甲基)苄腈代替实施例1中的1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷,将实施例1中的乙醇替换为甲醇、水和甲苯的混合溶剂(甲醇、水和甲苯的体积比为2:1:2),进行反应可得到黄色固体4-((4-硝基-6-氧代-1,2-二氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-3(11aH)-基)甲基)苯甲腈(化合物6),产率93%。熔点:243℃。
高分辨质谱C22H17N4O4+[M+H]+,理论值401.1244;实测值,401.1243。
实施例7:合成3-(4-氟苄基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物7)
用1-(4-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例1中的1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷进行反应,催化剂采用三乙胺,加入量为0.01mmol,可得到黄色固体3-(4-氟苄基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物7),产率96%。熔点:234–235℃。
高分辨质谱C21H17FN3O4+[M+H]+,理论值394.1198;实测值,394.1201。
实施例8:合成3-(4-氯苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物8)
用1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷代替实施例1中的1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷进行反应,催化剂采用碳酸钠,加入量为0.1mmol,可得到黄色固体3-(4-氯苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物8),产率97%。熔点:249–250℃。
高分辨质谱C21H17ClN3O4+[M+H]+,理论值410.0902;实测值,410.0900。
实施例9:合成3-苄基-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物9)
用1-苄基-2-(硝基亚甲基)咪唑烷代替实施例1中的1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体3-苄基-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物9),产率95%。熔点:242–243℃。
高分辨质谱C21H18N3O4+[M+H]+,理论值376.1292;实测值,376.1291。
实施例10:合成3-(4-甲基苄基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物10)
用1-(4-甲基苄基)-2-(硝基亚甲基)咪唑烷代替实施例1中的1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体3-(4-甲基苄基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物10),产率97%。熔点:219–220℃。
高分辨质谱C22H20N3O4+[M+H]+,理论值390.1448;实测值,390.1448。
实施例11:合成3-(3-氟苄基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物11)
用1-(3-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例1中的1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体3-(3-氟苄基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物11),产率94%。熔点:218–219℃。
高分辨质谱C21H17FN3O4+[M+H]+,理论值394.1198;实测值,394.1191。
实施例12:合成3-(3,5-二氟苄基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物12)
用1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例1中的1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体3-(3,5-二氟苄基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物12),产率94%。熔点:243–244℃。
高分辨质谱C21H16F2N3O4+[M+H]+,理论值412.1103;实测值,412.1103。
实施例13:合成3((6-氯吡啶-3-基)甲基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物13)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶代替实施例1中的1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体3((6-氯吡啶-3-基)甲基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物13),产率94%。熔点:230–231℃。
高分辨质谱C20H16ClN4O4+[M+H]+,理论值411.0855;实测值,411.0854。
实施例14:合成3-((2-氯噻唑-5-基)甲基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪 唑并[1,2-a]吡啶-6-酮(化合物14)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)噻唑代替实施例1中的1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体3-((2-氯噻唑-5-基)甲基)-4-硝基-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物14),产率93%。熔点:258–259℃。
高分辨质谱C18H14ClN4O4S+[M+H]+,理论值417.0419;实测值,417.0417。
实施例15:合成8-氟-4-硝基-3-(4-(三氟甲基)苄基)-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物15)
用2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷代替实施例2中的1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体8-氟-4-硝基-3-(4-(三氟甲基)苄基)-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物15),产率95%。熔点:233–234℃。
高分辨质谱C22H16F4N3O4+[M+H]+,理论值462.1071;实测值,462.1069。
实施例16:合成4-((8-氟-4-硝基-6-氧代-1,2-二氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-3(11aH)-基)甲基)苯甲腈(化合物16)
用4-((2-(硝基亚甲基)咪唑烷-1-基)甲基)苄腈代替实施例2中的1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体4-((8-氟-4-硝基-6-氧代-1,2-二氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-3(11aH)-基)甲基)苯甲腈(化合物16),产率94%。熔点:258–259℃。
高分辨质谱C22H16FN4O4+[M+H]+,理论值419.1150;实测值,419.1151。
实施例17:合成8-氟-3-(4-氟苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物17)
用1-(4-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例2中的1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体8-氟-3-(4-氟苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物17),产率95%。熔点:204–205℃。
高分辨质谱C21H16F2N3O4+[M+H]+,理论值412.1103;实测值,412.1102。
实施例18:合成3-苄基-8-氟-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物18)
用1-苄基-2-(硝基亚甲基)咪唑烷代替实施例2中的1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体3-(4-氯苄基)-8-氟-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物18),产率97%。熔点:231–232℃。
高分辨质谱C21H17FN3O4+[M+H]+,理论值394.1198;实测值,394.1199。
实施例19:合成8-氟-3-(4-甲基苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物19)
用1-(4-甲基苄基)-2-(硝基亚甲基)咪唑烷代替实施例2中的1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体8-氟-3-(4-甲基苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物19),产率96%。熔点:216–217℃。
高分辨质谱C22H19FN3O4+[M+H]+,理论值408.1354;实测值,408.1354,如图1所示。
实施例20:合成8-氟-3-(4-甲氧基苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物20)
用1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷代替实施例2中的1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体实施例20:8-氟-3-(4-甲氧基苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物20),产率95%。熔点:219–220℃。
高分辨质谱C22H19FN3O5+[M+H]+,理论值424.1303;实测值,424.1305。
实施例21:合成8-氟-3-(3-氟苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物21)
用1-(3-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例2中的1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体实施例21:8-氟-3-(3-氟苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物21),产率94%。熔点:237–238℃。
高分辨质谱C21H16F2N3O4+[M+H]+,理论值412.1103;实测值,412.1101。
实施例22:合成3-(3,5-二氟苄基)-8-氟-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物22)
用1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例2中的1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体3-(3,5-二氟苄基)-8-氟-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物22),产率98%。熔点:257–258℃。
高分辨质谱C21H15F3N3O4+[M+H]+,理论值430.1009;实测值,430.1008。
实施例23:合成3-((6-氯吡啶-3-基)甲基)-8-氟-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物23)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶代替实施例2中的1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体3-((6-氯吡啶-3-基)甲基)-8-氟-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物23),产率96%。熔点:218–219℃。
高分辨质谱C20H15ClFN4O4+[M+H]+,理论值429.0760;实测值,429.0762。
实施例24:合成3-((2-氯噻唑-5-基)甲基)-8-氟-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2a]吡啶-6-酮(化合物24)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)噻唑代替实施例2中的1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体3-((2-氯噻唑-5-基)甲基)-8-氟-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2a]吡啶-6-酮(化合物24),产率95%。熔点:230–231℃。
高分辨质谱C18H13ClFN4O4S+[M+H]+,理论值435.0325;实测值,435.0327。
实施例25:合成8-氯-3-(4-氟苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物25)
用1-(4-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例3中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体8-氯-3-(4-氟苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物25),产率96%。熔点:242–243℃。
高分辨质谱C21H16ClFN3O4+[M+H]+,理论值428.0808;实测值,428.0810。
实施例26:合成3-苄基-8-氯-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物26)
用1-苄基-2-(硝基亚甲基)咪唑烷代替实施例3中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体3-苄基-8-氯-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物26),产率95%。熔点:230–231℃。
高分辨质谱C21H17ClN3O4+[M+H]+,理论值410.0902;实测值,410.0900。
实施例27:合成8-氯-3-(4-甲基苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物27)
用1-(4-甲基苄基)-2-(硝基亚甲基)咪唑烷代替实施例3中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体8-氯-3-(4-甲基苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物27),产率97%。熔点:233–234℃。
高分辨质谱C22H19ClN3O4+[M+H]+,理论值424.1059;实测值,424.1057。
实施例28:合成8-氯-3-(4-甲氧基苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物28)
用1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷代替实施例3中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体8-氯-3-(4-甲氧基苄基)-4-硝基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物28),产率96%。熔点:218–219℃。
高分辨质谱C22H19ClN3O5+[M+H]+,理论值440.1008;实测值,440.1008。
实施例29:合成8-氯-3-(3-氟苄基)-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物29)
用1-(3-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例3中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体8-氯-3-(3-氟苄基)-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物29),产率97%。熔点:254–255℃。
高分辨质谱C21H16ClFN3O4+[M+H]+,理论值428.0808;实测值,428.0808。
实施例30:合成8-氯-3-(3,5-二氟苄基)-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物30)
用1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例3中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体8-氯-3-(3,5-二氟苄基)-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物30),产率98%。熔点:267–268℃。
高分辨质谱C21H15ClF2N3O4+[M+H]+,理论值446.0714;实测值,446.0715。
实施例31:8-氯-3-((6-氯吡啶-3-基)甲基)-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物31)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶代替实施例3中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体8-氯-3-((6-氯吡啶-3-基)甲基)-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物31),产率94%。熔点:241–242℃。
高分辨质谱C20H15Cl2N4O4+[M+H]+,理论值445.0465;实测值,445.0468。
实施例32:合成8-氯-3-((5-氯噻唑-2-基)甲基)-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物32)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)噻唑代替实施例3中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体8-氯-3-((5-氯噻唑-2-基)甲基)-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物32),产率94%。熔点:260–261℃。
高分辨质谱C18H13Cl2N4O4S+[M+H]+,理论值451.0029;实测值,451.0029。
实施例33:合成4-((8-甲基-4-硝基-6-氧代-1,2-二氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-3(11aH)-基)甲基)苯甲腈(化合物33)
在25毫升圆底烧瓶中加入4-((2-(硝基亚甲基)咪唑烷-1-基)甲基)苄腈(1mmol,244mg)和3-甲酰基-6-甲基色酮(2mmol,376mg)后,加入甲醇(17毫升)磁力搅拌下加热至50℃下,反应180分钟。TLC监测反应,待原料点完全消失后,过滤后用少量乙醇洗涤沉淀,得黄色固体,红外灯下干燥,产率98%。熔点:290–291℃。
高分辨质谱C23H19N4O4+[M+H]+,理论值415.1401;实测值,415.1398。
实施例34:合成3-(4-甲氧基苄基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物34)
用1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷代替实施例33中的4-((2-(硝基亚甲基)咪唑烷-1-基)甲基)苄腈进行反应可得到黄色固体3-(4-甲氧基苄基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物34),产率98%。熔点:217–218℃。
高分辨质谱C23H22N3O5+[M+H]+,理论值420.1554;实测值,420.1557。
实施例35:合成3-((6-氯吡啶-3-基)甲基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物35)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶代替实施例33中的4-((2-(硝基亚甲基)咪唑烷-1-基)甲基)苄腈进行反应可得到黄色固体3-((6-氯吡啶-3-基)甲基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮(化合物35),产率97%。熔点:248–249℃。
高分辨质谱C21H18ClN4O4+[M+H]+,理论值425.1011;实测值,425.1008。
以上所合成的色酮并吡啶类中间体,结构如表1所示:
表1色酮并吡啶类中间体结构式
二、式(IV)1,3-二氮杂环并吡啶季铵盐类化合物的合成
实施例36:合成6-(2-羟基苯甲酰基)-8-硝基-1-(4-硝基苄基)-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物36)
在10毫升圆底烧瓶中加入4-硝基-3-(4-硝基苄基)-1,2,3,11a四氢-6H-苯并吡喃并[3,2-e]咪唑并[1,2-a]吡啶-6-酮120mg,加入水7mL磁力搅拌,然后加入高氯酸0.1mL,反应30分钟。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,红外灯下干燥得产品6-(2-羟基苯甲酰基)-8-硝基-1-(4-硝基苄基)-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物36),产率94%。熔点:236–237℃。
波谱数据为:1H NMR(500MHz,DMSO-d6+HClO4)(δ,ppm):9.27(s,1H,ArH),8.84(s,1H,ArH),8.27(d,J=8.5Hz,2H,ArH),7.78(d,J=8.5Hz,2H,ArH),7.52–7.55(m,1H,ArH), 7.48(d,J=7.5Hz,1H,ArH),7.01–7.08(m,2H,ArH),5.11(s,2H,CH2),4.88(t,J=10.0Hz,2H,CH2),4.22(t,J=9.8Hz,2H,CH2);13C NMR(125MHz,DMSO-d6+HClO4)(δ,ppm):189.4,156.9,149.5,147.6,142.7,142.3,135.1,132.4,131.3,128.8,124.1,124.1,123.8,123.0,120.3,117.6,53.7,52.5,51.1;HRMS(ESI-TOF,[M-ClO4-]+):calcd for C21H17N4O6,421.1143;found,421.1143.
实施例37:合成6-(2-羟基苯甲酰基)-8-硝基-1-(4-(三氟甲基)苄基)-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物37)
在25毫升圆底烧瓶中加入2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷(1mmol,287mg)和色酮-3-甲醛(1.2mmol,209mg)后,加入乙醇(15mL)磁力搅拌下加热至75℃下,反应15分钟。停止加热,待溶液冷却至室温后,滴加高氯酸0.2mL,继续搅拌5分钟。TLC监测反应,待原料点完全消失后过滤,用少量酸性乙醇洗涤沉淀,得黄色固体,红外灯下干燥得到产品6-(2-羟基苯甲酰基)-8-硝基-1-(4-(三氟甲基)苄基)-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物37),产率96%。熔点:184–185℃。
波谱数据为:1H NMR(500MHz,DMSO-d6+HClO4)(δ,ppm):9.24(d,J=1.0Hz,1H,ArH),8.83(d,J=1.5Hz,1H,ArH),7.78(d,J=8.0Hz,2H,ArH),7.71(d,J=8.0Hz,2H,ArH),7.52–7.55(m,1H,ArH),7.47–7.49(m,1H,ArH),7.01–7.08(m,2H,ArH),4.91(s,2H,CH2),4.88(t,J=10.0Hz,2H,CH2),4.21(t,J=10.0Hz,2H,CH2);13C NMR(125MHz,DMSO-d6+HClO4)(δ,ppm):189.4,156.9,149.3,147.6,142.5,139.0,135.0(d,2JC–F=15.0Hz),132.4,131.2,129.2(m),128.5(d,2JC–F=21.3Hz),125.9(d,3JC–F=3.8Hz),124.6(q,1JC–F=270.4Hz),123.7,122.9,120.2,117.6,53.6,52.4,51.0;HRMS(ESI-TOF,[M-ClO4-]+):calcd for C22H17F3N3O4,444.1163;found,444.1167.
实施例38:合成1-(3,5-二氟苄基)-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物38)
在25毫升圆底烧瓶中加入1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷(1mmol,255mg)和6-氟色酮-3-甲醛(1.5mmol,288mg)后,加入乙醇和水=5:1的混合溶剂(12毫升)磁力搅拌下加热至20℃下,反应8分钟后,滴加高氯酸0.2mL,维持溶液pH 2–4,继续搅拌4分钟。TLC监测反应,待原料点完全消失后过滤,用少量乙醚洗涤沉淀,得黄色固体,红外灯下干燥后得到产品1-(3,5-二氟苄基)-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物38),产率98%。熔点:194–195℃。
波谱数据为:1H NMR(500MHz,DMSO-d6+HClO4)(δ,ppm):9.23(s,1H,ArH),8.82(d,J=1.5Hz,1H,ArH),7.34–7.38(m,1H,ArH),7.23–7.25(m,3H,ArH),7.18(t,J=9.3Hz,2H,ArH),7.03–7.06(m,1H,ArH),4.84(t,J=9.8Hz,2H,CH2),4.81(s,2H,CH2),4.19(t,J=10.0Hz,2H,CH2);13C NMR(125MHz,DMSO-d6+HClO4)(δ,ppm):188.1,163.0(dd,1JC–F=245.0Hz,3JC–F=13.8Hz),155.8(d,1JC–F=235.0Hz),153.0,149.3,147.7,142.4,138.8(t,3JC–F=10.0Hz),132.5,124.3(d,3JC–F=7.5Hz),122.4,121.5(d,2JC–F=22.5Hz),119.1(d,3JC–F=7.5Hz),116.5(d,2JC–F=25.0Hz),110.9(dd,2JC–F=20.0Hz,3JC–F=6.3Hz),113.8(t,1JC–F=25.6Hz),53.2,52.4,51.0; HRMS(ESI-TOF,[M-ClO4-]+):calcd for C21H15F3N3O4,430.1009;found,430.1010.
实施例39:合成6-(5-氯-2-羟基苯甲酰基)-1-((6-氯吡啶-3-基)甲基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物39)
在25毫升圆底烧瓶中加入2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶(1mmol,255mg)和6-氯-3-甲酰基色酮(1.2mmol,250mg),加入乙腈(17毫升)磁力搅拌下加热至80℃下,反应30分钟。之后滴加高氯酸0.2mL,维持溶液pH 2–4,继续搅拌30分钟。TLC监测反应,待原料点完全消失后,过滤后用少量酸水洗涤沉淀,得黄色固体,红外灯下干燥得产品6-(5-氯-2-羟基苯甲酰基)-1-((6-氯吡啶-3-基)甲基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物39),产率93%。熔点:143–144℃。
波谱数据为:1H NMR(500MHz,DMSO-d6+HClO4)(δ,ppm):9.23(s,1H,ArH),8.83(s,1H,ArH),8.51(s,1H,ArH),7.96(d,J=8.0Hz,1H,ArH),7.52–7.58(m,2H,ArH),7.42(s,1H,ArH),7.06(d,J=8.5Hz,1H,ArH),4.83(s,2H,CH2),4.80(m,2H,CH2),4.18(t,J=9.5Hz,2H,CH2);13C NMR(125MHz,DMSO-d6+HClO4)(δ,ppm):188.0,155.4,150.4,149.4,149.4,147.7,142.4,139.5,134.1,132.5,129.9,129.6,125.4,124.6,123.8,122.4,119.4,52.2,51.2,51.0;HRMS(ESI-TOF,[M-ClO4-]+):calcd for C20H15Cl2N4O4,445.0465;found,445.0466.
实施例40:合成1-(4-氰基苄基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物40)
用4-((2-(硝基亚甲基)咪唑烷-1-基)甲基)苄腈代替实施例37中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应,溶剂采用丙酮、水和DMF的混合溶剂(体积比为1:2:1)替换乙醇,可得到黄色固体1-(4-氰基苄基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物40),产率90%。熔点:211–212℃。
高分辨质谱C22H17N4O4+[M-ClO4-]+,理论值401.1244;实测值,401.1243。
实施例41:合成1-(4-氟苄基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物41)
在25毫升圆底烧瓶中加入1-(4-氟苄基)-2-(硝基亚甲基)咪唑烷(1mmol)和色酮-3-甲醛(1.2mmol,209mg)后,加入DMF(15mL)磁力搅拌下加热至150℃下,反应30分钟。停止加热,待溶液冷却至室温后,滴加高氯酸0.2mL,继续搅拌10分钟。TLC监测反应,待原料点完全消失后过滤,用少量酸性乙醇洗涤沉淀,得黄色固体,红外灯下干燥得到产品1-(4-氟苄基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物41),产率95%。熔点:137–138℃。
高分辨质谱:C21H17FN3O4[M-ClO4-]+,理论值394.1198;实际值,394.1197.
实施例42:合成1-(4-氯苄基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物42)
用1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷代替实施例37中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体1-(4-氯苄基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物42),产率96%。熔点:193–194℃。
高分辨质谱C21H17ClN3O4+[M-ClO4-]+,理论值410.0902;实测值,410.0902。
实施例43:合成1-苄基-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物43)
用1-苄基-2-(硝基亚甲基)咪唑烷代替实施例37中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体1-苄基-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物43),产率94%。熔点:155–156℃。
高分辨质谱C21H18N3O4+[M-ClO4-]+,理论值376.1292;实测值,376.1292。
实施例44:合成6-(2-羟基苯甲酰基)-1-(4-甲基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物44)
用1-(4-甲基苄基)-2-(硝基亚甲基)咪唑烷代替实施例37中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体6-(2-羟基苯甲酰基)-1-(4-甲基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物44),产率97%。熔点:147–148℃。
高分辨质谱C22H20N3O4+[M–ClO4-]+,理论值390.1448;实测值,390.1448。
实施例45:合成6-(2-羟基苯甲酰基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物45)
用1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷代替实施例37中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体6-(2-羟基苯甲酰基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物45),产率96%。熔点:172–173℃。
高分辨质谱C22H20N3O5+[M-ClO4-]+,理论值406.1397;实测值,406.1396。
实施例46:合成1-(3-氟苄基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物46)
用1-(3-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例37中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体1-(3-氟苄基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物46),产率90%。熔点:178–179℃。
高分辨质谱C21H17FN3O4+[M-ClO4-]+,理论值394.1198;实测值,394.1196。
实施例47:合成1-(3,5-二氟苄基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物47)
用1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例37中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体1-(3,5-二氟苄基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物47),产率93%。熔点:220–221℃。
高分辨质谱C21H16F2N3O4+[M-ClO4-]+,理论值412.1103;实测值,412.1104。
实施例48:合成1-((6-氯吡啶-3-基)甲基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物48)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶代替实施例37中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体1-((6-氯吡啶-3-基)甲基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物48),产率94%。熔 点:203–204℃。
高分辨质谱C20H16ClN4O4+[M-ClO4-]+,理论值411.0855;实测值,411.0853。
实施例49:合成1-((2-氯噻唑-5-基)甲基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物49)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)噻唑代替实施例37中的2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷进行反应可得到黄色固体1-((2-氯噻唑-5-基)甲基)-6-(2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物49),产率93%。熔点:201–202℃。
高分辨质谱C18H14ClN4O4S+[M-ClO4-]+,理论值417.0419;实测值,417.0419。
实施例50:合成6-(5-氟-2-羟基苯甲酰基)-8-硝基-1-(4-(三氟甲基)苄基)-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物50)
用2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷代替实施例38中的1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体6-(5-氟-2-羟基苯甲酰基)-8-硝基-1-(4-(三氟甲基)苄基)-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物50),产率94%。熔点:160–161℃。
高分辨质谱C22H16F4N3O4+[M-ClO4-]+,理论值462.1071;实测值,462.1072。
实施例51:合成1-(4-氰基苄基)-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物51)
用4-((2-(硝基亚甲基)咪唑烷-1-基)甲基)苄腈代替实施例38中的1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体1-(4-氰基苄基)-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物51),产率92%。熔点:209–210℃。
高分辨质谱C22H16FN4O4+[M-ClO4-]+,理论值419.1150;实测值,419.1151。
实施例52:合成6-(5-氟-2-羟基苯甲酰基)-1-(4-氟苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物52)
用1-(4-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例38中的1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体6-(5-氟-2-羟基苯甲酰基)-1-(4-氟苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物52),产率93%。熔点:161–162℃。
高分辨质谱:C21H16F2N3O4+[M-ClO4-]+,理论值412.1103;实际值,412.1104.
实施例53:合成1-(4-氯苄基)-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物53)
用1-(4-氯苄基)-2-(硝基亚甲基)咪唑烷代替实施例38中的1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体1-(4-氯苄基)-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物53),产率95%。熔点:199–200℃。
高分辨质谱C21H16ClFN3O4+[M-ClO4-]+,理论值428.0808;实测值,428.0808。
实施例54:合成1-苄基-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物54)
用1-苄基-2-(硝基亚甲基)咪唑烷代替实施例38中的1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体1-苄基-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物54),产率96%。熔点:159–160℃。
高分辨质谱C21H17FN3O4+[M-ClO4-]+,理论值394.1198;实测值,394.1196。
实施例55:合成6-(5-氟-2-羟基苯甲酰基)-1-(4-甲基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物55)
用1-(4-甲基苄基)-2-(硝基亚甲基)咪唑烷代替实施例38中的1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体6-(5-氟-2-羟基苯甲酰基)-1-(4-甲基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物55),产率96%。熔点:148–150℃。
高分辨质谱C22H19FN3O4+[M-ClO4-]+,理论值408.1354;实测值,408.1354。
实施例56:合成6-(5-氟-2-羟基苯甲酰基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物56)
用1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷代替实施例38中的1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体6-(5-氟-2-羟基苯甲酰基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物56),产率95%。熔点:154–155℃。
高分辨质谱C22H19FN3O5+[M-ClO4-]+,理论值424.1303;实测值,424.1302。
实施例57:合成6-(5-氟-2-羟基苯甲酰基)-1-(3-氟苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物57)
用1-(3-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例38中的1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体6-(5-氟-2-羟基苯甲酰基)-1-(3-氟苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物57),产率93%。熔点:196–197℃。
高分辨质谱C21H16F2N3O4+[M-ClO4-]+,理论值412.1103;实测值,412.1099。
实施例58:合成1–((6-氯吡啶-3-基)甲基)-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物58)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶代替实施例38中的1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体1–((6-氯吡啶-3-基)甲基)-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物58),产率96%。熔点:219–220℃。
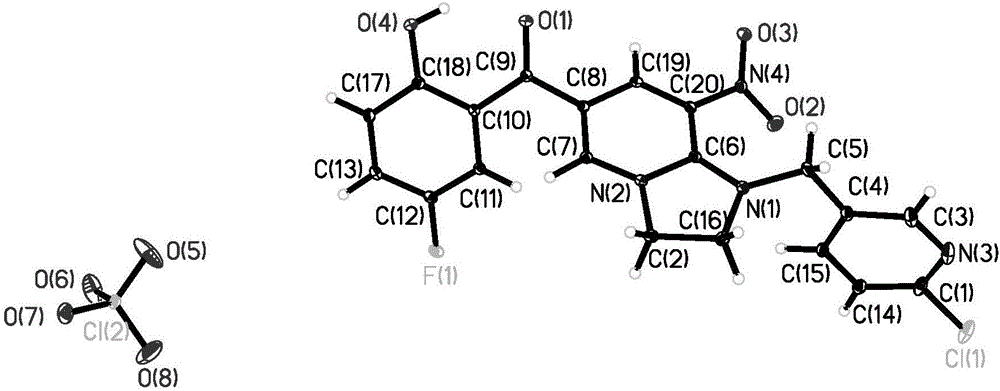
高分辨质谱C20H15ClFN4O4+[M-ClO4-]+,理论值429.0760;实测值,429.0759。
单晶结构如图2所示。
实施例59:合成1-((2-氯噻唑-5-基)甲基)-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物59)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)噻唑代替实施例38中的1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷进行反应可得到黄色固体1-((2-氯噻唑-5-基)甲基)-6-(5-氟-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物59),产率94%。熔 点:203–204℃。
高分辨质谱C18H13ClFN4O4S+[M-ClO4-]+,理论值435.0325;实测值,435.0327。
实施例60:合成6-(5-氯-2-羟基苯甲酰基)-8-硝基-1-(4-(三氟甲基)苄基)-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物60)
用2-(硝基亚甲基)-1-(4-(三氟甲基)苄基)咪唑烷代替实施例39中的2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶进行反应可得到黄色固体6-(5-氯-2-羟基苯甲酰基)-8-硝基-1-(4-(三氟甲基)苄基)-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物60),产率92%。熔点:178–179℃。
高分辨质谱C22H16ClF3N3O4+[M-ClO4-]+,理论值478.0776;实测值,478.0777。
实施例61:合成6-(5-氯-2-羟基苯甲酰基)-1-(4-氟苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物61)
用1-(4-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例39中的2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶进行反应可得到黄色固体6-(5-氯-2-羟基苯甲酰基)-1-(4-氟苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物61),产率94%。熔点:149–151℃。
高分辨质谱:C21H16ClFN3O4+[M-ClO4-]+,理论值428.0808;实际值,428.0806.
实施例62:合成1-苄基-6-(5-氯-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物62)
用1-苄基-2-(硝基亚甲基)咪唑烷代替实施例39中的2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶进行反应可得到黄色固体1-苄基-6-(5-氯-2-羟基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物62),产率94%。熔点:172–173℃。
高分辨质谱C21H17ClN3O4+[M-ClO4-]+,理论值410.0902;实测值,410.0901。
实施例63:合成6-(5-氯-2-羟基苯甲酰基)-1-(4-甲基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物63)
用1-(4-甲基苄基)-2-(硝基亚甲基)咪唑烷代替实施例39中的2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶进行反应可得到黄色固体6-(5-氯-2-羟基苯甲酰基)-1-(4-甲基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物63),产率97%。熔点:184–185℃。
高分辨质谱C22H19ClN3O4+[M-ClO4-]+,理论值424.1059;实测值,424.1061。
实施例64:合成6-(5-氯-2-羟基苯甲酰基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物64)
用1-(4-甲氧基苄基)-2-(硝基亚甲基)咪唑烷代替实施例39中的2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶进行反应可得到黄色固体6-(5-氯-2-羟基苯甲酰基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物64),产率95%。熔点:154–155℃。
高分辨质谱C22H19ClN3O5+[M-ClO4-]+,理论值440.1008;实测值,440.1006。
实施例65:合成6-(5-氯-2-羟基苯甲酰基)-1-(3-氟苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a] 吡啶-4-鎓高氯酸盐(化合物65)
用1-(3-氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例39中的2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶进行反应可得到黄色固体6-(5-氯-2-羟基苯甲酰基)-1-(3-氟苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物65),产率97%。熔点:180–181℃。
高分辨质谱C21H16ClFN3O4+[M-ClO4-]+,理论值428.0808;实测值,428.0808。
实施例66:合成6-(5-氯-2-羟基苯甲酰基)-1-(3,5-二氟苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物66)
用1-(3,5-二氟苄基)-2-(硝基亚甲基)咪唑烷代替实施例39中的2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶进行反应可得到黄色固体6-(5-氯-2-羟基苯甲酰基)-1-(3,5-二氟苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物66),产率98%。熔点:220–221℃。
高分辨质谱C21H15ClF2N3O4+[M-ClO4-]+,理论值446.0714;实测值,446.0714。
实施例67:合成6-(5-氯-2-羟基苯甲酰基)-1-((2-氯噻唑-5-基)甲基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物67)
用2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)噻唑代替实施例39中的2-氯-5-((2-(硝基亚甲基)咪唑烷-1-基)甲基)吡啶进行反应可得到黄色固体6-(5-氯-2-羟基苯甲酰基)-1-((2-氯噻唑-5-基)甲基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓高氯酸盐(化合物67),产率92%。熔点:233–234℃。
高分辨质谱C18H13Cl2N4O4S+[M-ClO4-]+,理论值451.0029;实测值,451.0029。
实施例68:合成1-(4-氰基苄基)-6-(2-羟基-5-甲基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓盐酸盐(化合物68)
在25毫升圆底烧瓶中加入4-((8-甲基-4-硝基-6-氧代-1,2-二氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-3(11aH)-基)甲基)苯甲腈1mmol,加乙醇17mL磁力搅拌,然后加入盐酸2mmol,反应10分钟。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,自然干燥得产品1-(4-氰基苄基)-6-(2-羟基-5-甲基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓盐酸盐(化合物68),产率99%。
高分辨质谱C23H19N4O4+[M-Cl-]+,理论值415.1401;实测值,415.1400。
实施例69:合成6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓枸橼酸盐(化合物69)
在25毫升圆底烧瓶中加入3-(4-甲氧基苄基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮1mmol,加水17mL磁力搅拌,然后加入枸橼酸1.2mmol,在60℃反应6小时。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,30℃下烘干得产品6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓枸橼酸盐(化合物69),产率99%。
高分辨质谱C23H22N3O5+[M–C6H7O7-]+,理论值420.1554;实测值,420.1554。
实施例70:合成1-((6-氯吡啶-3-基)甲基)-6-(2-羟基-5-甲基苯甲酰基)-8-硝基-2,3-二氢-1H- 咪唑并[1,2-a]-4-鎓乳酸盐(化合物70)
在25毫升圆底烧瓶中加入3-((6-氯吡啶-3-基)甲基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮1mmol,加DMF 17mL磁力搅拌,然后加入乳酸1.2mmol,150℃反应1小时。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,红外灯下干燥得产品1-((6-氯吡啶-3-基)甲基)-6-(2-羟基-5-甲基苯甲酰基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]-4-鎓乳酸盐(化合物70),产率99%。
高分辨质谱C21H18ClN4O4+[M–C3H5O3-]+,理论值425.1011;实测值,425.1013。
实施例71:合成6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓苹果酸盐(化合物71)
在25毫升圆底烧瓶中加入3-(4-甲氧基苄基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮1mmol,加乙醇17mL磁力搅拌,然后加入苹果酸1.2mmol,在60℃反应6小时。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,红外灯下干燥得产品6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓苹果酸盐(化合物71),产率95%。
实施例72:合成6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓苯甲酸盐(化合物72)
在25毫升圆底烧瓶中加入3-(4-甲氧基苄基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮1mmol,加乙醇17mL磁力搅拌,然后加入苯甲酸1.2mmol,在60℃反应6小时。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,红外灯下干燥得产品6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓苯甲酸盐(化合物72),产率96%。
实施例73:合成6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓氢溴酸盐(化合物73)
在25毫升圆底烧瓶中加入3-(4-甲氧基苄基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮1mmol,加乙醇17mL磁力搅拌,然后加入氢溴酸1.2mmol,在60℃反应6小时。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,红外灯下干燥得产品6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓氢溴酸盐(化合物73),产率97%。
实施例74:合成6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓氢碘酸盐(化合物74)
在25毫升圆底烧瓶中加入3-(4-甲氧基苄基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮1mmol,加水17mL磁力搅拌,然后加入氢碘酸1.2mmol,在60℃反应6小时。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,红外灯下干燥得产品6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓氢碘酸盐(化合物74),产率94%。
实施例75:合成6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓乙酸盐(化合物75)
在25毫升圆底烧瓶中加入3-(4-甲氧基苄基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮1mmol,加乙醇17mL磁力搅拌,然后加入乙酸1.2mmol,在60℃反应2小时。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,红外灯下干燥得产品6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓乙酸盐(化合物75),产率92%。
实施例76:合成6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓甲磺酸盐(化合物76)
在25毫升圆底烧瓶中加入3-(4-甲氧基苄基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮1mmol,加乙醇17mL磁力搅拌,然后加入甲磺酸1.2mmol,在60℃反应4小时。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,红外灯下干燥得产品6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓甲磺酸盐(化合物76),产率97%。
实施例77:合成6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓苯磺酸盐(化合物77)
在25毫升圆底烧瓶中加入3-(4-甲氧基苄基)-8-甲基-4-硝基基-1,2,3,11a-四氢-6H-色烯并[3,2-e]咪唑并[1,2-a]吡啶-6-酮1mmol,加乙醇17mL磁力搅拌,然后加入苯磺酸2mmol,在60℃反应6小时。TLC监测反应,待原料点完全消失后,过滤后得黄色固体,红外灯下干燥得产品6-(2-羟基-5-甲基苄基)-1-(4-甲氧基苄基)-8-硝基-2,3-二氢-1H-咪唑并[1,2-a]吡啶-4-鎓苯磺酸盐(化合物77),产率92%。
以上所合成的1,3-二氮杂环并吡啶季铵盐类化合物,结构如表2所示:
表2、1,3-二氮杂环并吡啶季铵盐类化合物的结构式
第二部分本发明化合物的抗肿瘤效果
应用例
对上述70个化合物进行针对三种人类肿瘤细胞株实验:HCT116(人结直肠癌),HepG2(肝癌),SGC7901(胃腺癌)。将细胞测试用化合物孵育144小时,然后采用MTT测定法测量细胞毒性(Mossman,T.J.Immunol.Methods 1983,65,55“细胞活力的快速比色测试法;细胞毒性和生长抑制淋巴因子定量的应用”。Green,L.M.J.Immunol.Methods 1984,70,257“细胞活力的快速比色测试法;细胞毒性和生长抑制淋巴因子定量的应用”),所得数据证实,本发明的化合物对实体肿瘤、特别是肺癌和直结肠癌有明显的活性。部分数据结果如表3所示。
表3本发明的代表性化合物对人体肿瘤细胞株的细胞毒素活性
以上显示和描述了本发明的基本原理、主要特征和本发明的优点。本行业的技术人员应该了解,本发明不受上述实施例的限制,上述实施例和说明书中描述的只是说明本发明的原理,在不脱离本发明精神和范围的前提下,本发明还会有各种变化和改进,这些变化和改进都落入要求保护的本发明范围内。本发明要求保护范围由所附的权利要求书及其等效物界定。
- 还没有人留言评论。精彩留言会获得点赞!