甲基化DNA检测方法与流程
本发明涉及检测特定基因组位置的DNA甲基化的方法。
背景技术:
在真核生物的DNA中,部分胞嘧啶会发生甲基化,从而产生甲基化的DNA。研究表明,DNA的甲基化可能对DNA的功能有重大影响,特别是DNA甲基化可能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。例如,基因启动子序列的甲基化一般会抑制该基因的表达。在一些研究中发现,DNA甲基化对生物的正常发育是必需的。在另一些研究中发现,DNA甲基化同基因印记,X染色体失活,以及重复元件的抑制有关。特别的,一些研究中发现,DNA甲基化和肿瘤产生相关。
基因的启动子区或末端通常会存在一些富含“CG”核苷酸对(其中G紧随C后,两个核苷酸之间通过磷酸酯键相连,因此称为“CpG”)的区域。在哺乳动物的DNA中,60%~90%的CpG序列被甲基化(Ehrlich等,1982,Amount and distribution of 5-methyl-cytosine in human DNA from different types of tissues or cells,Nucleic Acids Research 10(8):2709-21)。当基因的表达调控区中某些区段富含CpG(CpG序列出现频率远高于平均)时,将该区段称为CpG岛。研究表明,肿瘤细胞的DNA中发现部分基因的表达调控区发生了在正常情况下非甲基化或低甲基化的CpG岛甲基化程度明显增高的情况,抑制了一些基因(例如,抑癌基因)的表达。而另一方面,肿瘤细胞的DNA中还发现有部分基因的表达调控区发生CpG岛的甲基化程度降低的情况,使这些基因(例如,致癌基因)表达异常。因此,通过研究DNA片段特定基因组位置的甲基化情况可以获取关于肿瘤的重要信息。
肿瘤细胞在人体内会因为细胞凋亡、免疫反应等原因释放其基因组DNA至血液中。正常组织也会将正常的基因组DNA释放至血液中。这些血浆中存在的DNA统称为细胞外游离DNA(Cell-free DNA,cfDNA),而其中的来自肿瘤细胞的部分则被称为循环肿瘤DNA(Circulating Tumor DNA,ctDNA)。检测ctDNA中的甲基化DNA对肿瘤的早期诊断很有帮助。但是,由于ctDNA在cfDNA中的丰度极低,这要求检测ctDNA中甲基化DNA的方法有极高的灵敏度。因此,需要一种具有高灵敏度和准确性的检测DNA片段的特定基因组位置的甲基化的方法。
技术实现要素:
本发明的一个方面提供了一种检测包含DNA的样品中DNA片段的特定基因组位置的甲基化的方法。在一些实施方式中,该方法包括以下步骤:用亚硫酸氢钠处理包含特定基因组位置的DNA片段,所述亚硫酸氢钠处理能够使得DNA片段中未甲基化的胞嘧啶转化为尿嘧啶;将经亚硫酸氢钠处理过的所述DNA片段变性为单链DNA片段;环化所述单链DNA片段;将所述环化的单链DNA片段制备为包含所述特定基因组位置的DNA测序文库;对所述DNA测序文库进行测序以鉴定所述单链DNA片段的序列。
在一些实施方式中,在变性处理前在所述DNA片段一端或两端加上接头。在一些实施方式中,在经亚硫酸氢钠处理前在所述DNA片段一端或两端加上接头。在一些实施方式中,所述接头可耐受亚硫酸氢盐。在一些实施方式中,所述接头包括DNA分子标签。在一些实施方式中,其中所述接头包括第二类限制性内切酶位点。在一些实施方式中,所述第二类限制性内切酶选自下组:HpaII/MspI、SmaI/XmaI、BamHI、HpaII。
在一些实施方式中,使用高效环化试剂环化所述单链DNA片段。在一些实施方式中,所述高效环化试剂为单链DNA连接酶。在一些实施方式中,所述单链DNA连接酶是CircLigase。
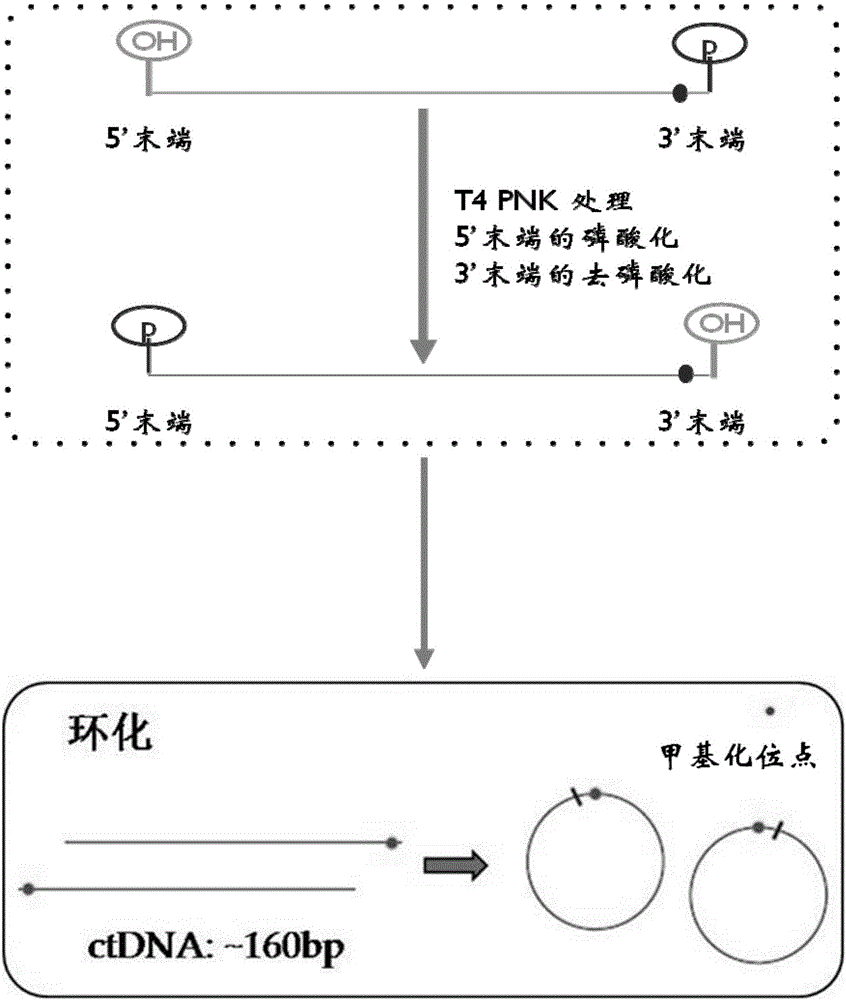
在一些实施方式中,在将所述单链DNA片段环化前,对所述DNA片段的5’末端进行磷酸化处理和对3’末端进行去磷酸化处理。
在一些实施方式中,在亚硫酸氢钠处理前对所述DNA片段进行切割处理,使得切割得到的DNA片段大小为0.1-5kb、0.1-1kb、1-2kb、2-3kb、3-4kb、4-5kb、0.2-0.4kb、0.5-1kb或0.1-0.5kb,并且所述切割得到的DNA片段包含所述特定基因组位置。
在一些实施方式中,所述的方法中的将环化的单链DNA片段制备为DNA测序文库的步骤包括:在所述环化步骤后扩增环化的所述单链DNA片段,并且获得由包含所述特定基因组位置的DNA的扩增产物组成的所述DNA测序文库。在一些实施方式中,所述扩增的步骤使用反向PCR扩增。在一些实施方式中,所述扩增的步骤使用滚环扩增。在一些实施方式中,所述接头包含与扩增步骤使用的引物部分或全部互补的序列。在一些实施方式中,所述测序步骤使用高通量DNA测序技术测定所述DNA测序文库的序列。
在一些实施方式中,所述的方法中的将环化的单链DNA片段制备为DNA测序文库的步骤进一步包括:在扩增步骤后使用寡核苷酸探针富集所述扩增产物。
在一些实施方式中,包含在所述样品中的DNA为细胞外的游离DNA。在一些实施方式中,在所述细胞外的游离DNA中包含循环肿瘤DNA。
本发明的另一个方面提供了一种检测包含DNA的样品中DNA片段的特定基因组位置的甲基化的试剂盒。在一些实施方式中,该试剂盒包括:亚硫酸氢钠,所述亚硫酸氢钠以使得DNA片段中未甲基化的胞嘧啶转化为尿嘧啶;环化试剂,所述环化试剂能够将单链DNA片段环化;测序试剂。在一些实施方式中,该试剂盒进一步包括切割试剂,其可用于在亚硫酸氢钠处理前对所述DNA片段进行切割处理,使得切割得到的DNA片段大小为0.1-5kb、0.1-1kb、1-2kb、2-3kb、3-4kb、4-5kb、0.2-0.4kb、0.5-1kb或0.1-0.5kb。
在另一些实施方式中,该试剂盒进一步包括扩增试剂,其可用于扩增包含特定基因组位置的单链环状DNA。在一些实施方式中,所述扩增试剂包括DNA聚合酶、反应溶液和dNTPs。
在一些实施方式中,该试剂盒进一步包括接头连接试剂,其可用于在变性处理前、或者在经亚硫酸氢钠处理前在所述DNA片段一端或两端加上接头序列。在一些实施方式中,所述接头连接试剂包括接头序列DNA片段、连接酶、反应溶液。
在一些实施方式中,所述环化试剂为高效环化试剂。在一些实施方式中,所述高效环化试剂为单链DNA连接酶。在一些实施方式中,所述单链DNA连接酶是CircLigase。在一些实施方式中,所述环化试剂进一步包括T4PNK,其可用于对DNA片段进行5’末端进行磷酸化处理和3’末端进行去磷酸化处理。
本发明的再一个方面提供了一种环化试剂在制备检测包含DNA的样品中DNA片段的特定基因组位置的甲基化的试剂盒中的用途,其中所述检测包括以下步骤:用亚硫酸氢钠处理包含特定基因组位置的所述DNA片段,所述亚硫酸氢钠处理能够使得DNA片段中未甲基化的胞嘧啶转化为尿嘧啶;将经亚硫酸氢钠处理过的所述DNA片段变性为单链DNA片段;环化所述单链DNA片段;DNA测序。
在一些实施方式中,所述检测进一步包括在所述环化步骤后扩增环化的所述单链DNA片段,并且所述测序步骤为测定扩增产物的序列。
在一些实施方式中,所述检测进一步包括在变性处理前在所述DNA片段一端或两端加上的DNA接头序列。在一些实施方式中,所述检测进一步包括在经亚硫酸氢钠处理前在所述DNA片段一端或两端加上的接头序列。
在一些实施方式中,所述检测进一步包括在将所述单链DNA片段环化前,对所述DNA片段的5’末端进行磷酸化处理和对3’末端进行去磷酸化处理。
在一些实施方式中,所述检测进一步包括在测序步骤前使用寡核苷酸探针富集包含DNA片段的特定基因组位置的扩增产物。
附图说明
通过下面说明书和所附的权利要求书并与附图结合,将会更加充分地描述本申请内容的上述和其他特征。可以理解,这些附图仅描绘了本申请内容的若干实施方式,因此不应认为是对本申请内容范围的限定。通过采用附图,本申请内容将会得到更加明确和详细的说明。
图1:亚硫酸氢钠处理原理示意图;
图2:单链DNA环化处理示意图;
图3:反向PCR扩增包含甲基化位点的序列的示意图;
图4:滚环扩增包含甲基化位点的序列的示意图。
具体实施方式
本发明的一个方面提供了一种检测包含DNA的样品中DNA片段的特定基因组位置的甲基化的方法。
本发明中使用的术语“DNA”即脱氧核糖核酸,是组成遗传指令的长链聚合物生物大分子。DNA的组成单位是核苷酸,DNA中的每个核苷酸由含氮碱基、五碳糖(2-脱氧核糖)和磷酸基团组成。相邻的核苷酸通过脱氧核糖和磷酸形成酯键相连从而组成长链骨架组成。DNA的核苷酸中的含氮碱基一般有四种,分别为腺嘌呤(A)、鸟嘌呤(G)和胞嘧啶(C)、胸腺嘧啶(T)。两条DNA长链上的碱基通过氢键配对,其中腺嘌呤(A)和胸腺嘧啶(T)配对,鸟嘌呤(G)和胞嘧啶(C)配对。
本发明中使用的术语“包含DNA的样品”是指任何包含DNA片段的样品,其中包括但不限于细胞、组织、体液等。在一些实施方式中,所述包含DNA的样品为细胞,例如细菌(包含病毒)或动植物细胞等。在另一些实施方式中,所述包含DNA的样品为体液,例如血液、血浆、血清、唾液、羊水穿刺液、胸腔积液、腹腔积液等。在一些特定的实施方式中,所述包含DNA的样品为血液、血清或血浆。在一些特定的实施方式中,包含在所述样品中的DNA为细胞外的游离DNA(cfDNA)。在一些优选的实施方式中,包含在所述样品中的DNA为循环肿瘤DNA(ctDNA)。
“细胞外的游离DNA”是指在循环系统(例如,血液)中发现的游离于细胞外的DNA。其来源一般认为是由于细胞凋亡过程中释放的基因组DNA。研究发现,人体内绝大部分的细胞外的游离DNA的大小在160bp左右(参见Fan et al.,(2010)Analysis of the Size Distributions of Fetal and Maternal Cell-Free DNA by Paired-End Sequencing,Clin Chem 56:8 1279-86)。
“循环肿瘤DNA”是指来源于肿瘤细胞的细胞外游离DNA。肿瘤细胞在人体内会因为细胞凋亡、免疫反应等原因释放其基因组DNA到血液中。由于正常细胞也同样会将其基因组DNA释放到血液中,因此,一般情况下,循环肿瘤DNA只占细胞外游离DNA的很小一部分。
本发明中使用的术语“DNA甲基化”是指一种表观遗传的修饰方式。在真核生物中,DNA的甲基化仅发生于胞嘧啶,具体是指在DNA甲基转移酶(DNMTs)的催化下,将甲基基团转移到胞嘧啶的上,使得胞嘧啶转变为5-甲基胞嘧啶(mC)的一种修饰。研究表明,DNA的甲基化对DNA的功能有重大影响,特别是DNA甲基化可能引起染色质结构、DNA构象、DNA稳定性及DNA与蛋白质相互作用方式的改变,从而控制基因表达。例如,基因启动子序列的甲基化一般会抑制该基因的表达。在一些研究中发现,DNA甲基化对生物的正常发育是必需的。在另一些研究中发现,DNA甲基化同基因印记,X染色体失活,以及重复元件的抑制有关。特别的,一些研究中发现,DNA甲基化和肿瘤产生相关。
本发明中所述的“DNA片段的特定基因组位置”泛指一切目标检测位置。在一些优选的实施方式中,所述DNA片段的特定基因组位置是指CpG富集的区域,特别是CpG岛区域。在另一些优选的实施方式中,所述DNA片段的特定基因组位置是指其甲基化程度与疾病(例如肿瘤、炎症、出生缺陷等)有关的CpG岛区域。
在一些实施方式中,所述检测包含DNA的样品中DNA片段的特定基因组位置的甲基化的方法包括以下步骤:用亚硫酸氢钠处理包含特定基因组位置的DNA片段,所述亚硫酸氢钠处理能够使得DNA片段中未甲基化的胞嘧啶转化为尿嘧啶;将经亚硫酸氢钠处理过的所述DNA片段变性为单链DNA片段;环化所述单链DNA片段;将所述环化的单链DNA片段制备为包含所述特定基因组位置的DNA测序文库;对所述DNA测序文库进行测序以鉴定所述单链DNA片段的序列。
本发明中所述的“亚硫酸氢钠处理”是指利用亚硫酸氢钠处理目标DNA片段,使得目标DNA片段中未甲基化的胞嘧啶(C)转化为尿嘧啶(U),而甲基化的胞嘧啶保持不变。具体地,在一定的温度和pH条件下,利用亚硫酸氢钠将变性DNA(单链DNA)中的胞嘧啶转化为胞嘧啶-亚硫酸氢盐衍生物,对胞嘧啶-亚硫酸氢盐衍生物进行水解脱氨基,得到尿嘧啶-亚硫酸氢盐衍生物,最后,在一定条件下将尿嘧啶-亚硫酸氢盐衍生物脱磺酸基得到尿嘧啶;在此反应中只有未甲基化的胞嘧啶在亚硫酸氢盐处理下才会发生碱基变化,甲基化的胞嘧啶仍然保持不变。
在一些实施方式中,若起始的DNA片段>5kb,则所述检测包含DNA的样品中DNA片段的特定基因组位置的甲基化的方法进一步包括在亚硫酸氢盐处理前对所述DNA片段进行切割处理(包括但不限于机械打断、使用特定的限制性内切酶进行酶切等),使得切割得到的DNA片段大小适合后续处理,所述适合后续处理的DNA片段大小为0.1-5kb、0.1-1kb、1-2kb、2-3kb、3-4kb、4-5kb、0.2-0.4kb、0.5-1kb或0.1-0.5kb,并且使得所述切割得到的DNA片段包含所述特定基因组位置(目标检测位置)。在一些实施方式中,若起始的DNA片段>0.5kb,则需要在亚硫酸氢盐处理前对所述DNA片段进行切割处理,切割得到的DNA片段大小为0.1-0.2kb、0.1-0.3kb、0.1-0.4kb、0.2-0.3kb、0.2-0.4kb、0.2-0.5kb、0.3-0.4kb、0.3-0.5kb、0.4-0.5kb或0.1-0.5kb。
本发明中所述的“将DNA片段变性为单链DNA的方法”是指本领域技术人员公知的任何方法,包括但不限于热变性(例如高于90℃)、碱(例如NaOH)处理等。
在一些实施方式中,在亚硫酸氢钠处理前对所述DNA片段进行切割处理,使得切割得到的DNA片段大小为0.1-5kb、0.1-1kb、1-2kb、2-3kb、3-4kb、4-5kb、0.2-0.4kb、0.5-1kb或0.1-0.5kb,并且所述切割得到的DNA片段包含所述特定基因组位置。
在一些实施方式中,包含在所述样品中的DNA为细胞外的游离DNA。在一些实施方式中,包含在所述细胞外的游离DNA优选地为循环肿瘤DNA。
在一些实施方式中,在变性处理前在所述DNA片段一端或两端加上DNA接头。在另一些实施方式中,在经亚硫酸氢钠处理前在所述DNA片段一端或两端加上接头。在一些实施方式中,所述接头可耐受亚硫酸氢盐处理。
本发明中所述的“接头”是指根据需要在DNA片段(单链或双链)的一端或两端附加的特异性DNA序列,其通常在5-50bp长度范围内。在一些实施方式中,在DNA片段为双链的情况下,可以通过设计在单链接头中包含与DNA片段的末端连接的序列或部分(例如杂交互补区、或者随机杂交短序列,例如poly-T),之后通过将所述接头与目标DNA片段的互补链进行分子杂交,并且在杂交后通过加入聚合酶(如逆转录酶)来延伸接头将所述接头连接至目标DNA片段的末端。在另一些实施方式中,在DNA片段为双链并且DNA片段末端为粘性末端的情况下,可以设计接头序列并利用与接头互补的序列与其退火互补形成具有粘性末端的结构,之后通过连接酶将该互补短序列连接至目标DNA双链上,在后续过程中使DNA变性形成单链,从而达到在DNA片段末端加上接头的目的。在又一些实施方式中,在DNA片段为单链的情况下,可以对DNA片段及接头序列进行磷酸化、去磷酸化处理,后利用单链连接酶将接头序列连接至DNA片段的末端。
本发明中所述的“可耐受亚硫酸氢盐”是指所述接头中不含胞嘧啶或者不含未甲基化的胞嘧啶,从而在DNA片段经亚硫酸氢钠处理时,所述接头的序列不发生改变。
在一些实施方式中,所述在DNA片段一端或两端加上的接头包含第二类限制性内切酶位点。本发明中所述“第二类限制性内切酶”是指能识别和切割特定的4~8个碱基对序列的内切酶,其中大多数被识别的序列具有回文结构;第二类限制性内切酶的切割方式有三种:1)切割产生5'突出的粘性末端(sticky ends),2)切割产生3'突出的粘性末端,3)切割产生平头末端(blunt ends)。本发明中所述“第二类限制性内切酶位点”包括本领域技术人员公知的任何第二类限制性内切酶位点,包括但不限于:ApaI、BamHI、BglII、EcoRI、HindIII、HpaII、KpnI、MspI、NcoI、NdeI、NheI、NotI、SacI、SalI、SmaI、SphI、XbaI、XhoI、XmaI。在一些实施方式中,所述第二类限制性内切酶选自下组:HpaII、MspI、SmaI、XmaI、BamHI。在一些实施方式中,在所述DNA片段两端均加上接头,并且两端加上的限制性内切酶位点接头是相同的。例如,在一些实施方式中在所述DNA片段两端均加上选自下组中的任意一种限制性内切酶位点接头:HpaII、MspI、SmaI、XmaI、BamHI。在另一些实施方式中,在所述DNA片段两端均加上接头,并且两端加上的限制性内切酶位点接头是不同的。例如,在一些实施方式中在所述DNA片段两端加上选自HpaII、MspI、SmaI、XmaI、BamHI中的任意两种限制性内切酶位点接头的组合,例如:HpaII/MspI、SmaI/XmaI的组合等。
在一些实施方式中,所述在DNA片段一端或两端加上的接头包含DNA分子标签。本发明中使用的术语“分子标签”是指一段用于作为标签的序列,其可被连接至所述DNA片段的5’端或者3’端。在DNA测序中,特别是在高通量测序技术中,分子标签被用以标记特定的序列,在经过扩增、测序后可以根据标签序列的计数来确定被标记基因的表达量。
本发明中所述的“环化单链DNA片段的方法”是指本领域技术人员公知的任何方法,包括但不限于使用高效环化试剂环化单链DNA。在一些实施方式中,所述高效环化试剂环化是DNA连接酶。在一些实施方式中,所述DNA连接酶是单链DNA连接酶(例如但不限于CircLigaseTM ssDNA Ligase,Epicentre科技公司),其是一种热稳定的、APT依赖的连接酶,其能够催化单链DNA的5'-磷酸和3'-羟基基团的连接,从而使单链DNA环化。CircLigaseTMssDNA Ligase与T4DNA Ligase和DNA Ligase不同,T4DNA Ligase和DNA Ligase仅能够连接彼此相邻的互补的DNA序列的末端,而CircLigaseTMssDNA Ligase可以在没有互补序列存在的情况下连接单链DNA末端,大于15个碱基的线性单链DNA,包括cDNA,均可被CircLigase环化。因此,该酶在将线性单链DNA连接成环状单链DNA中具有重要作用。环状的单链DNA分子可被用作滚环复制或滚环转录研究的底物。
在一些实施方式中,在将所述单链DNA片段环化前,对所述DNA片段的5’末端进行磷酸化处理和对3’末端进行去磷酸化处理。所述5’末端的磷酸化和3’末端的去磷酸化可以通过本领域技术人员公知的任何方法进行,包括但不限于利用T4多聚核苷酸激酶(T4PNK)催化。T4PNK是一种多聚核苷酸5'羟基激酶,可以催化ATP的γ位磷酸基团向单链或双链DNA、RNA、寡核苷酸或带有3'磷酸基团的单核苷酸的5'羟基转移。其他NTP也可产生相同的反应:5'-OH+NTP→5'-P+NDP。T4PNK同时具有3'磷酸酯酶活性,可催化3'磷酸化的多聚核苷酸的去磷酸化:3'-P→3'-OH+Pi(最适pH为5.9左右)。T4PNK的激酶活性在C-末端附近,而磷酸酯酶活性在N-末端附近,因此可用于使寡核苷酸、DNA或RNA的5'端磷酸化和/或去除3'端磷酸基团,以确保后续连接反应顺利进行。
本发明中所述的“DNA测序文库”是指丰度达到可测序的程度的DNA片段集合,其中所述DNA片段集合中每条片段的一端或两端包含与测序用引物部分或全部互补的特定序列,从而可以直接用于后续的测序上机。
在一些实施方式中,将环化的单链DNA片段制备为DNA测序文库的步骤包括:在所述环化步骤后扩增环化的所述单链DNA片段,并且获得由包含所述特定基因组位置的DNA的扩增产物组成的所述DNA测序文库。在一些实施方式中,所述扩增的步骤使用反向PCR扩增。在一些实施方式中,所述扩增的步骤使用滚环扩增。在一些实施方式中,将环化的单链DNA片段制备为DNA测序文库的步骤包括在扩增产物的一端或两端加上可用于测序的接头序列。在一些实施方式中,在变性处理前、或者在经亚硫酸氢钠处理前在所述DNA片段一端或两端加上接头。在一些实施方式中,所述在DNA片段一端或两端加上的接头包含与扩增步骤使用的引物部分或全部互补的序列。
本发明所述的“反向PCR”是指在已知一段序列的情况下,通过基于该已知序列设计引物,并且在引物外侧合成DNA从而达到扩增已知序列旁侧的DNA的目的。在本发明的一些实施方式中,反向PCR中的已知序列为所述DNA片段的特定基因组位置中的一段已知序列。在本发明的另一些实施方式中,反向PCR中的已知序列可以为前述的在DNA片段两端加上的接头的部分或全部。
本发明所述的“滚环扩增”是指一条引物结合到环状DNA上后,在DNA聚合酶作用下被延伸,产物是具有大量重复序列(与环状DNA完全互补)的线状DNA单链。同样的,在本发明的一些实施方式中,滚环扩增中的引物可以是针对所述DNA片段的特定基因组位置中的一段已知序列的。或者,在本发明的另一些实施方式中,滚环扩增中的引物可以包括与前述的在DNA片段两端加上的接头的部分或全部互补的序列。
在一些实施方式中,所述测序步骤使用高通量DNA测序技术测定所述扩增产物的序列。
经亚硫酸氢钠处理后的DNA在测序时,或者上述经亚硫酸氢钠处理后的DNA在经扩增后(例如经反向PCR扩增或者滚环扩增后),由未甲基化的胞嘧啶(C)转化的尿嘧啶(U)将转变为胸腺嘧啶(T)。通过对经亚硫酸氢盐处理的DNA片段进行测序并将测序结构与未被亚硫酸氢盐处理的DNA片段的序列(已知序列或者通过对未被亚硫酸氢盐处理的DNA片段进行测序得到的测序结果)进行比较,可以确定DNA片段中的特定基因组位置的甲基化情况,具体地可以通过在序列比对结果发现具有由C到T的转变的位置即为未被甲基化的位置。
在一些实施方式中,所述的方法中的将环化的单链DNA片段制备为DNA测序文库的步骤进一步包括:在扩增步骤后使用寡核苷酸探针富集所述扩增产物。本发明中所述的“使用寡核苷酸探针富集包含所述特定基因组位置的DNA的扩增产物”的步骤可以通过本领域技术人员公知的任何方法完成,例如但不限于磁珠富集、标签pull-down等。
本发明的另一个方面提供了一种检测包含DNA的样品中DNA片段的特定基因组位置的甲基化的试剂盒。在一些实施方式中,该试剂盒包括:亚硫酸氢钠,所述亚硫酸氢钠以使得DNA片段中未甲基化的胞嘧啶转化为尿嘧啶;环化试剂,所述环化试剂可以将单链DNA片段环化;测序试剂。
在一些实施方式中,该试剂盒进一步包括切割试剂,其可用于在亚硫酸氢钠处理前对所述DNA片段进行切割处理,使得切割得到的DNA片段大小适合后续处理,所述适合后续处理的DNA片段大小为0.1-5kb、0.1-1kb、1-2kb、2-3kb、3-4kb、4-5kb、0.1-0.5kb、0.5-1kb或0.2-0.4kb,并且使得所述切割得到的DNA片段包含所述特定基因组位置(目标检测位置)。在一些实施方式中,所述切割试剂为盐溶液。在一些实施方式中,所述切割试剂为TE溶液(需要配合使用不包含在试剂盒内的DNA机械打断仪器)。在另一些实施方式中,所述切割试剂为内切酶(或内切酶及其反应溶液)。
在一些实施方式中,该试剂盒进一步包括扩增试剂,其可用于扩增包含特定基因组位置的单链环状DNA。在一些实施方式中,所述扩增试剂包括DNA聚合酶、反应溶液和dNTPs。在一些实施方式中,所述扩增试剂为反向PCR扩增试剂。在另一些实施方式中,所述扩增试剂为滚环扩增试剂。
在一些实施方式中,该试剂盒进一步包括接头连接试剂,其可用于在变性处理前、或者在经亚硫酸氢钠处理前在所述DNA片段一端或两端加上接头序列。在一些实施方式中,所述接头连接试剂包括接头序列DNA片段、连接酶、反应溶液。在一些实施方式中,所述接头序列DNA片段包括选自下组的一种或几种:限制性内切酶位点序列、分子标签序列、与扩增步骤使用的引物部分或全部互补的序列。
在一些实施方式中,所述环化试剂为高效环化试剂。在一些实施方式中,所述高效环化试剂为CircLigase。在一些实施方式中,所述环化试剂进一步包括T4PNK,其可用于对DNA片段进行5’末端进行磷酸化处理和3’末端进行去磷酸化处理。
本发明的再一个方面提供了一种环化试剂在制备检测包含DNA的样品中DNA片段的特定基因组位置的甲基化的试剂盒中的用途,其中所述检测包括以下步骤:用亚硫酸氢钠处理包含特定基因组位置的所述DNA片段,所述亚硫酸氢钠处理可以使得DNA片段中未甲基化的胞嘧啶转化为尿嘧啶;将经亚硫酸氢钠处理过的所述DNA片段变性为单链DNA片段;环化所述单链DNA片段;DNA测序。
在一些实施方式中,所述检测进一步包括在所述环化步骤后扩增环化的所述单链DNA片段,并且所述测序步骤为测定扩增产物的序列。
在一些实施方式中,所述检测进一步包括在变性处理前、或者在经亚硫酸氢钠处理前在所述DNA片段一端或两端加上的接头序列。
在一些实施方式中,所述检测进一步包括在将所述单链DNA片段环化前,对所述DNA片段的5’末端进行磷酸化处理和对3’末端进行去磷酸化处理。
在一些实施方式中,所述检测进一步包括在测序步骤前使用寡核苷酸探针富集包含特定基因组位置DNA片段的的扩增产物。
实施例
以下将通过一些非限制性实施例进一步描述本发明。需要说明的是这些实施例仅用于进一步说明本发明的技术特征,并非旨在也不能够被解释为对本发明的限制。所述实验例不包含本领域一般技术人员所公知的传统方法(不同种类样本中DNA的提取、纯化等)的详细描述。
亚硫酸氢钠处理
首先,通过DNA提取试剂盒或者通过DNA富集工具(DNA吸附柱、磁珠等)等提取或富集样品中包含的DNA,利用Nanodrop测量DNA浓度,并进行记录。
取2μg DNA,用双蒸水稀释至200μl,根据实际需求选择使用DNaseI酶或者限制性内切酶进行消化、超声打断、反复冻融等方法使上述DNA断裂为约200-800bp的片段(可选步骤)。通常采用超声打断,使用参数为振幅40、功率50w、时间15sec、间隔5sec、次数15,0-4℃低温下进行(超声参数可以根据实际情况进行摸索调整)。利用凝胶电泳确认经处理后的DNA片段大小在所需范围内。
取0.5μg的上述DNA于1.5ml EP管中,并加入5.5μl新鲜配置的3M的NaOH溶液,将EP管置于42℃水浴中孵育30min(在此过程中发生DNA变性得到单链DNA)。水浴期间,配制10mM氢醌和3.6mM亚硫酸氢钠溶液。其中3.6M的亚硫酸氢钠溶液配置步骤如下:使用双蒸水溶解1.88g亚硫酸氢钠,并以3M的NaOH滴定溶液至pH为5.0,定容为5ml。在42℃水浴孵育30min结束后,取30μl上述10mM氢醌至EP管中(溶液变成淡黄色),之后再取520μl上述3.6M的亚硫酸氢钠溶液加入EP管中。在EP管外包上铝箔纸,轻柔颠倒混匀溶液,之后在EP管中加入200μl石蜡油封液,以防止水分蒸发。将上述EP管进一步置于50℃水浴中避光孵育16hr(完成胞嘧啶-亚硫酸氢盐衍生物至尿嘧啶-亚硫酸氢盐衍生物的转化)。之后利用市售的DNA纯化柱等方式将包含尿嘧啶-亚硫酸氢盐衍生物的DNA吸附于纯化柱上,经纯化洗脱后得到50μl的DNA洗脱液。加入5.5μl新鲜配制的3M NaOH,室温放置15min;之后加入33μl 10M的乙酸铵以中和NaOH,使溶液pH于7.0左右,并加入4μl 10mg/ml的糖原作为沉淀指示剂(因为其与乙醇混合后可产生沉淀,便于在用乙醇沉淀离心后识别回收物);最后在溶液中加入270μl的冰(0-4℃)无水乙醇,将EP管置于-20℃环境中2-6hr(或过夜)以沉淀DNA(对应脱磺酸基步骤)。经沉淀的DNA可经多次70%的乙醇洗涤后干燥,再用双蒸水复溶获得经亚硫酸氢钠处理修饰后的DNA溶液。
在此反应中只有未甲基化的胞嘧啶在亚硫酸氢盐处理下才会发生碱基变化,甲基化的胞嘧啶仍然保持不变(参见图1)。
应当理解,上述亚硫酸氢钠处理的实验操作仅为示例性的,本领域技术人员可以采用任何市售的亚硫酸氢钠处理试剂盒完成该步骤,其中在该步骤中使用的试剂、反应条件、反应时间等各不相同但基本原理基本一致。
DNA环化
可选地,可以对上述经亚硫酸氢盐处理的DNA片段进行5’末端的磷酸化和3’末端的去磷酸化处理(参见附图2中虚线框中内容)。具体地,可以使用T4PNK并依照相应的说明书配置反应液并进行DNA片段的处理。例如,在50μl反应体系中加入5-50pmol单链DNA模板、5μl的10x T4PNK反应溶液、1μl的1mM ATP和10U的T4PNK酶,定容至50μl后将反应体系置于37℃孵育30分钟,最后经80℃孵育10min以使得T4PNK失活。
将经亚硫酸氢盐处理的DNA片段(经5’末端的磷酸化和3’末端的去磷酸化处理或未经该处理)置于95℃孵育2min使得上述DNA片段变性为单链DNA片段。接着根据如下配方配置反应液:10pmol单链DNA模板、2μl CircLigase10x的反应溶液、1μl 1mM的ATP、1μl 50mM的MnCl2、1μl CircLigaseTM ssDNA Ligase(100U),定容至20μl。并将上述配置的反应液置于60℃孵育1个小时。最后将反应溶液置于80℃孵育10min以使得CircLigaseTM ssDNA Ligase失活。(参见附图2中实线框中内容)
环化DNA的扩增
上述环化的DNA可以直接用于后续测序,或者当该环化的DNA丰度较低时,可以先对其进行扩增再将扩增产物应用于后续的测序步骤中去。
对环化DNA的扩增可以采取本领域技术人员公知的任何方法,较为常见的包括反向扩增和滚环扩增。
反向PCR扩增
反向PCR扩增可用于研究与已知DNA区段相连接的未知区段的序列,也可用于扩增环状的DNA片段,其中使用的引物对虽然与已知DNA区段内的两段相邻序列互补,但两引物3’端是相互反向的(参见附图3中的引物对:引物1和引物2、引物3和引物4;即每对引物对中两个引物的5’端相邻)。通过反向PCR扩增引物向上下游进行延伸,从而环状DNA的线性扩增产物(具体参见附图3)。
在反向PCR扩增中使用的反应条件与经典的聚合酶链反应所用条件的相似,例如使用Taq聚合酶,先对DNA进行94℃的30秒变性,之后重复58℃引物退火30秒合70℃延伸3分钟的步骤30个循环。
滚环扩增
可使用针对环化DNA已知的部分序列设计的引物或以针对环化DNA在环化前一端或两端接入的接头部分序列的引物来扩增环化的DNA,以产生多拷贝的线性连接的环化DNA的互补序列(参见附图4)。在滚环扩增中使用的反应条件也与经典的聚合酶链反应所用条件的相似,在此不做赘述。
DNA片段的接头
在环化前,或者在亚硫酸氢盐处理前,可以根据需要将特异性序列结合到DNA片段(单链或双链)的一端或两端,被加到DNA片段两端的特异性序列分别称为第一接头和/或第二接头。
在一个实施方案中,第一接头含有能使其与DNA片段的末端连接的序列或部分(例如杂交互补区、或者随机杂交短序列,例如poly-T),则可通过与目标DNA片段的互补链进行分子杂交,并且在杂交后通过加入聚合酶(如逆转录酶)来延伸该第一接头将所述第一接头连接至目标DNA片段的末端(在此情况下,目标DNA片段处于双链状态下)。
在另一个实施方案中,第一接头可选择地可以包含能用于后续环化、扩增的其它特定的序列。不限于上述概念,这种特定的序列可能包含有限制性内切核酸酶位点、聚合酶结合位点、聚合酶终止位点、发夹环结构等。例如,该接头可含有限制性内切酶位点,借此可在DNA的一端或两端产生粘性末端。如果DNA片段两端均连接了能够产生粘性末端的接头,并且这两个粘性末端是互补的,则所得到的具有接头的DNA片段可以被环化。将第一接头连接于DNA片段。又例如,该接头可能含有与后续扩增使用的引物的部分或全部区域互补的序列。
在又一个实施方案中,第一接头可选择的可在其3’端或其5’端包含分子标签或包含特定序列。在后续的扩增中可以利用上述分子标签或特定序列对目标DNA进行特异性的扩增。或者在后续的测序中可以利用上述分子标签或特定序列对于包含该特定序列的分子进行特异性的富集。
在一些特殊的实施方案中,接头可选择的可包含上述的一种或多种。
DNA测序
使用高通量DNA测序的方法对DNA文库进行测序。测序前可以通过利用寡核苷酸探针对目标测序DNA进行富集。
对于DNA甲基化的测序可以基本通过对经亚硫酸氢盐处理的DNA片段、或者经扩增的经亚硫酸氢盐处理的DNA片段进行测序并将测序结构与未被亚硫酸氢盐处理的DNA片段的序列(已知序列或者通过对未被亚硫酸氢盐处理的DNA片段进行测序得到的测序结果)进行比较,之后通过在序列比对结果发现具有由C到T的转变的位置即可能为被甲基化的位置。根据每个可能被甲基化的位置在多个拷贝中出现的频率评估该位置是否确实存在甲基化。
应当理解,尽管在上文的实施例中详细地描述了本发明公开的方法的一些具体步骤的操作方法,但是这种描述仅仅是示例性的而并非是对本发明的限制。实际上,根据本发明的实施例,本技术领域的一般技术人员可以通过研究说明书、公开的内容及附图和所附的权利要求书,理解和实施对披露的实施方式的其他改变。在权利要求中,措词“包括”不排除其他的元素和步骤,并且措辞“一”、“一个”不排除复数。
- 还没有人留言评论。精彩留言会获得点赞!