一株生防链霉菌及其应用的制作方法
本发明属于微生物农药技术领域,具体涉及一株生防链霉菌及其应用。
背景技术:
随着人们对生态平衡、有机食品和绿色健康的概念越来越重视和深入了解,生物防治手段因其可以有效地避免化学农药所带来的一系列问题,同时又具有深刻的社会效益、生态效益和长远利益,在农业生产中得到了广泛且前所未有的关注,在农业科学可持续发展的大背景下,生物防治也是农业发展的必由之路。放线菌是最早应用最为广泛的生防微生物,在植物病害的生物防治中发挥了巨大作用。放线菌仍然是目前世界范围内研制开发新医药、新农药和生物防治活菌剂的研究热点,其种类繁多代谢功能各异,是一类有着广泛实际用途的微生物资源。
桃子是最为人们喜爱的水果之一,桃树也已成为很多地区的支柱产业。由链核盘菌(Monilinia spp.)引起的褐腐病是桃生产中最重要的病害之一,也是世界范围内核果类最重要的采后病害。此病在采前、采后及贮藏运输期均可造成大量减产,采后尤为严重,在欧美损失高达59-90%。但桃褐腐病是桃果生长期和贮藏期的一种常见且发生严重的病害,呈世界性分布。中国的南北方均有发生,尤其以浙江、山东等沿海地区和江淮流域的桃产区发生最重,自2000年以来,桃褐腐病在北京的平谷区普遍发生,且逐年加重。很多研究报道,果实的腐烂主要归因于病原微生物的侵入所致。为了能有效地减少水果采后腐烂引起的损失,长期以来人们多采用低温、气调、减压等物理措施配合使用化学农药进行防治褐腐病等诸多真菌病害的发生。但目前主要应用化学药剂防治该病害,虽能有效、快速地达到防治目的,但大量使用会造成农药残留、污染环境和对人类健康产生不良影响,如长期单一使用,病菌会产生抗性,如上所述,生物防治因具备对环境安全、无污染且成本较低,符合农业生态和可持续发展的要求,成为目前研究和开发的热点。
技术实现要素:
本发明所要解决的技术问题是如何抑制植物病原菌并促进植物生长。
为解决以上技术问题,本发明提供了一株链霉菌。
本发明所提供的链霉菌,稻瘟霉素链霉菌(Streptomyces blastmyceticus),其菌株号为JZB130180,其在中国微生物菌种保藏管理委员会普通微生物中心的登记入册编号为CGMCC No.13270。下文中简称为稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180或菌株JZB130180。
稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180在固体培养基上,菌落呈规则边缘整齐的圆形,菌体呈黄色,菌落表面出现皱缩,中央凸起,随着培养时间的延长,出现灰白色的孢子堆。稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180为革兰氏阳性菌,可液化明胶,接触酶和氧化酶阳性,能将牛奶凝固和胨化,能将淀粉水解,能微弱利用柠檬酸盐,不产生黑色素和硫化氢。稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180具有序列表中的序列1的16S rDNA序列,具有序列表中序列2-4所示的atpD,recA,rpoB基因序列。
为解决以上技术问题,本发明提供了含有稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180或/和稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180的代谢物的菌剂。
上述菌剂具体可为病原菌抑制剂或病害抑制剂。
上述病原菌抑制剂的活性成分可为稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180或/和稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180的代谢物,上述病原菌抑制剂的活性成分还可含有其他生物成分或非生物成分,上述病原菌抑制剂的其他活性成分本领域技术人员可根据对病原菌的抑制效果确定。
上述病害抑制剂的活性成分可为稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180或/和稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180的代谢物,上述病害抑制剂的活性成分还可含有其他生物成分或非生物成分,上述病害抑制剂的其他活性成分本领域技术人员可根据对病害的抑制效果确定。
稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180或/和稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180的代谢物的下述任一种应用也属于本发明的保护范围:
1)在抑制病原菌中的应用;
2)在制备病原菌抑制剂中的应用;
3)在制备病害抑制剂中的应用;
4)在抑制病害中的应用。
上文中,所述病原菌可为下述全部或部分病原菌:植物灰霉病菌,植物褐腐病菌,小麦纹枯病菌,小麦赤霉病菌,小麦全蚀病菌,辣椒炭疽病菌,葡萄炭疽病菌,植物枯萎病菌,水稻纹枯病菌,百合根腐病菌,苹果轮纹病菌,辣椒疮痂病菌,黄瓜角斑病菌,茄子青枯病菌,蜡状芽胞杆菌,土壤根癌杆菌和大白菜黑腐病菌。
所述植物枯萎病菌可为下述病菌中的全部或部分:黄瓜枯萎病菌,棉花枯萎病菌,西瓜枯萎病菌和甘蓝枯萎病菌。
所述芽胞杆菌可为蜡状芽胞杆菌。
所述植物褐腐病菌中,所述植物的果实为核果,如桃。植物褐腐病菌具体可为美澳型核果链核盘菌(Monilinia fructicola)。
所述植物灰霉病菌中,所述植物可为茄科植物,如番茄。
上文中,所述病害可为下述全部或部分病害:植物灰霉病,植物褐腐病,小麦纹枯病,小麦赤霉病,小麦全蚀病,辣椒炭疽病,葡萄炭疽病,植物枯萎病,水稻纹枯病,百合根腐病,苹果轮纹病,辣椒疮痂病,黄瓜角斑病,茄子青枯病和大白菜黑腐病。
所述植物枯萎病可为下述四种病中的全部或部分:黄瓜枯萎病,棉花枯萎病,西瓜枯萎病和甘蓝枯萎病。
所述植物褐腐病中,所述植物的果实可为核果,如桃。
所述植物灰霉病中,所述植物可为茄科植物,如番茄。
上文中,所述菌剂中,除所述活性成分外,还含有载体。所述载体可为农药领域常用的且在生物学上是惰性的载体。所述载体可为固体载体或液体载体;所述固体载体可为矿物材料、植物材料或高分子化合物;所述矿物材料可为粘土、滑石、高岭土、蒙脱石、白碳、沸石、硅石和硅藻土中的至少一种;所述植物材料可为玉米粉、豆粉和淀粉中的至少一种;所述高分子化合物可为聚乙烯醇或/和聚二醇;所述液体载体可为有机溶剂、植物油、矿物油或水;所述有机溶剂可为癸烷或/和十二烷。
所述菌剂的剂型可为多种剂型,如液剂、乳剂、悬浮剂、粉剂、颗粒剂、可湿性粉剂或水分散粒剂。
根据需要,所述菌剂中还可添加表面活性剂(如吐温20、吐温80等)、粘合剂、稳定剂(如抗氧化剂)、pH调节剂等。
稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180或/和稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180的代谢物在促进植物生长中的应用也属于本发明的保护范围。
上述应用中,所述植物可为下述任一种植物:
P1)种子植物;
P2)双子叶植物;
P3)茄科植物;
P4)番茄。
上述应用中,所述促进植物生长可为提高植物主根长度和/或提高植物须根数和/或提高茎高和/或植株重量。
上文中,稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180的代谢物可从稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180的发酵液中获得。稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180的代谢物具体可按照如下方法制备:在液体培养基中培养稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180,除去液体培养物(发酵液)中的稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180即得到稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180的代谢物。
本申请中,所述番茄灰霉病菌可为灰葡萄孢(Botrytis cinerea)。
稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180对农业生产上发生严重的14种植物病原真菌和6种植物病原细菌有显著的拮抗作用,抑菌谱广。该菌株产生几丁质酶、纤维素酶、蛋白酶和嗜铁素,具备生防菌的基本特征,该菌株的发酵液对番茄灰霉病和桃褐腐病有较强的防控效果,且对番茄植株具有明显的促生作用,说明该菌株在植物病害的生物防治领域具有广阔的应用前景。
保藏说明
菌种名称:稻瘟霉素链霉菌(Streptomyces blastmyceticus)
菌株编号:JZB130180
保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
保藏机构简称:CGMCC
地址:北京市朝阳区北辰西路1号院3号
保藏日期:2016年11月14日
保藏中心登记入册编号:CGMCC No.13270
附图说明
图1为分离平板。
其中,A-E为土壤分离时平板上的菌落,F为纯化后保存的放线菌斜面。
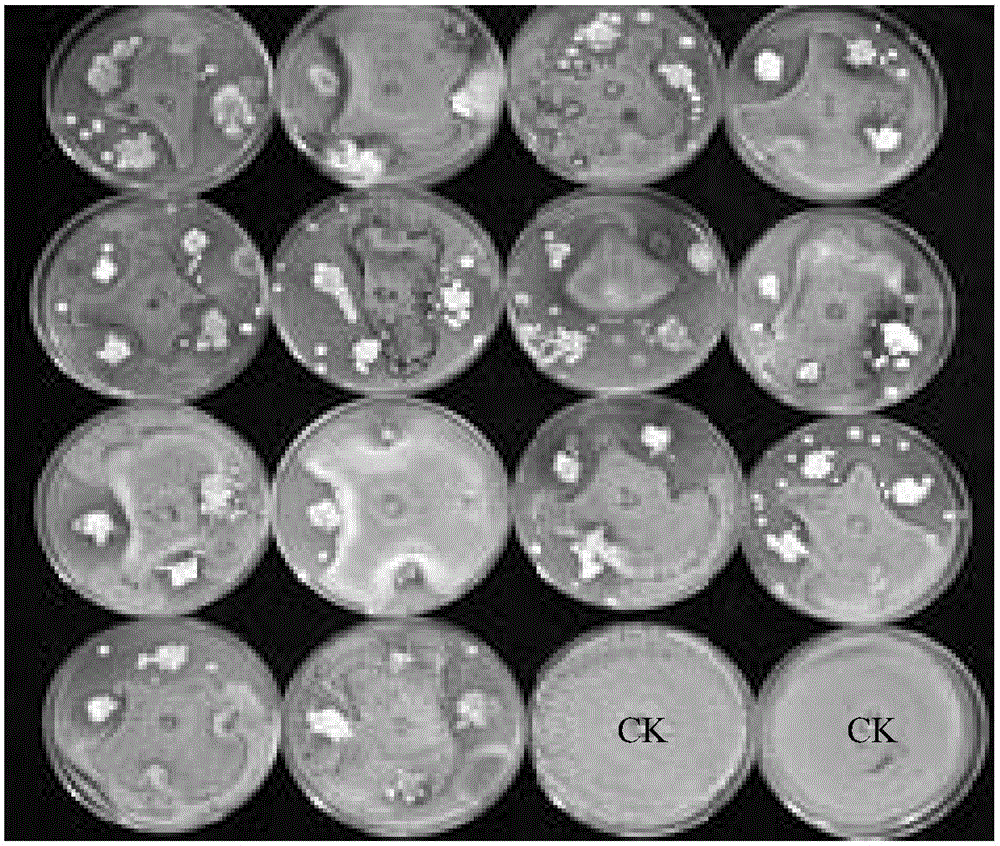
图2为平板拮抗活性测定对桃褐腐病菌的拮抗结果。
其中,CK为桃褐腐病菌对照。
图3为菌株JZB130180在三种培养基上的培养状态(左图)及在400倍光镜下的菌丝体形态(右图)。
图4为菌株JZB130180鉴定中的PCR扩增结果。
M:DL2000DNA Marker,泳道1和2:提取的DNA样品;泳道3-6:依次为16S rDNA,atpD,recA,rpoB的基因扩增条带。
图5为基于菌株JZB130180的16S rDNA序列构建的系统发育树。
图6为菌株JZB130180对植物病原菌的抑菌测定结果。
其中,A:小麦纹枯病菌,B:小麦赤霉病菌,C:小麦全蚀病菌,D:辣椒炭疽病菌,E:葡萄炭疽病菌,F:桃褐腐病菌,G:番茄灰霉病菌,H:黄瓜枯萎病菌,I:棉花枯萎病菌,J:西瓜枯萎病菌,K:甘蓝枯萎病菌,L:水稻纹枯病菌,M:百合根腐病菌,N:苹果轮纹病菌,O:辣椒疮痂病菌,P:黄瓜角斑病菌,Q:茄子青枯病菌,R:蜡状芽胞杆菌,S:根癌土壤杆菌C58,T:大白菜黑腐病菌。
图7为菌株JZB130180产与生防相关胞外酶的检测。
其中,A:几丁质酶检测;B:蛋白酶检测;C:纤维素酶检测;D:嗜铁素检测
图8为菌株JZB130180无菌发酵滤液对桃褐腐病菌的抑菌效果。
图9为桃褐腐病菌在含毒介质中生长情况。
其中,1~6表示菌株JZB130180无菌发酵滤液在含毒介质中的浓度依次为0μg/mL12.5μg/mL、25.0μg/mL、50.0μg/mL、100μg/mL、200μg/mL。
图10为菌株JZB130180无菌发酵滤液对桃褐腐病的抑制效果。
其中,1-3行依次为处理B1、处理C1和阴性对照。
图11为菌株JZB130180无菌发酵滤液对番茄灰霉病的抑制效果。
其中,1-4行依次为处理B2、处理C2、处理D和阴性对照。
图12为菌株JZB130180无菌发酵滤液对番茄植株的促生作用测定。
其中,AZ10、BZ10和CZ10为浸种处理的从播种起10天的结果;DZ20为浸种处理的从播种起20天的结果;DG20为灌根处理的从播种起20天的结果;EZ30为浸种处理的从播种起30天的结果;EG30为灌根处理的从播种起30天的结果;FZ40为浸种处理的从播种起40天的结果;FG40为灌根处理的从播种起40天的结果。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中所用到的病原菌公众可从野外采集,也可从北京市农林科学院获得,以重复本申请实验:
甘蓝枯萎病菌——尖孢镰刀菌粘团专化型[Fusarium oxysporum Schl.f.sp.conglutinans(Wollenw.)Snyder&Hansen](李明远等.十字花科蔬菜枯萎病及其病原鉴定.植物保护.2003,29(6):44-45);
西瓜枯萎病菌(Fusarium oxysporum f.sp.niveum)(耿丽华等.西瓜枯萎病菌生理小种鉴定技术体系的建立和验证.中国蔬菜.2010,(20):52-56)
小麦纹枯病菌(Rhizoctonia cerealis)(纪兆林等.小麦纹枯病菌毒素对小麦植株的作用.扬州大学学报(农业与生命科学版)).2011,3 2(3):55-59);
小麦全蚀病菌(Gaeumannomyces graminis(Sacc.)Arx&Olivier var.tritici J.Walker)(刘卫国.药剂处理对小麦全蚀病防效及其产量因素的影响.湖北农业科学.2012,51(16):3483-3487);
番茄灰霉病菌——灰葡萄孢(Botrytis cinerea Per.ex Fr.)(李兴红等.北京地区番茄灰霉病菌对嘧霉胺的抗药性检测.植物保护.2012,38(4):141-143);
桃褐腐病菌——链核盘菌(Monilinia fructicola(wint.)Rehm)(王菲等.桃褐腐病的发生与防治.果树花卉.2012,5:58);
辣椒炭疽病菌(Colletotrichum capsici)(宋根苗等.噻霉酮和苯醚甲环唑混配对4种不同病原菌的增效作用.植物保护.2012,38(4):171-174);
葡萄炭疽病菌——胶孢炭疽菌(Colletortrichum gloeosporioides Penz.e t Sacc.)(李利霞等.葡萄炭疽病菌S R AP遗传多样性分析.中国农学通报.2012,2 8(1 2):230-235);
黄瓜角斑病菌(Pseudomonas syringae pv.lachrymans)(A.T.Alleyne.et.al.Identification of Pseudomonas syringae pv.lachrymans in Barbados by rep-PCR.Journal of Agricultural Science and Technology B1.2001,593-597);
茄子青枯病菌(Ralstonia solanacearum)(封林林等.茄子青枯病抗性材料的鉴定及性状观察.长江蔬菜.2000,(10):35-37);
大白菜黑腐病菌(Xanthomonas campestris pv.campsetris)(翟文慧等.大白菜黑腐病鉴定的湿度试验及其苗期与成株期抗病性的相关分析.中国蔬菜.2010,(10):59-63);
百合根腐病菌-尖孢镰孢(Fusarium oxysporum Schlecht)(安智慧等.百合根腐病病原鉴定及防治方法.中圈蔬菜.2010,(3):23-24)
根癌土壤杆菌C58(Agrobacterium tumefaciens C58cereon)(范成明等.根癌土壤杆菌C58Cereon中分泌蛋白信号肽分析.微生物学报.2005,45(4):561-566);
小麦赤霉病菌(Fusarium graminearum Schw.)(陈然等,小麦赤霉病生物防治研究进展.河南农业科学.2014,43(12):1-5)
黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerinum Owen)(韦巧婕等.黄瓜枯萎病拮抗菌的筛选鉴定及其生物防效.南京农业大学学报.2013,36(1):40-46)
棉花枯萎病菌(Fusarium oxysporum f.sp.vasinfectum)(朱薇玲等,棉花枯萎病菌的拮抗细菌筛选.2006,25(2):7-9)
水稻纹枯病菌(Rhizoctonia solani)(陈思宇等,水稻纹枯病菌拮抗细菌的筛选及鉴定.植物保护学报.2013,40(3):211-218)
苹果轮纹病菌(Botryosphaeria dothidea)(刘保友等,苹果轮纹病菌对苯醚甲环唑和氟硅唑的敏感性及其交互抗性.植物病理学报.2013,43(5):541-548)
辣椒疮痂病菌(Xanthomonas vesicatoria)(向平安等,辣椒疮痂病菌(Xanthomonas vesicatoria)和水稻细菌性条斑病菌(X.oryzae pv.oryzicola)的质粒及其与耐链霉素和耐铜性关系.植物病理学报.2003,33(4):330-333)
蜡状芽胞杆菌(Bacillus cereus)(卫昆等,蜡状芽胞杆菌对芘的降解特性及降解酶研究.环境科学学报.2016,36(2):506-512)
下述实施例中涉及的部分培养基如下:
马铃薯葡萄糖琼脂培养基(PDA):马铃薯200g,洗净切成约1cm3的小块煮沸约30min后用四层纱布过滤,滤液用自来水补足至1000ml,加葡萄糖20g,琼脂15g,pH自然,121℃高压灭菌30min。
PD液体培养基:马铃薯200g,洗净切成约1cm3的小块煮沸约30min后用四层纱布过滤,滤液用自来水补足至1000ml,加葡萄糖20g,pH自然,121℃高压灭菌30min。
高氏一号琼脂培养基:可溶性淀粉20g,NaCl 0.5g,KNO3 1g,FeSO4﹒7H2O 0.01g,K2HPO4 0.5g,MgSO4﹒7H2O 0.5g,琼脂20g,自来水1000ml,pH 7.2~7.4,121℃灭菌30min。
放线菌分离培养基Ⅰ:葡萄糖10g,牛肉膏2g,天门冬素0.5g,K2HPO4 0.5g,琼脂20g,自来水1000ml,pH6.8或自然,121℃灭菌30min。
放线菌分离培养基Ⅱ:可溶性淀粉20g,NaCl 0.5g,KNO3 1g,Fe2(SO4)3 0.01g,K2HPO4 0.5g,MgSO4﹒7H2O 0.5g,琼脂20g,自来水1000ml,pH 7.2~7.4,121℃灭菌30min。
放线菌分离培养基Ⅲ:甘油20g,NaCl 1g,CaCO3 0.1g,L-精氨酸2.5g,FeSO4﹒7H2O 0.1g,MgSO4﹒7H2O 0.1g,琼脂20g,自来水1000ml,pH 6.8~7.0,121℃灭菌15min。
放线菌分离培养基Ⅳ:蔗糖15g,NaNO3 2g,酵母膏4g,K2HPO4 0.5g,MgSO4﹒7H2O0.5g,KCl 0.5g,FeSO4﹒7H2O 0.01g,琼脂20g,自来水1000ml,pH 7.2,121℃灭菌20min。
放线菌分离培养基Ⅴ:可溶性淀粉10g,(NH4)2SO4 2g,K2HPO4 1g,MgSO4﹒7H2O 1g,NaCl 1g,CaCO3 3g,琼脂15g,自来水1000ml,pH 7.2~7.4,121℃灭菌20min。
放线菌分离培养基Ⅵ:燕麦粉浸液20g,迹量盐溶液(FeSO4﹒7H2O 0.1g,MnCl2﹒4H2O 0.1g,ZnSO4﹒7H2O 0.1g,自来水100ml)1ml,琼脂15g,自来水1000ml,pH 7.2,121℃灭菌90min。
放线菌分离培养基Ⅶ:葡萄糖1g,可溶性淀粉2g,酵母膏0.5g,N-Z Amine 0.5g,CaCO30.1g,琼脂20g,自来水1000ml,pH 7.2~7.4,121℃灭菌20min。
ISP2培养基:酵母膏4.0g,麦芽汁10.0g,葡萄糖4.0g,琼脂20.0g,蒸馏水1000mL,pH7.2-7.4,121℃灭菌20min。
实施例1、稻瘟霉素链霉菌JZB130180的分离与鉴定
1.1菌株分离
采集中国贵州省雷公山高海拔区域的土壤样品经过干热处理,在室温干燥1-2周,经磨细过筛后,在鼓风干燥箱中将每份土样于100℃处理1个小时后再进行分离。准确称取土样1g放入装有9ml无菌盐溶液与小玻璃珠的50ml无菌三角瓶中,在摇床上充分振荡均匀后,即为10-1浓度稀释液,再用1ml移液器吸取10-1浓度稀释液移入9ml无菌三角瓶中,摇匀即成10-2浓度稀释液,以此类推,稀释到10-3浓度的稀释液。样品悬浮液准备好后,用无菌移液器严格按照无菌操作要求吸取10-2浓度和10-3浓度稀释液各0.1ml分别放入事先倒好的、对应编号的放线菌分离培养基平板上(培养基中含有20mg/l K2Cr2O7作为抑制剂来抑制土样中的真菌和细菌),然后用无菌的玻璃涂布铲在平板上将悬浮液轻轻涂布均匀,将涂布好的平板置于28℃恒温培养箱中恒温培养,至长出菌落。观察在恒温培养箱中培养的放线菌,将生长成熟的菌落及时用无菌接种针挑取到高氏一号琼脂培养基斜面上,划线培养,为分离更多的放线菌,每个培养皿中至少倾倒25-30ml的分离培养基,以防干裂菌体失活,培养时间延长至3-4周,分批挑菌。同一土壤样品在不同培养基上分离到的不同放线菌菌株统一编号后,在4℃冰箱暂时斜面保存(图1)。
生防菌株的筛选:以桃褐腐病菌为靶标病原菌,在PDA上于25℃恒温培养箱中培养5-7天,此时平板上均有大量的孢子层产生。在厚度均匀一致的PDA平板上先在中央点接少许桃褐腐病菌的孢子,然后在距离病原菌2cm处分别点上四株已分离纯化的放线菌孢子少许,以周围未接放线菌的病原菌为空白对照。做好标记后置于25℃恒温培养箱中培养,待对照平板铺满整个平板时,观察并记录实验结果。该试验重复三次。
试验结果:结果共得到20余株对桃褐腐病菌抑菌作用较强的拮抗放线菌菌株,其中一株编号为JZB130180的菌株抑菌效果最好,其抑菌带宽在7mm以上(图2)。
1.2菌株鉴定
形态培养特征:将活化后的菌株JZB130180分别划线接种于PDA、ISP2及高氏一号琼脂平板上,28℃恒温培养,在培养第2天、4天、6天、8天和10天时分别观察并记录该菌株在各培养基上的培养形态,采用插片法接菌培养5-7d,在光学显微镜下观察并拍照气生菌丝的形态。结果表明菌株JZB130180在上述三种培养基上均能生长,菌落呈规则边缘整齐的圆形,菌体呈黄色,菌落表面出现皱缩,中央凸起,随着培养时间的延长,出现灰白色的孢子堆。在上述三种培养基中,该菌在ISP2培养基上生长较为茂盛,产孢能力较强,其次为PDA培养基,高氏一号培养基上的菌生长较差。从菌落形态和显微观察,初步认为该菌属于放线菌(图3)。
生理生化特征:对菌株JZB130180参考文献《土壤微生物研究原理与方法》(林先贵,2010)中方法进行淀粉酶水解、硫化氢产生、柠檬酸盐利用、明胶液化、接触酶、黑色素产生、硝酸盐还原、牛奶凝固与胨化等部分生理生化特性测定。结果表明菌株JZB130180为革兰氏阳性菌,可液化明胶,接触酶和氧化酶阳性,能将牛奶凝固和胨化,能将淀粉水解,能微弱利用柠檬酸盐,不产生黑色素和硫化氢。
序列测定及分析:将菌株JZB130180在PDA平板上活化,28℃培养5d,转接入PD液体培养基中摇培24h,取1mL菌液,离心留菌体,采用Biomed细菌基因组DNA快速提取试剂盒提取JZB130180菌株的基因组DNA。扩增所选基因的引物序列设计及PCR扩增程序等详细介绍见表1。PCR均采用25μL扩增体系:10pmoL/L上下游引物各1μL,超纯dNTP Mixture(10mmol/L)1μL,2.5U Taq DNA聚合酶0.5μL,10×PCR Buffer 2.5μL,基因组DNA模板(10ng)1μL,ddH2O 18μL。PCR扩增产物均用1%的琼脂糖凝胶电泳检测,目标条带经切胶回收纯化后,连接pMD-18T载体,转化DH5α大肠杆菌感受态,X-gal蓝白斑筛选,PCR方法检测阳性克隆子,将阳性克隆子的菌液送往公司测序。本研究中的引物合成和序列测序均由中美泰和生物技术(北京)有限公司完成。菌株JZB130180的16S rRNA基因扩增并测序后,在LPSN(http://www.bacterio.net/)中选取同源性较高种的标准菌株,以Actinoalloteichuscyanogriseus IFO 14455T为外围,获得的序列在NCBI网站利用BLAST进行比对分析,并通过DNAMAN 5.2.2和MEGA 5.2.1Version 3软件与GenBank中相近序列进行多重序列匹配排列分析,Neighbor-joining法构建系统发育树,经bootstrap(1000次循环)验证系统发育树的可靠性。结果表明菌株JZB130180的16S rDNA,atpD,recA,rpoB的基因扩增结果如图4所示。从菌株JZB130180的16S rDNA序列(序列表中的序列1)构建的系统发育树(图5)上可以看出,菌株JZB130180与稻瘟霉素链霉菌Streptomyces blastmyceticus NRRL B-5480AY999802.1聚在了一个分支上。扩增得到的菌株JZB130180的看家基因atpD,recA,rpoB的序列分别如序列表中序列2-4所示。这几个看家基因的序列经过NCBI网站的Blast搜索比对结果发现,和由16S rDNA序列比对分析的结果基本一致,因此,将JZB130180菌株鉴定为稻瘟霉素链霉菌(Streptomyces blastmyceticus)。
表1PCR扩增基因及引物序列
稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180已于2016年11月14日保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏号为CGMCC No.13270。下文简称稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180或菌株JZB130180。
实施例2、稻瘟霉素链霉菌(Streptomyces blastmyceticus)JZB130180的抑菌谱测定
供试培养基:
LB琼脂培养基:胰蛋白胨10.0g,酵母提取物5.0g,NaCl 10.0g,琼脂15.0g,蒸馏水1000mL,pH 7.0~7.2;
LB液体培养基:除不加琼脂外,其他同LB琼脂培养基制作。
KB培养基:蛋白胨20.0g,甘油10.0mL,K2HPO4 1.50g,MgSO4·7H2O 1.50g,琼脂15.0g,蒸馏水1000mL,KOH调pH值至7.2;
上述所有培养基经121℃高压灭菌20min。
试验方法:
(1)对植物病原真菌的抑菌作用测定采用平板对峙法。具体操作步骤如下:先将菌株JZB130180和各种植物病原真菌(表2)分别在PDA培养基上培养4-5d,用直径为7mm的无菌打孔器打制菌饼,在空白PDA平板上,平板中央放置病原菌菌饼,菌丝面紧贴培养基,在距离病原菌2.5cm处呈180°将菌株JZB1301800的菌饼反贴至培养基上,在25-28℃恒温培养箱中恒温培养5-7d,以仅接病原菌的平板为空白对照,测定病原菌和菌株JZB130180菌落边缘之间的抑菌带宽和各病原菌空白对照的菌落直径,每种病原菌三次重复;
(2)对植物病原细菌的抑菌作用测定采用双层培养法,具体操作步骤如下:将活化的菌株JZB130180菌液点种在KB平板上,28℃培养48h,用3mL三氯甲烷以其蒸汽杀死菌株JZB130180菌体,静置10~12h,以便三氯甲烷蒸气挥发完全。植物病原细菌(表2)分别在LB液体培养基上活化培养,180r/min 28℃振荡培养24h。将培养好的各种靶标病原细菌分别用无菌生理盐水制备成108cfu/mL菌悬液。吸取100μl菌悬液加入3mL融化后冷却至50℃的1%水琼脂中,迅速混匀,立即倒入三氯甲烷已杀死菌株JZB130180的平板上,铺成均匀的薄层,每个处理三次重复,28℃培养36h,观察抑菌效果并十字交叉法测量抑菌圈直径。
试验结果:
抑菌谱测定结果表明(见表2和图6),该菌几乎对所有的植物病原真菌都有非常明显的抑菌作用,对甘蓝枯萎病菌和小麦纹枯病菌的抑菌带宽达12mm,对苹果轮纹病菌的抑菌作用较小,抑菌带宽为0.5mm。对所选的植物病原细菌也均表现出较强的抑制作用,抑菌圈直径在35-50mm之间。表明该菌有较宽的抑菌谱。
表2JZB130180菌株的抑菌谱测定结果
注:“-”表示未测该项内容;表中数据为3次重复数值的平均值,相同字母表示差异不显著(P<0.05)。
实施例3、菌株JZB130180的生防相关活性测定
1、供试培养基:CAS培养基(检测嗜铁素)由4种溶液(混合前单独灭菌)组成。溶液1(CAS/HDTMA溶液)包括CAS溶液:60.5mg CAS(铬天青)溶解在50mL水中;铁溶液:含有1mmol/L FeCl3·6H2O的10mmol/L HCl溶液,pH为2.0;HDTMA溶液:72.9mg溴化十六碳烷基三甲氨溶解于40mL水中;把50mL的CAS溶液与10mL铁溶液混合后加入40mL的HDTMA溶液并搅拌均匀,把得到的蓝黑色液体灭菌,该液体即CAS/HDTMA溶液;溶液2(Salts/Buffer溶液):将30.24g Pipes溶解于750mL Salts溶液(KH2PO40.3g,NaCl0.5g,NH4Cl 1.0g)中,以50%(W/V)KOH调节pH至6.8,加入15g琼脂并用蒸馏水定容至800mL,高压灭菌后冷却至50℃;溶液3(750mL):葡萄糖2g,甘露醇2g,MgSO4·7H2O 493mg,CaCl2 11mg,H3BO3 1.4mg,ZnSO4·7H2O 1.2mg,MnSO4·2H2O 1.17mg,Na2MoO4·2H2O 1mg,CuSO4 40μg,蒸馏水定容至750mL,高压灭菌后冷却至50℃。将750mL的溶液3加入到800mL溶液2后,并与30mL溶液4即过滤除菌的10%(W/V)casamino acid混合,最后将1580mL混合液加入100mL溶液1中,缓慢搅拌(避免产生泡沫),铺平板。
几丁质培养基(检测几丁质酶):胶体几丁质2.5g,K2HPO4 0.7g,KH2PO40.3g,MgSO4·7H2O 0.5g,FeSO4·7H2O 0.01g,琼脂15g,蒸馏水1000mL,pH 7.0。
脱脂牛奶琼脂培养基(检测蛋白酶):进口脱脂奶粉40g,琼脂10g,去离子水1000mL,115℃高压灭菌30min,与LB固体培养基1:9混匀,铺成平板备用。
刚果红培养基(检测纤维素酶):MgSO4·7H2O 0.25g,K2HPO4 0.5g,纤维素1.88g,刚果红0.2g,明胶2g,琼脂4g,蒸馏水1000mL,pH 7.0。
Pikovskaya’s琼脂培养基(检测磷酸酯酶):酵母提取物0.5g,葡萄糖10g,Ca3(PO4)25g,(NH4)2SO4 0.5g,KCl0.2g,MgCl2 0.1g,MnSO4·H2O0.1mg,FeSO4 0.1mg,琼脂15g,蒸馏水1000mL,pH 7.0。
液体种子培养基和发酵培养基:玉米淀粉30.0g,葡萄糖10.0g,豆粕粉20.0g,蛋白胨6.0g,硫酸铵2.50g,MgSO4﹒7H2O 1.50g,KH2PO4 0.30g,NaCl 7.50g,CaCO3 4.0g,高温淀粉酶0.05g,蒸馏水1000mL,pH 7.0~7.4。
上述所有培养基经121℃高压灭菌20min。
2、试验
2.1生防相关胞外酶的检测
2.1.1嗜铁素的检测
将菌株JZB130180先经28℃在高氏一号培养基上培养3-5d后,接种于CAS培养基,28℃培养3-5天后,观察菌落外围是否产生黄色晕圈。每个处理设3个重复。由于嗜铁素竞争培养基中EDTA螯合的铁离子,使培养基由蓝色变成黄色,因此菌落周围黄色晕圈出现表明嗜铁素的产生。
2.1.2几丁质酶的检测
将菌株JZB130180先经28℃在高氏一号培养基上培养3-5d后,接种于几丁质培养基,28℃培养3-5天后,观察菌落外围透明圈的产生,出现透明圈表明几丁质酶的产生。每个处理设3个重复。
2.1.3蛋白酶的检测
将菌株JZB130180先经28℃在高氏一号培养基上培养3-5d后,接种于脱脂牛奶琼脂培养基,28℃培养3-5天后,后观察菌落外围透明圈的产生,出现透明圈表明蛋白酶的产生。每个处理设3个重复。
2.1.4纤维素酶的检测
将菌株JZB130180先经28℃在高氏一号培养基上培养3-5d后,接种于刚果红培养基,28℃培养3-5天后,观察菌落周围红色水解圈的产生,出现红色水解圈表明纤维素酶的产生。每个处理设3个重复。
2.1.5磷酸酯酶的检测
将菌株JZB130180先经28℃在高氏一号培养基上培养3-5d后,接种于Pikovskaya’s琼脂培养基,28℃培养3-5天后,观察菌落周围透明圈的产生,出现透明圈表明磷酸酯酶的产生。每个处理设3个重复。
结果表明,菌株JZB130180能够分泌几丁质酶、纤维素酶、嗜铁素和蛋白酶,不分泌磷酸酯酶(图7)。其中的几丁质酶、纤维素酶和嗜铁素活性均是生防菌具备生防功能的重要参考指标。
2.2菌株JZB130180无菌发酵滤液的制备
菌株JZB130180在ISP2培养基上,28℃恒温培养5~7d后,取2环菌体接种到液体种子培养基(50mL装量/500mL三角瓶)中,28℃200r/min在摇床上振荡培养20~24h,取少量培养液于显微镜下观察,观察到大量菌丝且没有被球状或杆状细菌污染,即为种子培养液,以3%接种量接种于发酵培养基(100mL装量/500mL三角瓶)中,28℃200r/min振荡培养5~7d,结束发酵后,即为制备的发酵培养液。将该发酵培养液12000rpm离心10min取上清液,采用0.22μm微孔滤膜过滤上清液除菌,得到菌株JZB130180无菌发酵滤液。
2.3菌株JZB130180对桃褐腐病菌的抑菌活性
将桃褐腐病菌接种于PDA平板上,22℃培养5~7d至整个平板产丰富的孢子,加适量的无菌水至产孢平板上,将孢子刮下过自制的脱脂棉滤层,除掉菌丝,将孢子悬浮液用无菌水稀释至107个孢子/mL备用。一次性培养皿(Φ=9cm)每皿倒入25mL PDA培养基,待凝固后吸取200μL桃褐腐病菌的孢子悬浮液均匀涂布于PDA平板上,在无菌条件下,将在PDA平板上培养好的桃褐腐病菌用Φ=7mm的无菌打孔器打制菌饼,取出菌饼,每孔加入100μL的步骤2.2的菌株JZB130180无菌发酵滤液,放置22℃恒温培养2~3d,观察并测量抑菌圈直径。
结果表明菌株JZB130180无菌发酵滤液在平板上对桃褐腐病菌的抑菌圈直径达3.0cm以上(图8),说明菌株JZB130180无菌发酵滤液中含有对桃褐腐病菌强抑菌活性的物质。
2.4菌株JZB130180对桃褐腐病菌的毒力测定
2.4.1桃褐腐病菌菌饼的制作
将桃褐腐病菌接种于PDA平板上,22℃培养5~7d至整个平板产丰富的孢子,加适量的无菌水至产孢平板上,将孢子刮下过自制的脱脂棉滤层,除掉菌丝,将孢子悬浮液用无菌水稀释至107个孢子/mL备用。一次性培养皿(Φ=9cm)每皿倒入25mL PDA培养基,待凝固后吸取200μL桃褐腐病菌的孢子悬浮液均匀涂布于PDA平板上,在无菌条件下,将在PDA平板上培养好的桃褐腐病菌用Φ=6mm的无菌打孔器打出一定数量的桃褐腐病菌菌饼。
2.4.2含毒介质制备:当PDA培养基熔化凉至45℃左右,将步骤2.2的菌株JZB130180无菌发酵滤液和PDA(20mL)按照1.25%、2.5%、5%、10%、20%的比例混合,菌株JZB130180无菌发酵滤液的最终浓度为12.5μg/mL、25.0μg/mL、50.0μg/mL、100μg/mL、200μg/mL制成薄厚一致的均匀平板,得到含毒介质。以不加菌株JZB130180无菌发酵滤液的PDA为空白对照。每个处理3次重复,冷却后待用。
2.4.3室内毒力测定
用无菌的接种针把2.4.1的桃褐腐病菌菌饼置于2.4.2的含毒介质上,菌丝面朝下,每个平板中央上放置1块6mm菌饼,22℃低温培养箱中培养。
结果记录:培养5~7d后,十字交叉法测量菌落直径,数据分析回归求出发酵液的EC50。
菌落直径(mm)=实际测量菌落直径平均值-6
相对抑制率(%)=(对照菌落直径-处理菌落直径)/对照菌落直径×100%
以菌株JZB130180无菌发酵滤液在PDA中的含量为浓度,浓度的对数值为自变量X、抑制率几率值为因变量Y,求出毒力回归方程、相关系数(r)、EC50值结果见表3。
从表3可知,菌株JZB130180无菌发酵滤液对桃褐腐病菌的EC50为40.5μg/mL,说明菌株JZB130180无菌发酵滤液对桃褐腐病原具有较强的抑制作用。从图9可以明显看出随着浓度的增加对桃褐腐病原菌菌丝的生长抑制作用越强,浓度为20%时,菌丝完全不生长。
表3菌株JZB130180无菌发酵滤液对桃褐腐病的毒力测定结果
2.5菌株JZB130180对桃褐腐病和番茄灰霉病防效的测定
2.5.1病原菌的孢子悬浮液制备:桃褐腐病菌和番茄灰霉病菌分别在PDA上23~25℃恒温培养4~5d后,刮取其分生孢子置于无菌水中,放到振荡器上振荡,配成桃褐腐病菌孢子悬浮液(桃褐腐病菌含量为108cfu/mL)和番茄灰霉病菌孢子悬浮液(番茄灰霉病菌含量为108cfu/mL)。
实验重复三次,每次重复的实验方法如下:选择外表整齐、没有病虫害和机械损害的桃果实(品种:久保)和番茄果实(品种:佳粉19)。先用0.5%NaClO将果实处理1min,用无菌水多次冲洗干净。在果实腰部用无菌接种针刺5mm(深)×3mm(宽)的伤口,每个果实扎4个孔,伤口晾干后,将桃果实随机均分为3组,每组5个果实,分别为处理A1(阴性对照)、处理B1和处理C1。将番茄果实随机均分为4组,每组5个果实,分别为处理A2(阴性对照)、处理B2、处理C2和处理D。
处理A1的每个桃果实接种50μl无菌水,待完全吸收后,每个桃果实接种30μl步骤2.5.1的桃褐腐病菌孢子悬浮液;处理B1的每个桃果实接种50μl步骤2.2菌株JZB130180无菌发酵滤液,待完全吸收后,每个桃果实接种30μl步骤2.5.1的桃褐腐病菌孢子悬浮液;处理C1的每个桃果实接种50μl步骤2.2菌株JZB130180无菌发酵滤液5倍稀释液(用无菌水稀释步骤2.2菌株JZB130180无菌发酵滤液5倍得到的液体),待完全吸收后,每个桃果实接种30μl步骤2.5.1的桃褐腐病菌孢子悬浮液。处理A2的每个番茄果实接种50μl无菌水,待完全吸收后,每个番茄果实接种30μl步骤2.5.1的桃褐腐病菌孢子悬浮液;处理B2的每个番茄果实接种50μl步骤2.2菌株JZB130180无菌发酵滤液,待完全吸收后,每个番茄果实接种30μl步骤2.5.1的桃褐腐病菌孢子悬浮液;处理C2的每个番茄果实接种50μl步骤2.2菌株JZB130180无菌发酵滤液5倍稀释液(用无菌水稀释步骤2.2菌株JZB130180无菌发酵滤液5倍得到的液体),待完全吸收后,每个番茄果实接种30μl步骤2.5.1的桃褐腐病菌孢子悬浮液;处理D的每个番茄果实接种50μl步骤2.2菌株JZB130180无菌发酵滤液10倍稀释液(用无菌水稀释步骤2.2菌株JZB130180无菌发酵滤液10倍得到的液体),待完全吸收后,每个番茄果实接种30μl步骤2.5.1的桃褐腐病菌孢子悬浮液。放置到塑料包装箱中,外套一层保鲜膜,23℃,保湿(湿度不低于90%)培养。每隔24h统计各处理发病情况和病斑直径。根据病斑直径按照如下公式计算桃褐腐病和番茄灰霉病的防治效果:防治效果(%)=(阴性对照病斑直径-相应处理的病斑直径)/阴性对照病斑直径×100%。
从桃果实的发病率与病斑直径可以看出,步骤2.2菌株JZB130180无菌发酵滤液(简称原液)和步骤2.2菌株JZB130180无菌发酵滤液5倍稀释液(简称5倍稀释液)对褐腐病菌均表现抑制效果,浓度越高抑制效果较好(表4和图10)。原液处理的果实在前2天防治效果达100%。在第3天以后,原液对褐腐病菌的防效高于5倍稀释液10%以上。说明接种菌株JZB130180无菌发酵滤液能推迟桃果实褐腐病的发生,并对病斑扩展也有一定抑制作用,对桃褐腐病的防治效果达50%以上。
表4菌株JZB130180无菌发酵滤液对桃褐腐病的防效测定结果
步骤2.2菌株JZB130180无菌发酵滤液(简称原液)和步骤2.2菌株JZB130180无菌发酵滤液5倍稀释液(简称5倍稀释液)和步骤2.2菌株JZB130180无菌发酵滤液10倍稀释液(简称10倍稀释液)对番茄灰霉病菌均表现出较强的抑制效果(表5和图11)。原液处理表现最好,在整个实验过程中一直未发病,其次是5倍稀释液处理,最后是10倍稀释液。前2天所有的处理病斑直径均不明显,但发病率随浓度的增加而降低。在第6天时,5倍稀释液和10被稀释液的发病率为20%和70%均明显低于CK(100%),并随培养时间延长,防治效果仍很明显。随着浓度的增加,处理组与CK相比病斑直径小,发病率低。说明步骤2.2菌株JZB130180无菌发酵滤液能够预防番茄灰霉病的发生,可有效预防番茄灰霉病。
表5菌株JZB130180无菌发酵滤液对番茄灰霉病的防效测定结果
实施例4、菌株JZB130180对植物的的促生作用测定
(1)浸种处理:佳粉19番茄种子使用75%酒精表面消毒5分钟,无菌水冲洗3次,10%次氯酸钠溶液表面消毒10min,无菌水漂洗5次后,将形态尽量一致的番茄种子分为自来水浸种处理(空白对照CK1)、50倍浸种处理、100倍浸种处理和500倍浸种处理。
50倍发酵稀释液浸种处理(50X):用实施例3的步骤2.2菌株JZB130180无菌发酵滤液50倍稀释液(用自来水稀释实施例3的步骤2.2菌株JZB130180无菌发酵滤液50倍得到的液体)浸种24h,每12h更换一次处理液。
100倍发酵稀释液浸种处理(100X):用实施例3的步骤2.2菌株JZB130180无菌发酵滤液100倍稀释液(用自来水稀释实施例3的步骤2.2菌株JZB130180无菌发酵滤液100倍得到的液体)浸种24h,每12h更换一次处理液。
500倍发酵稀释液浸种处理(500X):用实施例3的步骤2.2菌株JZB130180无菌发酵滤液500倍稀释液(用自来水稀释实施例3的步骤2.2菌株JZB130180无菌发酵滤液500倍得到的液体)浸种24h,每12h更换一次处理液。
自来水浸种处理(空白对照CK1):用等体积的自来水浸种24h,每12h更换一次处理液。
浸种后,将其播种于营养钵(灭菌土+草炭=1:1)中,以自来水浸种为对照,在播种后培养的第10d、20d、30d和40d时调查促生效果。每个处理设三个重复,每个重复5个营养钵,每钵播三粒番茄种子。
(2)浇灌处理:将经过预处理萌发的佳粉19番茄种芽播种于营养钵中,待苗长至两叶期,分为自来水灌根处理(空白对照CK2)、50倍灌根处理、100倍灌根处理和500倍灌根处理。
50倍发酵稀释液灌根处理(50X):用20mL实施例3的步骤2.2菌株JZB130180无菌发酵滤液50倍稀释液开始进行第一次根部浇灌,以后每隔10d用与第一次浇灌相同体积的实施例3的步骤2.2菌株JZB130180无菌发酵滤液50倍稀释液根部浇灌1次,共浇灌三次。
100倍发酵稀释液灌根处理(100X):用20mL实施例3的步骤2.2菌株JZB130180无菌发酵滤液100倍稀释液开始进行第一次根部浇灌,以后每隔10d用与第一次浇灌相同体积的实施例3的步骤2.2菌株JZB130180无菌发酵滤液100倍稀释液根部浇灌1次,共浇灌三次。
500倍发酵稀释液灌根处理(500X):用20mL实施例3的步骤2.2菌株JZB130180无菌发酵滤液500倍稀释液开始进行第一次根部浇灌,以后每隔10d用与第一次浇灌相同体积的实施例3的步骤2.2菌株JZB130180无菌发酵滤液500倍稀释液根部浇灌1次,共浇灌三次。
空白对照灌根处理(空白对照CK2):用20mL自来水开始进行第一次根部浇灌,以后每隔10d用与第一次浇灌相同体积的自来水根部浇灌1次,共浇灌三次。
每个处理设三个重复,每个重复5个营养钵,每钵播三粒番茄种子。
测定指标和方法:苗高和根长,根数,发芽率、苗鲜重等。用直尺测量各处理幼苗和根的长度,其中根以最长的一根为测量对象,以每一处理的所有参试幼苗的平均值作为苗高和根长。根数:统计所有长度大于1cm的根的条数,最后同样取每一处理的所有参试幼苗的平均值。
试验结果:
连续检测40d的试验结果表明,与自来水处理的空白对照相比,各浓度菌株JZB130180无菌发酵滤液处理后番茄苗的长势旺,其中,经过浸种处理的番茄,苗的须根数明显增多,主根长占明显优势;经过灌根处理的番茄苗,茎粗、主根及茎长,须根数、株高、植株鲜重等与空白对照相比有显著差异,且在生长后期上述各指标优于空白对照自来水浸种处理番茄苗(表6和图12)。综合考虑统计结果,选择100倍发酵稀释液灌根,500倍发酵稀释液浸种效果为最佳。
表6 JZB130180菌株处理对番茄幼苗的促生作用测定(从播种起第20d调查结果)
注:表中a.b.c.d.列的数据均为所设试验重复的平均值。
<110> 北京市农林科学院
<120> 一株生防链霉菌及其应用
<160> 4
<170> PatentIn version 3.5
<210> 1
<211> 1535
<212> DNA
<213> 稻瘟霉素链霉菌(Streptomyces blastmyceticus)
<400> 1
agcttgcatg cctgcaggtc gacgattgag agtttgatcc tggctcagga cgaacgctgg 60
cggcgtgctt aacacatgca agtcgaacga tgaagccttt cggggtggat tagtggcgaa 120
cgggtgagta acacgtgggc aatctgccct gcactctggg acaagccctg gaaacggggt 180
ctaataccgg ataatacctg ccgaggcatc tcggtgggtt gaaagctccg gcggtgcagg 240
atgagcccgc ggcctatcag cttgttggtg gggtgatggc ctaccaaggc gacgacgggt 300
agccggcctg agagggcgac cggccacact gggactgaga cacggcccag actcctacgg 360
gaggcagcag tggggaatat tgcacaatgg gcgaaagcct gatgcagcga cgccgcgtga 420
gggatgacgg ccttcgggtt gtaaacctct ttcagcaggg aagaagcgag agtgacggta 480
cctgcagaag aagcgccggc taactacgtg ccagcagccg cggtaatacg tagggcgcaa 540
gcgttgtccg gaattattgg gcgtaaagag ctcgtaggcg gcttgttgcg tcggatgtga 600
aagcccgggg cttaaccccg ggtctgcatt cgatacgggc aggctagagt tcggtagggg 660
agatcggaat tcctggtgta gcggtgaaat gcgcagatat caggaggaac accggtggcg 720
aaggcggatc tctgggccga tactgacgct gaggagcgaa agcgtgggga gcgaacagga 780
ttagataccc tggtagtcca cgccgtaaac gttgggaact aggtgtgggc gacattccac 840
gtcgtccgtg ccgcagctaa cgcattaagt tccccgcctg gggagtacgg ccgcaaggct 900
aaaactcaaa ggaattgacg ggggcccgca caagcagcgg agcatgtggc ttaattcgac 960
gcaacgcgaa gaaccttacc aaggcttgac atacaccgga aacggccaga gatggtcgcc 1020
cccttgtggt cggtgtacag gtggtgcatg gctgtcgtca gctcgtgtcg tgagatgttg 1080
ggttaagtcc cgcaacgagc gcaacccttg ttctgtgttg ccagcatgcc cttcggggtg 1140
atggggactc acaggagact gccggggtca actcggagga aggtggggac gacgtcaagt 1200
catcatgccc cttatgtctt gggctgcaca cgtgctacaa tggccggtac aatgagctgc 1260
gataccgtga ggtggagcga atttcaaaaa gccggtctca gttcggattg gggtctgcaa 1320
ctcgacccca tgaagttgga gttgctagta atcgcagatc agcattgctg cggtgaatac 1380
gttcccgggc cttgtacaca ccgcccgtca cgtcacgaaa gtcggtaaca cccgaagccg 1440
gtggcccaac ccttgtggag ggagccgtcg aaggtgggac tggcgattgg gacgaagtcg 1500
taacaaggta tccgtaatct ctagaggatc cccgg 1535
<210> 2
<211> 870
<212> DNA
<213> 稻瘟霉素链霉菌(Streptomyces blastmyceticus)
<400> 2
tccgagatca ccgagcgctg gccgatccac cgcaaggcgc cgaacttcga ccagctcgag 60
tccaagaccg agatgttcga gaccggcgtc aaggtcatcg acctgctgac cccgtacgtc 120
aagggcggca agatcggtct gttcggtggt gccggtgtcg gcaagaccgt gctgatccag 180
gaaatgatct accgcgtggc caacaaccac gacggtgtgt cggtgttcgc cggtgtcggt 240
gagcgcaccc gtgagggcaa cgacctcatc gaggaaatga ccgactcggg cgtcatcgac 300
aagacggcgc tcgtcttcgg ccagatggac gagcccccgg gcacccgtct gcgcgtcgcc 360
ctggccggtc tgaccatggc ggagtacttc cgcgatgtgc agaagcagga cgtgctcttc 420
ttcatcgaca acatcttccg ttacacccag gccggttccg aggtgtccac cctgctcggc 480
cgcatgccgt ccgcggtggg ttaccagccg aacctggcgg acgagatggg tctgctgcag 540
gagcgcatca cctcgacccg cggtcactcg atcacctcga tgcaggcgat ctacgtcccc 600
gcggacgacc tgaccgaccc ggcgccggcc accaccttcg cccacctgga cgcgacgacc 660
gttctgtcgc gtccgatctc ggagaagggc atctacccgg cggtcgaccc gctggactcg 720
acgtcccgca tcctggaccc gcgctacatc gcgcaggagc actacgactg cgccatgcgc 780
gtcaagacga tcctgcagaa gtacaaggac ctccaggaca tcatcgcgat cctcggtatc 840
gacgagctgg gcgaggagga caagctcgtc 870
<210> 3
<211> 825
<212> DNA
<213> 稻瘟霉素链霉菌(Streptomyces blastmyceticus)
<400> 3
cctcggcgac cggccgaacg accccatcga ggtcatcccc accgggtcga ccgcactcga 60
cgtcgctctc ggcgtcggcg ggctgccccg cggccgcgtc gtggaggtgt acggaccgga 120
gtcctccggt aagaccaccc tcaccctgca cgccgtggcc aacgcccaga aggcgggcgg 180
caccgtcgcc ttcgtcgacg cggagcacgc gctcgacccg gagtacgcga aggcgctggg 240
cgtcgacacc gacaacctca tcctctccca gccggacacc ggcgagcagg cgctggagat 300
cgtggacatg ctggtccgct ccggcgccct cgacctgatc gtcatcgact ccgtcgccgc 360
gctcgtgccg cgtgcggaga tcgagggcga gatgggcgac tcccacgtcg gcctccaggc 420
gcgactgatg agccaggcgc tccgcaagat caccagcgcg ctcaaccagt ccaagaccac 480
cgcgatcttc atcaaccagc tccgcgagaa gatcggcgtc atgttcggct cgccggagac 540
gacgaccggt ggccgggccc tgaagttcta cgcctcggtg cgcctggaca tccgccgcat 600
cgagaccctc aaggacggca cggaggccgt cggcaaccgc acccgcgtca aggtcgtcaa 660
gaacaaggtc gcgccgccct tcaagcaggc cgagttcgac atcctctacg gccagggcat 720
cagccgcgag ggcggcctga tcgacatggg cgtggagcac ggcttcgtcc gcaaggccgg 780
cgcctggtac acgtacgagg gcgaccagct cggccagggc aagga 825
<210> 4
<211> 871
<212> DNA
<213> 稻瘟霉素链霉菌(Streptomyces blastmyceticus)
<400> 4
tcaaggagtt cttcggcacc agccagctgt cccagttcat ggaccagacg aacccgctgt 60
cgggcctgac ccacaagcgc cgtctgtccg cgctgggccc cggtggtctg tcccgtgagc 120
gggccggctt cgaggtccga gacgtccacc cgtcgcacta cggccgcatg tgcccgatcg 180
agacgcccga aggcccgaac atcggtctga tcggctcgct cgcgtcgtac ggccgcgtca 240
acgcgttcgg tttcgtcgag accccgtacc gcaaggtcgt gggcggcgtc gtcaccgacg 300
acgtggacta cctgactgcc gacgaggaag accgcttcgt catcgcgcag gcgaacgccc 360
ccctcaccga ggacatgcgt tacgccgagt cgcgcgtgct ggtccgccgc cgtggcggcg 420
agatcgacta catcgccggc gacgacgtcg actacatgga cgtctccccg cgccagatgg 480
tgtcggtcgc gaccgcgatg atccccttcc tcgagcacga cgacgccaac cgcgcgctca 540
tgggatcgaa catgatgcgc caggccgttc cgctgatcaa ggcggaggcc ccgctggtcg 600
gcaccggcat ggagtaccgc tgtgcggtcg acgccggtga cgtcatcaag gcggagaagg 660
acggtgtggt ccaggaggtc tccgcggact acgtcaccgt cgccaacgac gacggcacgt 720
acaacacgta ccgggtcgcc aagttctccc gctccaacca gggcacgtcc ttcaaccaga 780
aggtcgtcgt cgacgagggc gcccgggtcg tctccggcca ggtgctcgcc gacggtccgt 840
ccacggacga gggcgagatg gccctcggca a 871
- 还没有人留言评论。精彩留言会获得点赞!