利用PCR‑SSCP快速检测绵羊NELF基因单核苷酸多态性的方法及其应用与流程
本发明属于分子遗传学领域,涉及绵羊单核苷酸多态性(SNP)分子标记的筛选与检测,特别涉及利用PCR-SSCP方法快速检测NELF基因组第454位点单核苷酸多态性。具体来说,就是对PCR扩增获得的产物变性之后进行聚丙烯酰胺凝胶电泳,然后根据电泳结果确定其单核苷酸多态性。
背景技术:
近20年来,尤其是近10年来,分子遗传学和分子生物技术有了突飞猛进的发展,其中,分子遗传标记是目前在家畜育种中研究得最多的内容,也是近期内最可能在家畜育种中得到广泛应用的研究项目。遗传标记是指那些可以准确鉴别的、能反映个体特异性的遗传特征。分子遗传标记则是指以个体遗传物质即核苷酸序列变异为基础的DNA分子标记,是DNA水平遗传多态性的直接反映。利用分子标记辅助选择育种,是现代动物分子育种的一项主要研究内容,其直接在DNA水平上对性状的基因型进行选择,因此其选种的准确性大大提高,克服了传统动物育种方法的缺陷。
单核苷酸多态性(SNP)是一种重要的分子遗传标记,它是由美国学者Lander于1996年提出的第三代DNA遗传标记,是基因组中单个核苷酸变异引起的DNA序列多态性,包括碱基的转换、插入及缺失等形式。PCR-SSCP技术的基本原理是PCR扩增后的DNA片段经变性成单链DNA,单链DNA在中性聚丙烯酰胺凝胶中电泳时形成不同的立体构象,其构象直接影响泳动速率,相同长度的DNA单链其核苷酸顺序仅有单个碱基的差别,就可以产生立体构象的不同,造成泳动速率的不同,产生不同的泳动带。因此,可以通过PCR-SSCP技术检测基因组是否存在SNP位点,并且准确的鉴别SNP位点的基因型。现在已经公认单链构象多态性(SSCP)可作为遗传标记应用于育种中。该方法不仅具有DNA测序法的准确性,又克服了费用昂贵、繁琐操作、假阳性的缺点,而且检测序列位点无特殊要求。
鼻胚胎促黄体激素释放激素因子(Nasal embryonic LHRH factor,NELF)编码基因与动物的生殖有密切关系。Samuel D.Quaynor等通过创建纯合NELF敲除(KO)小鼠模型,证明雌性小鼠NELF基因敲除将推迟阴道口开放,并没有延迟第一次发情的时间,减少了子宫重量并且减少了GnRH的神经元数目。与此相反,雄性小鼠的青春期表现正常。NELF敲除导致雌雄小鼠都表现为生育能力受损,平均窝产仔数降低。此外,越来越多的报道表明,NELF在小鼠的生殖方面有重要作用。绵羊的NELF基因定位在第20号染色体上,全长5928bp,编码区全长1112bp。
目前,国内外对NELF基因多态性的研究主要集中于小鼠等模式动物,而对于家畜NELF基因单核苷酸多态性的研究尚未见报道。
技术实现要素:
本发明的目的在于提供一种利用PCR-SSCP快速检测绵羊NELF基因单核苷酸多态性的方法及其应用,从而为绵羊的分子标记辅助选择育种提供基础资料,加快中国绵羊的种质资源改良工作。
本发明是通过以下技术方案来实现的:
以包含NELF基因的待测绵羊全基因组DNA为模板,以引物对P为引物,PCR扩增绵羊NELF基因片段;对扩增片段进行变性,然后进行聚丙烯酰胺凝胶电泳;根据凝胶电泳结果判定绵羊NELF基因的单核苷酸多态性;
所述的引物对P为:
上游引物F:5’-TTGCCCCTTTCGTTGCTC-3’ 18nt;
下游引物R:5’-TTTCTCCACTGTCACCGCC-3’ 19nt。
所述的PCR扩增反应程序为:
95℃预变性5min;95℃变性30s,64℃退火50s,72℃延伸30s,34个循环;72℃延伸10min。
根据聚丙烯酰胺凝胶凝胶电泳结果鉴定绵羊NELF基因accession number NC_019477.2:g.454位的T>C突变的多态性。
根据聚丙烯酰胺凝胶电泳结果鉴定绵羊NELF基因组第454位存在TT、TC、CC三种基因型。
所述的凝胶电泳为10-12%的聚丙烯酰胺凝胶电泳,先在4℃下,200-250V预电泳20-60min,再在室温下,120-150V电泳3-4h。
本发明的有益效果体现在:
针对绵羊NELF基因第454位T>C的突变,本发明提供了其检测方法,通过设计特定的引物,PCR扩增目的片段,然后变性成单链DNA,再进行聚丙烯酰胺凝胶电泳鉴定。该方法能够简单、快速、低成本、精确度高的鉴定基因的单核苷酸多态性。
本发明对突变位点的基因型进行了检测和基因频率分析,并将该位点与绵羊的繁殖性状进行关联分析。结果表明该位点可作为分子遗传标记进行分子标记辅助选择育种,以提高绵羊繁殖性状。
附图说明
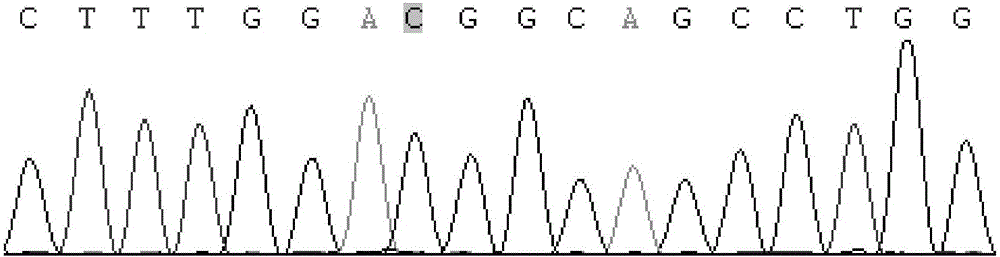
图1为绵羊NELF基因组第454位(具有深色背景的位点)TT基因型个体的测序图。
图2为绵羊NELF基因组第454位CC基因型个体的测序图。
图3为绵羊NELF基因组第454位TC基因型个体的测序图。
图4为绵羊NELF基因组第454位不同基因型PCR产物经聚丙烯酰胺凝胶电泳结果。
具体实施方式
下面结合附图和实施例对本发明做详细的说明,所述是对本发明的解释而不是限定。
本发明根据绵羊NELF基因组序列设计引物,分别以2种绵羊品种的基因组DNA池为模板,进行PCR扩增,产物测序得到绵羊NELF基因的部分序列。与NCBI上公布的参考序列比对,发现在绵羊NELF基因组第454位存在T>C的突变,该突变位点位于绵羊NELF基因内含子内,产生一个无意突变,并将其与繁殖性状进行关联分析,确定为与绵羊繁殖性状相关的分子遗传标记,利用PCR-SSCP方法对该突变进行检测。
一、绵羊NELF基因部分序列的克隆及其多态性检测
1.样本采集及基因组DNA提取
⑴血样的采集
本发明采用了2个绵羊品种,共计607个个体作为检测对象,血液的采集方法为颈静脉采血。血样的采集地区,以及各品种的数据资料情况如表1所示:
表1实验动物情况
⑵血样DNA的提取
①冷冻血样(主要为血细胞)室温解冻,吸取500μL血液于1.5mL离心管中,加入等体积的磷酸缓冲液(PBS)混匀,温和摇动,4℃,12000r/min离心5min,弃去上清液,重复上述步骤至上清液透明、沉淀呈透明色。
②在离心管中加入DNA抽提缓冲液500μL,轻轻吹打,使血细胞沉淀脱离离心管壁,37℃水浴1h。
③加蛋白酶K至3μL(20mg/mL),并混匀,55℃水浴中消化过夜(16h左右)至絮状沉淀不见,溶液澄清,尚未澄清的,可补加1μL蛋白酶K混匀继续消化直至澄清。
④将反应液冷却至室温,加入500μL Tris饱和酚,温和摇动15min,使其充分混匀,4℃,12000r/min离心10min,将上层水相转入另一灭菌离心管,重复上述步骤1次。
⑤加入氯仿500mL,温和摇动20min,使其充分混匀,4℃,12000r/min离心15min,将上层水相转入另一灭菌的1.5mL离心管。
⑥加入氯仿、异戊醇混合液(24:1)500mL,充分混合20min,4℃,12000r/min离心10min,将上清液转入另一1.5mL离心管中。
⑦加入0.1倍体积的NaAc缓冲液及2倍体积的冰冷的无水乙醇,混合转动离心管直至白色的絮状沉淀析出。
⑧4℃,12000r/min离心10min,弃去上清液,用70%的冰冷乙醇漂洗DNA沉淀2次。
⑨4℃,12000r/min离心10min,弃上清液,室温下使乙醇挥发干净。
⑩干燥后的DNA溶液中加入80~100μL的超纯水溶解,4℃保存直至DNA完全溶解,利用紫外分光光度仪检测其质量,-80℃保存。
2.DNA池的构建
用紫外光光度计测定DNA样品在260nm、280nm处的OD值。计算DNA含量和OD260/OD280的比值,DNA浓度(ng/μL)=50×OD260值×稀释倍数。如果OD260/OD280比值小于1.6,说明样品中含有较多的蛋白质或酚,则应进行纯化;如果比值大于1.8,则应该考虑去除RNA纯化。DNA检测完毕后,取出一定的量稀释至50ng/μL,然后从2个绵羊群体中随机选择10个浓度为50ng/μL DNA样品中取5μL混合构建DNA池。
二、扩增引物设计
1.绵羊NELF基因PCR引物的设计
以NCBI所公布的绵羊序列(NC_019477.2)为参考,利用Primer 5.0软件设计能够扩增包含绵羊NELF基因第454位点的PCR引物,其引物序列如下:
上游引物F:5’-TTGCCCCTTTCGTTGCTC-3’ 18nt;
下游引物R:5’-TTTCTCCACTGTCACCGCC-3’ 19nt。
三、PCR扩增
PCR反应体系如表2所示。
表2 PCR反应体系
PCR反应程序为:95℃预变性5min;95℃变性30s,64℃退火50s,72℃延伸30s,34个循环;72℃后延伸10min。
四、PCR产物测序
将用以上混合的DNA池为模板扩增的PCR产物送上海生工有限公司进行双向测序。对绵羊NELF基因目的片段测序结果与参考序列进行比对,发现在基因组的第454位存在一个T>C的突变(参见图1、图2以及图3)。
五、PCR产物变性及SSCP检测
对于PCR扩增后的产物首先变性,然后进行聚丙烯酰胺凝胶检测,最终根据不同的带型结果判定其SNP多态性。具体步骤如下:
(1)根据不同的扩增片段,选择30%丙烯酰胺(29:1)配成10%~12%的聚丙烯酰胺凝胶(见表3)。
(2)加好上述溶液后,用玻璃棒慢慢搅动,使其充分混匀。立即缓慢倒入已准备好的底部密封的玻璃板之间,注意不要产生气泡;倒好凝胶后,立即插上梳子,切勿在梳子齿下留有气泡。
(3)待胶凝固后,拔掉梳子,轻轻的甩干点样孔中的水分,然后将玻璃板固定到垂直电泳槽上,并往槽中倒入1×TBE缓冲液。
(4)取8μL PCR产物,加入8μL变性缓冲液(95%甲酰胺、10mol/L EDTA、0.05%溴酚兰、0.05%二甲苯青),瞬时离心后在PCR仪中98℃变性10min,取出后立即置于冰上,30min后即可上样。
(5)4℃、先250V预电泳20min,然后120V电泳4h(根据扩增片段大小、凝胶浓度以及玻璃板的长度确定电压大小和电泳时间)。
(6)将电泳槽中的1×TBE缓冲液倒出回收,然后从玻璃板中取出凝胶,用蒸馏水漂洗2次后,加入适量的0.1%的硝酸银溶液,放于摇床避光轻轻摇15min(硝酸银可回收利用2~3次)。
(7)加入显色液(2%氢氧化钠+0.1%甲醛)浸没凝胶,边摇边观察,直到凝胶上显现电泳带。
(8)待条带清晰后,倒掉显色液,迅速用去离子水清洗2~3次。银染后的聚丙烯酰胺凝胶利用凝胶成像系统成像保存,留做后续的分析统计。
表3中性聚丙烯酰胺凝胶的组成
PCR-SSCP图片如图4所示。不同的带型表示不同的基因型。从图中可以看出NELF基因454位点存在三种基因型,即TT、TC、CC,其中,TT基因型和CC基因型均为两个条带,且TT基因型与CC基因型相比,远离上样端的条带距离上样端更远,TC基因型具有相应的三个条带。
六、绵羊NELF基因SNP位点的频率统计及其与繁殖性状的关联分析
1.基因和基因型频率
基因型频率是指一个群体中某一性状的各种基因型之间的比率。计算公式如下:
PBB=NBB/N
其中PBB代表某一位点的BB基因型频率;NBB表示群体中具有BB基因型的个体数;N为检测群体的总数量。
基因频率是指一个群体中某一基因对其等位基因的相对比率。计算公式可写成:
PB=(2NBB+NBb1+NBb2+NBb3+NBb4+……+NBbn)/2N
式中,PB表示等位基因B频率,NBB表示群体中具有BB基因型的个体数量,NBbi表示群体中具有Bbi基因型个体数量,b1~bn为等位基因B的n个互不相同的复等位基因。
各品种中的基因频率与基因型频率的统计结果如表4所示:
表4 2个绵羊品种中NELF基因的基因型和等位基因频率
从表3中可以看出等位基因T的频率变化范围为0.460~0.506,等位基因C的频率变化范围为0.494~0.500,由此可见,在2个绵羊品种中,对于等位基因C的选择具有很大的潜力。
2.相关分析统计模型
利用SAS(9.2)软件分析基因位点与繁殖性状(产羔数)的相关性。先对数据进行描述性统计分析,确定是否存在离群值,根据数据特征,利用t分析、方差分析或是多元线性模型分析基因型效应。在数据处理中,根据影响产羔数因素不同,考虑到环境效应、年龄、基因型效应及相关的互作效应,采用固定模型进行分析,同时,根据实际情况进行取舍。完整的模型如下:
Yijk=μ+Gj+Eijk
其中:Yijk为个体表型记录;μ为群体均值;Gj为各位点的基因型效应;Eijk为随机误差。
表5 NELF基因单核苷酸多态性与绵羊繁殖性状之间的方差分析
注:平均值肩标上具有相同字母表示差异不显著(P>0.05),平均值肩标上字母不同表示差异显著(P<0.05)。
表6 NELF基因单核苷酸多态性与湖羊繁殖性状之间的方差分析
表7 NELF基因单核苷酸多态性与小尾寒羊繁殖性状之间的方差分析
参见表5、6、7,结果表明,在绵羊NELF基因序列的第454位单核苷酸多态位点上的不同基因型与绵羊产羔数关联分析表明,TC基因的个体的产羔数显著高于TT和CC两种基因型的个体。如果分品种来看,对于湖羊来说TC基因型的个体的产羔数显著高于TT和CC基因型个体。但对于小尾寒羊来说,TC基因型的个体的产羔数与TT和CC基因型个体差异不显著。从群体来看,TC基因型与TT和CC基因型差异显著,但在品种上只在湖羊上检测到了差异性,而在小尾寒羊上未检测到,这可能是品种特异性造成的。因此推测TC基因型可作为湖羊早期选择的分子育种基因标记。
总之,本发明所述的方法能够快速的检测绵羊NELF基因的单核苷酸多态性,为NELF基因的SNP与繁殖性能关系的建立奠定基础,以便用于中国绵羊用繁殖性状的标记辅助选择(MAS)育种提供基础资料,快速建立遗传资源优良的绵羊种群。
核苷酸序列表
<110> 兰州大学
<120> 利用PCR-SSCP快速检测绵羊NELF基因单核苷酸多态性的方法及其应用
<160> 2
<210> 1
<211> 18
<212> DNA
<213> 人工合成
<400> 1
ttgccccttt cgttgctc 18
<210> 2
<211> 19
<212> DNA
<213> 人工合成
<400> 2
tttctccact gtcaccgcc 19
- 还没有人留言评论。精彩留言会获得点赞!