一种低盐泡菜微生态添加剂及其制备方法与流程
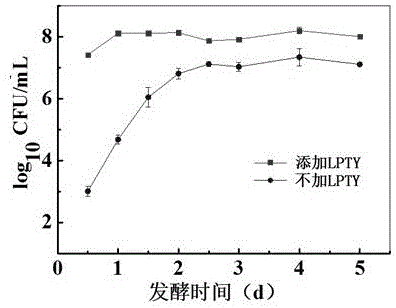
本发明属于食品领域,尤其是食品中泡菜发酵生物
技术领域:
,具体为一种低盐泡菜微生态添加剂及其制备方法。
背景技术:
:泡菜是一种传统发酵蔬菜制品,遍及全国各地,一直是不可缺少的佐餐小菜。但由于人体摄入盐过高,会增加患高血压、心脑血管和骨病的风险,因此低盐化工艺(食盐含量0.5~3%)将是传统泡菜产业发展的重要方向之一。但是,泡菜盐度低,微生物抑制能力弱,发酵前期,蔬菜表面杂菌迅速生长,存在亚硝酸盐含量超标(>20mg/kg)的安全隐患。过量的亚硝酸盐存在以下危害:1)被人体吸收,将低铁血红蛋白氧化为高铁血红蛋白,致使组织缺氧;2)在酸性环境下(例如胃液)生成具有强烈致癌作用的N-亚硝胺类化合物。近年来随着抗生素的滥用,致使耐药菌株大量出现,引起食品安全和环境污染等严重问题。细菌素作为一种新兴的生物抑菌剂,其所具有的高效、无毒、耐酸、耐高温、无残留、无抗药性等特点,使其成为研究的热点,目前作为一种“绿色防腐剂”正日益受到人们的重视。细菌素是由微生物通过核糖体合成机制产生的一类具有抗菌活性的蛋白质或低分子量多肽物质,抑菌范围不仅仅局限于同源的细菌,产生菌对其细菌素具有自身免疫性。细菌素作为一种特殊的抗菌抑菌蛋白质,具有抑菌活性强、生物相容性好、性能稳定、可生物降解、可消化吸收、生物安全性高的特点。目前发现主导泡菜发酵的乳酸菌为戊糖乳杆菌,其代谢产物包括细菌素、乳酸、消化酶等。戊糖乳杆菌与植物乳杆菌相似度极高,具有很多的保健作用,如:有一定的免疫调节作用;降低血清胆固醇含量和预防心血管疾病;维持肠道内菌群平衡;促进营养物质吸收;缓解乳糖不耐症;抑制肿瘤细胞的形成等。基于以上特性,我们把戊糖乳杆菌作为本案制备添加剂的主要种类。技术实现要素:本发明的发明目的是针对低盐泡菜存在致病菌的安全隐患问题,以及低盐泡菜中亚硝酸盐含量高于国家标准的问题,提供一种低盐泡菜微生态添加剂及其制备方法。该低盐泡菜微生态添加剂可以解决低盐泡菜频繁换菜而出现生花、粘稠的问题,使低温条件下低盐泡菜的发酵周期长。为了实现上述目的,本发明的具体技术方案为:一种低盐泡菜微生态添加剂,该微生态添加剂中包括戊糖乳杆菌PCYSWX-5,并进一步制备成细菌素。戊糖乳杆菌的分类命名为Lactobacilluspentosus,该菌株于2016年7月15日在中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCCNo.12793,保藏单位地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。一种低盐泡菜微生态添加剂的制备方法,包括如下步骤:(1)将戊糖乳杆菌PCYSWX-5接入灭菌后的液体培养基中,于30~40℃培养24~48小时,得到种子液;所述液体培养基的配制如下:蛋白胨9~11g,牛肉膏9~11g,酵母浸粉4~6g,葡萄糖18~23g,柠檬酸胺1~3g,乙酸钠3~6g,磷酸氢二钾1~3g,吐温900~1.1mL,硫酸镁0.1~0.2g,硫酸锰0.03~0.06,水1000mL。(2)将步骤(1)得到的种子液按接种量1%~15%接种到发酵培养基中进行发酵培养,培养条件:30~37℃,通气量0.5~2.5vvm,转速150~300rpm,发酵30~48小时;所述发酵培养基包括碳氮质量比为1∶2~20的发酵底物,发酵底物按照与水的质量比为3~20∶100配制成发酵培养基。(3)将步骤2)发酵得到的发酵液通过12000转/分钟离心15分钟后取上清液,在上清液中慢慢加入无水硫酸铵,缓慢搅动使其完全溶解,直至硫酸铵饱和度达80%,置于4℃静置过夜,然后将其在4℃,13000转/分钟的条件下冷冻离心20~30分钟,得到细菌素沉淀粗提物;(5)将步骤4)细菌素初粗提物进一步采用SephadexG-25凝胶过滤层析进行纯化,凝胶柱用10mM硫酸钠缓冲液进行预平衡,然后将硫酸铵沉淀的样品溶解于0.10M的磷酸盐缓冲液后上柱,上柱体积为15ml,固定流速0.5ml/min,分段收集,每段2ml,通过抑菌实验检测每段收集液活性,有活性的收集液通过疏水层析进行脱盐,最后通过反相高效液相层析进行进一步纯化,从而得到纯品添加剂,该纯化步骤可以采用传统方法。本发明的积极效果为:(一)、目前生产的传统低盐发酵泡菜,由于盐度低,蔬菜表面附带的致病菌不能被抑制,存在安全隐患。所添加的微生态添加剂可以抑制或杀死大肠杆菌、金黄色葡萄球菌、阪崎肠杆菌、单核增生李斯特菌、沙门氏菌等常见的致病菌,且对主要发酵菌无抑制作用,提高泡菜食用的安全性。(二)、本微生态添加剂能在发酵初期强烈抑制或杀死低盐泡菜中的硝酸盐还原菌,使低盐泡菜中的亚硝酸盐含量低于国家标准。(三)、目前主要通过添加乳酸菌菌剂来抑制泡菜中的有害菌,缩短发酵周期。但如果气温较低,乳酸菌生长较慢,往往会被生长迅速的有害菌所抑制,导致冬季泡制泡菜成熟时间较长且存在安全隐患。本添加剂属于微生物代谢产物,在-40℃下保藏1年仍存在抑菌活性。(四)、本添加剂用量是μL/100mL级,且具有很好的热稳定性及酸碱耐受性,这保证了其不易受热处理以及加工程序的影响;(五)、本添加剂分子量相对较小,且具有很好的抗逆性,无抗原性,通常可以被机体内的一些蛋白酶类物质降解,且没有任何毒副作用。(六)、本添加剂是由戊糖乳杆菌的基因编码并由蛋白表达,具有自身免疫性,不会使有害菌产生耐药性。(七)、本添加剂可间接或直接用于泡菜的保鲜剂。附图说明图1为自然发酵泡菜中大肠菌群计数结果曲线图;图2为自然发酵泡菜中乳酸菌计数结果曲线图;图3为自然发酵泡菜中亚硝酸盐含量曲线图。具体实施方式为了使本发明的发明目的、技术方案及优点更加清楚明白,下面结合具体实施方式对本发明作进一步的详细描述,但不应将此理解为本发明上述主题的范围仅限于下述实施例。实施例1:抑菌活性戊糖乳杆菌的筛选及鉴定取泡菜坛上中下层泡菜水25mL,置于225mL灭菌生理盐水中,均匀混合后用灭菌生理盐水进行梯度稀释至10-6,取各稀释度样品100μL涂布于MRS平板上,37℃静置培养48h。挑取培养基上肉眼可见的单菌落进行划线,反复纯化直至无其他杂菌,记录不同菌落的状态,并用革兰氏染色法进行镜检,观察其形态特征,将完全纯化后的各个菌株进行编号,并甘油保存于‐80℃冰箱中,分离纯化出戊糖乳杆菌。将戊糖乳杆菌以2%的接种量接种于100mL灭菌后的液体培养液中,于37℃静置培养48h,得到种子液。所述液体培养基的配制如下:蛋白胨9~11g,牛肉膏9~11g,酵母浸粉4~6g,葡萄糖18~23g,柠檬酸胺1~3g,乙酸钠3~6g,磷酸氢二钾1~3g,吐温900~1.1mL,硫酸镁0.1~0.2g,硫酸锰0.03~0.06,水1000mL。将得到的种子液按接种量2%接种到发酵培养基中进行发酵培养,培养条件:37℃,通气量0.5vvm,转速300rpm,发酵48小时。发酵得到的发酵液通过12000转/分钟离心15分钟后取上清液,置于4℃保藏。所述发酵培养基包括碳氮质量比为1∶2~20的发酵底物,发酵底物按照与水的质量比为3~20∶100配制成发酵培养基。采用牛津杯抑菌法来进行抑菌实验:向灭菌平板中倒入15mL2%的水琼脂(下层),凝固后将无菌牛津杯依次垂直摆放,向冷却至50℃左右含0.75%琼脂的LB培养基中加入指示菌(EscherichiacoliATCC25922和StaphylococcusaureusATCC25923),倾倒5mL于下层水琼脂上待凝固(上层),待充分冷却凝固后拔出牛津杯,取各菌株的发酵上清液100μL分别加入各孔中,每个菌株做三个平行,4℃冰箱中扩散4h后移至37℃培养箱中过夜培养,观察抑菌圈的大小以及透明度,选取抑菌效果最好的菌株为本添加剂选用菌株。最后通过16SrDNA同源性分析及多重PCR对该菌进行鉴定。微生态添加剂的制备向发酵液后的上清液中慢慢加入无水硫酸铵,缓慢搅动使其完全溶解,直至硫酸铵饱和度达80%,置于4℃静置过夜,然后将其在4℃,13000转/分钟的条件下冷冻离心20~30分钟,得到沉淀粗提物。初提物进一步采用SephadexG-25凝胶过滤层析进行纯化,凝胶柱用10mM硫酸钠缓冲液(pH7.0)进行预平衡,然后将硫酸铵沉淀的样品溶解于0.10M的磷酸盐缓冲液(PBS,pH6.8)后上柱,上柱体积为15ml,固定流速0.5ml/min,分段收集,每段2ml,通过抑菌实验检测每段收集液活性,有活性的收集液通过疏水层析进行脱盐,最后通过反相高效液相层析进行进一步纯化,从而得到纯品添加剂,将该纯品添加剂命名为LPTY。微生态添加剂LPTY的特性分析1)对温度的耐受性:将添加剂LPTY在60、80、100℃、121℃分别处理10min和20min,以未经热处理的样品为对照,大肠杆菌ATCC25922和金黄色葡萄球菌ATCC25923为指示菌,检测热处理对添加剂LPTY活性的影响,以处理组的抑菌圈直径与对照组抑菌圈直径之比表示抗菌活性存留率,结果如表1所示,60℃、80℃与100℃的温度处理对于添加剂LPTY的活性影响差异虽然存在,但幅度并不大;121℃的高温处理后,添加剂LPTY对大肠杆菌和金黄色葡萄球菌的抑菌效果与其他处理相比均有所降低,且差异显著,但其降低幅度也较小,仅仅为13%左右。由此可说明此添加剂LPTY具有很强的温度稳定性。2)对酸碱的耐受性:分别取1mL添加剂LPTY于试管中,用0.5M的盐酸或氢氧化钠调整pH至2、3、4、5、6、7、8、9、10、11,静置2h后将pH调整为7.0,以大肠杆菌ATCC25922和金黄色葡萄球菌ATCC25923为指示菌,未调pH的添加剂LPTY为对照,检测抗菌活性。结果如表1所示,在pH2-11的处理范围内,添加剂LPTY均保有抑菌活性。指示菌为大肠杆菌时,添加剂LPTY在pH3、4、5时的活性最佳,且与其他pH相比差异显著,pH为2和6时,添加剂LPTY的抑菌活性基本相当,而当pH≥7的偏碱性条件下,添加剂LPTY的抑菌活性有明显的降低pH;指示菌为金黄色葡萄球菌时,pH为2强酸性条件下抑菌效果极好pH3-6时,添加剂LPTY也具有良好的抑菌活性,当pH≥7的偏碱性条件下,添加剂LPTY的抑菌活性明显降低pH,且随着pH的下降,活性也随之下降。文献报道的大部分添加剂LPTY都是在酸性至中性条件下抑菌效果良好,而在碱性条件下抑菌作用降低甚至消失,因此此结果与大部分的文献报道相吻合。3)对酶的敏感性:取制备的添加剂LPTY分别加入胃蛋白酶、胰蛋白酶、木瓜蛋白酶、蛋白酶K的最适缓冲液中,酶的终浓度为10mg/mL,胃蛋白酶处理为pH2.5的柠檬酸钠缓冲液,胰蛋白酶和木瓜蛋白酶的酶处理为pH7.0的磷酸钠缓冲液,蛋白酶K的酶处理为pH7.0的Tris-HCl缓冲液,37℃水浴4h后,以大肠杆菌ATCC25922和金黄色葡萄球菌ATCC25923为指示菌检测抗菌活性的存留率,未处理的发酵上清液为对照,结果如表1所示,添加剂LPTY经过胃蛋白酶、胰蛋白酶、木瓜蛋白酶和蛋白酶K在37℃处理4h后,抑菌活性出现降低,且经胃蛋白酶处理后,抑菌活性完全消失,说明添加剂LPTY进入人体可被分解。表1不同条件处理下微生态添加剂LPTY的抑菌活性添加剂LPTY的贮藏稳定性将制备的添加剂LPTY分别置于-40℃(一年)及4℃(半年)冰箱中,回温至室温后使用牛津杯抑菌法测定其剩余抑菌活性。空白对照为新鲜制备的添加剂LPTY。结果如表2所示,添加剂LPTY置于-40℃(一年)和4℃(半年)冰箱中,抑菌效果与新鲜样品相比虽然有着显著性差异,但其活性仍然保持在90%以上,说明此添加剂LPTY具有良好的贮藏稳定性。表2添加剂LPTY的贮藏稳定性处理抑菌直径(mm)-40℃(一年)20.00±0.144℃(半年)20.00±O.OO新鲜添加剂22.20±0.14添加剂LPTY的抑菌谱通过检测对不同微生物的抗菌活性可以更好的在实践中应用本添加剂LPTY,本试验中检测的指示菌包括:常见致病菌、耐药菌及主导发酵的乳酸菌,结果如表3所示,添加剂LPTY对指示菌均有良好的抑菌效果,其中对于粪肠球菌ATCC29212的抑菌作用最强,对植物乳杆菌和戊糖乳杆菌无抑制作用。本添加剂LPTY能抑制或杀死泡菜中的常见致病菌及其耐药菌,同时不会影响乳酸菌对泡菜的发酵,提高了泡菜食用的安全性。表3添加剂LPTY的抑菌谱添加剂LPTY在泡菜中的应用将新鲜的萝卜进行切分成3cm×3cm的块状,然后进行清洗、沥干,准备2L已经灭菌的泡菜坛,向泡菜坛中加入650g萝卜和1300mL2%的盐水,其中一组加入20uL添加剂LPTY,一组接种20ml已活化的戊糖乳杆菌菌悬液,然后分别放入25℃和10℃培养箱中培养。每12h进行取样,对其亚硝酸盐含量进行检测,对大肠菌群和乳酸菌进行计数。结果如表4所示,添加戊糖乳杆菌菌悬液发酵的泡菜在25℃的条件下效果不如加添加剂LPTY发酵的泡菜,且添加菌悬液的泡菜在低温条件下存在安全风险。而加入添加剂LPTY后,明显缩短了泡菜的发酵成熟时间,加快了亚硝峰出现的时间和大肠菌群消亡的时间,并且使亚硝峰值降低到国家标准(20mg/kg)以内。表4添加剂LPTY在泡菜中的应用以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1