一种荧光探针PMPA及其制备方法与应用与流程
本发明涉及荧光探针,具体属于一种荧光探针及其制备方法,以及该探针应用于生物样品中pH和亚硫酸氢根的检测。
背景技术:
HSO3-和pH在现代工业和生产生活中具有重要意义。亚硫酸盐因为能够抑制氧化和微生物生长以及着色等优点被广泛应用于食物和饮料。但是亚硫酸过量会引起一些疾病,如过敏反应、哮喘、肠胃和皮肤过敏疾病等。WHO规定每人每日亚硫酸盐的允许摄入量为0-0.7mg/Kg(以SO2计)。现在工业生产中释放大量的二氧化硫,形成的酸雨严重腐蚀建筑物和庄稼,并且会导致河流湖泊过度酸化。因此在生物和实际样品中方便快速检测亚硫酸盐十分必要的。
细胞内的pH在参与细胞活动中起着必不可少的作用,比如:细胞循环调控、细胞的生长和凋亡、离子转运、酶活性、钙调控、肌肉收缩和多用耐药性等方面。
pH异常会导致细胞功能紊乱甚至严重者会引发诸如炎症、癌症、阿尔茨海默症等疾病。因此,对pH值的动态变化进行灵敏、准确的实时监测能够为分子水平上研究细胞的生理和毒理过程提供重要的信息。
目前已经存在的亚硫酸盐检测方法有色谱法。传感器法、电化学法、毛细血管电泳和酶技术联用等。常用于pH的检测方法有微电极、NMR和紫外吸收光谱等。但这些方法具有很大的局限性,如仪器昂贵、处理复杂、费事等,不利于检测。相反荧光光谱检测技术具有快速实时响应、分辨率高、灵敏度高、操作简便、非破坏性等优点,且基于荧光探针与分子作用引起的荧光信号变化的传感、荧光显微成像的荧光光谱法显示出独特的时间和空间上的优势,结合激光共聚焦显微镜,荧光成像技术成为分子水平上进行实时原位监测细胞内pH和HSO3-的重要手段。现在文献报道了许多用于检测pH或HSO3-的荧光探针,但是能同时检测pH和HSO3-的荧光探针是非常少的。因此,这就迫切需要计和合成具有合成简单、灵敏度高、选择性好、检出限低、光稳定性好的能检测生物样品的pH和HSO3-变化的荧光探针。
技术实现要素:
本发明的目的之一是提供一种荧光探针PMPA。目的之二是提供该探针PMPA的制备方法,该制备工艺简单,成本低廉。目的之三是提供该探针的用途,即应用于生物样品pH和HSO3-变化的检测。该探针应具有快速响应、灵敏度高、选择性、检出限低和光稳定性好,并且具有大的Stokes位移,能够有效减小生物样品自身荧光的干扰的优点。
本发明提供了一种荧光探针PMPA,其是1-(芘-1-基)-3-(6-甲氧基吡啶-3-基)丙烯酮,结构式为:
本发明提供的一种的荧光探针PMPA的制备方法,包括如下步骤:
(1)按摩尔比3:3-5将1-乙酰芘、6-甲氧基-吡啶-二甲醛溶解于无水乙醇中,并且在室温下搅拌至反应物完全溶解,呈淡黄色溶液;
(2)然后加入氢氧化钠溶液,常温下继续搅拌32小时,TLC跟踪反应(V乙酸乙酯:V石油醚=1:10);
(3)最后加入无水乙醇,生成黄色的絮状沉淀;静置,抽滤,干燥,即得到黄色固体PMPA。
其合成路线如下:
本发明提供的一种定量荧光检测酸性条件下pH的方法,其步骤为:
(1)用DMSO配制1mM的荧光探针PMPA储备液;
(2)将2.0mL蒸馏水以及30.0μL荧光探针PMPA储备液加入荧光比色皿中,在荧光分光光度仪上检测,随着待测样的加入,527nm处的荧光强度逐渐减弱,417nm处的荧光强度逐渐增强。
(3)以pH为横坐标,以相对荧光强度I417nm/I527nm为纵坐标绘制图并进行Sigmoidal拟合,求得pKa=2.70;通过线性拟合得到荧光探针的最佳线性响应范围为pH1.26-3.97,回归方程为:I417nm/I527nm=-4.64×pH+19.87,线性相关系数为R2=0.9906。
稳定性实验证明荧光探针对酸性pH的测定具有良好的光稳定性。
经实验验证,常见金属阳离子不干扰体系对酸性pH的测定。
本发明提供的一种定量荧光检测碱性条件下pH的方法,其特征在于,步骤为:
(1)用DMSO配制1mM的荧光探针PMPA储备液;
(2)将2.0mL蒸馏水以及30.0μL荧光探针PMPA储备液加入荧光比色皿中,在荧光分光光度仪上检测,随着待测样的加入,527nm处的荧光强度逐渐减弱,460nm处的荧光强度逐渐增强;
(3)以pH为横坐标,以相对荧光强度I527nm/I460nm为纵坐标绘制图并进行Sigmoidal拟合,求得pKa=9.32;通过线性拟合得到荧光探针的最佳线性响应范围为pH8.50-10.35,回归方程为:I527nm/I460nm=-1.15×pH+12.46,线性相关系数为R2=0.9904。
稳定性实验证明荧光探针对碱性pH的测定具有良好的光稳定性。
经实验验证,常见金属阳离子不干扰体系对碱性pH的测定。
本发明提供了一种定量荧光检测HSO3-的方法,其特征在于,步骤为:
(1)用DMSO配制1mM的荧光探针PMPA储备液;
(2)将2.0mLPBS缓冲溶液(pH=4.00)以及30.0μL荧光探针储备液加入荧光比色皿中,在荧光分光光度仪上检测,随着待测样的加入,527nm处的荧光强度逐渐减弱。
(3)以HSO3-浓度为横坐标,以相对荧光强度△F为纵坐标绘制图,得到HSO3-浓度的工作曲线,线性回归方程为:△F=64.53[HSO3-]+21.68。线性相关系数为R2=0.9943,最佳线性响应范围为0μM-6.5μM,检出限(LOD)为0.32μM,。
经实验验证,常见阴离子不干扰体系对HSO3-的测定。
本发明的荧光探针PMPA通过荧光共聚焦显微镜成像技术,证明了可用于检测生物(动物、微生物)样品内pH或HSO3-变化。
与现有荧光探针相比,本发明合成荧光探针PMPA具有以下优点:1、本发明的荧光探针合成步骤简单,成本低廉。2、该探针既能检测pH又能检测HSO3-,并且可以应用于生物样品的pH或HSO3-变化的检测。3、荧光PMPA对pH和HSO3-响应具有灵敏度高、检出限低和选择性好,不受常见金属离子的干扰并且具有大的Stokes位移,能够有效减小激发和生物样品自身荧光的干扰。4、检测手段简单,只需要借助荧光光谱仪即可实现。
附图说明
图1实施例2荧光探针随酸性变化的紫外吸收光谱图
图2实施例3荧光探针随酸性变化的荧光滴定图
图3实施例3荧光探针对酸性响应的工作曲线
图4实施例4荧光探针对常见金属离子的响应情况
图5实施例5大肠杆菌(E.coli)成像图
图6实施例6人肺腺癌细胞(A549)成像图
图7实施例7荧光探针随碱性变化的紫外吸收光谱图
图8实施例8荧光探针随碱性变化的荧光滴定图
图9实施例8荧光探针对碱性响应的工作曲线
图10实施例9荧光探针对常见金属离子的响应情况
图11实施例10大肠杆菌(E.coli成像图
图12实施例11人肺腺癌细胞(A549)
图13实施例12荧光探针随HSO3-变化的紫外吸收光谱图
图14实施例13荧光探针随HSO3-变化的荧光滴定图
图15实施例13荧光探针对HSO3-响应的工作曲线
图16实施例14荧光探针对常见阴离子的响应情况
图17实施例15人肺腺癌细胞(A549)成像图
具体实施方式
实施例1荧光探针的的制备
(1)在250mL双口烧瓶中分别加入0.7436g(3.0mmol)1-乙酰芘、0.5482g(4.0mmol)6-甲氧基-吡啶-二甲醛和60mL无水乙醇,常温(20℃)下磁力搅拌10分钟至反应物完全溶解,呈淡黄色溶液;
(2)然后加入3mL 10%氢氧化钠溶液,反应液变为黄色,常温下继续搅拌32小时,TLC跟踪反应(V乙酸乙酯:V石油醚=1:10);
(3)期间黄色溶液逐渐变为黄色晶体贴在烧瓶壁上,加入无水乙醇后,生成大量黄色的絮状沉淀;静置,抽滤,干燥,得到黄色固体产品0.5211g,产率47.1%。
荧光探针用1H NMR表征,结果如下:
1H NMR(600MHz,DMSO-d6,δ/ppm):δ8.625~8.609(d,1H,J=9.6Hz),8.544(s,1H),8.469~8.456(d,1H,J=7.8Hz),8.431~8.384(m,3H),8.348~8.283(m,4H),8.171~8.145(t,1H,J=7.8Hz),7.747~7.721(d,1H,J=15.6Hz),7.678~7.651(d,1H,J=16.2Hz),6.929~6.915(d,1H,J=8.4Hz),3.908(s,1H).
13C NMR(150MHz,DMSO-d6,δ/ppm):194.83,165.39,150.04,142.47,138.20,133.83,133.28,131.16,130.56,129.67,129.54,129.09,127.74,127.26,127.21,126.85,126.59,126.52,124.93,124.87,124.79,124.48,124.04,111.68,54.10.
实施例2荧光探针随酸性变化的紫外吸收光谱图
在2.0mL蒸馏水体系中加入30.0μL荧光探针储备液,并且用HCl进行调节pH值,并记录其紫外吸收光谱(图1)。随着酸性的减弱,在330nm处的紫外吸收逐渐下降。
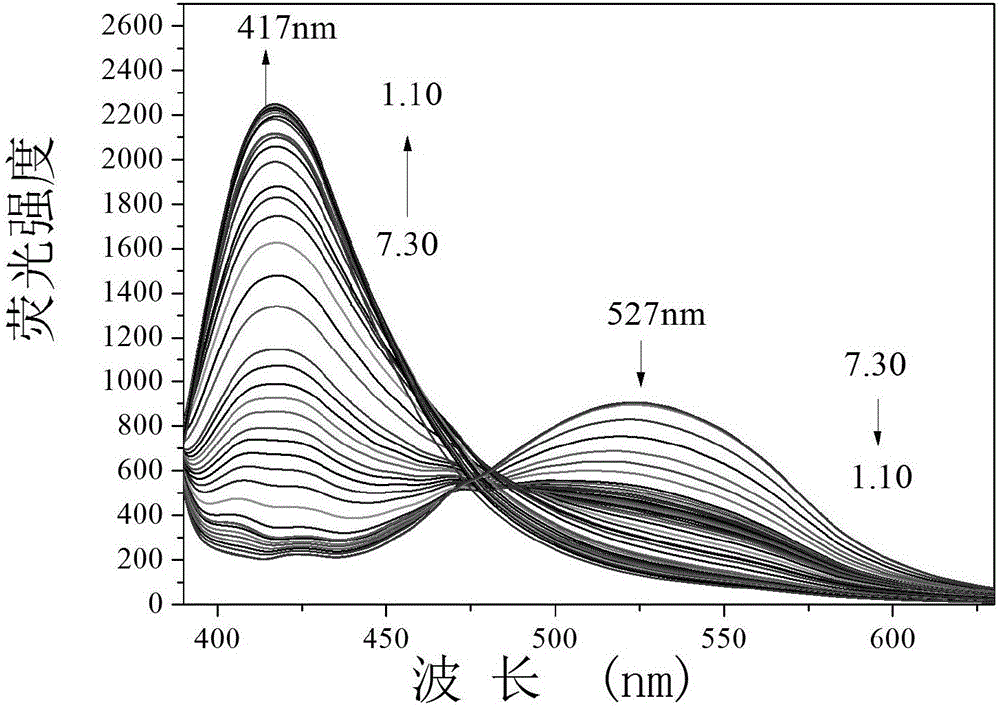
实施例3荧光探针PMPA随酸性变化的荧光滴定图
在2.0mL蒸馏水的体系中加入30.0μL荧光探针储备液,用HCl调节体系的pH值,在荧光分光光度仪上检测,随着酸性的增强,527nm处的荧光强度逐渐减弱,417nm处的荧光强度逐渐增强(图2)。仪器参数:激发波长和发射波长的狭缝宽度分别为5.0nm、5.0nm,电压为600V,荧光探针溶液的最大激发波长为:λex为370nm和最大发射波长为λem 527nm。以相对荧光强度I417nm/I527nm为对pH值作图,并利用Sigmoidal进行拟合,求得pKa=2.70;通过线性拟合得到PMPA最佳线性响应范围为pH 1.26-3.97,回归方程为:I417nm/I527nm=-4.64×pH+19.87,线性系数为R2=0.9906(图3)。
实施例4荧光探针对常见金属离子的响应情况
将实施例1中的探针浓度保持在15.0μM,考察该探针在常见金属离子存在下,对H+的选择性。图4所示,分别在不同pH(pH 7.30,3.05)条件下,探针对金属离子几乎没有响应,证明了对H+具有很高的选择性。图4中物质的顺序和浓度依次为:1.空白;2.Ca2+(150mM);3.Na+(150mM);4.K+(150mM);5.Zn2+(0.2mM);6.Mg2+(2.0mM);7.Hg2+(0.2mM);8.Fe2+(0.2mM);9.Al3+(0.2mM);10.Pb2+(0.2mM);11.Mn2+(0.2mM);12.Co2+(0.2mM);13.Cr3+(0.2mM);14.Cd2+(0.2mM);15.Fe3+(0.2mM);16.Ni2+(0.2mM);17.Cu2+(0.2mM).
实施例5大肠杆菌(E.coli)成像图
将接种好的大肠杆菌(E.coli)与实施1中的探针分别在pH 7.30,4,50,3.00,和1.50的条件下于摇床中共同孵育2h,在激光共聚焦显微镜下观察。分别固定激发波长为405nm和458nm,收集发射波段分别为蓝色通道(410-460nm)和橙色通道(480-560nm)。随着pH从7.30降低到1.50,大肠杆菌的橙色荧光逐渐减弱甚至粹灭,而蓝色荧光逐渐增强(图5)。
实施例6人肺腺癌细胞(A549)成像图
实验之前用无水DMSO溶解固体ECBT得到浓度为1mM荧光探针PMPA储备液。分别在pH7.30,5.00,4.00和3.00的条件下取上述15μL荧光探针PMPA储备液加入含有贴壁细胞的培养基,置于37℃的5%CO2培养箱中孵育15min后,用磷酸盐缓冲液(PBS,pH 7.4)清洗三次,以除去培养基中过量的未进入细胞的探针储备液,在激光共聚焦显微镜下观察。分别固定激发波长为405nm和458nm,收集发射波段分别为蓝色通道(410-460nm)和橙色通道(480-560nm)。随着pH从7.30降低到3.00,细胞内橙色荧光逐渐减弱,而蓝色荧光逐渐增强(图6)。
实施例7荧光探针PMPA随碱性变化的紫外吸收光谱图
在2.0mL蒸馏水体系中加入30.0μL荧光探针储备液,并且用NaOH进行调节pH值,并记录其紫外吸收光谱(图7)。随着碱性增强,在330nm处的紫外吸收逐渐下降,并且出现蓝移。
实施例8荧光探针PMPA随碱性变化的荧光滴定图
在2.0mL蒸馏水的体系中加入30.0μL荧光探针储备液,用NaOH调节体系的pH值,在荧光分光光度仪上检测,随着碱性增强,527nm处的荧光强度逐渐减弱,460nm处的荧光强度逐渐增强(图8)。仪器参数:激发波长和发射波长的狭缝宽度分别为5.0nm、5.0nm,电压为600V,荧光探针溶液的最大激发波长为:λex为370nm和最大发射波长为λem 527nm。以相对荧光强度I527nm/I460nm对pH值作图,并利用Sigmoidal进行拟合,求得pKa=9,.32;通过线性拟合得到最佳线性响应范围为pH 8.50-10.35,回归方程为:I527nm/I460nm=-1.15×pH+12.46,线性系数为R2=0.9904(图9)。
实施例9荧光探针对常见金属离子的响应情况
将实施例1中的探针浓度保持在15.0μM,考察该探针在常见金属离子存在下,对OH-的选择性。图10所示,分别在不同pH(pH 7.30,8.15)条件下,探针对金属离子几乎没有响应,证明了对OH-具有很高的选择性。图10中物质的顺序和浓度依次为:1.空白;2.Ca2+(150mM);3.Na+(150mM);4.K+(150mM);5.Zn2+(0.2mM);6.Mg2+(2.0mM);7.Hg2+(0.2mM);8.Fe2+(0.2mM);9.Al3+(0.2mM);10.Pb2+(0.2mM);11.Mn2+(0.2mM);12.Co2+(0.2mM);13.Cr3+(0.2mM);14.Cd2+(0.2mM);15.Fe3+(0.2mM);16.Ni2+(0.2mM);17.Cu2+(0.2mM).
实施例10大肠杆菌(E.coli)成像图
将接种好的大肠杆菌(E.coli)与实施1中的探针分别在pH 7.30,9,50,10.50,和11.50的条件下于摇床中共同孵育2h,在激光共聚焦显微镜下观察。分别固定激发波长为405nm和458nm,收集发射波段分别为绿色通道(410-490nm)和橙色通道(510-600nm)。随着pH逐渐增强,大肠杆菌的橙色荧光逐渐减弱甚至粹灭,而绿色荧光逐渐增强(图11)。
实施例11人肺腺癌细胞(A549)成像图
实验之前用无水DMSO溶解固体ECBT得到浓度为1mM荧光探针PMPA储备液。分别在pH7.30,8.00,8.50和9.00的条件下取上述15μL荧光探针PMPA储备液加入含有贴壁细胞的培养基,置于37℃的5%CO2培养箱中孵育15min后,用磷酸盐缓冲液(PBS,pH 7.4)清洗三次,以除去培养基中过量的未进入细胞的探针储备液,在激光共聚焦显微镜下观察。分别固定激发波长为405nm和458nm,收集发射波段分别为绿色通道(410-490nm)和橙色通道(510-600nm)。随着pH增强,细胞内橙色荧光逐渐减弱,而绿色荧光逐渐增强(图12)。
实施例12荧光探针的HSO3-变化的紫外吸收光谱图
在2.0mLPBS缓冲溶液(pH=4.0)的体系中加入30.0μL荧光探针储备液进行HSO3-紫外滴定实验,并记录其紫外吸收光谱(图13)。随着HSO3-量的增加,在345nm和427nm处的紫外吸收均下降。
实施例13荧光探针随HSO3-变化的荧光滴定图
在2.0mLPBS缓冲溶液(pH=4.0)的体系中加入30.0μL荧光探针储备液进行HSO3-荧光滴定实验,在荧光分光光度仪上检测,随着HSO3-的增加,527nm处的荧光强度逐渐减弱(图14)。仪器参数:激发波长和发射波长的狭缝宽度分别为5.0nm、5.0nm,电压为600V,荧光探针溶液的最大激发波长为:λex为410nm和最大发射波长为λem 527nm。以HSO3-浓度为横坐标,以相对荧光强度△F为纵坐标绘制图,并利用Sigmoidal进行拟合,得到HSO3-浓度的工作曲线,线性回归方程为:△F=64.53[HSO3-]+12.46。线性相关系数为R2=0.9943,最佳线性响应范围为0μM-6.5μM,检出限(LOD)0.32μM(图15)。
实施例14荧光探针对常见阴离子的响应情况
在2.0mLPBS缓冲溶液(pH=4.0)的体系中加入30.0μL荧光探针储备液,再分别加入其它阴离子(F-、Cl-、Br-、I-、CO32-、HCO32-、NO3-、SO42-、AcO-、SCN-、S2O32-、S2-、HS-),使其最终浓度为0.5mM,再加入HSO32-,使其最终浓度为7.0μM,分别测其荧光光谱,绘制不同阴离子对应527nm荧光强度的柱状图。经试验验证,其它阴离子不干扰体系对HSO32-的检测(图16)。
实施例15人肺腺癌细胞(A549)成像图
1)先将两个培养皿中的培养液抽出,并用pH=7.40的PBS缓冲液洗涤。
2)然后向两个培养皿中加入含有15.0μL探针PNPA(1mM,用DMSO溶解)的2.0mLPBS(pH7.40)缓冲溶液孵育20min左右,后抽出,在用pH=7.40的PBS缓冲液进行洗涤。
3)2.0向其中一个孔板中加入含有6.0μL(1×10-3M)HSO3-的2.0mL pH=4.00的PBS缓冲溶液孵育20min左右,另一个孔板中只加入2.0mL pH=4.00的PBS缓冲溶液孵育20min左右,后抽出,再用pH=7.40的PBS缓冲溶液进行洗涤,最后在培养皿中加入2.0mL pH=7.40的PBS溶液在激光共聚焦显微镜下观察。固定激发波长为458nm,收集发射波长橙色通道(480-600nm)。在荧光共聚焦显微镜下可以看到在只加入探针时,细胞内呈现橙色荧光,加入)HSO3-后橙色减弱甚至消失(图17)。
- 还没有人留言评论。精彩留言会获得点赞!