一种检测致癌蛋白表皮生长因子受体的试剂及试剂盒的制作方法
本发明涉及一种检测致癌蛋白表皮生长因子受体(EGFR)的试剂及试剂盒,属于肿瘤分子诊断技术领域。
背景技术:
表皮生长因子受体(EGFR)属于受体酪氨酸激酶分子,在细胞生长、增殖、分化、迁移、粘连、存活等过程中起关键的控制和调节作用。EGFR在肺癌、乳腺癌、胰腺癌、胃癌、直肠癌、肝癌、脑癌、肾癌、前列腺癌等多种肿瘤组织中高度表达,其过表达程度与肿瘤的发生发展以及转移具有密切的相关性,特别是在肺癌中,已证明EGFR的激酶编码区突变导致EGFR活化是其肿瘤发生和恶化的主要原因之一。 根据世界卫生组织的统计,在亚裔女性非吸烟肺癌患者中,约有20% 的患者是EGFR活化突变造成的。因此, EGFR是肿瘤靶向治疗中最重要的靶向分子之一。EGFR的激酶抑制剂和抑制性抗体,如Gefitinib (Iressa)、erlotinib (Tarceva)、lapatinib(Tykerb)、Cetuximab (Erbitux)、panitumumab(Vectibix)等,已在肺癌的临床治疗中广泛使用,是目前肺癌靶向治疗中最为有效的药物。
由于EGFR在肿瘤发生发展和临床治疗中的重要性,其检测和临床分子诊断对于肿瘤的预防、靶向治疗及预后效果预测成为一项关键指标。 目前肿瘤组织中的EGFR检测主要为抗体染色和二代测序。抗体染色是肿瘤组织EGFR检测的常规方法,其操作步骤比较简便,但检测结果不是很稳定,变异较大。且抗体制作过程较为繁琐,成本较高。二代测序虽然可检测到EGFR的突变位点,但检测过程非常复杂,技术要求较高,且结果分析繁琐,需要专门的技术人员才能完成。同时检测成本也较高。因此,设计、发展和建立新型的快速、简便、准确以及经济的EGFR检测技术,对肿瘤的分子诊断和EGFR靶向治疗具有非常重要的临床意义。
本发明的发明人研究发现,非受体酪氨酸激酶TNK2(亦称ACK1)含有一个与EGFR结合的结构域。该结构域特异性地与活化的EGFR激酶结构域结合,从而形成稳定的复合物,命名该TNK2结构域为EGFR激酶结合结构域(EGFR kinase-binding domain,简称EKBD)。本发明中基于TNK2的EGFR激酶结合结构域, 结合荧光染料和分子标签标记技术,设计和构建了一种新型的活化EGFR检测试剂,并建立了新型的活化EGFR检测技术。同时应用该活化EGFR检测试剂和技术,发明了肿瘤组织和细胞的活化EGFR检测试剂盒,以用于肿瘤的临床分子诊断和预后效果的预测。
技术实现要素:
本发明的目的在于克服现有技术中窜仔的技术缺陷,提供一种新型的检测致癌蛋白表皮生长因子受体的技术。
为达到以上目的,本发明公开了一种与活化EGFR激酶结合的结构域EKBD,它的编码核苷酸序列如SEQ.ID.NO.1所示,氨基酸序列如SEQ.ID.NO.2所示。
SEQ.ID.NO.1:
gcgcagctgg ccatggacgc ctgctccctg ctggacgaga ccccgcctca gagccccacg cgggcactgc cccggcccct gcaccccacg cctgtggtgg actgggacgc acgcccgctg ccccccccgc ccgcctatga cgacgtggcc caggatgagg atgactttga gatctgctcc atcaacagca ccctcgtggg cgcgggggtc cctgccgggc ccagccaggg ccagaccaac tacgcctttg tgcctgagca ggcgcggccg ccccctcccc tggaggacaa cctgttcctc ccgccccagg gtgggggc
SEQ.ID.NO.2:GPASPPRVPPREPLSPQGSRTPSPLVPPGSSPLPPRLSSSPGKTMPTTQSFASDPKYATPQVIQAPGPRAGPCILPIVRDGKKVSSTHYYLLPERPSYLERYQRFL
所述的EKBD的核苷酸或氨基酸序列包括人和其他哺乳动物的TNK2或MIG6同源序列;
所述的EKBD核苷酸或氨基酸序列包括不影响或增强其与EGFR结合的序列改变,如序列点突变、剪切和添加等;
所述的EKBD核苷酸或氨基酸序列包括相似的人工合成序列。
本发明公开了利用荧光染料标记EKBD和EKBD融合蛋白检测肿瘤组织和细胞中活化EGFR的试剂和技术。检测肿瘤组织和细胞中活化EGFR的EKBD试剂的制作技术流程如图1所示。
本发明还提供一种检测致癌蛋白表皮生长因子受体的试剂,所述试剂包括EKBD结构域,具体的,所述试剂为带有荧光染料、标签或蛋白标记的EKBD。
所述荧光染料为FITC、罗丹明、俄勒冈绿、德克萨斯红、Cy5或Cy3,优选FITC。
所述标记EKBD的蛋白为HPR或其它酶功能蛋白或标签蛋白。
本发明还公开了使用EKBD检测肿瘤组织和细胞中活化EGFR的试剂和技术而制作的试剂盒,所述试剂盒中包括所述的检测致癌蛋白表皮生长因子受体的试剂。
所述试剂盒包括2种,这两种试剂盒的组成如下:
(1)试剂盒#1: HPR-EKBD融合蛋白、二甲苯溶液、0.5M柠檬酸盐缓冲液、30%过氧化氢溶液、阻断液和DAB染色液。
(2)试剂盒#2:荧光染料标记的FITC-EKBD、10×细胞固定液、10×细胞渗透液和10X清洗液。
其中所述的标记EKBD的荧光染料除FITC外,还包括但不限于罗丹明、俄勒冈绿、德克萨斯红、Cy5或Cy3等。
所述HRP-EKBD融合蛋白中除HRP外,还包括但不限于其它的酶功能蛋白及标签蛋白等。
试剂盒的具体成分为:
阻断液:10% 山羊血清。
DAB染色液:1000μL染色液A + 25μL染色液B + 10μL染色液C;其中的染色液A为DAB缓冲液,即50 mM Tris-HCl,pH7.6;染色液B为2% DAB;染色液C为1% H2O2。
10×细胞固定液:30% 多聚甲醛。
10×细胞渗透液:含浓度为1% Triton X-100 的10×PBS。
10×清洗液:0.5 M Tris-HCl,pH 7.5, 1.5 M NaCl ,0. 5% Tween-20。
本发明技术的特点和优势:
目前,致癌蛋白EGFR的病理诊断和检测技术主要基于抗体的免疫染色技术。由于抗体需要进行动物免疫反应产生,因此生产周期长(需6-12个月)、成本高。且抗体与EGFR的亲和性不可预测,其检测灵敏度也难以改进。同已有的EGFR检测技术相比,本发明中EGFR检测试剂盒的EKBD由于是通过大肠杆菌离体表达生产的,其生产周期短(1-2周),生产简便易操作,成本低,且检测灵敏度可以通过蛋白工程进行改进。同时,EKBD可通过分子设计进行各种标签标记,使其在EGFR临床检测的应用范围和目的非常广泛,可用于肿瘤患者血液、尿液或肿瘤组织的EGFR分子精准检测和诊断。
附图说明
图1是制备检测活化EGFR的EKBD试剂的技术流程示意图。
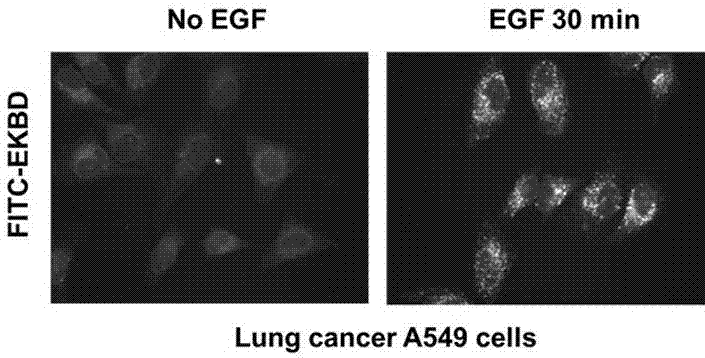
图2是应用FITC标记的EKBD检测肺癌细胞中活化的EGFR的结果;图中左图为没有EGF刺激的肺癌A549细胞,右图是经EGF刺激30分钟后的肺癌A549细胞。
图3是应用HRP标记的EKBD检测肺癌组织中活化的EGFR的结果。
具体实施方式
实施例一:荧光染料标记的EKBD的制备
1. EKBD的分子设计和克隆。从人类TNK2转录亚型I的cDNA(NCBI 基因登录号: NM_005781)中将EKBD的编码区(见SEQ.ID.NO.1)通过PCR复制出来,再转到带有6×his标签的大肠杆菌表达载体pET28a (Novagen,Madison,WI,USA)。PCR复制出的编码区经DNA测序证实是EKBD的序列。该编码区表达出来的EKBD氨基酸序列如SEQ.ID.NO.2所示。
2.EKBD的表达与纯化:将pET28a-His-EKBD转化到大肠杆菌菌株BL21中以用于表达EKBD蛋白。 转化后的细菌在37°C 下用LB培养基培养到A600(600 nm的光吸收)为1.0的密度,然后加入1/1000 IPTG(0.5mM)去诱导融合蛋白表达 3-5个小时。 融合蛋白表达后的细菌则用离心机8000 rpm离心10分钟沉淀收集。沉淀后的细菌重悬于细菌裂解液(25 mM HEPES (pH 8.0), 100 mM NaCl, 0.5% Triton X-100, 10% 甘油, 10 mM 咪唑)。每500毫升的细菌沉淀, 用细菌裂解液10毫升重悬。然后加入溶菌酶(50微克/毫升)和DNase I(10微克/毫升),在4°C下旋转培育 1小时。 之后用超声仪在能量水平3.5下超声裂解3×30秒加2秒间隔。裂解液在4°C下15000rpm离心20分钟, 将其上清液转移到15毫升锥形管。在上清液中加入200μL Ni-NTA琼脂糖珠(Qiagen,Germantown, MD,USA),并在4°C 下滚动培育 2-3小时。琼脂糖珠用加有20 mM 咪唑的细菌裂解液清洗3次(每次10毫升裂解液)。胶珠上的EKBD用洗脱液(100 mM 碳酸氢盐缓冲液 (pH 8.4), 100 mM NaCl, 250 mM咪唑)在4 °C下滚动洗脱15分钟,洗脱出来的EKBD 在透析液(100 mM 碳酸氢盐缓冲液, pH 8.4, 100 mM NaCl, 2 mM MgCl2)透析过夜。经透析出来的EKBD其纯度和浓度用SDS-PAGE凝胶电泳和考马斯亮蓝染色来进行测定。纯化好的EKBD储存在-80 °C用于荧光染料标记。
用于表达EKBD融合蛋白的亲和标签(Tag)不仅限于hexahistidine (6×His 标签),也包括其他的亲和标签,如谷胱甘肽-S-转移酶(GST)标签,麦芽糖结合蛋白(MBP)标签, T7标签,泛素标签,Flag 标签,Myc 标签,HA标签,聚精氨酸标签,polycysteine标签,polyphenylalanine标签,BTag标签,半乳糖结合域标签,纤维素结合域(CBD)标签,thioredoxin标签,金黄色葡萄球菌蛋白标签,链球菌G蛋白标签,钙调蛋白标签,β-半乳糖苷酶标签,氯霉素乙酰转移酶标签,S-肽标签,生物素标签,advidin标签, streptavidin标签以及链球菌标签等。
表达EKBD不仅限于大肠杆菌,也包括其它的表达系统,如酵母细胞、植物细胞、动物细胞等。因而表达的载体不仅限于细菌表达载体,也包括酵母、植物、动物以及病毒表达载体。
EKBD的生产不仅限于融合蛋白方式,也包括非融合蛋白和人工合成的多肽。
3.EKBD的染料标记:将纯化的EKBD用100 mM 碳酸氢钠缓冲液(pH 8.4)配成10 mg/mL的EKBD溶液。活化的荧光染料FITC(荧光素) 琥珀酰亚胺酯(FITC succinimidyl ester)(Molecular Probes, Eugene, OR, USA)溶解在DMSO溶剂中,浓度为10 mg/mL。将50-100μL的荧光染料(0.5-1 mg)慢慢加入到搅拌的1 mL EKBD溶液中。在室温(25 °C)下摇晃共育60分钟,然后加入0.1 mL新鲜配制的1.5 M 羟胺 停止反应,并在室温下继续共育60分钟。标记好的EKBD溶液中的游离的荧光染料分子通过PBS缓冲液(pH 7.4)透析去除。在透析好的FITC-EKBD溶液中加入BSA (终浓度为10 g/mL)和叠氮钠(sodium azide)(终浓度为1 mM)以稳定蛋白和防止菌类污染。标记好的EKBD储存在4 °C 备用。
EKBD的染料标记不仅限于FITC(fluorescein),也包括其它的染料,如Rhodamine,Oregon Green,Texas Red,Cy5,Cy3等。
实施例二: HRP(Horseradish Peroxidase)-EKBD蛋白的制备
从人类TNK2转录亚型I的cDNA中将EKBD的编码区(见SEQ.ID.NO.1)以及pUC19-6×HIS-HRP(Addgene,Cambridge, MA,USA)中的HIS标签和HRP的编码区通过PCR复制出来,再转到慢病毒载体pFUW(Addgene,Cambridge, MA,USA)上形成pFUW-HIS-HRP-EKBD表达质粒。该慢病毒表达质粒与慢病毒包装质粒psPAX2(Addgene,Cambridge, MA,USA)和pMD2.G(Addgene,Cambridge, MA,USA)一起转染到HEK293T细胞(ATCC,Manassas, VA,USA)中包装成病毒颗粒。转染24小时后,开始收集培养基。每24小时收集一次,共三次。收集的培养基中的细胞碎片则通过1000xg离心5分钟去除。离心后的带有病毒颗粒的培养基储存在4 °C备用。
带病毒颗粒的培养基与正常培养基1:1 混匀后再和6 g/mL聚凝胺 (Sigma-Aldrich, H9268)一起感染 HEK293T细胞。感染48-72小时后,收集细胞。细胞用冷冻的PBS 溶液 (137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.8 mM KH2PO4, pH 7.4)清洗一次,然后用冷冻的动物细胞裂解液(40 mM HEPES, pH 7.4, 100 mM NaCl, 1% Triton X-100, 25 mM 磷酸甘油, 1 mM 正钒酸钠, 1 mM EDTA, 10 µg/mL 抑酶肽)裂解。细胞裂解后,离心15,000g 15分钟去除细胞碎片和未溶解的残留细胞器及细胞骨架。离心的上清用来纯化HIS-HRP-EKBD。在上清液中加入200μL Ni-NTA琼脂糖珠(Qiagen,Germantown, MD,USA),并在4°C 下滚动培育 2-3小时。琼脂糖珠用清洗液(100 mM 碳酸氢盐缓冲液(pH 8.4), 100 mM NaCl, 20 mM 咪唑)液清洗3次(每次10毫升裂解液)。胶珠上的HRP-EKBD用洗脱液(100 mM 碳酸氢盐缓冲液 (pH 8.4), 100 mM NaCl, 250 mM 咪唑)在4 °C下滚动洗脱15分钟,洗脱出来的HRP-EKBD 在透析液(100 mM 碳酸氢盐缓冲液, pH 8.4, 100 mM NaCl, 2 mM MgCl2)透析过夜。经透析出来的HRP-EKBD其纯度和浓度用SDS-PAGE凝胶电泳和考马斯亮蓝染色来进行测定。其HRP活性则用ECL(Enhanced Chemiluminescence)试剂盒(PerkinElmer,Hopkinton, MA,USA)测定。
用于动物细胞中表达HRP-EKBD的载体不仅限于慢病毒载体,也包括其它类型的动物细胞表达载体,如腺病毒载体、动物细胞瞬时表达(Transient expression)载体、昆虫病毒表达载体等。
用于融合EKBD的蛋白不仅限于HRP,也包括其它的酶功能蛋白,如GFP、luciferase、nuclease等和标签蛋白如谷胱甘肽-S-转移酶(GST)标签、麦芽糖结合蛋白(MBP)标签、 T7标签、泛素标签、Flag 标签、Myc 标签、HA标签、聚精氨酸标签,polycysteine标签、polyphenylalanine标签、BTag标签、半乳糖结合域标签、纤维素结合域(CBD)标签、thioredoxin标签、金黄色葡萄球菌蛋白标签、链球菌G蛋白标签、钙调蛋白标签、β-半乳糖苷酶标签、氯霉素乙酰转移酶标签、S-肽标签、生物素标签、advidin标签、streptavidin标签以及链球菌标签等。
表达HRP-EKBD不仅限于人类细胞,也包括其它的动物细胞,如小鼠、大鼠和昆虫细胞。
实施例三:应用FITC-EKBD试剂盒检测肺癌细胞中的活化EGFR
非小细胞肺癌细胞A549购自American Type Culture Collection (ATCC,Manassas, VA,USA),正常培养在DMEM加10% FBS。培养条件为5% CO2,37 °C。检测前,细胞转到底部有玻片的培养皿中培养,并用无血清的DMEM培养18小时。细胞经EGF(100 ng/mL)处理30分钟后,迅速移至冰上,用PBS清洗一次。然后用试剂盒中细胞固定液固定10分钟。去除固定液后,再用试剂盒中的细胞渗透液处理10分钟。用试剂盒中的清洗液清洗一次。以1:100的比率用清洗液加1% BSA稀释试剂盒中FITC-EKBD,加入培养皿中,与细胞在室温下共育60分钟。移去FITC-EKBD溶液,用试剂盒中的清洗液清洗细胞三次后,在倒置荧光显微镜下观察染色结果并记录图像(见图2)。从图中可以看出,没有EGF刺激的肺癌A549细胞只有非常微弱的FITC-EKBD染色信号(图2左边照片),表明FITC-EKBD不能检测未活化的EGFR。而经EGF刺激30分钟后,肺癌A549细胞的FITC-EKBD染色信号大幅增强(图2右边照片),表明FITC-EKBD检测到细胞中被EGF刺激活化的EGFR。
用FITC-EKBD检测活化EGFR,不仅限于肿瘤细胞和组织的染色,也包括其它的检测技术和方法,如ELISA、沉淀分析、杂交分析、高通量筛选等技术和方法。检测的肿瘤组织和细胞不仅限于肺癌,也包括其它的癌症,如胃癌、乳腺癌、前列腺癌、肝癌等。
用FITC-EKBD检测EGFR不仅限于肿瘤组织和细胞,也包括血液、尿液、淋巴液等。
实施例四:应用HRP-EKBD试剂盒检测肺癌组织的活化EGFR
肺癌组织切片来源于江苏大学第一附属医院。首先将石蜡包埋的组织切片用试剂盒中的二甲苯和醇溶液进行脱石蜡和再水化。切片修复则用试剂盒中的0.01M柠檬酸盐缓冲液(pH 6.0 )在98℃下对切片处理5分钟(微波炉处理),然后将切片冷却至室温。用3 %过氧化氢溶液处理切片10分钟去除内源的过氧化物酶,再用PBS( pH 7.4)清洗。用试剂盒中的阻断液(blocking solution)在室温下对切片处理10分钟后,再用试剂盒中的HRP-EKBD(稀释度1:100 )在4 °C下孵育切片过夜。用试剂盒中的DAB(3,3’ Diaminobenzidine)染色溶液在室温下染色切片5分钟,PBS清洗5分钟,再用苏木精复染后,PBS清洗5分钟。封片后,染色结果在Olympus CX31显微镜下观察并记录图像 (见图3)。图中可观察到很强的HRP-EKBD染色信号,表明HRP-EKBD能够灵敏有效地检测肺癌肿瘤组织中的活化EGFR,可应用于肺癌肿瘤组织中活化EGFR的临床检测。
用HRP-EKBD检测活化EGFR,不仅限于肿瘤细胞和组织的染色,也包括其它的检测技术和方法,如ELISA、沉淀分析、杂交分析、高通量筛选等技术和方法。检测的肿瘤组织和细胞不仅限于肺癌,也包括其它的癌症,如胃癌、乳腺癌、前列腺癌、肝癌等。
用HRP-EKBD检测EGFR不仅限于肿瘤组织和细胞,也包括血液、尿液、淋巴液等。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种阿法替尼有关物质的分离检测方法与流程
- 用于检测人血清中HER2含量的ELISA试剂盒、使用方法及用途与流程
- 用于预防或治疗皮疹的药物组合物的制造方法与工艺
- 用于汽车内饰表皮的30ST/R双面布的制造方法与工艺
- 检测EGFR耐药性突变的方法和组合物与制造工艺
- 一种肝素结合表皮生长因子的单域抗体及其应用的制造方法与工艺
- 3‑[(3‑{[4‑(4‑吗啉基甲基)‑1H‑吡咯‑2‑基]亚甲基}‑2‑氧代‑2,3‑二氢‑1H‑吲哚‑5‑基)甲基]‑1,3‑噻唑烷‑2,4‑二酮和EGFR TYR激酶抑制剂的组合的制造方法与工艺
- 一种二甲苯磺酸拉帕替尼片剂及其制备方法与制造工艺
- 苯并咪唑衍生物作为ERBB酪氨酸激酶抑制剂用于治疗癌症的制造方法与工艺
- 包含STP和生长因子的活性组合物及其化妆品或护肤品的制造方法与工艺
- 5‑HT2B拮抗剂的制造方法与工艺
- 1‑(噻唑‑2‑基)哌啶‑4‑醇的合成方法与制造工艺
- 一种大麻酚类化合物的合成方法与制造工艺
- 一类对GPR84具有激动作用的化合物及其制备方法和用途与制造工艺
- eGFP标记GPR120阳性细胞的小鼠模型构建方法
- 靶向生长抑素受体的Al<sup>18</sup>F?NOTA?PEG<sub>6</sub>?TATE及其制备方法和应用
- 吡咯烷衍生物的口服制剂的制作方法
- 胰高血糖素样肽-1受体激动剂制备治疗肺动脉高压药物的应用
- 一种armc5基因检测试剂盒及突变位点的制作方法
- 作为mglu5受体的负性别构调节剂的6-氟-2-[4-(吡啶-2-基)丁-3-炔-1-基]咪唑并[1,2a ...的制作方法