一种脂肪干细胞分离培养方法与流程
本发明涉及脂肪干细胞分离培养领域,尤其涉及一种脂肪干细胞分离培养方法。
背景技术:
干细胞储存业务从单纯的脐带血储存发展到现今的脐带、胎盘、牙齿等多种来源的干细胞储存,其重要性和必要性已经为越来越多的人所认可。对于临床研究来说,干细胞应用于临床实践目前主要是从骨髓系统中分离纯化造血干细胞,但骨髓干细胞在获取过程中,骨穿异常疼痛,并且获取细胞数量少。而脂肪干细胞具有来源广泛,易获得,患者痛苦小,细胞量充足等优点,但是目前对于脂肪干细胞的培养,却缺乏一套完整的体系,脂肪干细胞的培养效果并不理想。
技术实现要素:
为了解决上述不足,本发明提供一种脂肪干细胞分离培养方法,通过建立一套完整的脂肪干细胞分离培养体系,提高脂肪干细胞的培养效率,其技术方案如下:
S1,洗涤脂肪组织,除去血细胞,向T175培养瓶中加入50ml脂肪组织、100ml氯化钠注射液,拧紧盖子,剧烈晃动3min以充分洗涤脂肪组织,接着静止3~5min,使不同相分离,吸去下层水相,重复S1步骤三次,直到下层液较为清澈;
S2,I型胶原酶消化,加入0.1%预热的I型胶原酶溶液,封口,剧烈晃动T175培养瓶5~10s,置于振动气浴锅中,37℃,70rpm,消化60min,每隔15min剧烈晃动培养瓶5~10秒,直到脂肪组织看起来较为平滑;
S3,分离脂肪基质血管组分,将消化后的脂肪组织用无菌40目滤网分装到50ml的离心管中,室温下400g离心10min,得到的沉淀即为脂肪基质血管组分;
S4,净化沉淀,离心后,脂肪基质血管组分沉积于离心管底部,用移液管自上而下除去上层油脂和下层的胶原酶溶液,再加入适量生理盐水重悬细胞,吹散,室温400g离心10min,离心完毕,再次吸取上层清液,最后加入10ml培养基悬浮细胞,将细胞汇总到50ml离心管中,过100目筛,再次在室温下,300g离心10min;
S5,细胞种植,离心后加20ml培养基充分混匀,按照每平方厘米接种0.16ml抽脂得到的脂肪量进行接种,即每个T75培养瓶中接种12ml抽脂脂肪量,每100ml脂肪组织,最终可以接种8个T75培养瓶,进行未处理脂肪量和最终得到的细胞悬液换算,进而接种细胞;
S6,细胞培养,将T75培养瓶放置于二氧化碳恒温恒湿培养箱,原代培养第24h后,进行全量换液,此后每隔3天全量换液,并且保持在二氧化碳恒温恒湿培养箱进行培养;
S7,原代细胞收获,7天左右,原代培养的细胞克隆团的面积百分比到达70%~80%时,收获原代细胞,在T75培养瓶中每75cm2加入2ml由125%Trypsin~0.01%EDTA组成的消化酶溶液,消化1.5~2.5min,再加入培养基2~3ml反复吹打瓶底至细胞大部分脱落,将脱落下来的原细胞移入50ml离心管中,并往原T75培养瓶中加入4~5ml氯化钠注射液冲洗瓶壁,最终加入50ml离心管中并定容至50ml,使用移液管吹打悬浮后,通过100目无菌滤网过滤,过滤液收集到另一个50ml离心管中,1000rpm,10min离心洗涤;
S8,原代细胞传代,观察单个离心管内余下细胞沉淀量,适当合并数个离心管中细胞沉淀至1个离心管中,加入适量培养基,轻轻吹打重悬浮细胞,定容至30ml,吹打混匀,取样计数,计数后进行1000rpm,10min二次离心,去除上清液,在离心管中加入培养基适量,轻轻吹打重悬浮细胞,定容后接种至新的培养容器中,传代细胞密度为5000~6000个/cm2,即(3.75~4.5)×105个cells/T75,在培养容器上标示细胞代数与培养时间等信息,将培养容器放置于二氧化碳恒温恒湿培养箱开始培养,直至培养至细胞融合达85%~90%。
进一步,在S1步骤中,T175培养瓶需用75%的酒精擦拭外壁。
进一步,在S2步骤中,I型胶原酶溶液的预热方法为提前半小时于37℃的气浴摇床预热。
进一步,在S4步骤中,移液管吸取下层的胶原酶溶液时,需要在脂肪基质血管组分沉淀上方留下少量的溶液,以免扰动沉淀细胞。
进一步,在S6、S8步骤中,培养箱中温度为37±0.5℃,二氧化碳体积分数为5±0.2%。
进一步,在S4至S8步骤中,所述培养基为Media31+GF30。
本发明提供的脂肪干细胞分离培养方法可以通过规范脂肪干细胞分离培养的步骤以及具体的操作中的各项参数,建立一套完整的脂肪干细胞分离培养体系,提高脂肪干细胞分离培养效率、产出率,降低生产成本。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为脂肪干细胞分离培养步骤;
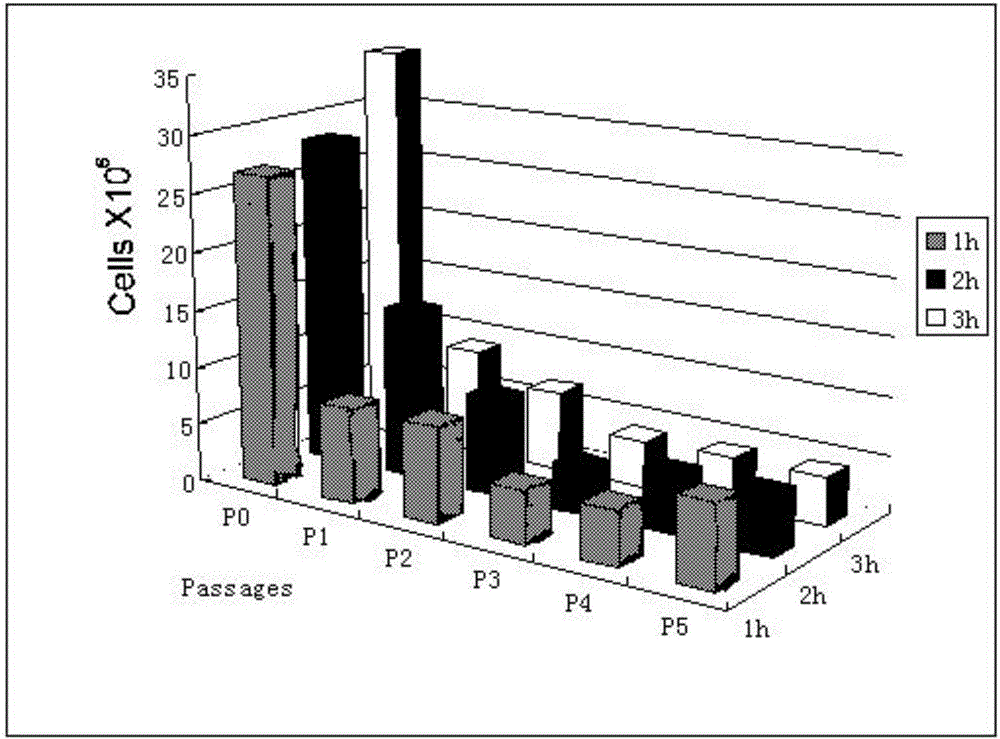
图2为I型胶原酶消化时间实验细胞计数统计图;
图3为传代密度细胞形态统计图;
图4为传代密度细胞计数结果图;
图5为培养基筛选实验细胞计数结果图。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供一种脂肪干细胞分离培养方法,通过建立一套完整的脂肪干细胞分离培养体系,提高脂肪干细胞的培养效率,包括以下步骤。
S1,洗涤脂肪组织,除去血细胞,向外壁用75%的酒精擦拭过的T175培养瓶中加入50ml脂肪组织、100ml氯化钠注射液,拧紧盖子,剧烈晃动3min以充分洗涤脂肪组织,接着静止3~5min,使不同相分离,吸去下层水相,重复S1步骤三次,直到下层液较为清澈。
S2,I型胶原酶消化,加入0.1%的I型胶原酶溶液,所述I型胶原酶溶液提前半小时于37℃的气浴摇床预热,然后封口,剧烈晃动T175培养瓶5~10秒,置于振动气浴锅中,37℃,70rpm,消化60min,每隔15min剧烈晃动培养瓶5~10秒,直到脂肪组织看起来较为平滑。
胶原酶是从溶组织梭状细胞芽孢杆菌提取制备的,主要水解结缔组织中胶原蛋白成分,常用剂量为最终浓度200U/ml(约为1mg/mL)或0.03%~0.3%。本发明所采用的I型胶原酶用于上皮、肺,脂肪和肾上腺组织细胞的分离,使消化组织中连接部分其成为单个细胞,用于哺乳动细胞的分离。
如图2,为I型胶原酶消化时间实验细胞计数统计图,在37℃气浴摇床中,70转每分钟,分别消化1h、2h和3h的时间长度,通过考察培养过程中的细胞形态和最终的细胞收获量来确定那个消化的时间长度是消化脂肪组织的最佳时间。在其他条件相同的情况下,采用0.1%的I型胶原酶对脂肪组织分别消化1h、2h和3h的时间长度,对培养过程中脂肪干细胞的生长情况进行拍照,在相同的时间点收获细胞进行细胞计数,对比收获的细胞数量的变化。从细胞形态上看I型胶原酶I消化2h和3h与消化1h对比没有明显区别。原代细胞得量,消化3h比消化1h和2h有明显的增多,1h和2h相比没有明显变化,分析原因可能是消化时间越长消化越充分,同时会有更多的其他非目的细胞也会消化下来,所以相对细胞量要多;同时消化时间越久对细胞的损伤越大。传代过程中各消化时间对细胞的收获量的影响区别不大。综合考虑细胞形态和细胞收获量以及时间成本等因素,本发明采用I型胶原酶消化1h。
S3,分离脂肪基质血管组分,将消化后的脂肪组织用无菌40目滤网分装到50ml的离心管中,室温下400g离心10min,得到的沉淀即为脂肪基质血管组分。
S4,净化沉淀,离心后,脂肪基质血管组分沉积于离心管底部,用移液管自上而下除去上层油脂和下层的胶原酶溶液,注意,移液管吸取下层的胶原酶溶液时,需要在脂肪基质血管组分沉淀上方留下少量的溶液,以免扰动沉淀细胞,移除上层油脂和下层的胶原酶溶液后,需要再加入适量生理盐水重悬细胞,吹散,室温400g离心10min,离心完毕,再次吸取上层清液,最后加入10ml培养基悬浮细胞,将细胞汇总到50ml离心管中,过100目筛,再次在室温下,300g离心10min。
S5,细胞种植,离心后加20ml培养基充分混匀,按照每平方厘米接种0.16ml抽脂得到的脂肪量进行接种,即每个T75培养瓶中接种12ml抽脂脂肪量,每100ml脂肪组织,最终可以接种8个T75培养瓶,进行未处理脂肪量和最终得到的细胞悬液换算,进而接种细胞。
S6,细胞培养,将T75培养瓶放置于二氧化碳恒温恒湿培养箱,原代培养第24h后,进行全量换液,此后每隔3天全量换液,并且保持在二氧化碳恒温恒湿培养箱进行培养。
S7,原代细胞收获,7天左右,原代培养的细胞克隆团的面积百分比到达70%~80%时,收获原代细胞,在T75培养瓶中每75cm2加入2ml由125%Trypsin~0.01%EDTA组成的消化酶溶液,消化1.5~2.5min,再加入培养基2~3ml反复吹打瓶底至细胞大部分脱落,将脱落下来的原细胞移入50ml离心管中,并往原T75培养瓶中加入4~5ml氯化钠注射液冲洗瓶壁,最终加入50ml离心管中并定容至50ml,使用移液管吹打悬浮后,通过100目无菌滤网过滤,过滤液收集到另一个50ml离心管中,1000rpm,10min离心洗涤。
S8,原代细胞传代,观察单个离心管内余下细胞沉淀量,适当合并数个离心管中细胞沉淀至1个离心管中,加入适量培养基,轻轻吹打重悬浮细胞,定容至30ml,吹打混匀,取样计数,计数后进行1000rpm,10min二次离心,去除上清液,在离心管中加入培养基适量,轻轻吹打重悬浮细胞,定容后接种至新的培养容器中,传代细胞密度为5000~6000个/cm2,即(3.75~4.5)×105个cells/T75,在培养容器上标示细胞代数与培养时间等信息,将培养容器放置于二氧化碳恒温恒湿培养箱开始培养,直至培养至细胞融合达85%~90%。
每一种类型的细胞种类,因为有它自身所特有的一些特征,所以增殖能力、大小和形态方面也是不一样的。细胞传代过程中,传代的密度是很重要的,过低则细胞容易老化,不容易长起来,过高细胞则收获量变少。我们设置了几个传代密度,根据这些不同密度的比较,从而鉴定出一个最适合脂肪干细胞传代的密度。设置的传代密度如下:2.5×105/T75、5.0×105/T75、7.5×105/T75;2.0×105/T75、3.0×105/T75、4.0×105/T75。考察细胞形态、融合度,细胞收获量两个指标。
如图3,为传代密度细胞形态统计图,从细胞形态上来看,不同传代密度对细胞形态的影响没有明显变化。如图4,为传代密度细胞计数结果图,7.5×105组接种两天细胞融合度大于90%,收获计数;2.5×105、5.0×105组接种三天收获计数;7.5×105组相对于5.0×105组细胞收获量没有明显差异,5.0×105组较2.5×105组细胞收获量有明显增加。为进一步得到最佳传代密度,设置2.0、3.0、4.0×105组,传代三天后收获。4.0×105组较其他两组细胞收获量有增加,比5.0×105组要稍少。所以本发明采用的细胞传代密度为5300cells/cm2,即4.0×105/T75。
在本实施例中,S6、S8步骤中,培养箱中温度为37±0.5℃,二氧化碳体积分数为5±0.2%。
如图5,为培养基筛选实验细胞计数结果图,将几种培养基的培养效果进行了对比,从而确定出最适合脂肪干细胞生长的培养基。可见,DMEM/F12+10%FBS培养基脂肪干细胞增殖缓慢,并且在P1代出现衰老现象(细胞增殖缓慢,细胞形态不再成成纤维状,细胞突触变多,细胞立体感变差);DMEM/F12+因子30培养基和Media31+GF30培养基细胞形态呈现典型的成纤维状,两者细胞形态相差不大。P0代Media31+GF30培养基细胞收获量是2.5×106/T75,DMEM/F12+因子30培养基细胞收获量是1.3×106/T75,DMEM/F12+10%FBS培养基细胞收获量是1.0×106/T75。在P1代Media31+GF30培养基细胞收获量是1.7×106/T75,DMEM/F12+30培养基细胞收获量是1.3×106/T75,DMEM/F12+10%FBS培养基细胞收获量是3.75×105/T75。在P2代Media31+GF30培养基细胞收获量是1.65×106/T75,DMEM/F12+因子30培养基细胞收获量是1.45×106/T75。从以上数据我们可以看到,在P0代Media31+GF30培养基细胞收获量明显大于其他两种培养基。综合考虑在S4至S8步骤中,所使用的培养基为Media31+GF30。
以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制,任何未脱离本发明技术方案内容,依据本发明的技术实质对以上实施例所作的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!