Nur77在制备改善缺血性脑卒中预后药物中的应用的制作方法
本发明属于生物医药领域,涉及促进缺血性脑卒中恢复的相关蛋白,即Nur77促进小胶质细胞向M2型转化促进缺血性脑卒中恢复。
背景技术:
在世界范围内,脑血管病是影响人类健康和生活质量的常见疾病,缺血性脑卒中是脑血管病中有着较高发病率及死亡率,现已成为全球第一大致死病因和第二大致残病因,但在我国,卒中却是第一大致死病因和第一大致残病因。探索缺血性脑卒中后脑损伤的内在机制,寻找对缺血性卒中的治疗新措施是目前势在必行的一项任务。缺血性脑卒中严重降低患者及家庭的生活质量,并可引起严重的并发症,如感染性肺炎、脑出血、继发性癫痫、心梗、肾功能不全等。因此,治疗缺血性脑卒中的目标是通过各种方法促进其恢复,减少并发症的发生。
缺血性脑卒中是指由于脑的供血动脉(颈动脉和椎动脉)狭窄或闭塞、脑供血不足导致的脑组织坏死的总称。有四种类型的脑缺血:短暂性脑缺血发作(TIA);可逆性神经功能障碍(RIND);进展性卒中(SIE);完全性卒中(CS)。TIA无脑梗死存在,而RIND、SIE和CS有不同程度的脑梗死存在。血管壁病变、血液成分病变和血液动力学改变是引起缺血性脑卒中的主要原因。目前,治疗缺血性脑卒中的药物主要有尿激酶、链激酶等溶栓药、有阿司匹林、氯吡格雷等抗血小板聚集药、有凯时、欧兰同等保护脑血管、甲钴胺营养神经、依达拉奉清除氧自由基等,这些促进缺血性脑卒中恢复的药物在临床上虽然具有一定的疗效,但是仍存在着疗效短、不能特异针对病因以及药物毒副作用等问题,因此,研发新型的促进缺血性脑卒中恢复的药物在临床上不仅十分迫切而且具有重要性。
小胶质细胞中枢神经系统的固有免疫细胞,占人类脑细胞的10-15%。其参与了缺血性脑损伤后的各种病理机制。生理情况下,小胶质细胞通过吞噬作用清除损伤和衰老的神经元,分泌各种递质、以及具有营养和神经保护属性的物质来维护神经元网络。当缺血性脑卒中发生后,小胶质细胞可分为促炎的M1型及抑炎的M2型。M2型小胶质细胞释放多种抑炎因子和神经营养因子,如IL-4、IL-10、TGF-β、BDNF、GDNF、NGF等,具有调控神经免疫,促进内源性的损伤修复,保护和修复神经血管单元和脑功能环路的作用。
Nur77是核受体Nr4A家族成员,又称为Nr4A1,具有转录因子的功能,其在免疫炎症、细胞凋亡、血管稳态、糖脂代谢等多方面都具有调节作用。
技术实现要素:
本发明的目的在于提供一种促进缺血性脑卒中恢复的蛋白Nur77,能够促进小胶质细胞转化为M2型小胶质细胞,促进缺血性脑卒中恢复。
本发明的技术方案是:
Nur77作为促进小胶质细胞向M2型转化蛋白在促进缺血性脑卒中恢复中的作用,其主要技术特征在于将Nur77作为促进小胶质细胞转化为M2型的蛋白,将Nur77设计为靶向药物来促进缺血性脑卒中恢复。
所述促进缺血性脑卒中恢复的蛋白为孤儿受体Nur77,即Nur77促进小胶质细胞转化为M2型小胶质细胞。
所述Nur77促进小胶质细胞转化为M2型小胶质细胞的检测方法选自但不限于:行为学检测方法、磁共振(MRI)及细胞分子生物学检测方法;
所述行为学检测方法可选自mNss评分、Rotarod Test(滚筒实验)
所述磁共振方法可选用9.0T磁共振仪器
所述细胞分子生物学检测方法可选自免疫荧光染色(IF)、定量聚合酶链反应(Q-PCR)、染色质免疫共沉淀方法(CHIP)
本发明的主要优点在于:
1.Nur77是一种转录因子,可透过血脑屏障;
2.作用于缺血性脑卒中的病理过程,符合当今研制治疗缺血性脑卒中药物的决策;首先促进小胶质细胞向M2型转化;其次通过对M2型小胶质细胞表达增多抑制缺血性脑卒中后的炎症作用。
本发明的其他具体优点和效果将在下面继续说明。
本发明利用现代生物学技术和生物信息学分析对Nur77的功能进行了初步研究,发现Nur77具有促进小胶质细胞转化为M2型的功能,进而发现Nur77具有改善缺血性脑卒中预后的用途,可以将Nur77设计为靶向药物来促进缺血性脑卒中恢复,对促进缺血性脑卒中治疗有着潜在的巨大应用价值,并且为进一步研究Nur77的生物学功能奠定了基础。
附图说明
图1——小鼠神经功能缺损评分(mNss)评分及滚筒实验的结果。
A——Nur77-/-及WT小鼠造模后各时间点mNss评分统计图;
B——Nur77-/-及WT小鼠造模后各时间点Rotarod Test实验统计图。
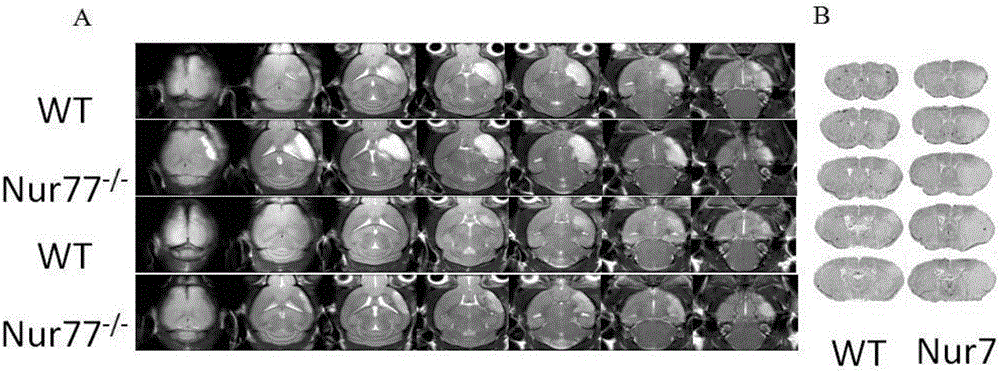
图2——MRI及焦油紫染色方法比较梗死体积:
A——磁共振扫描不同时间点梗死体积;
B——焦油紫染色梗死体积图。
图3——免疫荧光染色方法对小鼠脑组织中M2型小胶质细胞染色结果:
A——不同时间点脑组织染色示意图;
B——造模后3天荧光统计图;
C——造模后7天荧光统计图。
图4——mRNA水平比较两组小胶质细胞释放的炎症因子。
具体实施方式
本发明的技术思路是:
从整体到细胞、分子水平,系统探讨Nur77对小胶质细胞向M2型转化的作用。本发明首先,从整体角度,通过行为学Nur77敲除后神经功能缺损严重,运动能力下降,从而证明Nur77对缺血性脑卒中具有促进其恢复作用;其次,从离体水平,用分子生物学等技术研究Nur77可促进小胶质细胞向M2型转化;最后,从整体到从离体水平,用分子生物学等技术研究Nur77对小胶质细胞的转型作用对促进缺血性脑卒中恢复的影响,以证明Nur77可作为治疗缺血性脑卒中潜在靶点。
下面是本发明的具体实施例说明:
一、行为学
1、小鼠神经功能缺损模型(MCAO)制备:
A、麻醉,10%水合氯醛,4uL/g,待其麻醉后将其固定在手术台上,
B、剪毛、消毒、切开皮肤,钝性分离皮下组织、肌肉,分离到气管前肌后。
C、沿右侧胸锁乳突肌腱向下分离,见到颈动脉,分离好后见光滑的颈总动脉,分离出颈总、颈外、颈内动脉。
D、结扎颈外动脉,动脉夹夹闭颈总动脉,电凝刀切断颈外动脉,提起颈外动脉残端,向下拉直与颈内动脉成一直线。
E、在颈外动脉远端剪一小口,向颈内动脉插入栓线至大脑中动脉起始处。
F、线栓的标记在距球端9-10mm处。70min后,拔出栓线,松开颈总动脉进行再灌注。缝合皮肤,回笼饲养。
2、Rotaroad Test(滚筒实验):
实验设备为疲劳转棒实验仪,购自于(type 7650;Ugo Basile)。
1)实验步骤:
A、实验前将WT及Nur77-/-两组小鼠进行为期3天的适应性训练:将小鼠放置在杆上,第一天,在前面1分钟内,将杆的转速加速到20转/分钟,后4分钟保持20转/分钟。当其跌落后将其重拾上转棒,每只小鼠训练5分钟,重复3次。第二天及第三天分别将转速调制30转/分钟和40转/分钟,余同前。
B、实验时,将造模后不同时间的小鼠放置在转棒上,在1分钟内加速至40转/分钟,并持续4分钟纪录动物保持在杆上的时间。小鼠跌落后,不在重拾其上棒,记录其在棒时间即可。重复三次。
2)结果说明:在缺血性脑卒中早期Nur77-/-小鼠较WT组跌落时间明显缩短,说明Nur77-/-小鼠在缺血性脑卒中后其运动功能明显变差,在7天时二者之间无差异,说明运动功能稍恢复。
3、改良的大鼠神经功能缺损评分(mNss)评分:
1)实验步骤:mNSS评分用于评价MCAO模型后小鼠的神经功能缺损情况。将造模后不同时间点的小鼠进行评分,总分18分,分数越高,神经功能缺损越重。具体评分细则如下:
2)结果说明:Nur77-/-小鼠的神经功能缺损评分明显高于WT小鼠,并持续至7天未见明显恢复,说明Nur77-/-小鼠神经功能缺损较WT小鼠严重。
二、分子生物学
1、焦油紫染色
1)实验步骤:
A、处死造模后的小鼠,4%多聚甲醛灌注,后固定24小时,将固定好的组织浸入15%蔗糖,待组织下沉后,转入30%蔗糖,待组织再次下沉后,Leica冰动切片,切20um厚度,贴于载玻片上,37度复温1h。
B、切片浸于100%氯仿中约5min
C、组织脱脂:100%乙醇30秒,95%乙醇30秒,75%乙醇30秒
D、双蒸水清洗三次
E、1%焦油紫染色30min(此步时间长则在分化剂中时间亦长)
F、双蒸水清洗三次
G、组织脱水:75%乙醇60秒,95%乙醇60秒,100%乙醇60秒
H、100%氯仿5分钟,分化剂约1--2分钟(注意看片子)(分化剂:95%乙醇中滴加冰醋酸,调PH为4.10)
I、二甲苯透明三次,每次1--2min
J、树胶封片,显微镜下观察,拍照
2)结果说明:在造模后各时间点,Nur77-/-小鼠梗死体积较WT明显增大,说明Nur77可减小缺血性脑卒中的梗死体积。
2、组织免疫荧光染色
1)具体实验步骤:
A、冰冻切片复温:37度,1h。
B、PBS(PH:7.4,NaCl:8g;KCl:0.2g;Na2HPO4:3.63g;KH2PO4:0.24g)冲洗玻片3次,10min/次
C、0.2%Triton破膜20min;
D、PBS冲洗3次,10min/次;
E、封闭液(2%BSA+0.2%Triton)1h;
F、直接甩去加抗体加一抗IBa-1(1:500,Abcam)及CD206(1:500,Abcam);4度过夜。
G、第二天复温半小时;
H、PBS冲洗,3次,10min/次;
I、二抗Donkey anti goat 594(1:500,Life)、Donkeyanti rabbit 488(1:500,Life);室温2h;
J、PBS冲洗3次,10min/次;
K、DAPI稀释液(1:1000)染10min;
L、PBS冲洗3次,10min/次;
M、封片,显微镜下观察,拍片。
2)结果说明:在Nur77-/-小鼠中,CD206+的M2型小胶质细胞明显减少,说明Nur77敲减后,M2型小胶质细胞明显减少,间接说明Nur77可促进小胶质细胞向M2型转化。
3、定量聚合酶链反应(Q-PCR):
1)实验步骤
A、材料准备:SYBR、引物、cDNA、ROX、DDW、96孔板、冰块、贴膜、Q-PCR仪
B、溶液配制(20ul体系):每个引物按以下比例配制母液:SYBR:10ul,Primer mix:1.6ul(0.8ul Forward&0.8ul Reward),Rox Dye II 0.4ul,cDNA 2ul,DDW(已灭菌)7.0ul,加入至96孔Q-PCR板中。
C、上机:反应条件设置:Stage 1:预变性Reps:1s,95℃:10s;Stage 2:PCR反应:Reps:40s,95℃:5s,60℃:30-34s,Dissociation:Stage。
2)结果说明:在Nur77-/-小鼠中,MCAO后其释放的炎症因子(TNF-α、IL-1β)增多,说明Nur77-/-缺血性脑卒中后炎症反应更剧烈;同时M2表型相关的CD206、Arg-1等明显减少,说明Nur77促进小胶质细胞向M2型转化。
三、细胞培养
1、小胶质细胞的培养:
A、试剂准备:a、HBSS-A:500ml 1×HBSS吸出17.5ml加入5ml 1M HEPES Buffer Solution(1:100稀释)加入12.5ml 100×pen/strep,0.22μm过滤;b、10%PMG:45ml MEM(gibco#11095-080)加入FBS 4.5ml,加入1%L-glutamine(200mM 100×stock gibco#25030-081)0.45ml,加入1%Streptomycin(100×stock-1g/100ml)0.45ml,过滤;c、TrypLE Select(1×)(gibco#12563-011)
B、材料准备:新生乳小鼠、冰块、75%酒精、15mL离心管、50ml离心管、HBSS-A、TryplE酶、10%PMG、注射器、灭菌的显微镜、灭菌的玻璃培养皿2个)、6cm培养皿(1个)、细胞计数器、75cm2种植瓶冰块用塑料膜包好至超净台中,其上放置一6cm培养皿并倒入适量HBSS-A备用;两只玻璃皿中倒入适量HBSS-A液备用。
C、灭菌准备:操作前一天:将玻璃培养皿(2个、锡纸包裹)、滤器(清洗、换滤片、锡纸包裹)放入盒中、将盒拿到桶中高温高压灭菌,器械盒的器械在细胞培养前一天换新的酒精浸泡过夜;操作前:将显微镜用酒精擦干净后搬至超净台灭菌,将直头镊(2个)、弯头镊(2个)、剪刀(1个)放入盛有酒精的小烧杯,另准备两个小烧杯,一个小烧杯盛放适量酒精,一个小烧杯盛入解剖液(HBSS-A)放入超净台,将前一天准备的玻璃皿和滤器放入超净台。紫外灭菌30min。
D、将乳小鼠用培养皿转移至超净台,剪刀剪下头颅,弯镊镊取头颅浸泡于酒精约20s,迅速转移至HBSS-A液中涮洗残余酒精片刻,转移至一备有HBSS-A的玻璃皿中。撤除小鼠尸体、剪刀及盛有酒精和HBSS-A的小烧杯。另准备两50ml离心管,分别装入适量酒精和HBSS-A备用。
E、关灯,开显微镜,镜下脑组织分离:①用第一套镊子逐层剥离皮肤、硬脑膜(颅骨),暴露大脑皮层、小脑、脑干结构,用弯镊从底部挑出或从前至后轻轻掀开脑组织,转移至另一盛有HBSS-A的玻璃皿中。剥离过程中,可用左手执直镊插入两眼部位固定,右手执弯蹑沿矢状缝从前至后剥离。②用第二套镊子剥除嗅球、脑干和小脑,从而分离出大脑全球,进一步去除软脑膜(注意操作操作过程中镊子等接触酒精后需在HBSS-A中涮洗,避免酒精直接接触脑组织),分离好的脑组织置于冰块上的已备好HBSS-A的6cm培养皿中。
F、镜下再次检查收集好的脑组织软脑膜是否完全剥离干净,撤离解剖显微镜。
G、弃去HBSS-A,加入1-2mL tryplE酶,放于37℃细胞培养箱内10分钟。
H、吸出Tryple终止消化,加入适量培基轻轻吹打成细胞悬液,每吹打5-10次吸出上面的细胞悬液收集至一15ml离心管(注意枪头垂直加入悬液,避免细胞碰壁受损),再加入新的培基2-3ml继续吹打。
吹打完毕后将收集到的细胞悬液于100目细胞滤网过滤至另一15ml离心管中。
1500rpm,5min,4℃离心。
I、弃去上清,加入3-4ml 10%PMG培基重悬
J、细胞计数。
K、细胞种瓶,75cm2种植瓶加入10%PMG12ml。
H、放37℃细胞培养箱。
I、36-48小时待细胞贴壁后第一次换液。
J、6-7天待星胶铺满瓶底后第二次换液。
K、培养10-14天左右摇板。
2、糖氧剥夺(OGD)模型制备:
A、材料准备:缺氧罐(已紫外照射)、超净台、92孔细菌培养板、1X CSS(用前过滤)、培养液。
B、将培养液弃去,加入100uL 1X CSS。
C、将板子开启,板子和盖子同时加入缺氧罐,将进口夹闭,链接CO2和N2,比例19:1(9.5:0.5),进口打开,等待半小时。
D、将管子夹闭,缺氧罐放入培养箱1.5—2小时。
E、缺氧罐在超净台中打开,取出培养板,弃掉CSS,加入100uL培养液
F、放回培养箱。
以上所述,仅是本发明的较佳实施例,并非对本发明作任何形式上的限制,任何熟悉本专业的技术人员,在不脱离本发明技术方案范围内,依据本发明的技术实质,对以上实施例所作的任何简单的修改、等同替换与改进等,均仍属于本发明技术方案的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于图像信息的缺血性脑卒中治疗监测系统的制作方法
- miR-106b-5p及其检测引物和其反义核苷酸序列在诊断、治疗缺血性脑卒中领域中的应用
- 一种辅助诊断急性缺血性脑卒中的早期生物标志物及其基因芯片和实时荧光定量pcr评 ...的制作方法
- 瓜蒌桂枝汤在制备治疗缺血性脑卒中后遗症药物中的应用
- 一种治疗髓海不足型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 一种用于治疗缺血性脑卒中的药物组合物的制作方法
- 用于治疗和预防脑卒中或缺血、阿尔茨海默病和帕金森病和肌萎缩性侧索硬化的甾族硝酮的制作方法
- 一种治疗脾肾两虚型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 缺血性脑卒中诊断标记物的制作方法
- 缺血性脑卒中miRNA标记物的制作方法
- 一种基于图像信息的缺血性脑卒中治疗监测系统的制作方法
- miR-106b-5p及其检测引物和其反义核苷酸序列在诊断、治疗缺血性脑卒中领域中的应用
- 一种辅助诊断急性缺血性脑卒中的早期生物标志物及其基因芯片和实时荧光定量pcr评 ...的制作方法
- 瓜蒌桂枝汤在制备治疗缺血性脑卒中后遗症药物中的应用
- 一种治疗髓海不足型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 一种用于治疗缺血性脑卒中的药物组合物的制作方法
- 用于治疗和预防脑卒中或缺血、阿尔茨海默病和帕金森病和肌萎缩性侧索硬化的甾族硝酮的制作方法
- 一种治疗脾肾两虚型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 缺血性脑卒中诊断标记物的制作方法
- 缺血性脑卒中miRNA标记物的制作方法
- 一种基于图像信息的缺血性脑卒中治疗监测系统的制作方法
- miR-106b-5p及其检测引物和其反义核苷酸序列在诊断、治疗缺血性脑卒中领域中的应用
- 一种辅助诊断急性缺血性脑卒中的早期生物标志物及其基因芯片和实时荧光定量pcr评 ...的制作方法
- 瓜蒌桂枝汤在制备治疗缺血性脑卒中后遗症药物中的应用
- 一种治疗髓海不足型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 一种用于治疗缺血性脑卒中的药物组合物的制作方法
- 用于治疗和预防脑卒中或缺血、阿尔茨海默病和帕金森病和肌萎缩性侧索硬化的甾族硝酮的制作方法
- 一种治疗脾肾两虚型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 缺血性脑卒中诊断标记物的制作方法
- 缺血性脑卒中miRNA标记物的制作方法
- 一种用于缺血性脑卒中后神经再生的药物组合物及其应用的制作方法与工艺
- 一种与抗血小板药物氯吡格雷治疗缺血性脑卒中相关的SNP标志物及其应用的制作方法与工艺
- Nur77在制备改善缺血性脑卒中预后药物中的应用的制作方法与工艺
- 一种缺血性脑卒中治疗药物的制作方法与工艺
- 反式肉桂醛制备治疗缺血性脑卒中的药物的用途的制作方法与工艺
- LINC01094在诊治缺血性脑卒中的应用的制造方法与工艺
- 一种检测缺血性脑卒中的生物标志物及其应用的制造方法与工艺
- 与缺血性脑卒中组织特异性结合的HGG多肽及其应用的制造方法与工艺
- 一种检测缺血性脑卒中的分子标志物及其用途的制造方法与工艺
- 肉苁蓉多糖制备治疗缺血性脑卒中的药物的用途的制造方法与工艺