吲哚菁化合物、其合成及精制法、诊断用组合物、生物体内动态测定装置及循环可视化装置的制作方法
本专利申请是申请号为201180006735.x、申请日为2011年1月28日、发明名称为“新吲哚菁化合物、其合成法及其精制法、使用该吲哚菁化合物的诊断用组合物、使用该诊断用组合物的生物体内动态测定装置以及循环可视化装置”的专利申请的分案申请。本发明涉及一种属于对医疗诊断技术、医疗外科手术技术、科学测定分析技术、印刷技术、笔记技术、涂装技术、染料技术、染色技术有用的绿色色素,且具有发出近红外荧光的性质的新吲哚菁(indocyanine)化合物、其合成法及其精制法以及诊断用组合物。详细而言,涉及一种属于绿色色素且具有发出近红外荧光的性质的环状糖链环糊精结合吲哚菁化合物、其合成法及其精制法、使用该吲哚菁化合物的诊断用组合物、使用该诊断用组合物的生物体内动态测定装置以及循环可视化装置。
背景技术:
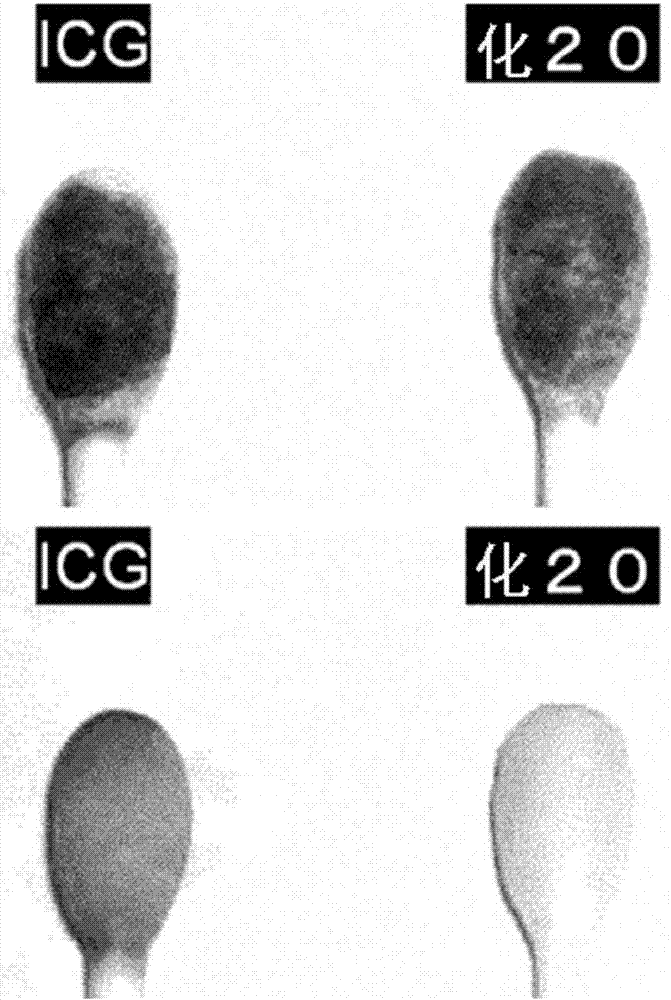
:迄今为止已合成了各种各样的属于绿色色素的发出近红外荧光的吲哚菁化合物,例如,它们在医疗领域中作为眼玻璃体手术用染色用色素,肝功能检查药用色素,循环功能检查药用色素,外科手术用色素,外科手术用近红外荧光化合物,在科学领域中作为蛋白质、糖等的染色或荧光化用化合物,在印刷技术中作为色素,具有广泛的用途。在这些吲哚菁化合物中,被称为吲哚菁绿(以下,略记为「icg」)的化合物作为肝功能检查药及循环功能检查药已被使用将近50年。近几年,作为icg的用途,除了肝功能检查药及循环功能检查药以外,已尝试利用icg的从生物体组织的光透过性高这一性质,向体内,例如血管、淋巴管、脑、眼、胃、乳房、食道、皮肤或其他部位,局部地给药icg,通过观察icg的近红外荧光来进行医疗手术及医疗诊断(非专利文献1)。在先技术文献非专利文献非专利文献1:“icg荧光navigationsurgery的全部”,草野满夫监制·编辑,インターメディカ社,(2008年11月发行).非专利文献2:“(商品名)diagnogreen注射用25mg”(第一三共株式会社)的附带说明书所记载的因特网主页的url(https://www.daiichisankyo.co.jp/med/contents/di/dg2/pi/pdf/pi_dg2_0909.pdf)非专利文献3:r.c.benson,h.a.kues,phys.med.biol.,23,159-163(1978).非专利文献4:s.yoneyama,t.saito,y.komatsu,i.koyama,k.takahashi,j.duvoll-young,iovs,37,1286-1290(1998).非专利文献5:y.ye,w.p.li,c.j.anderson,j.kao,g.v.nikiforovich,s.achilefu,j.am.chem.soc.,125,7766-7767(2003).非专利文献6:k.teranishiands.tanabe,itelettersonbatteries,newtechnologies&medicine,1,53-60(2000).非专利文献7:michaelo’shaughnessyetal:1994wiley-liss,incmicrosurgery15:40s4121994.非专利文献8:ralphj.p.metal:1997wiley-liss,inc.microsurgery17:402-4081996.技术实现要素:技术问题然而,icg的绿色发色团(呈绿色所需的化学结构体)及近红外荧光团(发出近红外荧光所需的化学结构体)是疏水性的,为了使其溶于水在侧链末端结合磺酰基。因此在现有的icg中存在如下的诸多问题。在医疗上的icg制剂的一般使用中,对icg25mg加蒸留水约5ml~10ml,振动搅拌溶解。icg未能完全溶解的情况下有可能出现恶心,干呕,发热,休克等症状(非专利文献2)。另外,因为不溶解,所以不能用生理食盐水等其他的水溶液进行初期溶解(非专利文献2)。icg由于如上所述结合有磺酰基所以具有水溶性,但化学结构上疏水性烃基多而具有表面活性,所以具有产生向脂质的吸附的性质。因此,注入到血管、脏器等的生物体组织中时,有时通过附着到注入部位、或误漏、或逆流而附着到非目标生物体组织上。附着于生物体组织的icg,难以通过擦拭操作、吸取操作从生物体组织除去,有可能成为外科手术、医疗诊断的障碍。icg在水溶液中具有分子缔合性质。其作为1个原因,在水溶液中的荧光强度低(非专利文献3、4)。另外,icg在水中溶解后随着时间变为不溶,难以作为水溶液长期保存,而且低温冻结保存会助长不溶解。另外,在icg制剂中含有5%以下的nai,根据情况还存在有可能引起碘过敏症的问题(非专利文献2)。另外,icg在静脉注射时,迅速集积在肝脏被肝排泄,因此其他的器官,例如肾脏、输尿管、膀胱、尿道、心脏、肺等器官的荧光摄像较困难。另外,icg在静脉注射时随血液移动,所以向末梢组织的移动少,难以观测向间质的移动。本发明以解决如上述的现有的icg的问题为目的。即,以提供一种属于绿色色素的可发出近红外荧光的新吲哚菁化合物为目的,其特征为在水或生理食盐水中的溶解性高,容易从生物体组织除去,水溶液中的分子缔合性低,在水溶液中的近红外荧光强度高,对肝脏以外的器官,例如肾脏、输尿管、膀胱、尿道、心脏、肺也能进行荧光摄像。另外,提供具有该特征的新吲哚菁化合物的化学合成法以及它的精制法。并且,提供含有上述新吲哚菁化合物的诊断用组合物也属于所要解决的课题。另外,以提供通过利用这些诊断用组合物而能对与生物体内水分平衡等相关的新吲哚菁化合物体内动态进行评价的生物体内动态测定装置,以及,使生物体中的血液、淋巴液、尿及其他水分的循环可视化的方法和装置为课题。解决问题的技术方案本发明人为了解决上述课题经反复潜心研究的结果,发现了可发出近红外荧光的化合物,其可使用于利用发出近红外荧光性质的外科手术和医疗诊断中,从而解决了上述的icg的问题。即,发现了一种新吲哚菁化合物,其特征为属于绿色色素且发出近红外荧光,在水或生理食盐水中的溶解性高,容易从生物体组织除去,水溶液中的分子缔合低,水溶液中的近红外荧光强度高,从而完成了本发明。而且还发现了该新吲哚菁化合物的化学合成方法以及精制方法,从而完成了本发明。并且得以提供含有上述新吲哚菁化合物的诊断用组合物。进而得以提供通过利用该诊断用组合物而即使在静脉给药时也能对肝脏以外的器官进行荧光摄像的方法。并且,得以提供对与生物体内水分平衡等相关的新吲哚菁化合物体内动态进行评价的方法和生物体内动态测定装置,以及,使生物体中的血液、淋巴液、尿以及其他水分的循环可视化的方法和装置。本发明的第一个新吲哚菁化合物是向icg的绿色发色团(呈绿色所需的化学结构体)和近红外荧光团(发出近红外荧光所需的化学结构体)使环状糖链环糊精共价结合的化合物。另外,本发明的第二个新吲哚菁化合物的特征是通过在环糊精的空洞内包合属于吲哚菁结构的疏水性部位的萘基部位,从而用亲水性的葡萄糖基披覆属于疏水性部位的萘基部位,使吲哚菁分子结构的大部分区域成为三维性亲水性。因此,相对于icg所具备的因同时具有疏水性部位和磺酰基的亲水性带来的类似表面活性的性质的特征,本发明的化合物的特征为其分子内的疏水性部位被环糊精披覆,所以没有类似表面活性的性质。具体而言,本发明如下:<1>化学式1表示的环糊精结合吲哚菁化合物,其特征在于,吲哚菁类与环状糖链环糊精共价结合而成;[化学式1](式中的r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15、r16、r17、r18、r19、r20、r21、r22、r23是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、磷酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。另外也可以是它们的取代基(羧酸、磺酸、磷酸),该取代基中氢离子离解的情况下,其氢离子可被钠离子、钾离子、镁离子、钙离子等的金属离子取代。氨基选自伯、仲、叔、季(作为与氮结合的取代可例举烷基等)。另外r8和r9也可以选择ch2、ch2ch2、ch2ch2ch2或ch2ch2ch2ch2的环状结构。另外也可以选择在这些烷基上氢原子被烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、磷酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环所取代的官能团。)<2>化学式2表示的环糊精结合吲哚菁化合物,其特征在于,吲哚菁的萘基的至少一部分被环糊精的空洞包合。[化学式2](式中的r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15、r16、r17、r18、r19、r20、r21、r22、r23是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、磷酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。另外也可以是它们的取代基(羧酸、磺酸、磷酸),该取代基中氢离子离解的情况下,其氢离子可被钠离子、钾离子、镁离子、钙离子等的金属离子取代。氨基选自伯、仲、叔、季。另外,r8和r9也可以选择ch2、ch2ch2、ch2ch2ch2或ch2ch2ch2ch2的环状结构。另外,也可以选择在这些烷基上氢原子被烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、磷酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环取代的官能团。)<3>化学式3表示的环糊精结合吲哚菁化合物,其特征在于,是吲哚菁类和环状糖链环糊精通过酰胺键共价结合而成的、化学式1表示的环糊精结合吲哚菁化合物。[化学式3](式中的r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15、r16、r17、r18、r19、r20、r21、r22、r23是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、磷酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。另外也可以是它们的取代基(羧酸、磺酸、磷酸),该取代基中氢离子在离解的情况下,其氢离子可被钠离子、钾离子、镁离子、钙离子等金属离子取代。氨基选自伯、仲、叔、季。m、n是1以上6以下的整数。另外,r8和r9可选择ch2、ch2ch2、ch2ch2ch2或ch2ch2ch2ch2的环状结构。另外,也可以选择在这些烷基上氢原子被烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、磷酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环取代的官能团。)<4>化学式4表示的是环糊精结合吲哚菁化合物,其特征在于,是吲哚菁类和环状糖链环糊精通过酰胺键共价结合而成的、化学式2表示的环糊精结合吲哚菁化合物。[化学式4](式中的r1、r2、r3、r4、r5、r6、r7、r8、r9、r10、r11、r12、r13、r14、r15、r16、r17、r18、r19、r20、r21、r22、r23是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、磷酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。另外也可以是它们的取代基(羧酸、磺酸、磷酸),该取代基在氢离子离解的情况下,其氢离子可被钠离子、钾离子、镁离子、钙离子等的金属离子取代。氨基选自伯、仲、叔、季。m、n是1以上6以下的整数。另外,r8和r9也可以选择ch2、ch2ch2、ch2ch2ch2或ch2ch2ch2ch2的环状结构。另外,也可以选择在这些烷基上氢原子被烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、磷酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环取代的官能团。)<5>化学式3表示的环糊精结合吲哚菁化合物中的化学式5表示的环糊精结合吲哚菁化合物。[化学式5](式中的m、n、p、q是2以上6以下的整数。r是5以上7以下的整数。s是0以上4以下的整数。r是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。)<6>化学式4表示的环糊精结合吲哚菁化合物中的化学式6表示的环糊精结合吲哚菁化合物。[化学式6](式中的m、n、p、q是2以上6以下的整数。r是5以上7以下的整数。s是0以上4以下的整数。r是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。)<7>化学式3表示的环糊精结合吲哚菁化合物中的化学式7表示的环糊精结合吲哚菁化合物。[化学式7](式中的m、n是2以上6以下的整数。r是5以上7以下的整数。s是0以上4以下的整数。r是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。)<8>化学式4表示的环糊精结合吲哚菁化合物中的化学式8表示的环糊精结合吲哚菁化合物。[化学式8](式中的m、n是2以上6以下的整数。r是5以上7以下的整数。s是0以上4以下的整数。r是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。)<9>化学式3表示的环糊精结合吲哚菁化合物中的化学式9表示的环糊精结合吲哚菁化合物。[化学式9](式中的m、n是2以上6以下的整数。r是5以上7以下的整数。s是0以上4以下的整数。r是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。)<10>化学式4表示的环糊精结合吲哚菁化合物中的化学式10表示的环糊精结合吲哚菁化合物。[化学式10](式中的m、n是2以上6以下的整数。r是5以上7以下的整数。s是0以上4以下的整数。r是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。)<11>化学式3表示的环糊精结合吲哚菁化合物中的化学式11表示的环糊精结合吲哚菁化合物。[化学式11](s是0以上4以下的整数。r是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。)<12>化学式4表示的环糊精结合吲哚菁化合物中的化学式12表示的环糊精结合吲哚菁化合物。[化学式12](s是0以上4以下的整数。r是氢原子、烷基、芳基、卤素原子、烷氧基、氨基、羧基、甲酰基、磺酰基、磺酸基、烷氧基羰基、芳氧基羰基、烷基羰基、芳基羰基或杂环。)<13>上述的化学式(化学式1、3、5、7、9、11)中的任一项所述的环糊精结合吲哚菁化合物的化学合成法,其特征在于,包括:(1)将吲哚菁羧酸化合物和氨基环糊精在溶剂中混合的工序;(2)加入脱水缩合剂进行脱水缩合反应的工序。<14>上述的化学式(化学式2、4、6、8、10、12)中的任一项所述的环糊精结合吲哚菁化合物的化学合成法,其特征在于,将上述的化学式(化学式1、3、5、7、9、11)中的任一项所述的环糊精结合吲哚菁化合物在水中进行包合反应。<15>上述的化学式(化学式1~12)中的任一项所述的环糊精结合吲哚菁化合物的精制法,是通过将该化合物用含hcl的溶剂进行洗提的柱层析法进行的。<16>一种诊断用组合物,通过向体内注入而使用,是含有上述化学式1~12中的任一项所述的环糊精结合吲哚菁化合物的水溶液。<17>如<16>所述的诊断用组合物,其中,实质上不含碘。<18>一种环糊精结合吲哚菁化合物的生物体内动态测定装置,具有:激发光照射单元,对于给药了上述<16>或<17>的诊断用组合物的生物体的一部分,向所述环糊精结合吲哚菁化合物照射激发光;荧光强度测定单元,测定通过上述激发光照射单元激发的上述环糊精结合吲哚菁化合物发出的荧光的强度;以及生物体内动态计算单元,由从上述荧光强度测定单元经时获取的上述荧光强度,求出该荧光强度的时间变化率的经时变化,从而算出上述环糊精结合吲哚菁化合物在上述生物体的一部分中向间质液中移动的速度和/或向上述间质外移动的速度。<19>一种循环可视化装置,具有:激发光照射单元,对于给药了上述<16>或<17>的诊断用组合物的生物体的一部分,向所述环糊精结合吲哚菁化合物照射激发光;荧光成像单元,二维性地获取通过上述激发光照射单元激发的上述环糊精结合吲哚菁化合物发出的荧光的强度,从而得到上述环糊精结合吲哚菁化合物在生物体内的分布状态数据;形态成像单元,二维性地获取除了上述环糊精结合吲哚菁化合物发出的上述荧光波长以外波长的光的强度,从而得到对上述生物体的一部分的形态数据;以及显示单元,将通过上述形态成像单元得到的上述形态数据和通过上述荧光成像单元得到的上述分布状态数据进行重叠而显示上述生物体的一部分中上述环糊精结合吲哚菁化合物的分布状态。<20>上述<19>记载的循环可视化装置,其中,上述显示单元将上述生物体的一部分中上述环糊精结合吲哚菁化合物的分布量低于规定基准的部分,作为坏死部分进行显示。<21>上述<18>记载的生物体内动态测定装置,具有:肿胀进展预测单元,从上述生物体的一部分中向间质液内外移动的速度,预测上述生物体的一部分以后进展的肿胀程度。<22>上述<21>记载的生物体内动态测定装置,其中,上述肿胀进展预测单元是预测与经过规定时间以后的向上述间质液中的移动速度的大小所相应的程度的肿胀进展,所述规定时间是从给药上述诊断用组合物至上述环糊精结合吲哚菁化合物在全身的血液中分散为止的时间。<23>一种生物体内动态测定装置,其特征在于,具有:激发光照射单元,对给药了上述<16>或<17>记载的诊断用组合物的生物体的一部分及对照部位,向上述环糊精结合吲哚菁化合物照射激发光,荧光强度测定单元,测定通过上述激发光照射单元激发的上述环糊精结合吲哚菁化合物发出的荧光的强度,生物体内动态计算单元,通过从上述荧光强度测定单元经时获取的上述荧光强度,求出其荧光强度的经时变化,从而算出上述环糊精结合吲哚菁化合物在上述生物体的一部分中的、向间质液中移动的速度和/或向上述间质外移动的速度,以及肿胀进展预测单元,从上述生物体的一部分中的向间质液内外移动的速度,预测上述生物体的一部分以后进展的肿胀程度;其中,上述肿胀进行预测单元,从到达规定时间为止的上述生物体的一部分的荧光强度的变化和上述对照部位的荧光强度的变化,求出流动于对照部位的血流量与上述生物体的一部分的血流量的关系,其中,所述规定时间是从给药上述诊断用组合物至上述环糊精结合吲哚菁化合物在全身的血液中分散为止的时间;将经过上述规定时间以后的、以上述对照部位荧光强度的变化作为对照的上述生物体的一部分的荧光强度的变化程度,用其关系进行计算,根据算出的上述变化程度的大小对肿胀的进展进行预测。<24>一种生物体内动态测定装置,其特征在于,具有:激发光照射单元,对给药了上述<16>或<17>记载的诊断用组合物的生物体器官,向上述环糊精结合吲哚菁化合物照射激发光;荧光强度测定单元,测定通过上述激发光照射单元激发的上述环糊精结合吲哚菁化合物发出的荧光的强度;以及生物体内动态计算单元,由上述荧光强度测定单元经时地获取的上述荧光强度,评价在上述器官中的上述环糊精结合吲哚菁化合物的生物体内动态。<25>上述<24>记载的生物体内动态测定装置,其中,上述器官为肾脏、输尿管、膀胱及尿道中的任一个。有益效果根据本发明的化学式1或化学式2表示的环糊精结合吲哚菁化合物,可提供具有如下特征的属于绿色色素的发出近红外荧光的化合物:与icg相比,在水或生理食盐水中的溶解性高,易从生物体组织除去,水溶液中的分子缔合低,水溶液中的近红外荧光强度高,对肝脏以外的器官也能进行荧光摄像,不含碘。另外,根据本发明的环糊精结合吲哚菁化合物的合成法,能够提供有用的环糊精结合吲哚菁化合物的合成。另外,根据本发明的环糊精结合吲哚菁化合物的精制法,能够提供有用的环糊精结合吲哚菁化合物的精制。另外,本发明的环糊精结合吲哚菁化合物即使不含碘也具有足够的溶解性,因此能够提供不含碘过敏症的原因的碘的诊断用组合物。这些诊断用组合物表现出与现有的只含icg的诊断用组合物不同的体内行为,因此可利用其性质提供各种各样的有益的装置。附图说明图1是表示icg及化学式19及20表示的异构化平衡化合物(tk1)向人体皮肤的吸附性试验结果。表示将icg及化学式19及20表示的异构化平衡化合物(tk1)的1mm水溶液(0.03ml)涂布在手腕后立刻摄取(照片左),5分钟后水洗后立刻摄取(照片中央),进而擦除水洗后立刻摄取(照片右)的照片。另外,右侧的点是用红色笔作的标记。图2是表示icg及化学式19及20表示的异构化平衡化合物(tk1)向纤维素纤维的吸附性试验结果。表示将icg及化学式19及20表示的异构化平衡化合物(tk1)的1mm水溶液(0.05ml)用棉棒涂布后立刻摄取(照片上),3分钟后用水冲洗5秒后的立刻摄取(照片下)的照片。图3是表示icg及化学式19及20表示的异构化平衡化合物(tk1)的向生物体肉模型的吸附性试验结果。表示将icg及化学式20表示的化合物的1mm水溶液(0.05ml)涂布在猪里脊肉的直径5mm的凹处后立刻摄取(照片左),3分钟后用水冲洗10秒后立刻摄取(照片右)的照片。图4是表示icg及化学式19及20表示的异构化平衡化合物(tk1)向生物体的蛋白质模型的吸附性试验结果。表示将icg及化学式19及20表示的异构化平衡化合物(tk1)的1mm水溶液(0.05ml)涂布于鸡胸肉的直径5mm的凹处后立刻摄取(照片左),3分钟后用水冲洗10秒后立刻摄取(照片右)的照片。图5是表示icg及化学式19及20表示的异构化平衡化合物(tk1)向疏水性化学纤维的吸附性的试验结果。表示将icg及化学式19及20表示的异构化平衡化合物(tk-1)的1mm水溶液(0.05ml)涂布于聚丙烯掩模后立刻摄取(照片左),放置20分钟后用水冲洗1秒后立刻摄取(照片右)的照片。图6是表示icg及化学式19及20表示的异构化平衡化合物(tk1)的分子缔合试验结果。左图是icg,右图是化学式19及20表示的异构化平衡化合物(tk1)。图7是表示icg、化学式19及20表示的异构化平衡化合物(tk1)及化学式15及16表示的异构化平衡化合物(tk2)在人体静脉血中的荧光强度的浓度相关性的曲线图。图8是表示将icg、化学式19及20表示的异构化平衡化合物(tk1)及化学式15及16表示的异构化平衡化合物(tk2)给药大鼠时观察到的情况的图。图9是表示将icg、化学式19及20表示的异构化平衡化合物(tk1)及化学式15及16表示的异构化平衡化合物(tk2)给药大鼠时在腹腔内的荧光的情况的图。图10是表示将化学式15及16表示的异构化平衡化合物的(tk2)0.1mm水溶液0.075ml尾静脉给药雄wistar大鼠(14周龄,300g),利用滨松光子学株式会社制近红外观察系统pde摄像的图。左为根据可视光的黑白图像,右为荧光图象。图11是表示将化学式15及16表示的异构化平衡化合物的(tk2)0.1mm水溶液0.075ml尾静脉给药雄wistar大鼠(14周龄,300g)的近红外荧光内视镜摄像图。左为根据可视光的黑白图像,右为荧光图象。图12是表示icg、化学式19及20表示的异构化平衡化合物(tk1)及化学式15及16表示的异构化平衡化合物(tk2)给药大鼠时的足背部的荧光的情况的图。图13是表示icg、化学式19及20表示的异构化平衡化合物(tk1)及化学式15及16表示的异构化平衡化合物(tk2)给药大鼠时的足背部的荧光强度的经时变化的曲线图。图14是表示icg、化学式19及20表示的异构化平衡化合物(tk1)及化学式15及16表示的异构化平衡化合物(tk2)给药大鼠时的足背部的荧光强度的经时变化的曲线图。图15是表示大鼠血管的直接观察手法的图。图16是表示大鼠的血管的直接观察部分(精巣提睾肌皮瓣)的图。图17是表示给药icg的大鼠的血管及其周边的组织的荧光的情况的图。图18是表示将化学式19及20表示的异构化平衡化合物(tk1)给药大鼠的血管及其周边的组织的荧光的情况的图。图19是表示对进行tk1试验的群,关于给药卡拉胶的群(edema)和没有给药的群(normal)给药后立刻(postinjection)和一周后(1wafter)测定的大鼠的左足容积的曲线图。纵轴是容积(ml)。图20是表示对进行tk1试验的群,关于给药卡拉胶的群(edema)和没有给药的群(normal),给药后立刻(postinjection)和一周后(1wafter)测定的大鼠的左足的vonfreytest的结果的图。纵轴是发生反应的载重(g)。图21是表示对给药卡拉胶的群(edema)和没有给药的群(normal),注射卡拉胶后立刻注射tk1后的左足表面的亮度的变化的情况的曲线图。纵轴是亮度(任意单位),横轴为时间(秒)。图22是表示对给药卡拉胶的群(edema)和没有给药的群(normal),注射卡拉胶后经过一周后注射tk1后的左足表面的亮度的变化的情况的曲线图。纵轴是亮度(任意单位),横轴是时间(秒)。图23是表示对icg进行试验的群,关于给药卡拉胶的群(edema)和没有给药的群(normal),给药后立刻(postinjection)和一周后(1wafter)测定的大鼠的左足容积的曲线图。纵轴是容积(ml)。图24是表示对icg进行试验的群,关于给药卡拉胶的群(edema)和没有给药的群(normal),给药后立刻(postinjection)和一周后(1wafter)测定的大鼠的左足的vonfreytest的结果的曲线图。纵轴是发生反应的载重(g)。图25是表示关于给药卡拉胶的群(edema)和没有给药的群(normal),注射卡拉胶后立刻注射icg后的左足表面的亮度的情况的曲线图。纵轴是亮度(任意单位),横轴是时间(秒)。图26是关于给药卡拉胶的群(edema)和没有给药的群(normal),注射卡拉胶后经过一周后注射icg后的左足表面的亮度变化的情况的曲线图。纵轴是亮度(任意单位),横轴是时间(秒)。具体实施方式本发明的诊断用组合物通过采用后述的本发明的环糊精结合吲哚菁化合物作为色素,不含碘就能够用于诊断。本诊断用组合物可以代替一直在使用的含有吲哚菁绿的诊断用组合物。例如,肝功能检查药,循环功能检查药等的用途。另外,通过观察向体内,例如血管、淋巴管、脑、眼、胃、乳、食道、皮肤、肾脏、输尿管、膀胱、尿道、肺、心脏或其他的部位给药而生成的近红外荧光,从而可应用于医疗手术及医疗诊断。本发明的诊断用组合物所含有的色素与生物体的结合性小,可以长时间标识需要的部位。在诊断用组合物中根据需要也可含有作为等张剂的盐或其他的添加物。另外,除预先调制的水溶液,还可适宜采用进行溶解而使用的形态。该诊断用组合物可经注射、点滴、塗布、经口给药等给药。该诊断用组合物适合在使血液、淋巴液、间质水及尿等的水溶液等的循环情况可视化时使用。通过使血液等的循环可视化,例如,能够用于通过评价末梢循环的坏死的判断,血运重建手术、移植手术后的组织成活的评价,血运不良的诊断等。另外,也可应用于迄今进行可视化的眼底造影、脑循环评价、脑外科手术中的术中造影、癌(乳癌、食道癌、胃癌、大肠癌、前列腺癌、皮肤癌等)中的前哨淋巴结鉴定、淋巴浮肿的评价、术中胆管造影、肿瘤的标记、冠动脉造影、腹部血管造影(肝动脉、腹部大动脉、消化管血流等)等。也可对肾脏、输尿管、膀胱、尿道等肾排泄系进行荧光摄像。<1.非包合型环糊精结合吲哚菁化合物及其合成>作为本发明的非包合型环糊精结合吲哚菁化合物可例举化学式1、化学式3、化学式5、化学式7、化学式9、化学式11,其合成法是通过使吲哚菁化合物与环糊精化合物在溶液中反应而完成的。在化学式1及3中,考虑与环糊精相当部分的包合,r1~r4及r13~r16优选为不阻碍环糊精包合的体积不大的基团。例如,氢或碳数1~3左右的烷基或烷氧基。优选氢、甲基、甲氧基,最优选氢。出于环糊精的包合,r5、r6、r11及r12也优选体积不大,但不到r1~r4及r13~r16的程度。例如为氢、碳数1~6左右的烷基或烷氧基。r1~r6及r11~r16是由环糊精包合的部位,所以即使在导入亲水性的官能团情况下也优选作为其整体为疏水性。r17、r18、r22及r23不太影响环糊精的包合,所以只要是上述的取代基则没有特别限定。r7、r10、r19及r21从合成容易的观点来看优选氢。r8、r9及r20只要为上述的取代基则也没有特别限定。在本发明的非包合型环糊精结合吲哚菁化合物是通过酰胺键使吲哚菁化合物与环糊精化合物共价结合的情况下,其非包合型环糊精结合吲哚菁化合物合成法可以是使吲哚菁羧酸化合物与氨基环糊精化合物在溶液中发生脱水缩合反应而实现。<2.包合型环糊精结合吲哚菁化合物>本发明的环糊精结合吲哚菁化合物的特征在于,是化学式2表示的吲哚菁类与环状糖链环糊精共价结合而成的环糊精结合吲哚菁化合物,吲哚菁的萘基的至少一部分包合于环糊精的空洞。另外,只要吲哚菁的萘基被包合在环糊精的空洞,发出近红外荧光,则吲哚菁基也可以具有取代基。另外,环糊精种类繁多,但吲哚菁的萘基被包合在环糊精的空洞是必要条件。例如,可以例举α-环糊精,β-环糊精,γ-环糊精。优选为β-环糊精。另外,环糊精可具有取代基。在化学式2及4中,r1~r4及r13~r16优选为不阻碍环糊精包合的体积不大的基团。例如氢、碳数1~3左右的烷基或烷氧基。特别优选氢、甲基、甲氧基,最优选的是氢。出于环糊精的包合,r5、r6、r11及r12虽然不如r1~r4及r13~r16,但也为体积不大。例如氢、碳数1~6左右的烷基或烷氧基。r1~r6及r11~r16是由环糊精包合的部位,所以优选即使导入亲水性的官能团的情况下,作为其整体为疏水性。r17、r18、r22及r23不太影响环糊精的包合,所以只要是上述的取代基则没有特别限定。r7、r10、r19及r21从合成容易的观点来看优选氢。r8、r9及r20只要为上述的取代基则对其也没有特别的限定。吲哚菁基和环糊精的结合,只要为共价结合就对其没有特别限定,例如可例举烷基键、氨键、酰胺键、双键、三键、酯键、醚键等。但在化学合成上,从注重效率的角度考虑,优选酰胺键。为了使吲哚菁的萘基的至少一部分在环糊精的空洞包合,优选使用间隔基使吲哚菁类和环状糖链环糊精介由间隔基进行共价结合而成。此时,可通过调节化学式2中的间隔基的长度来控制吲哚菁的萘基向环糊精的空洞包合的程度。因此,吲哚菁类和环状糖链环糊精介由间隔基通过共价结合而成的环糊精结合吲哚菁化合物且吲哚菁的萘基在环糊精的空洞包合为特征的化合物,优选例举化学式4的物质。另外,优选例举化学式6、化学式8、化学式10的物质。另外,优选例举化学式12的物质。化学式6中,m、n、p及q优选为m+p及n+q分别为5以上7以下。从环糊精包合容易的角度考虑,在所有化学式(化学式1~10)中,优选相当于吲哚菁结构中的氮原子和相当于环糊精结构中的氧原子之间的结构(间隔基)的原子数在7以上9以下。<3.包合型环糊精结合吲哚菁化合物的合成>本发明的包合型环糊精结合吲哚菁化合物为如上所述,其合成法为,以上述合成的非包合型环糊精结合吲哚菁化合物为合成前体,将该化合溶解于水溶液中而完成。在水溶液中,只要不妨碍包合化,可以含有任何物质,对水的含量没有特别限定。另外,适合包合化的温度为-20℃~100℃,优选0℃~50℃。另外,包合化需要的时间是在水溶液中添加后立刻开始至1个月左右。包合化反应根据如上的非包合型环糊精结合吲哚菁化合物的性质、包合化反应的温度、水溶液的组成、浓度等,可以为各种各样的形态。另外,可以通过使本发明的非包合型环糊精结合吲哚菁化合物溶解于包含水的溶剂而变换为包合型环糊精结合吲哚菁化合物。虽然对溶剂中的水的含量比例没有特别限定,从原理上讲水多时包合更容易,优选为50质量%以上。并且,只要在水溶液以外的溶剂中存有形成包合型环糊精结合吲哚菁化合物的物质,则没有必要必须在水溶液中进行包合化。另外,在非包合型环糊精结合吲哚菁化合物的合成阶段有形成包合型环糊精结合吲哚菁化合物的情况,在此情况下,没有必要重新进行包合化反应。<4.非包合型环糊精结合吲哚菁化合物的合成法(合成的一例)>将化学式11所示的化合物的合成作为一个例子举出。化学式11表示的吲哚菁化合物,例如可以通过将以非专利文献5所述的方法合成的化学式13所述的化合物、非专利文献6所述的方法合成的化学式14、作为脱水缩合剂的例如水溶性碳化二酰亚胺(wsc:例如,1-乙基-3-(3-二甲基氨基丙基)碳化二酰亚胺盐酸盐)或二环己基碳化二酰亚胺(dcc)、以及作为溶剂的吡啶或n,n-二甲基甲酰胺或水溶液进行添加,-20℃~60℃下反应10分钟~100小时而得到。另外,为了使反应活化作为活化剂例如还可以添加1-羟基苯并三唑(hobt)。脱水缩合剂的量是化学式13表示的化合物的2倍摩尔或其以上,所使用的溶剂,只要可以使反应物溶解,不妨碍脱水缩合反应则对其没有限制。活化剂只要是能活化脱水缩合反应则对其没有限制,添加的量只要能使脱水缩合反应进行为所期待的程度的量,则对其没有限制。[化学式13][化学式14]<5.非包合型环糊精结合吲哚菁化合物的精制法>将以上述的方法合成的含有非包合型环糊精结合吲哚菁化合物的混合物溶解于酸性水溶液中,提供给反相柱层析,作为洗提液例如使用含酸水和甲醇混合液、或含酸水和乙腈混合液、或含酸水和乙醇混合液、或含酸水和丙酮混合液中的任一种进行洗提,分离精制出高纯度的非包合型环糊精结合吲哚菁化合物。作为酸只要不使非包合型环糊精结合吲哚菁化合物分解,且能有效洗提,洗提后的处理容易,则对其没有其他限制,例如优选盐酸、三氟醋酸、醋酸、硫酸、硝酸、蚁酸等。优选为盐酸、三氟醋酸、醋酸。最优选盐酸。酸的浓度,只要非包合型环糊精结合吲哚菁化合物不分解、能有效进行洗提、且洗提后的处理容易,则对其没有其他限制,优选为0.01mm~10mm,最优选为0.1mm~1mm。通过使浓度在该范围内,能够不使目的化合物分解又能够快速洗提。对于洗提的非包合型环糊精结合吲哚菁化合物,通过去除溶剂可得到其固体。作为溶剂的去除方法也可以进行冷冻干燥。<6.包合型环糊精结合吲哚菁化合物的合成法(合成的一例)及精制法(精制的一例)>以上述的方法合成及精制的化学式11所述的非包合型环糊精结合吲哚菁化合物,例如在dmso中为非包合型,但溶解于水后立即变为包合型的化学式12所述的化合物。该现象能够使用1hnmr确认。因此,包合型化合物只要是水溶液,就以包合型化合物存在,可作为包合型化合物使用。另外,水溶液中的包合型化合物,可通过除去其水溶液的水成为固体,还可制成包合型化合物的固体。<7.适用于给药了诊断用组合物的生物体的、生物体内动态测定装置及循环可视化装置>·生物体内动态测定装置本装置是基于本发明的诊断用组合物所采用的本发明的环糊精结合吲哚菁化合物(以下,有时适当的称为“本发明化合物”)的、间质内移动程度等体内动态与icg不同而完成的。也就是说,本发明化合物的代谢速度、从血液或淋巴液等的循环系向间质的移动速度与icg不同,从而本发明化合物进入间质的比例与icg相比相对地大,因此可通过分析本发明化合物在生物体内的动态,能够正确地评价生物体内的体液移动(生物体内动态)的机理。这里,本装置通过尽量将测定条件(生物体的活动状态、环境温度等)设为常定状态,能够更准确的测定生物体内动态。生物体内的体液移动的异常的一种形态为发生浮肿。在此,根据所谓stirling假设,生物体内的体液(水分)的移动大体可以认为是由动脉到间质,然后由间质流向静脉。该从动脉到静脉的水分移动,可从根据动脉压与间质压的压差流向循环系外的水分移动(a),根据静脉压与间质压的压差流向循环系内的水分移动(b),根据间质液渗透压与动脉血渗透压的压差从间质流向动脉内的水分移动(c),根据间质液渗透压与静脉血渗透压的压差从间质流向静脉内的水分移动(d),作为(a)-(b)-(c)+(d)算出。因此,心力衰竭等而动脉压与静脉压的压差变小,或者营养失调而使间质液渗透压变低,则会破坏水分移动(a)~(d)的平衡,产生浮肿。另外,如糖尿病这种毛细血管的透过性存在异常(物质透过的选择性的异常)的情况下,也会破坏水分移动(a)~(d)的平衡,产生浮肿。在此,没有直接评价毛细血管的透过性异常的简便的方法,迄今为止虽然可以用现象检知浮肿的产生,但现状是很难确定浮肿发生的详细原因。根据以上的见解,当在毛细血管血管壁中产生物质透过异常的情况下,可期待本发明化合物的移动,与根据动脉压与静脉压的压差的降低、细胞内的渗透压的下降等而发生浮肿的情况相比有变化。因此,当确认有与水分移动相当的量以上(或以下)的本发明化合物质移动的情况下,可以判定为产生毛细血管的透过性异常。因为,可以认为若没有产生毛细血管的透过性异常,则只能确认到与水分移动的变化相当的程度的本发明化合物的移动,所以可以判别为血管壁上产生异常的情况。特别是采用向间质内的移动速度不同的两种以上的本发明化合物,通过分别测定这些化合物的生物体内动态并进行比较,从而可以对毛细血管的透过性变化的程度进行评价。也就是说,通过采用在毛细血管血管壁中的透过性不同的2种以上的本发明化合物并测定其透过性,可更准确的评价血管壁透过性异常的发生与否。即,通过采用对于血管壁透过性异常的感受性不同的两种以上的本发明化合物并测定其体内动态,能够更准确的评价水分移动的变动因素。另外,除了本发明化合物的水分移动的评价之外还可以利用常法测定水分移动。本发明的生物体内动态测定装置包括激发光照射单元、荧光强度测定单元、体内动态计算单元和其他的单元。可以根据需要选择其他的单元,例如根据由荧光强度测定单元测定的荧光强度算出环糊精结合吲哚菁化合物浓度的生物体内浓度计算单元。本装置是对给药了上述本发明的诊断用组合物的生物体的至少一部分进行测定的装置。诊断用组合物的给药量是在测定部位照射激发光时可观测到荧光的量。因此,根据测量部位适合量有变化。对诊断用组合物中含有的本发明化合物的种类没有特别限定。本发明化合物可以使用1种,也可以混合2种以上使用。另外,测量的过程中可以追加相同或者不同组成的诊断用组合物。激发光照射单元是对给药的诊断用组合物中含有的本发明化合物照射能够产生荧光的波长的激发光的单元。照射的激发光的波长可以限制在适当的范围。通过将波长限制在尽量狭小的范围可以使荧光和激发光进行可靠的分离。关于波长的限制,可以选择发出适当波长光的光源,或利用滤波器限制波长。关于激发光的照射形态,只要是所产生的荧光能被后述的荧光强度测定单元所测定,则没有特别限定。例如,作为激发光可例举连续的光、脉冲状的光、强度变化的光等。欲变化强度时,可以通过使激发光的脉冲以规定间隔照射等来调制激发光的强度。优选激发光的调制是采用脉冲振幅调制来调制激发光的强度。激发光是通过适当的光学系向应照射的部位照射。应照射的部位是欲进行生物体内动态测定的部位,例如想要评价发生浮肿部位的情况下,优选直接在发生浮肿的部位照射激发光。对激发光照射范围没有特别限定。根据需要确定照射范围。若照射范围狭窄,则被照射的狭窄的部分中可以对被细分化的生物体内动态进行精密测量。以广范围照射,则照射激发光而发出荧光的本发明化合物的相对量将增加,因此可以对荧光强度进行更为精密的测定。并且,利用激发光照射单元的激发光的照射优选在抑制环境光影响的状态下进行。例如,在黑暗处照射激发光,或对照射激发光部分进行披覆而免受外界光的状态下照射激发光。荧光强度测定单元是测定由通过激发光照射单元照射激发光的部位发出的荧光强度的单元。关于荧光强度的测定,优选通过将发出的荧光选择性地透过的滤光器,除去荧光以外的光(环境光、激发光等)而进行测定。作为激发光照射单元采用照射调制强度后的激发光的单元的情况下,可以从测定的光强度中分离显示与该调制对应的变化的成分后作为荧光强度。例如,在利用脉冲振幅调制来调制激发光强度的情况下,解调根据所调制的脉冲的强度而进行变化的光的成分,并通过测定其强度而能够分离荧光强度。因此可以降低环境光对荧光强度的测定结果带来的影响。生物体内浓度计算单元是根据通过荧光强度测定单元测定的荧光强度算出本发明化合物的生物体内浓度的单元。荧光强度与本发明化合物的生物体内浓度的关系可以用适当的方法算出。例如,预先作成标准曲线,可根据该标准曲线计算本发明化合物的生物体内浓度。另外,可将荧光强度的绝对值直接用作为与本发明化合物的生物体内浓度相关的值。生物体内浓度计算单元是经时地算出本发明化合物的生物体内浓度。生物体内动态计算单元是从通过生物体内浓度计算单元经时地得到的本发明化合物的生物体内浓度的数据,求得其生物体内浓度的时间变化率的经时变化的单元。生物体内动态计算单元通过求出的生物体内浓度的时间变化率算出本发明化合物在生物体一部分中由循环系向间质内移动的速度及由间质向循环系移动的速度。也可以不使用生物体内浓度而通过使用荧光强度测定单元经时地得到的荧光强度的变化直接算出向间质内外的移动速度。在此,可以推测向间质内(外)的本发明化合物的移动与体液中的水分移动之间具有很高的相关性,因此通过测定本发明化合物的体内动态而可以评价测量部位中的水分移动的情况。并且,当血管壁出现异常,物质的透过性非正常时,本发明化合物在生物体内的动态也应发生变化,因此,通过评价本发明化合物的动态可以对血管的透过性进行评价。荧光强度(或生物体内浓度)的时间变化率是将荧光强度(或生物体内浓度)的经时变化以时间进行微分求得,或可以算出每规定时间的荧光强度(或生物体内浓度)后作为与规定时间前(规定时间后)的荧光强度(或生物体内浓度)的差来求得。由求得的荧光强度(或生物体浓度)的时间变化率可以算出本发明化合物在所述生物体一部分中的进入间质液中的速度和被排出的速度。在此,进入间质液中的速度和被排出的速度可以由荧光强度作为相对值求出,要求更为精密时,可以根据间质内的本发明化合物的浓度及间质液的量算出。而且此外还考虑血液、淋巴液中的本发明化合物的浓度及其量,则能够更精密地算出。在血液等中的本发明化合物的浓度可以通过实际采取血液而能够以良好的精度进行测定。作为算出间质液中浓度的方法可以例举以下方法。第1方法是将算出的本发明化合物的生物体内浓度直接近似为该生物体一部分中的间质液中的浓度的方法。作为与第1方法相关的方法,也可以考虑间质液的量而算出间质液中的浓度。第2方法是在测定实际血液中存在的本发明化合物的浓度的基础上,利用使用不向间质移动的其他的标准物质(icg等)等的方法来算出血管内存在的物质对通过荧光强度测定单元测定的测定值的影响比例,通过除去实测的血液中本发明化合物的浓度的影响而算出间质液中的浓度的方法。间质液中的本发明化合物的浓度的时间变化率可以由向间质内移动速度减去向间质外移动速度而算出。在此,能够假设向间质内(外)的本发明化合物的移动以与体液中的水分移动相关的速度进行,且假设该水分移动达到平衡的话,则可将向间质内的移动速度和向间质外的移动速度视为常数,因此,可以由本发明化合物在血液中的浓度变化(新陈代谢、排出、向组织的移动等引起的变化)与在间质液中的浓度的时间变化率的推移,算出其移动速度。此外,即使在其移动速度变化的情况下,也能够通过制作与此变化对应的模型并适用来算出它们的移动速度。在算出的移动速度脱离正常的血管壁显示值的范围时,可以推测为血管壁出现了异常。另外,血管壁产生异常的结果,本发明化合物的透过性有提高的情况和下降的情况这两种情况。在此,由于急性炎症、局部缺血、外伤等各种各样的组织障碍而引起组织急性肿胀是众所周知的事实,与领域无关而在医疗现场是极其重要的组织反应。例如,除了纯粹的肿胀的发生自身成为问题以外,还有手术时等的肠管等的缝合的评价,肺炎等的炎症程度的评价,脏器移植的适合性的评价,脑、肾脏等的功能不全的评价等,是涉及全脏器的问题。但是,目前没有正确的预测组织肿胀的可能性和程度的手段,而只能从组织障碍的程度凭经验预测。所以绝大部分的情况是只能确认了肿胀的发生后讨论对策,成为了治疗上的较大制约。若早期能够以高精度预测肿胀的可能性,可以早期就采取减轻肿胀的措施,将影响控制到最低限度。例如若能够正确预测脑出血不久之后发生的脑浮肿的程度,则可在早期采取减压措施、降低血管透过性的对策,可将影响控制到最低限度。同样如果可以事前预测缺血压力带来的影响,就可以将由心肌梗塞和四肢外伤等引起的2次性的障碍降到最低限度。这样,肿胀的高精度定量预测的技术将会给整个医疗带来不小的影响。包括浮肿的组织肿胀的定量化,到目前为止一直通过观测定性地判断。虽然也尝试了定量化,但仅可应用极为有限的状况,并且,存在只能在肿胀产生后才能进行评价的缺点。对于这样的问题,通过使用本发明的生物体内动态测定装置,算出间质内外的水分移动速度,从而能够预测肿胀的进展。如在实施例详述,已知icg在肿胀进行时不向间质移动。相对于此,本发明的环糊精结合吲哚菁化合物可以在间质内外移动,向间质内的移动则在肿胀的进行时随着水分的移动能够进一步被促进。因此,通过对本发明的环糊精结合吲哚菁化合物向间质内的移动的评价,可以预测肿胀的进展。也就是说,可以推测最终形成多大程度大小的肿胀受向间质内外的水分的移动速度的影响,因此通过对与水分的移动速度相关的本发明的环糊精结合吲哚菁化合物的移动速度进行评价而能够评价最终的肿胀的进行程度。移动速度可以通过环糊精结合吲哚菁化合物的浓度进行算出,也可以直接使用荧光强度算出。另外,自然可以将向间质内外的移动速度作为绝对值算出,也可以将其作为相对值(例如可以将荧光强度的变化率直接作为移动速度相关的值使用)算出,根据该值可以预测肿胀的进展。优选肿胀的进展是以没有进行肿胀的平常时的向间质内的移动速度为基准来计算。然而,有时也有不知道平常时的向间质内移动速度的情况,在这种情况下,将没有进行肿胀的部位选择作为对照部位,求得该部位的移动速度而进行代用。另外,使用在间质内不移动的icg评价血液的循环量和代谢的程度,评价本发明的环糊精结合吲哚菁化合物的向间质内移动的程度。本发明的环糊精结合吲哚菁化合物在间质内移动的程度的测定是向生物体内给药本发明的诊断用组合物后经过规定时间以后进行的。所述规定时间是指本发明的诊断用组合物在血液中分布所需要的时间。使用规定时间以后的数据进行评价的理由是,给药诊断用组合物后,经规定的时间而分布到血液中时几乎不受肿胀进展程度的影响,在血液中的浓度迅速上升,荧光强度的变化的情况不受肿胀进行的有无的影响,几乎不产生差异。在血中分布后,在间质内移动的速度将根据肿胀的进展的有无而发生变化,因此在移动进行的部位(即进行肿胀的部位)上将有选择地确认到荧光强度的提高。作为具体的肿胀进展推定方法的例子,可以举出这样的方法:由体重等推测血液量,由推测出的血液量算出荧光强度的峰的大小、至峰为止的时间;考虑该时间、强度而测定可能伴随浮肿发生变化的时间的荧光强度,由其结果可以推测出浮肿的进行的程度,以及将来可能发生的浮肿的程度。循环可视化装置本装置是基于本发明的诊断用组合物采用的本发明的环糊精结合吲哚菁化合物(以下有时适当的称为“本发明化合物”)向间质内移动的程度等体内动态与icg的不同而完成的。也就是说,本发明化合物在间质液中容易移动,可以根据追踪本发明化合物的行为,使血液循环或者淋巴液循环的情况可视化。本发明的循环可视化装置具有激发光照射单元、荧光成像单元、形态成像单元和显示单元。本装置是对给药了上述本发明的诊断用组合物的生物体的至少一部分进行测定的装置。诊断用组合物的给药量是在测定部位照射激发光时可观测到荧光的量。因此,根据测量部位适合量有变化。诊断用组合物中含有的本发明化合物的种类没有特别限定。本发明化合物可以使用一种,也可以2种以上混合使用。另外,在测量的过程中可以追加给药具有相同或者不同组成的诊断用组合物。激发光照射单元是对给药的诊断用组合物中含有的本发明化合物照射能够产生荧光的波长的激发光的单元。照射的激发光的波长可以限制在适当的范围。通过尽量将波长限制在窄的范围能够可靠地分离荧光和激发光。波长的限制可以通过选择发出适当波长光的光源,或者利用滤波器进行波长限制而实现。关于激发光的照射的形态,只要产生的荧光能够通过后述的荧光成像单元被测定则没有特别限定。例如,作为激发光可例举连续的光、脉冲状的光、强度变化的光等。欲变化强度时,可以通过使激发光的脉冲以规定间隔照射等来调制激发光的强度。优选激发光的调制是采用脉冲振幅调制来调制激发光的强度。激发光通过适当的光学系,照射应照射的部分。应照射的部分是指生物体中的欲使循环的情况可视化的部位,例如由烫伤或者冻伤、炎症、创伤、梗塞等导致组织的坏死进行的部位及其周边部位。在组织中的坏死部分中,血液不循环,放任不管则几乎没有益处,因此可以考虑除去。在此情况下,在坏死部分和正常的部分中只将坏死部分完全除去是理想的。以往,对于坏死部分的特定是利用给药造影剂而进行的血管造影术、检测伴随血液循环定价的体温降低的方法等来进行的,血管造影术有x射线照射装置等的装置的使用不便的问题,由体温的判断方法有难以进行正确判断的问题。本发明的装置用于对坏死部分和正常部分通过有无体液(血液)循环来进行评价的用途。只要能使没有循环的部分可视化就可以容易地将该部分去除。除了坏死部分的可视化,还可以直接观察血液循环,因此可以简便地判别出循环功能发生异常的情况。例如,能够可视化虽然不至于坏死但发生了梗塞等而循环功能下降的部分。作为激发光照射范围,以包含欲循环可视化部分的方式根据需要确定照射范围。并且,利用激发光照射单元的激发光的照射优选是在控制环境光的影响的状态下进行。例如,在黑暗处照射激发光,或对照射激发光部分进行披覆而免受外界光的状态下照射激发光。荧光成像单元是二维地获取利用激发光照射单元激发的本发明化合物发出的荧光的强度,以此获得本发明化合物在生物体中的分布状态数据的单元。也就是说,本单元是将生物体一部分的本发明化合物的分布的情况作为二维图像数据表示的分布状态数据获取的单元。例如可由适当的光学系与ccd等摄像元件的组合构成。二维地获取的数据的分辨率可以根据目的设定为必要的值。荧光强度的测定优选使发出的荧光介由滤片选择性透过而除去荧光以外的光(环境光、激发光等)来测定。作为激发光照射单元采用照射调制强度后的激发光的情况下,由测量的光的强度将对应调制的变化的成分分离并获得荧光强度。例如,以脉冲振幅调制对激发光强度进行调制的情况下,通过解调根据被调制脉冲强度来变化的光的成分,并测定其强度,分离出荧光强度。因此,可以降低环境光对荧光强度测定结果的影响。形态成像单元是二维地获取本发明化合物发出的荧光波长以外的波长的光的强度获得其在生物体一部分的形态数据的单元。也就是说,本单元是在生物体一部分中,为获取其形态的二次元图像数据的单元。形态成像单元可由适当的光学系和ccd等的摄像元件所构成。二维获取的数据的分辨率可以根据所需的目的设定其值。在这种情况下不测定激发光所发出的荧光(或降低检测灵敏度)。形态成像单元将前述的荧光成像单元和光学系几乎都共用的基础上,最终在导入摄像元件前的光路上利用分光棱镜等将与荧光对应波长的光引导至荧光成像单元,可将其他波长的光引导至形态成像单元。分光棱镜通过适当形成双向色膜,可以合理控制分离光的波长。并且,荧光成像单元和形态成像单元可以共用在同一个摄像装置。也就是说,荧光和其他的光的分离也可以是得到其二维图像数据后进行的数学分离。并且,分布状态数据也可以是从生物体一部分的表面向深层方向的复数图像数据。荧光成像单元采用的光学焦点在向深层方向移动中在深层方向上得到复数的二维图像数据。另外,作为激发光照射单元采用可以变化焦点距离的光学系,并非在生物体一部分的表面,而是在深层方向的内部移动焦点,或将激发光聚集细而对生物体一部分照射,并不只在生物体表面而是在生物体的深层内部中可以选择地发出荧光,可以将此部分循环的情况可视化。显示单元是通过形态成像单元得到的形态数据和由荧光成像单元得到的分布状态数据的重叠来表示生物体一部分中的本发明化合物分布状态的显示单元。荧光的波长没有在可见光的范围内的情况下,优选将荧光的波长转换为可见光表示。从循环的可视化的观点来看,分布状态数据的表示优先于形态数据表示。特别是,可以判别的表示本发明化合物的分布量(即荧光强度)低的部分(低与否,根据循环可视化的目的决定。例如,在将坏死部分可视化目的中,在没有循环的部分,即确认不到荧光的部分)和其他的部分。例如,能够将该部分表示成与其他部分不同的颜色或闪烁表示。分布状态数据和形态数据的叠加可以利用电脑上的逻辑等实现。二维数据的表示可由一般的显示装置实现。该显示装置设置于生物体和测量者之间,因此可以一边观测显示装置一边对生物体进行处置。<8.定义等>在本发明中,“烷基”是指可有取代基的碳数1~20个的直链状或者支链状的烷基,例如,甲基、乙基、丙基、丁基、戊基、己基、庚基、辛基、壬基、癸基、十一烷基、十二烷基、十三烷基、十四烷基、十五烷基、十六烷基、十七烷基、十八烷基、十九烷基、二十烷基等直链基团,或者以支链状结合的基团。本发明中,“烷氧基”可例举例如甲氧基、乙氧基、丙氧基、丁氧基、戊氧基、己氧基,甲氧基乙氧基、甲氧基丙氧基、乙氧基乙氧基、乙氧基丙氧基、甲氧基乙氧基乙氧基等碳数1~20个的烷氧基在直链上或者支链状结合的基团。在本发明中,“芳基”可例举苯基、萘基等碳数6~20个的芳烃。实施例以下通过实施例具体说明本发明的优选实施方式,但本发明的技术范围并不限于下述实施方式,在本发明范围内可以进行各种变形来实施。<试验1:化学式15及化学式16所示的化合物的合成及精制>将化学式13表示的化合物0.20g、化学式14表示的化合物0.94g、wsc0.18g、hobt0.12g、吡啶4.0ml、n,n-二甲基甲酰胺2.0ml的混合物在0℃且在暗处搅拌6小时。其后加入丙酮50ml,析出物经减压过滤,将析出物溶解于0.1%三氟醋酸水溶液,提供给ods柱层析。洗提液使用含有1mm盐酸的水及甲醇的混合液,洗提化学式15表示的化合物。洗提液经减压浓缩得到绿色固体的化学式16表示的包合型化合物0.65g(在洗提液的减压浓缩中,浓缩的最后,水的含量高,所以自然成为包合型)。[化学式15][化学式16]其次,表示化学式16所示目的物的机器分析数据。1hnmr(500mhz,d2o,26℃,丙酮:2.10ppm)1.43(2h,m),1.55(2h,m),1.99(6h,s),2.09(6h,s),2.63(6h,m),2.80(6h,m),2.92(2h,m),3.02(2h,dd,j=3.7,9.8hz),3.08(2h,t,j=9.2hz),3.2-4.1(m),4.19(2h,t,j=9.8hz),4.26(2h,t,j=9.8hz),4.33(2h,m),4.43(2h,m),4.71(2h,d,j=2.4hz),4.81(4h,d,j=3.7hz),4.91(2h,d,j=3.7hz),4.99(2h,d,j=3.7hz),5.08(2h,d,j=3.7hz),5.13(2h,d,j=3.1hz),6.15(2h,d,j=13hz),6.52(2h,t,j=12hz),7.43(4h,m),7.57(1h,d,j=12hz),7.57(2h,d,j=9.2hz),7.78(2h,m),8.06(3h,m),8.15(2h,d,j=8.5hz).esi-msm/z计算值c131h191n4o722972,实验值2973[m]+.<试验2:化学式19及化学式20所示化合物的合成及精制>将化学式17表示的化合物0.17g、甲醇5ml、t-buok0.30g的混合物在室温搅拌12小时。其后,加入1m盐酸3ml,并加入水50ml。过滤析出物,用水清洗析出物后,减压干燥而得到化学式18所示的化合物0.17g。[化学式17][化学式18]将化学式18表示的化合物0.02g、化学式14表示的化合物0.081g、wsc0.016g、hobt0.011g、吡啶0.3ml、n,n-二甲基甲酰胺0.2ml的混合物在0℃暗处搅拌6小时。其后加入丙酮5ml,析出物经减压过滤,溶解于0.1%三氟醋酸水溶液中,提供给ods柱层析。洗提液中使用含1mm盐酸的水及甲醇的混合液,洗提化学式19表示的化合物。洗提液经减压浓缩得到绿色固体的化学式20表示的包合型化合物0.045g(在洗提液的减压浓缩中,浓缩的最后,水的含有量高,所以自然成为包合型)。[化学式19][化学式20]其次,表示化学式20所示目的物的机器分析数据。1hnmr(500mhz,d2o,40℃,丙酮:2.26ppm)1.54(2h,m),1.68(2h,m),1.98(2h,m),2.19(6h,s),2.20(2h,m),2.30(6h,s),2.6-2.85(10h,m),2.95(2h,m),3.00(4h,m),3.08(2h,t,j=12hz),3.17(2h,dd,j=3.7,9.8hz),3.26(2h,t,j=9.8hz),3.35-4.30(m),4.35(2h,t,j=9.2hz),4.50(2h,t,j=9.2h),4.52(2h,m),4.63(2h,m),4.87(2h,d,j=3.7hz),4.95(d,j=3.1hz),4.97(2h,d,j=3.7hz),5.08(2h,d,j=3.7hz),5.15(2h,d,j=4.3hz),5.25(2h,d,j=3.7hz),5.29(2h,d,j=3.7hz),6.30(2h,d,j=14.6hz),7.58(4h,m),7.73(2h,d,j=8.5hz),7.95(2h,m),8.25(2h,m),8.32(2h,d,j=14.6hz),8.35(2h,d,j=8.5hz).esi-msm/z计算值c135h197n4o733042,实验值3042[m]+.<试验3:化学式21表示的化合物的合成及精制>将化学式13表示的化合物0.04g、单-6-氨基-6-去氧-β-环糊精0.18g、wsc0.05g、hobt0.025g、吡啶0.8ml、n,n-二甲基甲酰胺0.4ml的混合物在0℃暗处搅拌3小时。其后加入丙酮10ml,析出物经减压过滤,溶解于0.1%三氟醋酸水溶液中,提供给ods柱层析。洗提液使用含1mm盐酸的水及甲醇的混合液,洗提化学式21表示的化合物。洗提液经减压浓缩得到绿色固体的化学式21表示的化合物0.11g。[化学式21]其次,表示化学式21所示目的物的机器分析数据。1hnmr(500mhz,d2o,29℃,丙酮:2.10ppm)1.79(12h,br.),2.68(4h,br.),3.0-4.5(98h),4.4(4h,br.),4.5-5.3(14h,br.),6.18(2h,br.),6.46(2h,br.),7.3-8.2(15h).esi-msm/z计算值c125h179n4o702856,实验值2856[m]+.<试验4:化学式23表示的化合物的合成及精制>将化学式22表示的化合物0.02g、单-6-氨基-6-去氧-β-环糊精0.096g、wsc0.032g、吡啶0.5ml、0.1m磷酸缓冲液0.05ml的混合物在室温暗处搅拌24小时。其后加入丙酮10ml,析出物经减压过滤,溶解于0.1%三氟醋酸水溶液中,提供给ods柱层析。洗提液使用水及乙腈的混合液,洗提化学式23表示的化合物。洗提液经减压浓缩得到绿色固体的化学式23表示的化合物0.014g。[化学式22][化学式23]其次,表示化学式21所示目的物的机器分析数据。1hnmr(500mhz,d2o,26℃,丙酮:2.15ppm)1.26(4h,m),1.5-2.25(24h,br),2.7-4.2(88h),4.82(2h,br),4.90(8h,br),4.97(2h,br),5.03(2h,br),6.11(2h,br),6.36(2h,br),7.3-8.01(15h,br).esi-msm/z计算值c131h191n4o702940,实验值2940[m]+.<试验5:化学式24表示的化合物的合成及精制>将化学式22表示的化合物0.20g、3-氨基-3-去氧-β-环糊精0.02g、wsc0.096g、hobt0.013g、吡啶0.4ml、n,n-二甲基甲酰胺0.2ml的混合物在室温暗处搅拌1小时。其后,加入丙酮10ml,析出物经减压过滤,溶解于0.1%三氟醋酸水溶液中,提供给ods柱层析。洗提液使用水及甲醇的混合液,洗提化学式24表示的化合物。洗提液经减压浓缩得到绿色固体的化学式24表示的化合物0.013g。[化学式24]其次,表示化学式24所示目的物的机器分析数据。1hnmr(500mhz,d2o,29℃,丙酮:2.10ppm)1.1-2.5(28h),3.0-4.25(88h),4.5-5.2(14h),7.3-8.02(15h).esi-msm/z计算值c131h191n4o702940,实验值2940[m]+.<试验6:化学式25表示的化合物的合成及精制>将化学式22表示的化合物0.02g、化学式14表示的化合物0.1g、wsc0.032g、吡啶0.5ml、0.1m磷酸缓冲液0.05ml的混合物在室温暗处搅拌24小时。其后加入丙酮10ml,析出物经减压过滤,溶解于0.1%三氟醋酸水溶液中,提供给ods柱层析。洗提液使用水及甲醇的混合液,洗提化学式25表示的化合物。洗提液经减压浓缩得到绿色固体的化学式25表示的化合物0.021g。[化学式25]其次,表示化学式25所示目的物的机器分析数据。1hnmr(500mhz,d2o,25℃,丙酮:2.10ppm)1.0-2.5(32h),3.0-4.5(96h),4.8-5.2(14h),6.09(2h,br),6.37(2h,br),7.3-8.02(15h,br).esi-msm/z计算值c137h203n4o723056,实验值3056[m]+.<试验7:本发明的环糊精结合吲哚菁化合物的溶解性>对icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)进行了向水及生理食盐水的溶解性试验。使用水及生理食盐水的molecularprobe社的粉末状的icg的溶解需要1分钟左右的激烈振动搅拌,本发明的环糊精结合吲哚菁化合物特别是化学式16及化学式20所示的化合物不需要振动搅拌即可快速溶解。<试验8:本发明的环糊精结合吲哚菁化合物向人体皮肤的吸附性>对icg以及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)进行了向人体皮肤的吸附性试验。将icg以及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)分别取1mm水溶液(0.03ml)滴在腕上,5分钟后水洗,擦拭后进行再次水洗。其结果是,icg没有被完全水洗掉,而本发明的环糊精结合吲哚菁化合物特别是化学式16及化学式20所示的化合物容易被水洗掉,显示本发明的环糊精结合吲哚菁化合物向人体皮肤的吸附性显著低于icg(图1)。<试验9:本发明的环糊精结合吲哚菁化合物向纤维素纤维的吸附性>对icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)进行了向纤维素纤维的吸附性试验。纤维素纤维的模型用棉棒(株式会社三洋),icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)分别取1mm水溶液0.05ml塗布,3分钟后在流水(自来水,1l/min)中水洗5秒钟。其结果是,icg没有被完全水洗掉,本发明的环糊精结合吲哚菁化合物特别是化学式16及化学式20表示的化合物容易被水洗掉,显示本发明的环糊精结合吲哚菁化合物表示的化合物在纤维素纤维上的吸附性显著低于icg(图2)。<试验10:本发明环糊精结合吲哚菁化合物向生物体肉模型的吸附性>对icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)进行了向生物体的肉模型的吸附性试验。生物体肉模型选用市场上贩卖的猪里脊肉,在猪里脊肉上制作直径5mm的凹部,icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)分别取1mm水溶液0.05ml塗布,3分钟后在流水(自来水,1l/min)中水洗10秒钟。其结果是,icg没有被完全水洗掉,本发明的环糊精结合吲哚菁化合物特别是化学式16及化学式20表示的化合物容易被水洗掉,显示本发明的环糊精结合吲哚菁化合物在生物体肉模型上的吸附性显著低于icg(图3)。<试验11:本发明的环糊精结合吲哚菁化合物向生物体蛋白质模型的吸附性>对icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)进行了向生物体蛋白质模型的吸附性试验。生物体蛋白质模型选用市场上贩卖的鸡胸肉,在鸡胸肉上制作直径5mm的凹部,icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)分别取1mm水溶液0.05ml塗布,3分钟后在流水(自来水,1l/min)中水洗10秒钟。其结果,icg没有被完全水洗掉,本发明的环糊精结合吲哚菁化合物特别是化学式16及化学式20表示的化合物容易被水洗掉,显示本发明的环糊精结合吲哚菁化合物在生物体蛋白质模型上的吸附性显著低于icg(图4)。<试验12:本发明的环糊精结合吲哚菁化合物向疏水性化学纤维的吸附性>对icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)进行了向疏水性化学纤维的吸附性试验。疏水性化学纤维的模型选用聚丙烯口罩(玉川卫材株式会社),icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)分别取1mm水溶液0.05ml塗布,放置20分钟后(样品中有水分的话就不附着在口罩上,所以为了除去水分放置20分钟)在流水(自来水,1l/min)中水洗1秒钟。其结果,icg没有被完全水洗掉,本发明的环糊精结合吲哚菁化合物特别是化学式16及化学式20表示的化合物容易被水洗掉,显示本发明的环糊精结合吲哚菁化合物向疏水性化学纤维的吸附性显著低于icg(图5)。<试验13:本发明环糊精结合吲哚菁化合物在水溶液中的分子缔合性>对icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)在水溶液中的分子缔合性进行了研究。分别配制icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)的0.01mm、0.025mm、0.05mm、0.1mm水溶液,装入光路长1mm的石英比色皿中,测定25℃下600nm至1000nm的光吸收光谱。其结果是,icg在此浓度范围内产生了被称作h-聚集的分子缔合(图6左图),本发明的环糊精结合吲哚菁化合物特别是化学式16及化学式20表示的化合物在此浓度范围内没有产生被称作h-聚集的分子缔合(图6右图)。<试验14:本发明的环糊精结合吲哚菁化合物在水溶液中的荧光性>对icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)在水溶液中的荧光性进行了研究。icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)分别取0.1μm水溶液,在25℃装入1cm见方石英比色皿中,用720nm的激发光(带通:10nm)激发,测定荧光光谱(带通:10nm)。荧光效率是以icg的荧光效率0.13(在dmso中,25℃)为基础计算。其结果,icg的荧光量子效率是0.021,本发明的环糊精结合吲哚菁化合物特别是化学式16及化学式20表示的化合物的荧光量子效率是0.054及0.042,荧光量子效率是icg的2.6倍和2倍。<试验15:本发明的环糊精结合吲哚菁化合物在血液中的荧光性>对icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)在血液中的荧光性进行了研究。将icg及本发明的环糊精结合吲哚菁化合物(化学式16、20、21、23~25)分别溶解于血液(人)中以达到100μm。并在25℃装入三角石英比色皿中,用760nm的激发光(带通:10nm)激发,测定表面荧光光谱(带通:10nm)。极大荧光波长中的荧光强度是,icg为58(任意单位)。本发明的环糊精结合吲哚菁化合物特别是化学式16及化学式20表示的化合物的荧光强度是270(任意单位)及190(任意单位),是icg的4.7倍和3.3倍。这可以认为是因为本发明的环糊精结合吲哚菁化合物在生物体内中不阻碍发光。<试验16:关于本发明的环糊精结合吲哚菁化合物在生物体内的行为>作为代表例子,关于化学式19及20表示的异构化平衡化合物(tk1)和化学式15及16表示的异构化平衡化合物(tk2),对作为生物体对象物的人类血液以及大鼠体内的行为进行了评价。·人类血液中的荧光行为关于icg、tk1及tk2,对于在三角比色皿中的人类静脉血中的表面荧光强度的浓度相关性进行了评价。具体地,在三角石英比色皿中加入人类静脉血液1.0ml,并添加规定浓度的icg、tk1及tk2。在25℃照射760nm(带通:10nm)的激发光后,测定表面荧光(带通:10nm)。将结果表示在图7。从图7中可以明确知道,tk1及tk2都可以在人类静脉血中通过激发光的照射发出荧光。·向大鼠体内给药可能性的研究将icg、tk1及tk2分别配制成浓度1mm的水溶液,各取0.1ml,在开腹大鼠的大腿静脉剥露出后进行注射。其后,用760nm的激发光照射开腹部,评价有无荧光。其结果,在开腹部中的内脏观察到了荧光。观察到tk1及tk2在肾脏的集聚高(如已知icg在肝脏的集聚高)。另外,没有确认到这些给药对大鼠的病情非常严重的影响,而能够确认到比较安全的生物体内给药的可能性。·大鼠体内分布的观察将wistar雄大鼠(9周龄,体重350g)用乙醚麻醉后,将戊巴比妥钠(nembutal)0.1ml用26g针腹腔内给药来麻醉。大鼠的尾巴根部用橡胶带驱血,用24g留置针确保尾静脉,并连接3头方活栓和延长管而确保末梢线。将大鼠以仰卧姿势固定在平面台上(图8)。将滨松光子学株式会社制pde摄像机单元正确设置于离大鼠身体16cm的位置。但对全身范围摄影时固定在20cm处。观察范围是图8中黒圈表示程度的范围。其后,通过确保的末梢线,给药浓度1mm的icg和tk1及tk2。给药量为0.1ml。将给药20分钟后开腹时的腹腔内的荧光的情况表示在图9,足背部的荧光的情况表示在(达到最高亮度时的画像)图12。图9表示,icg主要在肝脏(图9(a)),tk1主要在肾脏(图9(b)),tk2也主要在肾脏(图9(c))集聚。给药后立刻对内脏进行近红外摄像的结果,显示出能够鲜明地摄像肾脏、输尿管、膀胱(图10)。另外,显示出能够应用近红外内视镜摄像输尿管(图11)。由摄像图12可知,在足背部中的对应血液流动发出荧光的情况被明确。另外,虽然图中没有显示,对结扎大鼠右大腿动脉的下肢缺血模型同样给药icg、tk1及tk2后观察荧光的结果,由于缺血部分中没有确认到荧光,因此可以依赖有无荧光来评价血流的程度。在这里,图13和图14表示足背部的荧光强度经时间的变化。另外,在表1中表示到达最大荧光强度值(imax)的时间、imax值、达到imax值一半时的时间(t1/2)。[表1]化合物imax到达时间imax*t1/2icg0.5min1242.3mintk-110min16040mintk-215min10655min由表1、图13和图14可知,tk1以及tk2的最大荧光强度值达到时间、减半时间与icg比较都要更长。也就是说,能长时间在体内发出荧光。例如,相对于icg给药后不到10分钟荧光强度下降到初始值,tk1及tk2在给药后经过1小时后也显示高的荧光强度。·血管水平上的观察根据非专利文献7及8披露的方法(图15),在大鼠血管直接露出的状态下给药icg、tk1进行观察。露出后的精巣提睾肌皮瓣的情况如图16所示。其结果,icg相对于tk1在血管内显现为不均匀。也就是说,可知tk1从血管向间质液中移动。为了更精密地进行研究,将给药后血管的显微镜照片表示在图17(icg)和图18(tk1)。由图17及18可知,分别比较血管中的荧光强度和其周边组织中的荧光强度时,icg在间质内几乎确认不到荧光,相对于此tk1则确认到在间质内的荧光。另外,虽然没有详细表示,但确认到间质内的荧光强度是经时增加的。因此,icg几乎确认不到从血管向间质液中的移动,但tk1确认到从血管向间质液中的移动。·本发明的环糊精结合吲哚菁化合物在间质内移动的程度和浮肿形成的大小之间的关联的评价(评价方法)选用大鼠(雄性,wister大鼠)10周龄约350g作为试验动物(n=4)。对大鼠用异氟烷进行全身麻醉,在左后足跖上用26g针注射0.5%λ卡拉胶0.1ml。结果,迅速出现足浮肿。15分钟后用大鼠足跖体积测量器(室町机械株式会社制:mk-101cmpplethysmometer)测量了大鼠的左足体积。此后关闭异氟烷确认了大鼠觉醒。实施vonfreytest后,再次用异氟烷进行全身麻醉。将大鼠的尾静脉用24g留置针确保后,以仰卧位姿势固定在水平台上。设置滨松光子学株式会社制pde摄像头,固定在离大鼠足背16cm的高度。用pde摄像头将测定的部位(roi)设定在足背中央部消灯。测量开始后,将1mmoltk1水溶液0.1ml经尾静脉注入,用1ml的生理食盐水冲洗5秒。在注入的最初5分钟进行连续拍摄,测量roi的亮度。以后以5分钟间隔测定1分钟亮度,持续到注入后120分钟为止。测量结束后,关闭异氟烷返还为觉醒(急性炎症实验)。7日后,进行大鼠的vonfreytest后,迅速对大鼠用异氟烷进行全身麻醉,用大鼠足跖体积测量器测量大鼠的左足体积。将大鼠的尾静脉用24g留置针确保后,以仰卧位姿势固定在水平台上。设置滨松光子学株式会社制pde摄像头,固定在离大鼠足背16cm的高度。将roi设定在足背中央部,消灯后开始测定。将1mmoltk1水溶液0.1ml从尾静脉注入,用1ml的生理食盐水冲洗5秒。在注入的最初5分钟进行连续拍摄,测量roi的亮度。以后间隔5分钟测量1分钟亮度,持续到注入后120分钟为止。测量结束后,关闭异氟烷返还为觉醒。对于没有注射λ卡拉胶的群也进行了同样试验。icg也同样实行了以上的过程。(结果)在图19~26表示结果。将对于给药tk1的群进行测定的大鼠的左足容积表示在图19(越向纵轴的上方体积越大),将vonfreytest的结果表示在图20(越向纵轴的下方越是痛觉过敏),将注射后不久的亮度的变化情况表示在图21(越向纵轴的上方亮度越大),将注射卡拉胶后经过1周后的亮度的变化情况表示在图23(越向纵轴的上方亮度大)。将对于给药icg的群进行测定的大鼠的左足容积表示在图23(越向纵轴的上方体积越大),将vonfreytest的结果表示在图24(越向纵轴的下方越是痛觉过敏),将注射后不久的亮度的变化情况表示在图25(越向纵轴上方亮度越大),将注射卡拉胶后经过1周后的亮度的变化情况表示在图26(越向纵轴上方亮度大)。全部的图表的纵轴的值是任意单位。确认了icg和tk1之间在roi中的亮度的变化图案上有大的差异。在icg给药后的短时间内急速增强的亮度在此后迅速转为减少,约10分钟后下降到了基线。相对于此,tk1给药后的早期的亮度的增强呈现出与icg同样的轨迹,其后亮度居高不下,恢复到基线需要6小时。根据该结果我们认为icg滞留于血管内没有向间质内漏出,因此急速的亮度的増强和其后的急速的衰减是由于分布在roi的血管内的通过。相对于此,tk1则反映出了反映一开始的急速向血管内的通过的部分(以后称“血管相”)和其后逐渐向间质漏出的tk1发出荧光的相(以下称“间质相”)的两个相。从血管相向间质相移动的时间对应于规定时间。急性炎症实验中对于icg、tk1两个群而言,大鼠足容积在注射λ卡拉胶后被确认有显著的容积增加,1周后则恢复正常到与腱侧相同(图19、23)。另外,对icg、tk1两个群中,在vonfreytest中注射λ卡拉胶后有非常明显的痛觉过敏,1周后则恢复正常与腱侧相同(图20、24)。关于足背的亮度,tk1群在血管相的亮度变化的情况与对照群之间没有差距,但间质相中比λ卡拉胶给药群更迅速增加亮度,在整个评价时间都保持了高的值(图21)。给药λ卡拉胶而炎症消退后的给药1周后,卡拉胶给药侧与腱侧之间在间质相的亮度变化上并无差别(图22)。如图21中的曲线明确表示,在间质相的亮度的推移以光滑的曲线推移,该曲线的高度依存于间质相的向上的变化率。换句话说,间质相的值的变化能够根据时系列解析以高精度预测,是我们在本工作中假设成立的重要根据。icg群则在注射λ卡拉胶后立刻和1周后都未能确认亮度的差异(图25、图26)。该结果表示以往应用于临床的疏水性高的icg即使存在由λ卡拉胶等引起的高度的急性炎症,也不会发生向血管外的荧光物质的泄漏。由以上结果可知,将tk1给药生物体后,在与间质相相当的期间,可以对预测肿胀进展部位的荧光强度进行经时测定,由此可以对其后的荧光强度的推移进行预测,其荧光强度的推移与其部位的肿胀的进展有关系。因此tk1可以适用于icg所不能进行的肿胀的预测。产业上的利用可能性根据本发明的化学式1或化学式2表示的环糊精结合吲哚菁化合物,可提供具有如下特征的属于绿色色素的发出近红外荧光的化合物:与icg相比,在水或生理食盐水中的溶解性高,易从生物体组织除去,水溶液中的分子缔合低,水溶液中的近红外荧光强度高,不含碘。另外,根据本发明的环糊精结合吲哚菁化合物的合成法,能够提供有用的环糊精结合吲哚菁化合物的合成。另外,根据本发明的环糊精结合吲哚菁化合物的精制法,能够提供有用的环糊精结合吲哚菁化合物的精制。进而,由于本发明的环糊精结合吲哚菁化合物即使不含碘也显示足够的溶解性,因此能够提供不含碘过敏症的原因的碘的诊断用组合物。这些诊断用组合物表现出与现有的只含icg的诊断用组合物不同的体内行为,因此可利用其性质提供各种各样的有益的诊断法和诊断装置。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1