一种用于农作物病害防治的重组菌株的制作方法
本发明属于植物病害防治技术领域,具体涉及一种用于农作物病害防治的重组菌株。
背景介绍
植物病原菌存在于各种经济作物的不同生长阶段,其致病性严重影响作物生长及经济效益。目前应对该问题,主要是通过使用抗生素的手段提高农作物的抗病害能力。但是抗生素的使用诱使抗药性细菌出现(defoirdtetal.2011)。并且药物会在植物体内残留并导致环境污染。新型环境友好型的病害防治策略需要深入研究及广泛应用。
moml是属于金属-β-内酰胺酶家族的群体感应淬灭酶。moml具有明显的抑制病原菌致病因子及防病害能力,可作为生防蛋白进行改造利用。但是在正常培养条件下,群体感应淬灭酶的转录表达水平并不高,这影响到有益菌株作为生防菌的广泛应用,因此将群体感应淬灭酶在有益菌中异源表达,提高有益菌的群体感应淬灭酶的表达水平变得非常重要。
产酶溶杆菌广泛生存于土壤和水环境中,能够分泌一系列胞外酶及具有抗植物真菌病原菌活性的次级代谢产物,是溶杆菌属中最具有生物防治潜力的一种革兰氏阴性菌。近年来,产酶溶杆菌作为一种新的生物防治剂被普遍用于防治由真菌引起的农作物病害(borasretal.1993;folmanetal.2003);相对而言,对植物细菌性病害的控制报道较少,并且没有群体感应淬灭活性。为扩大产酶溶杆菌对植物致病菌的防治范围,可以将抑菌蛋白moml在其内异源表达构建具有更广谱抑菌活性的产酶溶杆菌工程菌株用于植物细菌性病害的防治。
技术实现要素:
本发明的目的是提供种用于农作物病害防治的重组菌株,与改造的群体感应淬灭蛋白moml制备成生物制剂,对一系列植物病害细菌进行防治。
本发明首先提供一种重组产酶溶杆菌,该重组产酶溶杆菌携带有用于重组表达群体感应淬灭酶moml基因的重组载体,该重组载体的启动子的核苷酸序列为seqidno:1;
所述的群体感应淬灭酶moml,其氨基酸序列为seqidno:2;
编码群体感应淬灭酶moml的基因,其核苷酸序列为seqidno:3;
上述的重组产酶产酶溶杆菌用于植物病害防治和制备植物病害防治的生物制品;
本发明再一个方面提供一种植物病害防治的生物制品,包含有上述的重组产酶溶杆菌和改造后的群体感应淬灭酶moml;
所述的改造后的群体感应淬灭酶moml41,其氨基酸序列为seqidno:4;
编码改造后的群体感应淬灭酶moml41的基因,其核苷酸序列为seqidno:5。
本发明利用构建的重组表达群体感应淬灭蛋白moml的产酶溶杆菌,以及改造后的群体感应淬灭蛋白moml41制备植物病害防治制品,提高了对植物细菌性软腐病致病菌的抑制效果,并应用于植物细菌性软腐病防治。
附图说明
图1:moml41对pcc致病因子果胶酶的抑制作用,
图2:重组表达菌株与pcc共培养对pcc果胶酶表达的抑制作用,
图3:moml41对果胶酶产生相关基因的转录影响分析,
图4:酮还原酶基因片段和pgroel的双酶切凝胶电泳检测结果图,
图5:lemoml菌株与野生菌株菌落颜色对比图,
图6:lemoml菌株对c6-shl的降解作用图,
图7:lemoml菌株对pcc存活率率的影响图,
图8:lemoml菌株对由pcc引起的大白菜软腐病的抑制效果图。
具体实施方式
moml蛋白的稳定性有待提高,在室温下放置一段时间后酶活降低较快,从而影响这类蛋白后续开发及广泛应用。因此,申请人对moml蛋白进行了改造。改造后的moml蛋白具有更好的稳定性。
下面结合实例对本发明的方法做进一步说明。但实例仅限于说明,并不限于此)
实施例1:在产酶溶杆菌中异源表达群体感应淬灭酶moml的方法
研究表明外源群体感应淬灭酶基因moml在陆生菌产酶溶杆菌中存在表达效率低下的问题。为了解决这一问题,申请人对陆生菌产酶溶杆菌oh11基因组和moml基因的序列组进行了分析,最终发现核苷酸序列为seqidno:1的pgroel启动子使moml基因在产酶溶杆菌中具有很高的表达能力及稳定性。
通过产酶溶杆菌oh11的全基因组测序及基因注释结果可知,其基因组中基因groel与groes反向共转录,因此推测基因groel的启动子位于基因groes编码区的上游,通过softberry及berkeleydrosophilagenomeproject(bdgp)对启动子进行在线预测并得到相关序列,其中启动子的sedidno为ky863517,启动子序列如下:cgatgcctttgtgccagatcgccagaccggaccgaaaggcgtcgggcctgaaagccctcccactagagcccccagggtgaagagccctcccacaacagctccggggtccgcgggctctcccagcgccgccggccggccccgcggaccgaccgctgtcaccgttccgatgcaggattcgtcgcggccccccttgaaagccgtccgaggcgccctatctccgaaccagtcccggcttgccgggcgctttcgtccccggcattggcactcgccgggtgcgactgctaaaattcccgttctttatccaccaattcaattacttacagaggtcgcc(seqidno:1)。
产酶溶杆菌作为一种新的生物防治剂被普遍用于防治由真菌引起的农作物病害;但并没有群体感应淬灭的抑菌活性。此工程菌株扩大了产酶溶杆菌对植物致病菌的防治范围,使其具有更广谱抑菌活性,使该工程菌株用于多种植物细菌性病害的防治。
实施例2:产酶溶杆菌过表达载体pex18-w的构建。
选用产酶溶杆菌中黄色素合成基因簇中的关键基因酮还原酶合成基因作为重组载体的整合位点,利用软件primerpremier5设计基因片段的上、下引物分别带有ecorⅰ、kpnⅰ限制性酶酶切位点,up:5’-cggaattctccagggcgtggtcaaca-3’;down:5’-ggggtacctctgcttgatcgcctccg-3’,利用primestarg×ldna扩增酶进行目的片段扩增。得到的扩增产物与过表达载体pex18同时进行ecorⅰ、kpnⅰ限制性酶酶切,将双酶切后的扩增产物与双酶切后的载体pex18置于16℃进行过夜连接,最后构建成产酶溶杆菌过表达载体pex18-w。利用双酶切检测的方法对过表达载体pex18-w中的目的基因进行检测,凝胶电泳结果显示目的基因的大小长度符合。凝胶电泳检测结果如附图4所示。
实施例3:产酶溶杆菌过表达载体pex18-w-p的构建。
用已报道的产酶溶杆菌本源启动子进行moml异源表达,均不能达到蛋白的稳定高效表达。利用前期转录组学数据,筛选到启动子pgroel。将其与已报到的本源启动子进行对比,发现pgroel能够实现moml的稳定高量表达(表1)。具体方法如下:选取产酶溶杆菌本源groel基因前端的启动子作为外源基因前端紧密连接的启动子,利用软件primerpremier5设计分别带有kpnⅰ、bamhⅰ限制性酶酶切位点的上、下引物,
up:5’-ggggtacccgatgcctttgtgccag-3’;
down:5’-cgggatccggcgacctctgtaagtaattg-3’,利用primestardna扩增酶进行启动子片段扩增。得到的扩增产物同过表达载体pex18-w一起,同时进行kpnⅰ、bamhⅰ限制性酶酶切,双酶切后的扩增产物与双酶切后的载体pex18-w在16℃条件下过夜连接,构建过表达载体pex18-w-p。将连接产物通过42℃热击转化的方法转入到e.colis17-1感受态细胞中,并通过加有25μg/mlgen的lb平板筛选阳性单克隆。利用双酶切检测的方法对阳性克隆进行目的基因的检测,凝胶电泳结果显示目的基因的大小与启动子片段长度符合。凝胶电泳检测结果如附图4所示。
实施例4:产酶溶杆菌过表达载体pex18-w-p-moml的构建。
采用氛氯仿法提取耐油具柄菌th120基因组作为模板,利用软件primerpremier5设计moml基因对应的分别带有bamhi及xbai酶切位点的上、下引物,up:5’-cgggatccaaaaaggaagctgcagaatcg-3’,down:5’-gctctagattgtaaatagttgggtgcctgg-3’,利用primestardna扩增酶进行pcr扩增。随后,使用bamhi和xbai两种限制性内切酶对纯化后的扩增产物及产酶溶杆菌过表达载体pex18-w-p进行双酶切,并将带有粘性末端的目的片段及线性载体16℃过夜连接,获得产酶溶杆菌过表达载体pex18-w-p-moml。
实施例5:工程菌株lemoml的构建。
将实施例2中得到的连接产物通过42℃热击转化的方法转入到e.colis17-1感受态细胞中,并通过加有25μg/mlgen的lb平板筛选阳性单克隆,获得供体菌株s17-1-pex18-w-p-moml,并接于含25μg/mlgen的lb培养基中培养。与此同时,将受体菌株产酶溶杆菌单克隆接于含50μg/mlkan的1/10tsb培养基中培养,当两种菌液od值均达到0.7左右时,13200rpm离心菌体2分钟,弃上清后菌体均用100μl的lb培养基重悬,并将产酶溶杆菌菌悬液与s17-1-pex18-w-p-moml菌悬液混合,30℃培养4小时后将菌液涂布于含100μg/mlgen,25μg/mlkan的lb平板上,将平板置于30℃培养箱培养2-4天,待长出单菌落后,挑取足够数量的单克隆进行平板划线,通过黄-白颜色变化作为筛选标记,最终获得白色重组菌株lemoml,菌落黄-白颜色变化如附图5所示。
实施例6:启动子pgroel表达效率的检测
为检测启动子pgroel表达效率的水平,本发明将pgroel对基因moml启动转录的水平与目前已报道的产酶溶杆菌本源启动子中表达最强的启动子phsaf、已报道的高表达启动子pclp及另一待检测启动子pqsec进行比较。具体实施方法为将过表达载体pex18-w-p-moml中启动子pgroel的基因片段序列分别被启动子phsaf、pclp及pqsec的序列取代,随后将带有不同启动子的过表达载体分别通过结合转化整合到产酶溶杆菌oh11的基因组中,通过“黄-白”颜色筛选法筛选出目的转化子,利用实时荧光定量pcr的方法,对这些重组产酶溶杆菌菌株在不同时间点moml的转录水平进行检测,实验结果如表1所示。相比于其他检测的启动子,pgroel在12小时时已激发基因moml进行转录,且表达水平远高于其他启动子;在60小时时,启动子pgroel依然保持着相对较高的启动转录水平,而此时启动子pclp和pqsec启动的基因已检测不到转录水平,因此相比于其他启动子pgroel具有较高表达效率,是启动外源基因表达的效果最佳的启动子。
表1:启动子表达效率表
实施例7:lemoml工程菌qq酶活性检测
以紫色色杆菌突变株cv026为报告菌株,通过平板法检测qq酶活性。首先,野生型产酶溶杆菌、重组菌株lemoml和报告菌cv026分别接于lb培养基中活化。随后,取1ml活化好的cv026菌液接于15mllb半固体培养基中,混匀倒入空平板,待培养基凝固后打孔。与此同时,将稀释后的c6-shl加于将产酶溶杆菌及lemoml菌株的液体培养基中反应3小时。最后,取40μl产酶溶杆菌及lemoml菌株菌液加于孔中,以等量稀释的c6-shl为对照,将平板置于28℃培养24小时,观察紫色色素圈直径的大小推知的lemoml菌株对c6-shl的降解情况,另外,本发明对紫色色素圈直径大小与c6-shl浓度之间的关系进行了相关实验。实验结果如表2及图6所示,说明重组菌株lemoml产生的qq酶moml能够降解信号分子c6-shl,实验样品周围的cv026因缺失诱导产生紫色色素的信号分子c6-shl含量较少,从而使实验样品周围产生的紫色色素圈小于野生菌株产酶溶杆菌及对照组。
表2c6-shl浓度与色素圈大小
实施例8:lemoml菌株对胡萝卜果胶杆菌胡萝卜亚种(p.carotovorumsubsp.carotovorum,pcc)存活率的影响。
将野生型产酶溶杆菌及lemoml菌株分别接于lb培养基中培养,当菌液达到同一od值(0.8-1.0)后,按10:1的比例分别与处于对数生长期的pcc共培养,以pcc单菌培养作为对照,在28℃摇床培养6小时后,将实验组与对照组的菌液均稀释105倍进行涂板,将平板置于28℃培养24小时后,对平板上的pcc单菌落进行查数,计算出实验组与对照组中pcc的存活率并比较研究。实验结果表明,pcc与产酶溶杆菌及lemoml菌株共培养后,如附图7所示,pcc的存活率均有所下降,但后者下降趋势更明显。
实施例9:lemoml菌株对pcc表达致病因子的抑制作用。
pcc是植物细菌性软腐病主要的病原菌,其中,胞外水解酶类是最主要的致病因子,包括果胶酶、蛋白酶和纤维素酶等,而果胶酶又是胞外水解酶中最为重要的致病因子,本实施例以果胶酶为例进行说明。将野生型产酶溶杆菌及lemoml菌株分别接于lb培养基中培养,当菌液达到同一od值(0.8-1.0)后,按10:1的比例分别与处于对数生长期的pcc共培养,以pcc单菌培养作为对照,在28℃摇床培养6小时后,按实施例5的方法对实验组与对照组中pcc单菌落进行计数。与此同时,将培养后的菌液13000×g,4℃离心10min,取上清用0.22μm孔径滤膜过滤除菌,得到粗酶液用于果胶酶的dns法检测。取0.2g多聚半乳糖醛酸和0.41g无水乙酸钠溶于100ml去离子水中,配成多聚半乳糖醛酸溶液,ph调至5.2待用。将50μl粗酶液加入到450μl多聚半乳糖醛酸溶液中立即混匀,25℃水浴中反应20min,反应结束后时,立即将反应物取出,放碎冰中冷却以终止反应。在500μl反应体系中,加入500μldns试剂,煮沸5min显色,冷却至室温后,在4℃,10,000rpm的条件下离心1分钟以去除不容物。将样品稀释三倍至3ml,分别测定实验组与对照组od540的值,相对果胶酶活性以od540与pcc菌落个数的比值表示。
实施例10:lemoml菌株对pcc植物侵染力的影响
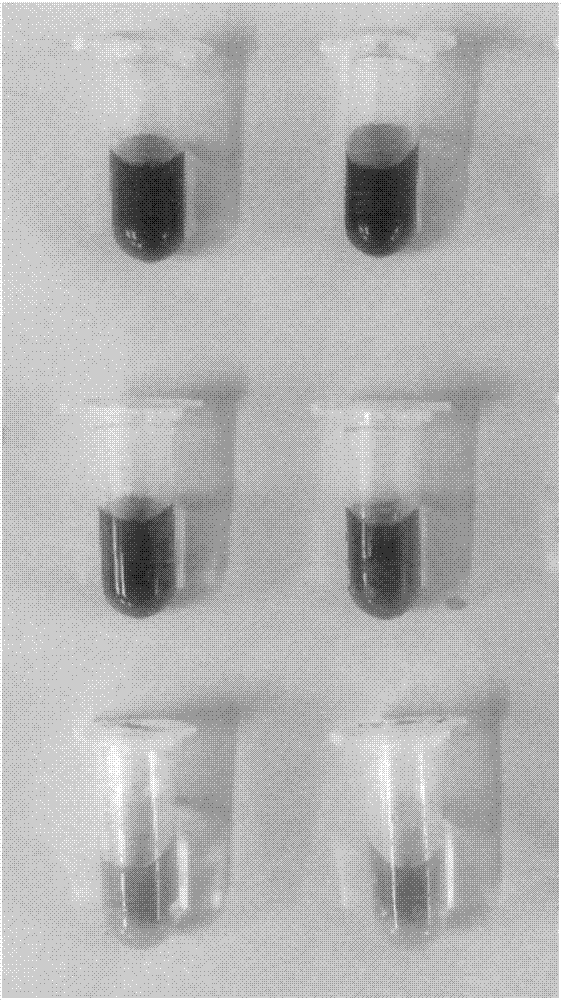
pcc可侵染多种寄主,包括十字花科、茄科、豆科、葫芦科等多种蔬菜,造成经济农作物损失。本实施例以pcc侵染白菜为例,研究lemoml菌株对pcc植物侵染力的影响。首先,将产酶溶杆菌及lemoml菌株分别接于lb培养基中培养,当菌液达到同一od值(0.8-1.0)时,对菌液进行稀释,使细菌群体为108cfuml-1。与此同时,将pcc接于lb培养基中进行培养,当达到对数生长期时,对菌液进行稀释,使细菌群体为106cfuml-1。将稀释过的野生型产酶溶杆菌和lemoml菌株菌液分别与稀释后的pcc菌液按照1:1的比例混合,待用。然后,挑选同一白菜形态、大小、生长发育状况相近的叶片进行清洗,置于超净工作台中自然晾干,并喷洒70%乙醇进行杀菌。待乙醇完全挥发后,用无菌刀片在叶片中央割出1cm的伤口,将10μl混合菌液注入伤口,以pcc单菌培养液为对照。最后,将无菌滤纸片用10ml无菌水打湿,与接过病原菌的白菜叶片一同放于保鲜袋中进行密封,28℃培养48小时后,观察白菜叶片被侵染的情况。结果如附图8所示,pcc与产酶溶杆菌及lemoml菌株共培养后侵染白菜叶片,pcc的侵染能力均有所下降,但与后者共培养时侵染能力下降比前者明显。
实施例11:大肠杆菌表达载体pet24a(+)-moml41的构建
moml蛋白的稳定性有待提高,在室温下放置一段时间后酶活降低较快,从而影响这类蛋白后续开发及广泛应用。因此,申请人对moml蛋白(氨基酸序列为seqidno:2,编码基因的核苷酸序列为seqidno:3)进行了改造。具体就是将moml蛋白的n末端进行了截断处理,改造后的moml蛋白的氨基酸序列为具有更好的稳定性;改造后的蛋白命名为moml41,其氨基酸序列为seqidno:4,编码基因的核苷酸序列为seqidno:5.
表达载体pet24a(+)用ecori和xholi双酶切,酶切体系(20μl)如下:
反应体系1:ddh2o8μl,pet24a(+)质粒dna8μl,ecori1μl,xholi1μl,10×hbuffer2μl,目的片段进行pcr扩增,上游引物:5‘-cggaattcaagctctatgcttttagc-3’,下游引物:5‘-ccctcgagttgtaaatagttgggtg-3’,用同样的两种酶进行酶切,37℃酶切30min,电泳后分别回收两个目的片段,用dnaligationkit连接,连接体系(10μl)如下:solutioni5μl,dna片段1.5μl,pet24a(+)载体1.1μl,ddh2o2.4μl。16℃连接16小时即可获得大肠杆菌表达载体pet24a(+)-moml41,用于转化大肠杆菌bl21(de3)。moml41蛋白可溶性很高,经过超声破碎后,可溶蛋白比例达90%以上,并且与野生型蛋白moml相比,改造的moml41稳定性提高,放置3天后,蛋白活力是野生型蛋白的2倍。
实施例12:moml41蛋白对胡萝卜果胶杆菌胡萝卜亚种致病因子果胶酶的抑制作用
胡萝卜果胶杆菌胡萝卜亚种(p.carotovorumsubsp.carotovorum,pcc)是植物细菌性软腐病主要的病原菌,其中,果胶酶是胞外水解酶中最为重要的致病因子。此例将纯化的重组蛋白moml41加入到pcc的菌液中,检测moml41对pcc中果胶酶表达的抑制作用。
将活化好的活化好的pcc按1%接种量接于5mllb液体培养基中,加入10μl纯化的重组蛋白moml41于28℃下培养12-16h。将培养后的菌液13000×g,4℃离心10min,取上清用0.22μm孔径滤膜过滤除菌,得到粗酶液用于果胶酶的dns法检测。取0.004g多聚糖醛酸加入到4ml,ph4.8乙酸-乙酸钠缓冲液中配成1mg/ml的多聚半乳糖醛酸溶液,48℃预热5min。取2ml多聚半乳糖醛酸溶液加入1ml粗酶液,立即摇匀,48℃水浴中精确反应30min,与此同时,对照组加入1ml粗酶液,立即放入沸水中煮沸10min,冷却后加入2ml多聚半乳糖醛酸溶液。反应完毕后向管中加入2mldns,沸水浴中煮沸5min显色,再用冰水浴迅速冷却,测定od540。相对果胶酶活性以od540与od600的比值表示,每个实验组设置三个平行。实验结果如附图1所示,加入蛋白moml41后,pcc的相对果胶酶活性较对照组有明显的下降。
实施例13:重组表达菌株与pcc共培养对pcc果胶酶表达的抑制作用
将含有pet24-moml41的大肠杆菌接入加kana(5μg/ml)的lb培养基中,于28℃培养12-16h;与此同时,将pcc接入lb培养基中,28℃培养12-16h。培养后的pet24-moml41和pcc菌液用lb培养基分别稀释成1:1、1:10、1:100的菌液浓度比例,接入到加有iptg(0.5mm)的lb培养基中共培养。28℃培养12-16h后,用实施例1中的方法进行果胶酶的检测。共培养时moml41对果胶酶表达的影响如附图2所示,每一菌液浓度比例设置两个平行,从上到下pet24-moml41:pcc的浓度比例依次为1:1、1:10、1:100,随着菌液浓度比例的增加,果胶酶表达量降低,被果胶酶水解产生的还原性半乳糖醛酸减少,显色反应越不明显。
实施例14:用rt-pcr相对定量法检测moml41对果胶酶表达量的影响
对pcc的rna进行提取。在pcc被10μl纯化的重组蛋白moml41诱导后,在生长到对数生长期时进行rna的提取,与此同时,对照组不加蛋白moml41,以相同的方法进行rna提取,实验室细菌rna提取所用的是e.z.n.a.@bacterialrnakit。取1.5ml菌液于2mleppendorf管中,5000×g,4℃离心5-10min。弃上清,在沉淀中加入100μl溶菌酶,涡旋振荡30s后,于30℃金属浴中温育10min,并且每2min涡旋振荡30s。温育后,将350μl缓冲液brk和25-40mg玻璃研磨珠加入到离心管中涡旋振荡5min,再用离心机13000×g离心5min。取上清400μl于新的1.5mleppendorf管中,加入400μl70%乙醇,吸打混匀后加入到与2ml收集管组装的hibindrna微型柱中,10000×g离心30-60s,倒掉收集管中的液体。加300ulrna洗涤缓冲液ⅰ,10000×g室温离心30-60s,弃流穿液。更换新的2ml收集管,加500ulrna洗涤缓冲液ⅰ于hibindrna微型柱中10000×g离心30-60s,弃流穿液,再加500ulrna洗涤缓冲液ⅱ重复上述操作2次,最后一次离心后,倒掉收集管中的液体,将空收集管装回hibindrna微型柱,1000×g室温离心2min。将hibindrna微型柱装入新的1.5eppendorf管中,在柱中加入30-50μl经70℃预热的depc水,在室温下静置5min后10000×g离心1min。
在对pcc的rna进行反转录之前需要除去样品rna中的dna,去除dna实验室使用的是takaraprimescripttmrtreagentkit。反应体系如下(10μl反应体系):5×gdnaeraserbuffer2.0μl、gdnaeraser1.0μl、pccrna5μl、rnasefreeh202.0μl。反应条件为:42℃金属浴10min,反应完成后4℃保存。
使用takaraprimescripttmrtreagentkit将pcc的rna反转录为cdna。具体反应体系如下(20μl反应体系):上一步反应液10μl、primescriptrtenzymemixⅰ1.0μl、rtprimermix1.0μl、5×primescriptbuffer24.0μl、rnasefreeh204.0μl。反应条件为:37℃金属浴15min后,85℃反应5sec,4℃保存。
做realtimepcr时,除了样品的cdna,更重要的是用于evagreen法时的一对引物。果胶酶以多种形式存在(同功酶),从pcc基因组中找出4个与果胶酶相关的基因,利用生物学软件primer5.0进行上下游引物设计,并以16srrna作为参考基因进行rt-pcr。设计的4对引物分别为:pectatelyase(pel1)的上游引物(5’-gaatgccaaaaacagccacac-3’)和下游引物(5’-ggatttcagcgacatcaccaa-3’),pectatelyase1precursor(pelp1)的上游引物(5’-aagccatccacaccacacatc-3’)和下游引物(5’-gccagtttatccttcacgcac-3’),pectatelyaseprecursor(pelp2)的上游引物(5’-gcagtatgccaacaaccaga-3’)和下游引物(5’-ggataaataaccttccacca-3’),regulatorofpectinlyaseproduction(pnlr)的上游引物(5’-tatcctggcgtgcttctc-3’)和下游引物(5’-tcctcttttcgcattgtt-3’)。实验室用takaraprimescripttmrtreagentkit进行rt-pcr。反应体系如下(10μl反应体系):evagreen2×qpcrmastermix5μl、forwardprimer(10μm)0.3μl、reverseprimer(10μm)0.3μl、tamplatedna≤500ng/reaction、nuclease-freeh20将反应液补至10μl。扩增曲线的反应条件为:95℃预变性10min,95℃变性15sec,55℃退火30sec,72℃延伸30sec,共35个循环。反应数据结果出来后,将4个基因的ct值通过2–δδct(livak)法进行相对基因表达分析。分析结果如附图3所示,以实验组4个基因的变化量为1,对照组中除基因pnlr的表达量降低外,其他3个基因的表达量分别是实验组的2.4、1.2、2.6倍,推测pnlr的调控方式可能为负调控。
实施例15:含有有益菌lemoml与抑菌蛋白moml41的制剂配制与应用
将lemoml菌株接于lb培养基中培养,使菌液达到od1.0。将菌液稀释100倍后,取200微升与不同浓度的moml41蛋白混合,与处于对数生长期的pcc共培养,以pcc单菌培养作为对照,在28℃摇床培养6小时后,将实验组与对照组的菌液均稀释105倍进行涂板,28℃培养24小时后,对平板上的pcc单菌落进行查数,计算出实验组与对照组中pcc的存活率并比较研究。实验结果表明,moml41蛋白与菌株lemoml的混合制剂,具有明显加强的致病菌pcc的抑制效果,并且寻找到最有配比(表3)。
表3:含有有益菌与抑菌蛋白的制剂配制与作用分析
结果表明,工程菌lemoml不仅保留了产酶溶杆菌原有的生防活性,并且具有了基于群体感应淬灭活性的新型生防功能,并且额外添加了工程蛋白moml41,使该组合物最终具有了很好的广谱性抑菌活性。
sequencelisting
<110>中国海洋大学
<120>一种用于农作物病害防治的重组菌株
<130>
<160>5
<170>patentinversion3.5
<210>1
<211>331
<212>dna
<213>1
<400>1
cgatgcctttgtgccagatcgccagaccggaccgaaaggcgtcgggcctgaaagccctcc60
cactagagcccccagggtgaagagccctcccacaacagctccggggtccgcgggctctcc120
cagcgccgccggccggccccgcggaccgaccgctgtcaccgttccgatgcaggattcgtc180
gcggccccccttgaaagccgtccgaggcgccctatctccgaaccagtcccggcttgccgg240
gcgctttcgtccccggcattggcactcgccgggtgcgactgctaaaattcccgttcttta300
tccaccaattcaattacttacagaggtcgcc331
<210>2
<211>293
<212>prt
<213>2
<400>2
metasnmetlyslysleuleuvalleuleuleuvalvalglyalaphe
151015
sercyslysglnalalyslysglualaalaglusergluthralaval
202530
thrglualaalalysprogluilelysleutyralapheserglygly
354045
thrvalasnalaasnmetleugluleupheserglnaspthrthrtyr
505560
thrglyglnserlysgluphealaaspalaphetyrvalilevalhis
65707580
prolysglythrleumettrpaspalaglyleuprogluserleuval
859095
glyleuprogluprophethrserproaspglyalaphethrvalser
100105110
arglysaspservalalaasnglnleualaserileaspmetthrval
115120125
aspaspileasppheilealaleuserhisthrhispheasphisile
130135140
glyhisalaasnvalphealaglyserthrtrpleuvalglnglulys
145150155160
glutyraspphevalthrsergluaspasnglnlysserasnproasp
165170175
iletyrasnserilelysgluleuthrlysvallyslysileasngly
180185190
asptyraspvalpheglyaspglyservalvalmetlysphemetpro
195200205
glyhisthrproglyhisglnvalleutyrleuaspmetvalgluhis
210215220
glyproleumetleuserglyaspmettyrhisphetyrgluasnarg
225230235240
glupheargargvalproilepheasntyraspvalalaleuthrlys
245250255
lyssermetglyglupheglualaphealagluglulysglyalalys
260265270
valtyrleuglnhisserlysgluasppheglulysleuproglnala
275280285
proasntyrleugln
290
<210>3
<211>882
<212>dna
<213>3
<400>3
atgaatatgaaaaagctacttgtactactattggttgttggcgcattttcatgcaagcag60
gccaaaaaggaagctgcagaatcggaaacagcggtgaccgaggcagcaaaacccgagata120
aagctctatgcttttagcggaggtaccgtaaatgccaatatgttggagctcttttcacag180
gataccacgtacacgggtcagtccaaggaatttgccgatgctttttacgtcatcgttcac240
cccaagggcactttgatgtgggatgcaggtcttcccgaaagcttggtgggtcttccagag300
ccctttacatcacccgatggggcatttaccgtttcccgaaaagattccgtggccaaccaa360
ttggcaagtatcgacatgactgttgatgatattgattttatcgcattgtcccatacccat420
tttgatcatattggccatgcgaacgtgtttgcagggtccacgtggttggtacaggaaaag480
gaatacgactttgtgacaagcgaggacaaccaaaagagcaatccggacatctacaattcc540
attaaagagcttaccaaagtgaagaaaatcaatggggattacgatgtgttcggggatgga600
agtgtggtaatgaaatttatgccaggccatacccctggccatcaagtgttgtacttggat660
atggttgagcacggaccgttgatgctttctggggacatgtaccatttttacgagaaccgg720
gagttccgaagagtgcccatttttaattacgatgtggccctcaccaagaaaagtatggga780
gagtttgaagcttttgccgaagaaaaaggggcaaaagtgtatttgcaacactccaaggaa840
gattttgaaaaactgccccaggcacccaactatttacaataa882
<210>4
<211>253
<212>prt
<213>4
<400>4
lysleutyralapheserglyglythrvalasnalaasnmetleuglu
151015
leupheserglnaspthrthrtyrthrglyglnserlysglupheala
202530
aspalaphetyrvalilevalhisprolysglythrleumettrpasp
354045
alaglyleuprogluserleuvalglyleuprogluprophethrser
505560
proaspglyalaphethrvalserarglysaspservalalaasngln
65707580
leualaserileaspmetthrvalaspaspileasppheilealaleu
859095
serhisthrhispheasphisileglyhisalaasnvalphealagly
100105110
serthrtrpleuvalglnglulysglutyraspphevalthrserglu
115120125
aspasnglnlysserasnproaspiletyrasnserilelysgluleu
130135140
thrlysvallyslysileasnglyasptyraspvalpheglyaspgly
145150155160
servalvalmetlysphemetproglyhisthrproglyhisglnval
165170175
leutyrleuaspmetvalgluhisglyproleumetleuserglyasp
180185190
mettyrhisphetyrgluasnargglupheargargvalproilephe
195200205
asntyraspvalalaleuthrlyslyssermetglygluphegluala
210215220
phealagluglulysglyalalysvaltyrleuglnhisserlysglu
225230235240
asppheglulysleuproglnalaproasntyrleugln
245250
<210>5
<211>762
<212>dna
<213>5
<400>5
aagctctatgcttttagcggaggtaccgtaaatgccaatatgttggagctcttttcacag60
gataccacgtacacgggtcagtccaaggaatttgccgatgctttttacgtcatcgttcac120
cccaagggcactttgatgtgggatgcaggtcttcccgaaagcttggtgggtcttccagag180
ccctttacatcacccgatggggcatttaccgtttcccgaaaagattccgtggccaaccaa240
ttggcaagtatcgacatgactgttgatgatattgattttatcgcattgtcccatacccat300
tttgatcatattggccatgcgaacgtgtttgcagggtccacgtggttggtacaggaaaag360
gaatacgactttgtgacaagcgaggacaaccaaaagagcaatccggacatctacaattcc420
attaaagagcttaccaaagtgaagaaaatcaatggggattacgatgtgttcggggatgga480
agtgtggtaatgaaatttatgccaggccatacccctggccatcaagtgttgtacttggat540
atggttgagcacggaccgttgatgctttctggggacatgtaccatttttacgagaaccgg600
gagttccgaagagtgcccatttttaattacgatgtggccctcaccaagaaaagtatggga660
gagtttgaagcttttgccgaagaaaaaggggcaaaagtgtatttgcaacactccaaggaa720
gattttgaaaaactgccccaggcacccaactatttacaataa762
- 还没有人留言评论。精彩留言会获得点赞!