一株高产β‑苯乙醇的酿酒酵母菌株及其应用的制作方法
本发明涉及一株高产β-苯乙醇的酿酒酵母菌株及其应用,属于工业微生物技术领域。
背景技术:
β-苯乙醇是一种具有玫瑰风味的芳香醇,天然存在于茉莉、玫瑰等植物精油中,同时作为一种重要的香精香料成分,在化妆品、烟草及日化用品中也广泛应用。β-苯乙醇由微生物代谢产生,在黄酒、料酒、酿造食醋、酱油、白酒等发酵产品中含量较高,同时作为发酵产品中特征的风味物质,可以提高发酵产品风味和整体品质。
目前,工业合成β-苯乙醇过程中会存在难以去除的副产物,存在致癌风险,严重影响产品质量,虽然从天然植物中物理提取可以获得无毒无害、质量上乘的β-苯乙醇,用于食品或其他产品生产,但是生产周期长、产量低、价格高,难以满足市场需求。
通过微生物发酵能够提高发酵食品中β-苯乙醇含量,所获产品属于天然食品。酿酒酵母在发酵过程中通过艾利希途径和其他代谢途径产生β-苯乙醇,在黄酒等发酵食品中β-苯乙醇含量可以达到100mg/l左右,虽然浓度已经较高,但是进一步提高β-苯乙醇对于提升黄酒风味显著。
虽然目前已有能够显著提高微生物产β-苯乙醇能力的措施,但是绝大多数都需要外源添加l-苯丙氨酸等前体化合物。另外,少数非酿酒酵母类的酵母如库德里阿紫威毕赤酵母(pichiakudriavzevii)、马克斯克鲁维酵母(marxkluyveromyces)可以在不外源添加l-苯丙氨酸的情况下,产生一定浓度的β-苯乙醇,用于提高发酵食品中β-苯乙醇浓度,但是由于非酿酒酵母产乙醇能力较低,不能够作为主要菌株用于酒类及醋的酿造。rafael等(overproductionof2-phenylethanolbyindustrialyeaststoimproveorganolepticpropertiesofbakers'products,internationaljournaloffoodmicrobiology,2014,180(1):7-12.)中报道了一株高产β-苯乙醇面包酵母在烘焙食品中的应用,并未对所报酵母的产酒精特性做出报道,其所应用范围为烘焙食品。另外虽然有多个具有产生一定浓度的酿酒酵母应用于酿造食品的报道,但是菌株是否具有较高的酒精生产能力尚不清楚。由于β-苯乙醇对酵母的胁迫能力显著高于乙醇,高产β-苯乙醇的酿酒酵母产乙醇的能力通常会有降低,所以已有高产β-苯乙醇的酿酒酵母的酒精生产能力较低,因此在不外源添加前体化合物情况下,能够高产β-苯乙醇和乙醇的酿酒酵母在酿造工业中具有较高应用价值。
技术实现要素:
为了解决上述问题,本发明提供了一株不添加外源氨基酸而具有高产β-苯乙醇特性且产酒精特性良好的酿酒酵母菌株,及其在黄酒、料酒、酿造食醋、酱油、白酒中的应用。
本发明的第一个目的是提供一株高产β-苯乙醇的酿酒酵母菌株(saccharomycescerevisiae),于2016年12月26日保藏于中国典型培养物保藏中心,保藏地址为中国武汉武汉大学,保藏编号为cctccno:m2016785。
本发明所述酿酒酵母菌株是从黄酒醪液筛选出的酿酒酵母作为出发菌株,经紫外诱变后进行对氟苯丙氨酸抗性筛选,然后筛选长势良好的菌株接种在含有10%乙醇的ypd液体培养基中,进行酒精耐受性筛选以及黄酒模拟液发酵筛选,得到的β-苯乙醇产量相对较高的菌株作为常温等压等离子诱变出发菌株,对二次诱变后菌株进行对氟苯丙氨酸抗性筛选,以及发酵特性筛选,得到高产β-苯乙醇酿酒酵母。
本发明的酿酒酵母,具有如下特性:
(1)应用于黄酒发酵体系,发酵所得黄酒中β-苯乙醇含量可达410mg/l,乙酸-2-苯乙酯含量为56μg/l,酒精度14%(v/v);
(2)应用于料酒发酵体系,发酵所得料酒中β-苯乙醇含量可达450mg/l,乙酸-2-苯乙酯含量为50μg/l,酒精度13%(v/v);
(3)在酿造食醋发酵中的应用,使用本发明的酿酒酵母代替酒母,所得酒醪再经醋酸发酵,酿造食醋中β-苯乙醇含量为300mg/l,乙酸-2-苯乙酯含量为45μg/l;
(4)在酱油中的应用,将所述酿酒酵母接种于酱油发酵体系,发酵所得酱油中β-苯乙醇含量为200mg/l;
(5)在白酒中的应用,将所述酿酒酵母接种于白酒发酵体系,蒸馏白酒中β-苯乙醇含量为110mg/l,乙酸-2-苯乙酯含量为64μg/l,酒精度可达60%(v/v)。
(6)菌落为白色,圆形或者椭圆形,边缘整齐。
本发明的第二个目的是提供所述含有所述酿酒酵母cctccno:m2016785菌株的微生物菌剂。
在本发明的一种实施方式中,所述微生物菌剂含有酿酒酵母cctccno:m2016785菌体的活细胞、冷冻干燥得到的酿酒酵母cctccno:m2016785干菌体、固定化的酿酒酵母cctccno:m2016785细胞、酿酒酵母cctccno:m2016785的液体菌剂、酿酒酵母cctccno:m2016785的固体菌剂,或者以其他任何形式存在的酿酒酵母cctccno:m2016785菌株。
本发明的第三个目的是提供所述酿酒酵母菌株或者微生物菌剂的应用。
在一种实施方式中,所述应用是指用于酿造技术领域。
本发明的第四个目的是提供一种酿造食品,所述酿造食品是酿酒酵母cctccno:m2016785为发酵剂或者主要发酵剂发酵得到的。
在一种实施方式中,所述酿造食品为酒类、食醋或酱油。所述酒类包括但不限于黄酒、料酒、白酒等。
在一种实施方式中,所述酿造食品为黄酒,使用所述的酿酒酵母作为酒母。
在一种实施方式中,所述黄酒的酿造是将所述酿酒酵母作为酒母,按照5%-10%的添加量添加到蒸煮或糊化好的原料中,经发酵、压榨、煎酒、陈酿、过滤、灭菌灌装得到黄酒。
在一种实施方式中,所述黄酒的酿造具体是:先将所述酿酒酵母培养制备酒母,然后按照总体积4%加入麦曲、按总体积10%加入酒母到高温糊化好的糯米中,搅拌均匀,然后经发酵、压榨、煎酒、陈酿、过滤、灭菌灌装得到黄酒。
在一种实施方式中,所述酿造食品为料酒。
在一种实施方式中,所述料酒的酿造是先利用所述酿酒酵母作为酒母酿造得到黄酒,再利用得到的黄酒制备成料酒。
在一种实施方式中,所述酿造食品为食醋。
在一种实施方式中,所述食醋的酿造是先利用所述酿酒酵母作为酒母酿造得到黄酒,再利用得到的黄酒作为醋酸发酵原料来酿造食醋。
在一种实施方式中,所述食醋是采用固态发酵或者液态发酵的方法酿造。
在一种实施方式中,所述酿造食品为酱油。
在一种实施方式中,所述酱油的酿造是采用高盐稀态发酵或者低盐固态发酵制备酱油。
在一种实施方式中,所述高盐稀态发酵制备酱油具体是:将豆粕和小麦混匀蒸熟,接种米曲霉,加入盐水使酱醪含盐量为18%、含水量为65%,搅拌混匀;然后将培养好的cctccno:m2016785酵母接入部分蒸熟冷却后的豆粕和小麦中,加入清水,培养制成cctccno:m2016785酒母,等待加入酱醪中;当酱醅温度在发酵过程中升高到20℃时接入cctccno:m2016785酒母;发酵时间为5个月;发酵结束后的酱醪经过压榨、过滤、澄清,得到酱油。
一种实施方式中,所述低盐固态发酵制备酱油具体是:豆粕和小麦混匀蒸熟,接种米曲霉量,加入盐水使酱醪含盐量为7%、含水量为40%,搅拌混匀;然后将培养好的cctccno:m2016785酵母接入部分蒸熟冷却后的豆粕和小麦中,加入清水,培养制成cctccno:m2016785酒母,接入酱醪发酵体系,品温控制在40℃;发酵时间为15d;发酵结束后的酱醪去除杂质和沉淀、过滤澄清得到酱油。
一种实施方式中,所述酿造食品为白酒。
一种实施方式中,所述白酒的酿造,是在白酒发酵入池发酵时额外添加所述酿酒酵母。
一种实施方式中,所述白酒酿造时酿酒酵母额外添加量为1%。
本发明的优点和效果:
(1)本发明获得了一株不添加外源氨基酸而具有高产β-苯乙醇特性且产酒精特性良好的酿酒酵母菌株。
(2)本发明的酿酒酵母菌株可以用于黄酒、料酒、食醋、酱油、白酒的酿造;应用于这些产品的酿造时,不仅可以产生高浓度的β-苯乙醇、具有较高的酒精生产能力,而且可有效提高其他风味成分或者有益成分的含量,比如乙酸-2-苯乙酯、甘油的含量。
生物材料保藏
一株酿酒酵母菌株,分类学命名为酿酒酵母byc3saccharomycescerevisiaebyc3,于2016年12月26日保藏于中国典型培养物保藏中心,保藏地址为中国武汉武汉大学,保藏编号为cctccno:m2016785。
附图说明
图1是实施例1中出发酵母菌株生长曲线;
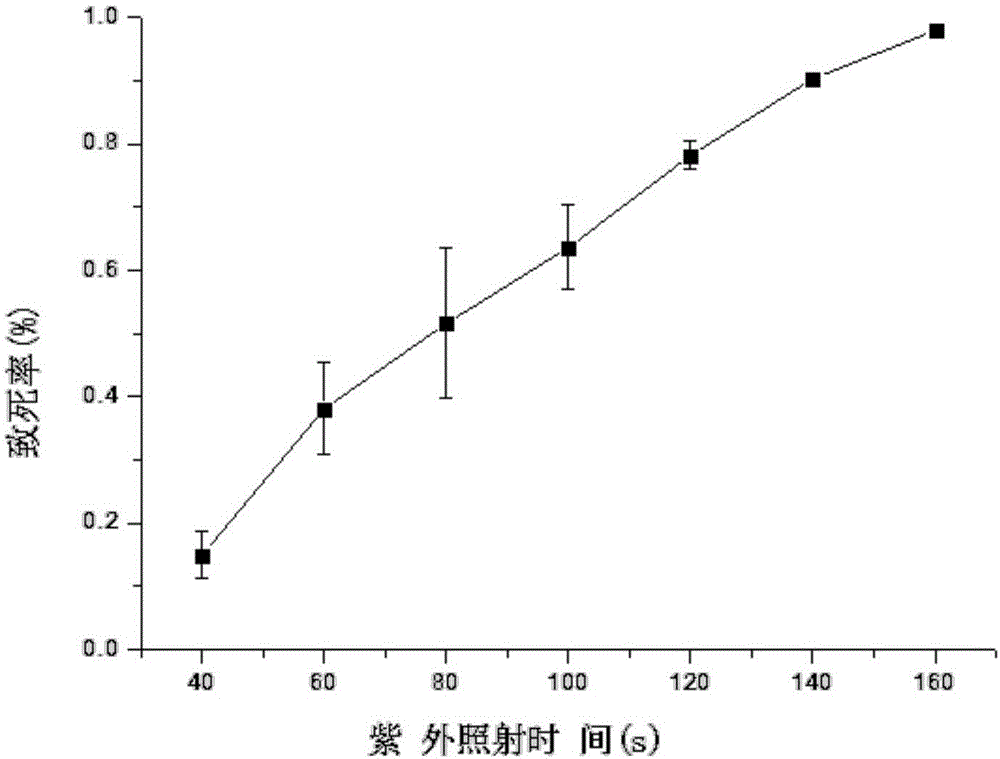
图2是实施例1中出发酵母菌株紫外照射致死率曲线;
图3是实施例1中出发菌株对氟苯丙氨酸致死率曲线;
图4是实施例2中黄酒发酵酒精度变化曲线;
图5是实施例2中黄酒发酵酸度变化曲线;
图6是实施例2中黄酒发酵ph变化曲线;
图7是实施例2中byc3酿酒酵母菌落形态;
图8是实施例2中酿酒酵母菌株在ypd中β-苯乙醇产量。
具体实施方案
下面是对本发明进行具体描述。
实施例1:紫外诱变与筛选
ypd液体培养基:酵母提取物10g/l、鱼粉蛋白胨20g/l、葡萄糖20g/l。
ypd固体培养基:酵母提取物10g/l、鱼粉蛋白胨20g/l、葡萄糖20g/l,营养琼脂20g/l。
1、诱变出发菌株的获得
(1)从甘油保藏管中取由本实验室从黄酒醪液筛选的酿酒酵母菌液200ul,涂布ypd平板,30℃培养24h。
(2)用接种环挑取单菌落到含100mlypd液体培养基的摇瓶,30℃、200r/min培养24h。
(3)取5ml所得菌液,接种到含100mlypd液体培养基的摇瓶,30℃、200r/min培养,每隔1h测定菌液的od600,酵母指数增长期结束后每隔3h测定od600,每次取三个样品。绘制生长曲线,确定出发菌株指数增长中期时间即是紫外诱变开始时间,此时的菌株即为诱变出发菌株。
实验结果如附图1中所示:培养到3-5h时酵母od600值增长显著,此时酵母生长处于指数生长期,而摇床培养4h时野生菌株处于指数生长中期。因此选择摇床培养4h的酵母作为诱变出发菌株。
2、紫外诱变时间的确定
(1)如步骤1,获得诱变出发酵母菌株菌液。
(2)取10ml诱变出发菌株菌悬液,6000r/min离心5min后去上清,加入50ml生理盐水震荡混匀,6000r/min离心5min后去上清,加入50ml生理盐水震荡混匀得到菌悬液。
(3)紫外线照射:先将紫外灯打开预热20min,以稳定光波。用5ml无菌移液管移取上述菌悬液4.5ml于无菌的直径为9cm的培养皿中,培养皿中加入无菌大头针。将装有菌悬液的培养皿放置于磁力搅拌器上,垂直放置于紫外灯下,照射20s,黑暗条件下打开皿盖(确保紫外灯照射均匀),暴露紫外光下照射(15w紫外灯,距离30cm),时间为40s、60s、80s、100s、120s。
(4)照射完毕后,在红光灯下或者黑暗条件下,将诱变后的酵母菌悬液以10倍稀释法稀释4个梯度10-1、10-2、10-3、10-4,每个梯度各取200μl涂布ypd平板,用锡纸包好以避光。每个照射时间下三个平行,30℃培养48h。
(5)未经诱变的酵母菌悬液以10倍稀释法稀释5个梯度10-1、10-2、10-3、10-4、10-5,每个梯度各取200μl涂布ypd平板,作为对照。对照组做三个平行,30℃培养48h。
(6)平板计数,记录表格,计算致死率,绘制致死率曲线。分别确定紫外致死率为70%-80%、80%-90%、90%-100%时紫外照射时间。致死率=(对照组菌落数一诱变组菌落数)/对照组菌落数。
实验结果:诱变出发菌株进行紫外诱变,涂布不同浓度梯度菌悬液到ypd平板,根据生长菌落数,绘制致死率曲线,结果如附图2。根据致死率曲线图,致死率70-80%、80-90%、90-100%时照射时间分别为110s、130s、150s。
3、对氟苯丙氨酸最低全部致死浓度的确定
ynbp固体培养基:6.7%ynb、20g/l葡萄糖、10g/l脯氨酸,额外的加入对氟苯丙氨酸,浓度分别为0(对照组)、0.04g/l、0.05g/l、0.06g/l、0.07g/l、0.08g/l、0.09g/l、0.1g/l。
(1)指数增长中期菌悬液,10倍稀释法稀释4个梯度10-1、10-2、10-3、10-4,取10-4梯度菌悬液200μl涂布ynbp平板。
(2)30℃培养48-72h。记录菌落数,绘制对氟苯丙氨酸致死率曲线。
致死率=(对照组菌落数一诱变组菌落数)/对照组菌落数
实验结果:对氟苯丙氨酸致死率曲线如附图3,随着ynbp平板上对氟苯丙氨酸浓度的增加,酵母致死率不断增加,对氟苯丙氨酸浓度增加到0.09g/l时酵母全部致死,因此对氟苯丙氨酸最低全部致死浓度确定为0.09g/l。
4、紫外诱变
如步骤2获得紫外诱变出发菌株并对其进行紫外照射,紫外诱变总时间分别为110s、130s、150s。
5、对氟苯丙氨酸抗性筛选和酒精耐受性筛选
(1)对氟苯丙氨酸抗性筛选
对氟苯丙氨酸抗性筛选培养基配方:6.7%ynb、20g/l葡萄糖、10g/l脯氨酸、对氟苯丙氨酸0.09g/l,营养琼脂20g/l。
分别取紫外诱变菌悬液200μl涂布到对氟苯丙氨酸抗性筛选平板,用锡纸包好以避光。每个致死率下做3个平板,30℃培养72h。
(2)酒精耐受性筛选
酒精筛选培养基配方:酵母提取物10g/l、鱼粉蛋白胨20g/l、葡萄糖20g/l,无菌乙醇10%。
1)96孔板每孔加入20μlypd液体培养基,将对氟苯丙氨酸抗性筛选后的突变菌株分别接种到孔中,30℃培养24h。
2)96孔板每孔加入200μl酒精筛选培养基,将上一步每孔的种子液按5%接种到此孔板,30℃静止培养。分别在12h和24h用酶标仪测定od600。
3)计算od60012h、od60024h以及od60024h-od60012h值,挑选数值相对较高的诱变酵母菌共计22株。
6、黄酒模拟液发酵筛选
黄酒模拟液的制备:1kg蒸熟米饭(含水率为70%)中加入水1l、麦曲0.05kg,搅拌均匀,60℃保温8h,4500r/min离心5min,取上清液115℃灭菌15min。
(1)将22株突变菌株,分别划线到ypd平板上,30℃培养24h。
(2)分别挑取单菌落,接种到含有10mlypd的50ml离心管中,30℃、200r/min培养12h。
(3)移取5%菌液,接种到含有20ml黄酒模拟液的50离心管中,30℃,静止发酵7d,每组三个平行。
(4)高效液相色谱法测定黄酒模拟液中β-苯乙醇含量,筛选β-苯乙醇含量相对较高的菌株。
高效液相色谱分析:
1)将2ml样品放入2ml离心管中离心去除菌体,离心条件为12000rpm、1min。
2)取上清液1ml过0.22μm水系膜,移入液相进样瓶中备用。
3)选用x-bridgec18柱,流动相为甲醇:纯水=1:1,在30℃条件下以1ml/min的流速进样,进样量为10ul。
高效液相色谱测定黄酒模拟发酵液中β-苯乙醇含量,1-e4突变菌株的β-苯乙醇平均含量相对较高为185.032mg/l(如表1所示),产酒精能力优良,因此将此菌株作为下一轮常温等压等离子诱变的出发菌株。
表1紫外诱变后黄酒模拟发酵液中β-苯乙醇含量
实施例2:常温等压等离子诱变与筛选
1、常温等压等离子诱变与黄酒模拟液发酵筛选
第一轮紫外诱变后所选菌株1-e4作为常温等压等离子诱变出发菌株。1-e4菌株ypd摇瓶30℃培养24h,用生理盐水制成od600为0.6-0.8的菌悬液,进行常温等压等离子诱变,诱变时间为60s,功率为100w,将诱变后菌株重悬成菌液,稀释涂布于ypd平板,30℃培养48h,将单菌落划线到ynbp平板(对氟苯丙氨酸浓度为0.5g/l),ynbp平板长势良好菌株进行黄酒模拟液发酵筛选。高效液相色谱法测定黄酒模拟液中β-苯乙醇含量,筛选β-苯乙醇含量相对较高的菌株。
高效液相色谱法测定发酵8d后的黄酒模拟发酵液中β-苯乙醇含量。3-c10、4-c7、5-f5突变菌株β-苯乙醇平均含量相对较高,分别为217.192mg/l、257.388mg/l、337.168mg/l,将该三株菌株分别命名为byc1、byc2、byc3。酿酒酵母β-苯乙醇产量增加,虽然诱变后酿酒酵母乙醇产量略有下降,但是所得酿酒酵母仍可良好进行酒精发酵。
表2常温等压等离子诱变黄酒模拟发酵液中β-苯乙醇含量
2、黄酒发酵筛选
酒母制备:50mlypd摇瓶接种酵母菌株,30℃、200r/min培养24h。1kg蒸熟米饭(含水率为70%)中加入水1l、麦曲0.05kg,搅拌均匀,60℃保温4h,冷却后按5%接种酵母菌液,30℃、200r/min培养16h。
(1)配料
蒸熟米饭(含水率为70%)加入等重量清水,2%麦曲、5%酒母,搅拌均匀。
(2)发酵与搅拌
发酵温度为28℃,在配料完成后18h、24h、30h、42h、54h、78h,126h搅拌并取样。5000r/min离心10min得到上清液样品,用于指标检测。
(3)指标检测
18h、24h、30h、42h、54h、78h、126h时所取样品测定其总酸(以乳酸计)、酒精度、ph,观察三项指标变化情况,并用高效液相色谱法测定126h时样品中β-苯乙醇含量。
用本轮诱变出发菌株和三株筛选后突变酵母菌株发酵黄酒,产酒精能力结果如图4:三株正突变菌株和出发菌株相比,产酒精性能基本没有差别,酒精度达13%-15%(v/v),酒精发酵良好。三株酵母在前60h时酒精发酵迅速,在60h后酒精含量基本稳定。酸度变化结果如图5:三株突变酵母发酵黄酒酸度在3-4g/l之间,随着发酵进行酸度略显上升且趋于平缓。ph变化如图6:ph在3-4.5之间,酿酒酵母可以良好的进行酒精发酵。
黄酒发酵液中β-苯乙醇含量如下表3所示,用byc1、byc2、byc3菌株发酵黄酒,β-苯乙醇含量为219.08、254.91、365.70mg/l,出发菌株发酵黄酒β-苯乙醇产量仅为188.07mg/l,三株菌株β-苯乙醇产量分别为出发菌株的1.16倍、1.35倍、1.94倍,有良好的高产β-苯乙醇能力。
表3常温等压等离子诱变黄酒发酵液中β-苯乙醇含量
黄酒发酵液中异丁醇、异戊醇、乙酸-2-苯乙酯、甘油作为风味物质,可以提高黄酒整体质量,其含量见表4,通过比较,byc3菌株的乙酸-2-苯乙酯以及甘油含量明显高于出发菌株以及byc1及byc2。
表4黄酒发酵液中异丁醇、异戊醇、乙酸-2-苯乙酯、甘油含量表
综上比较结果,byc3的β-苯乙醇产量高,且异丁醇、异戊醇、乙酸-2-苯乙酯含量也较高。byc3菌株划线到ypd固体培养基平板,30℃培养24h,菌落形态如图7。将byc3菌株于保藏于中国典型培养物保藏中心,保藏编号为cctccno:m2016785。将byc3菌株接种于黄酒发酵体系,酒精发酵性能良好,所得黄酒中β-苯乙醇含量为365.70mg/l。
3、高产β-苯乙醇酵母菌株验证性实验
用byc3菌株、商业酵母菌株、野生酵母菌株进行对比发酵实验。三株菌株用ypd平板活化后接入ypd摇瓶,再分别按5%依次接入ypd摇瓶、ypd摇瓶(加入1g/l苯丙氨酸的)。
实验结果如附图8,酿酒酵母菌株byc3的β-苯乙醇产量明显高于商业酵母菌株和野生酵母菌株,byc3酵母在ypd培养基中β-苯乙醇产量达31.6mg/l,是添加1g/l苯丙氨酸的ypd培养基的50.9%(而商业酵母为27%、野生酵母为22%左右),酵母byc3高产β-苯乙醇性能得到验证。
实施例3:高产β-苯乙醇酵母在黄酒中的应用
1、黄酒酿造工艺一
(1)酒母制作:50mlypd摇瓶接种酵母菌株,30℃、200r/min培养24h。1kg蒸熟米饭(含水率为70%)中加入水1l、麦曲0.05kg,搅拌均匀,60℃保温4h,冷却后按5%接种酵母菌液,30℃、200r/min培养16h;酵母选用高产β-苯乙醇酿酒酵母byc3(即cctccno:m2016785)。
(2)蒸熟米饭(含水率为70%),加入等重量清水,2%麦曲、5%酒母,搅拌均匀。
(3)发酵与搅拌:发酵温度为28℃,落料完成后开始计时,每隔8h进行搅拌,至48h时共搅拌6次。发酵5-7天,检测酒精度指标不再升高时结束发酵。
(4)压榨:发酵结束后,发酵醪液过板框过滤机进行压榨得到清酒。
(5)煎酒:清酒过煎酒灭菌机85℃灭菌30min。
(6)陈酿:煎酒后清酒入陈酿罐陈酿6个月。
(7)过滤:陈酿后清酒用硅藻土过滤机和膜过滤机过滤除去杂菌及杂质。
(8)灭菌灌装:过灭菌机,85℃灭菌30min,热灌装。
所得产品用高效液相法检测β-苯乙醇含量高达152mg/l,酒精度为12%(v/v),乙酸乙酯含量为12mg/l,乙酸-2-苯乙酯含量为22μg/l。
2、黄酒酿造工艺二
(1)酒母制作:如本实施例上述工艺一。
(2)糯米粉碎,加入糯米质量2.5倍的清水,高温淀粉酶110℃高温糊化40min,降温到35℃加入糖化酶糖化40min,降温到28℃,按总体积4%加入麦曲、按总体积10%加入酒母,搅拌均匀。
(3)其余步骤如本实施例的工艺一所述。
所得产品用高效液相法检测β-苯乙醇含量高达410mg/l,酒精度为14%(v/v),乙酸乙酯含量为24mg/l,乙酸-2-苯乙酯含量为56μg/l。
实施例4:高产β-苯乙醇酵母在料酒中的应用
1、料酒酿造工艺一
按实施例3中酿造工艺一获得黄酒,加入食盐10%,过灭菌机85℃灭菌30min热灌装。β-苯乙醇含量高达140mg/l,酒精度为10%(v/v),乙酸乙酯含量为10mg/l,乙酸-2-苯乙酯含量为20μg/l。
2、黄酒酿造工艺二
按实施例3中酿造工艺二获得黄酒,加入食盐10%,过煎酒灭菌机85℃灭菌30min热灌装。
所得产品用高效液相法检测β-苯乙醇含量高达450mg/l,酒精度为13%(v/v),乙酸乙酯含量为20mg/l,乙酸-2-苯乙酯含量为50μg/l。
实施例5:高产β-苯乙醇酵母在酿造食醋固态发酵中的应用
以实施例3中工艺二发酵黄酒,作为醋酸发酵原料。
醋酸发酵采用固态发酵工艺:将大糠、麸皮、黄酒按照1:4:10的比例拌匀,接入5%醋醅,接种后1-2天内每天从物料表面翻醅,温度为35-40℃。到6-8天时翻到物料底部。第8-12天,每天从底部翻醅,温度自然下降。从醋醅中分离后得生醋,在经过85℃灭菌30min后陈酿12个月。在灌装前经过高温灭菌后热灌装。
所得固态发酵酿造食醋中醋酸含量为60g/l,β-苯乙醇含量高达300mg/l,乙酸-2-苯乙酯含量为45μg/l。
实施例6:高产β-苯乙醇酵母在酿造食醋液态发酵中的应用
以实施例3中工艺二发酵黄酒,作为醋酸发酵原料。
醋酸发酵采用液态发酵工艺:将黄酒用清水稀释4倍后,接入5%培养好的醋酸菌菌液,通氧1l/min并进行搅拌,待发酵体系中酒精含量少于1%时,分批次加入黄酒,醋酸发酵体系中酒精含量控制在为1%-4%,发酵体系中醋酸含量约80g/l时离心分离,得到液态食醋。经过高温灭菌后热灌装。所得液态发酵酿造食醋中β-苯乙醇含量达100mg/l,乙酸-2-苯乙酯含量为36μg/l。
实施例7:高产β-苯乙醇酵母在酿造酱油高盐稀态发酵中的应用
酿造酱油选用高盐稀态法发酵,豆粕和小麦按1:1比例混匀蒸熟。米曲霉接种量为10%,控制温度为30℃,加入2倍物料质量的盐水,酱醪含盐量为18%、含水量为65%,搅拌混匀。byc3酵母用ypd摇瓶培养,按5%接种量接入部分蒸熟冷却后的豆粕和小麦中,加入2倍体积清水,30℃、200r/min培养24h制成byc3酒母,等待加入酱醪中。酱醅起始发酵温度为15℃,随着发酵进行温度升高为15-35℃,在温度升高到20℃时接入byc3酒母。发酵时间为5个月。
发酵结束后的酱醪经过板框压榨,去除酱醅。压榨结束后进行硅藻土过滤和膜过滤,去除沉淀。过滤澄清的酱油经过85℃灭菌30min热灌装。高产β-苯乙醇酵母用于高盐稀态法发酵,所得酱油产品中含有β-苯乙醇200mg/l。
实施例8:高产β-苯乙醇酵母在酿造酱油低盐固态发酵中的应用
酿造酱油选用低盐固态发酵,豆粕和小麦按1:1比例混匀蒸熟。米曲霉接种量为10%,控制温度为30℃,加入2倍物料质量的盐水,酱醪含盐量为7%、含水量为40%,搅拌混匀。byc3酵母用ypd摇瓶培养,按5%接种量接入部分蒸熟冷却后的豆粕和小麦中,加入1倍体积的清水,30℃、200r/min培养24h,制成byc3酒母接入酱醪发酵体系,品温控制在40℃。发酵时间为15d。
发酵结束后的酱醪去除杂质和沉淀。过滤澄清的酱油经过85℃灭菌30min热灌装。高产β-苯乙醇酵母用于高盐稀态法发酵,所得酱油产品中含有β-苯乙醇50mg/l。
实施例9:高产β-苯乙醇酵母在白酒中的应用
1、白酒酿造工艺一
采用两轮发酵法,第一轮发酵时高粱蒸熟后,风冷降温至28℃,添加4%米曲霉,28℃培养24h。添加稻壳10%、曲15%、麸皮8%、按1%接入ypd摇瓶培养的byc3酵母,密闭发酵30天后蒸酒。二次发酵时添加中温大曲10%、按1%接入ypd摇瓶培养的byc3酵母,发酵15天后蒸酒。两种酒勾兑成酒精度60%(v/v),β-苯乙醇含量为110mg/l,乙酸-2-苯乙酯含量为64μg/l。
2、白酒酿造工艺二
高粱40%、小麦10%、玉米5%、大米25%、糯米20%蒸熟后,风冷后温度25℃,大糠使用量20%、曲20%、水分30%,按1%接入ypd摇瓶培养的byc3酵母。温度在20℃,湿度在70%,发酵60天,蒸馏获得38%白酒。β-苯乙醇含量为50mg/l,乙酸-2-苯乙酯含量为26μg/l。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!