皱纹盘鲍硫氧还蛋白过氧化酶及其制备方法和应用与流程
本发明涉及酶及其编码的基因与应用,特别涉及一种皱纹盘鲍的基因工程表达,具体涉及一种皱纹盘鲍硫氧还蛋白过氧化酶(tpx)及其制备方法和应用。
背景技术:
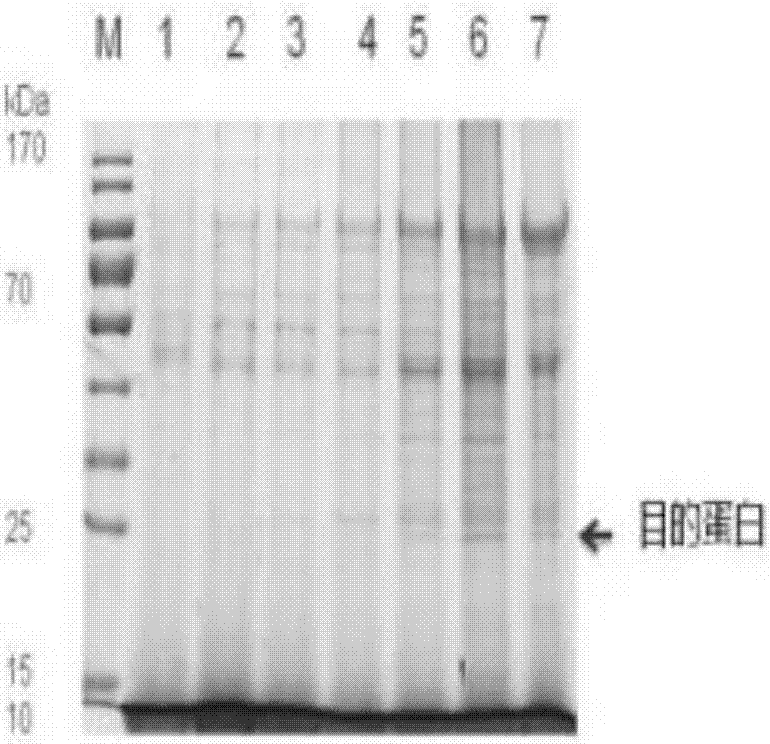
:硫氧还蛋白过氧化酶(thioredoxinperoxidase,tpx)是过氧化物还原酶家族的一员,是过氧化物酶超家族的新成员,广泛存在于自然界中,能够清除体内的多种自由基,维持体内环境平衡。硫氧还蛋白过氧化酶中tpx1、tpx2、tpx6均位于胞浆中;tpx3存在于线粒体;tpx4位于内质网和细胞外基质;tpx5则分布在过氧化物酶体内。其含有一个或者二个半胱氨酸残基,其主要分为六种类型:前五种同工酶均含有二个半胱氨酸残基,第六种同工酶则含有一个半胱氨酸残基。具有相同数量的半胱氨酸残基,它们的同源性较高。在体内参与细胞的许多生理生化反应:作为细胞传递的信号、对细胞增殖和分化起调控作用等。而且由于tpx2天然的抗氧化性能,可用于开发抗氧化性食品、医药制备等领域。皱纹盘鲍(h.discushannaiino)隶属于软体动物门(mollusca)、腹足纲(gastropoda)、前鳃亚纲(prosobranchia)、原始腹足目(archaeogastropoda)、鲍科(haliotidae),以其丰富的营养价值在民间一直被认为是与鱼翅、燕窝齐名的营养食品。目前,已有的对鲍药用及食用价值的研究主要集中在多肽与多糖的提取制备及其生物活性研究。海洋生物因其特殊的生活环境和代谢方式,体内存在许多具有药用价值的特殊生理活性物质,是开发新型海洋药物和功能食品的重要资源。福建省皱纹盘鲍资源丰富、产量大,至2013年,鲍产量达到88470t,所占比例超过全国产量的80%。鲍产业已成为福建省海水养殖的支柱产业之一,也是水产业增长速度最快、经济效益最好的产业。如何充分高效地利用鲍资源,挖掘其中的生物活性物质往保健食品和海洋药物方向高值化利用,符合我省和我国当今新兴的海洋战略发展研究。对于硫氧还蛋白过氧化酶的直接分离提取工艺相对复杂;而化学合成成本过高且难以保持其天然结构。基因工程以及蛋白质工程的应用为获得天然活性肽开辟了有效途径。基因工程制备生物活性肽克服了直接从动、植物原料中提取抗氧化蛋白筛选的盲目性,纯化工艺简单,便于规模化生产,具有很好的产业化前景。技术实现要素:本发明的目的在于提供皱纹盘鲍硫氧还蛋白过氧化酶hdhtpx2的制备方法以其在制备食品、医药和化妆品等领域的应用。具体而言,本发明提供了如下技术方案:第一方面,本发明提供了一种编码皱纹盘鲍硫氧还蛋白过氧化酶的基因,含有seqidno.1所述的碱基序列或者含有编码如下蛋白质(a)或(b)的基因:(a)由seqidno.2所示的氨基酸序列组成的蛋白质;(b)在(a)限定的氨基酸序列中经过取代、缺失或添加一个或几个氨基酸且具有硫氧还蛋白过氧化酶活性的由(a)衍生的蛋白质。优选的,根据以上所述的基因,其中用于所述基因扩增的引物如seqidno.3和seqidno.4所示。第二方面,本发明还提供了一种皱纹盘鲍硫氧还蛋白过氧化酶,含有以上所述的编码超氧化物歧化酶的基因所编码。第三方面,本发明提供了一种表达皱纹盘鲍硫氧还蛋白过氧化酶基因的载体,所述载体为含有以上所述的硫氧还蛋白过氧化酶基因、aox1启动子和终止子序列、多克隆位点以及筛选标志的毕赤酵母表达载体,所述毕赤酵母表达载体优选为ppic9k。优选的,根据以上所述的载体,所述硫氧还蛋白过氧化酶基因位于毕赤酵母表达载体ppic9k的多克隆位点处snabⅰ和notⅰ限制性内切酶酶切位点之间。优选的,根据以上所述的载体,所述筛选标志为6×his-tag标签。本发明还提供了一种皱纹盘鲍硫氧还蛋白过氧化酶制备方法,包括以下步骤:(1)构建含有编码皱纹盘鲍硫氧还蛋白过氧化酶的基因的重组表达载体;(2)将步骤(1)所得重组表达载体导入宿主细胞,并将宿主细胞进行诱导表达,获得可表达皱纹盘鲍硫氧还蛋白过氧化酶的基因工程菌菌株;(3)发酵培养已得到的基因工程菌菌株并进行诱导表达,获得表达产物;(4)分离纯化步骤(3)所得的表达产物,获得重组蛋白,皱纹盘鲍硫氧还蛋白过氧化酶;其中,步骤(1)中所述编码皱纹盘鲍硫氧还蛋白过氧化酶的基因,含有seqidno.1所述的碱基序列或者含有编码如下蛋白质(a)或(b)的基因:(a)由seqidno.2所示的氨基酸序列组成的蛋白质;(b)在(a)限定的氨基酸序列中经过取代、缺失或添加一个或几个氨基酸且具有硫氧还蛋白过氧化酶活性的由(a)衍生的蛋白质。优选的,根据以上所述的制备方法,其中步骤(1)中,所述表达载体为毕赤酵母表达载体,优选为ppic9k。优选的,根据以上所述的制备方法,其中步骤(2)中,所述宿主细胞为毕赤酵母gs115菌株。另外,本发明还提供了以上所述的皱纹盘鲍硫氧还蛋白过氧化酶在食品添加剂、药物制备领域、保健品领域或者化妆品领域中的应用。优选的,根据以上所述的应用,其中所述食品添加剂为动物饲料添加剂,所述皱纹盘鲍硫氧还蛋白过氧化酶和动物血液的溶血率小于10%。优选的,根据以上所述的应用,其中所述皱纹盘鲍硫氧还蛋白过氧化酶能够保护和修复过氧化氢引起的细胞损伤。本发明所取得的有益效果是:本发明借助基因工程技术,利用ppic9k毕赤酵母表达载体,成功高效得在体外表达了可溶的、易纯化分离的、具有抗氧化活性的皱纹盘鲍hdhtpx2蛋白,该重组蛋白具有很强的清除超氧阴离子自由基、羟自由基等活性。皱纹盘鲍hdhtpx2的基因工程表达产品将在制备食品、医药和化妆品等领域中发挥其应用价值。附图说明图1为pcr扩增hdhtpx2目的基因片段。m为dnamarkerdl2000,其中标号1为hdhtpx2目的基因pcr产物,bp代表碱基。图2为sds-page电泳分析ppic9k-hdhtpx2重组载体转化毕赤酵母gs115菌株后,hdhtpx2蛋白的诱导表达图,其中m为预染蛋白marker26616,标号1-7为重组表达载体ppic9k-hdhtpx2转化毕赤酵母后,甲醇诱导0h,6h,12h,24h,48h,72h,96h不同时间蛋白表达产物。图3为sds-page电泳分析不同甲醇浓度诱导下hdhtpx2蛋白的表达图,其中m为预染蛋白marker26616,标号1-4分别为0.5%体积、1%体积、2%体积、3%体积甲醇浓度诱导下hdhtpx2蛋白的表达条带。图4为不同ph条件下hdhtpx2的表达图,其中m为预染蛋白marker26616,标号1-5分别ph为4,5,6,7,8时hdhtpx2蛋白的表达条带。图5为sds-page电泳分析纯化前后hdhtpx2的表达图,其中m为预染蛋白marker26614,1为纯化前hdhtpx2蛋白的表达条带,2为纯化后hdhtpx2蛋白的表达条带。图6为不同浓度的hdhtpx2蛋白清除羟自由基能力测定结果图。图7为不同浓度的维生素c(vc)清除羟自由基能力测定结果图。图8为l929细胞在不同浓度的hdhtpx2蛋白处理下的细胞存活率图。图9为l02细胞在不同浓度的hdhtpx2蛋白处理下的细胞存活率图。图10为马血在不同浓度的hdhtpx2蛋白处理下的溶血率图。图11为l929细胞在不同浓度的过氧化氢处理的hdhtpx2蛋白作用下的细胞存活率图。图12为l02细胞在不同浓度的过氧化氢处理的hdhtpx2蛋白作用下的细胞存活率图。图13为本发明构建的ppic9k-hdhtpx2重组表达载体图。具体实施方式如上所述,本发明的目的在于提供一种皱纹盘鲍硫氧还蛋白过氧化酶,其可以在体外表达,而且易于分离纯化,具有很强的清除超氧阴离子自由基、羟自由基等活性,而且具有细胞安全性和损伤修复和保护功能,可以用作食品添加剂、药物制备以及化妆品或者保健品等领域。本发明通过借助基因工程技术,提供了一种编码皱纹盘鲍硫氧还蛋白过氧化酶的基因,含有seqidno.1所述的碱基序列或者含有编码如下蛋白质(a)或(b)的基因:(a)由seqidno.2所示的氨基酸序列组成的蛋白质;(b)在(a)限定的氨基酸序列中经过取代、缺失或添加一个或几个氨基酸且具有硫氧还蛋白过氧化酶活性的由(a)衍生的蛋白质。本发明所述的皱纹盘鲍硫氧还蛋白过氧化酶包括在seqidno.2所示的氨基酸基础上,进行一个或者几个,优选10个以内的氨基酸的取代、缺失或者增加,本领域技术人员应该知晓,几个氨基酸的取代、缺失或者增加并不影响蛋白质整体的功能。在本发明的一种优选实施方式中,所述皱纹盘鲍硫氧还蛋白过氧化酶,具有seqidno.2所示的氨基酸序列。本发明借助基因工程手段,提供了一种皱纹盘鲍硫氧还蛋白过氧化酶的制备方法,具体通过借助毕赤酵母表达载体,将编码皱纹盘鲍硫氧还蛋白过氧化酶的基因构建到该载体中,然后导入宿主细胞,筛选可以表达皱纹盘鲍硫氧还蛋白过氧化酶的工程菌菌株,然后进行发酵培养,并进行诱导表达,纯化后得到该蛋白。本发明所构建的真核重组表达载体ppic9k-hdhtpx2如图12所示,其特点是采用aox1启动子,酵母信号肽α-factor因子引导目的蛋白hdhtpx2的分泌表达,并在c端带有6×his-tag便于亲和层析纯化目的蛋白。其中,在本发明的一种优选实施方式中,所述皱纹盘鲍硫氧还蛋白过氧化酶的制备方法,包括以下步骤:(1):构建皱纹盘鲍hdhtpx2的毕赤酵母表达载体;(2):将步骤(1)所得毕赤酵母表达载体导入宿主细胞,并将宿主细胞进行诱导表达,获得可表达hdhtpx2的基因工程菌菌株;(3):发酵培养已得到的基因工程菌菌株并进行诱导表达,获得表达产物;(4):分离纯化步骤(3)所得的表达产物,获得重组蛋白,即hdhtpx2。其中,在一种优选实施方式中,步骤(4)中分离纯化为先将表达产物透析后,再进行亲和层析。以下通过实施例结合附图详细说明本发明的技术方案。本领域技术人员应该知晓的,这些实施例仅用来说明本发明,而不应看做是对本发明保护范围的限制。本领域技术人员在本发明的基础上,可以进行常规手段置换,或者在本发明所构建的编码皱纹盘鲍硫氧还蛋白过氧化酶基因的基础上,进行基因的添加的取代、缺失或者添加等,并不影响或者基本不影响所表达的硫氧还蛋白过氧化酶的蛋白活性。本发明实施例中所用到的试剂或者仪器,均为本领域技术人员常用的试剂或者仪器。本发明所用到的方法为分子生物学领域的常规方法。其中,实验过程中用到的仪器和设备如下:pcr扩增仪(ptc0-200)购自bio-rad公司;凝胶成像分析系统(tanon2500)购自上海天能科技有限公司;高速冷冻离心机(5810r)购自eppendorf公司;纯水系统(direct-q3uv)购自milipore公司;分析天平(bsa224s)购自sartoriusag公司;高压蒸汽灭菌锅(gi54dws)购自致微仪器有限公司;酶标仪(infinite200pro)购自tecan公司;蓝光切胶仪(equ312)购自sangonbiotech;恒温金属浴(chb-t2-b)购自thermoq公司;振荡仪(ms3bs25)购自ika公司;电子天平(bsa8201)购自sartorius公司;电子ph计(fe28-standard)购自mettlertoledo;冷藏冰箱bcd-277(kk28f58ti)购自haier公司;普通干燥箱(dhg-9141a)购自上海浦东荣丰科学仪器有限公司;垂直板电泳仪(dyy-6c)购自biorad公司;垂直板电泳槽(552br)购自bio-rad公司;aktapurrifier蛋白纯化系统(zq23494)购自akta公司;-80℃超低温冰箱(dw-86l388a)购自haier公司;低温摇床(maxq6000)购自thermo公司;脱色摇床(ty-808)购自南京大学;电转仪(1652100)购自bio-rad公司;微量移液枪(p37050e)购自eppendorf公司;薄层扫描仪(v700)购自epson公司;透析袋(含透析夹)(161129)购自greenbird公司。实施例1皱纹盘鲍hdhtpx2重组表达载体的构建1.皱纹盘鲍hdhtpx2目的基因的获得根据ppic9k载体多克隆位点,设计扩增编码皱纹盘鲍hdhtpx2基因的特异性上游引物f1和下游引物r1。pcr扩增皱纹盘鲍hdhtpx2基因序列,扩增的hdhtpx2基因序列如seqidno.1所示,该序列编码的氨基酸序列如seqidno.2所示。在上游引物hdhtpx2的5`端加上snabi酶切位点,在下游引物hdhtpx2的5`端添加noti酶切位点,终止密码子和6×his组氨酸标签:下游引物采用noti酶切位点:上游引物hdhtpx2f1序列如seqidno.3所示:5`catgtacgtagcccaagtcggaaacctc3`,其中seqidno.3序列中的第五个碱基到第十个碱基表示引入的snabi酶切位点。下游引物hdhtpx2f1r1序列如seqidno.4所示:5`atgcggccgctcaatggtgatggtgatgatggttgaccttggagaag3`,其中,seqidno.4序列中的第三个碱基到第十个碱基表示引入的noti酶切位点,第十一个碱基到第十三个碱基表示终止密码子,第十四个碱基到第三十一个碱基为6×his-tag序列。以皱纹盘鲍cdna为模板,以hdhtpxf1和hdhtpxr1为上、下游引物扩增目的基因片段,然后与ppmd18-t质粒连接,获得含有hdhtpx2目的基因的重组阳性质粒,然后以该阳性质粒为扩增模板,分别以hdhtpxf1和hdhtpxr1为上、下游引物,以transstartfastpfudnapolymerase高保真酶(购自transgen公司),扩增目的基因片段,反应体系为:表1pcr反应体系无菌miliq水31.5μl5×buffer(含mg2+)10μldntps(2.5mmeach)4μlpmd18-t/hdhtpx重组阳性质粒1.5μl上游引物hdhtpx2f1(10μm)1μl下游引物hdhtpx2r1(10μm)1μltransstartfastpfudnapolymerase(2.5u/μl)1μl总反应体积50μl将上述体系混合均匀,在热循环仪上按照以下程序进行pcr反应:皱纹盘鲍hdhtpx2基因pcr程序为:95℃预变性1min;94℃变性30sec,60℃退火30sec,72℃延伸45sec,进行40个循环;72℃延伸5min,4℃保存。反应结束后,将所有反应液进行1.2%(w/v)琼脂糖凝胶-tae电泳,用axygen公司的凝胶回收试剂盒回收和纯化含目的片段的琼脂糖凝胶(如图1所示),其中dnamarkerdl-2000购自于takara公司。从图1可以看出,回收得到的皱纹盘鲍hdhtpx2目的基因pcr产物长度为600bp左右,与理论值相符。2.hdhtpx2目的基因酶切(1)hdhtpx2目的基因片段的第一次单酶切:取20μg上述回收的皱纹盘鲍hdhtpx2目的基因片段,用snabⅰ限制性内切酶(购自takara公司)单酶切,充分混匀后37℃孵育8h,单酶切见表2。表2含目的基因的酶切体系回收目的基因片段20μg10×snabⅰ酶反应缓冲液12μl0.1%bsa12μlsnabⅰ限制性内切酶(15u/μl)2μl无菌miliq水67μl总反应体积120μl反应结束后,pcr酶切产物经过1.2%(w/v)琼脂糖凝胶-tae电泳鉴别酶切效果;用核酸共沉剂(takara公司)回收酶切后的hdhtpx2目的基因片段。处理后的hdhtpx2目的基因片段具有snabⅰ的粘性末端。(2)hdhtpx2目的基因片段的第二次单酶切:取40μg上述核酸共沉剂回收的hdhtpx2的目的基因片段,用限制性内切酶notⅰ(购自takara公司)单酶切,充分混匀后37℃孵育8h,单酶切体系如表3所示。表3单酶切体系核酸共沉剂回收产物40μg10×notⅰ酶反应缓冲液12μl0.1%bsa12μl0.1%tritonx-10012μlnotⅰ限制性内切酶(10u/μl)1μl无菌miliq水43μl总反应体积120μl反应完成后,用1.2%(w/v)琼脂糖凝胶-tae电泳鉴别酶切效果;用核酸共沉剂(购自takara公司)回收酶切后的hdhtpx2目的基因片段。处理后的hdhtpx2目的基因片段具有snabⅰ和notⅰ的粘性末端。3.ppic9k载体双酶切位点的构建将ppic9k(购自invitrogen公司)载体转化至大肠杆菌dh5α感受态细胞(购自tiangen公司),然后涂板于含50μg/ml的氨苄霉素的lb平板上,37℃培养过夜。次日挑取单克隆菌落,接种于5ml含50μg/ml的氨苄霉素的lb液体培养基中,37℃,180rpm/min培养8h至对数生长期,离心收集菌体,小量提取ppic9k质粒。取3μg上述纯化的ppic9k载体,用snabⅰ和notⅰ限制性酶双酶切,37℃孵育8h,酶切体系如表4所示;反应结束后,用0.8%(w/v)琼脂糖凝胶-tae电泳检测酶切结果。然后用核酸共沉剂(d605a,购自takara公司)回收酶切后的载体。表4重组载体酶切体系10×h酶反应缓冲液12μl0.1%bsa12μlecorⅰ限制性内切酶(15u/μl)2μlnotⅰ限制性内切酶(10u/μl)2μlppic9k载体质粒40μl无菌miliq水52μl总反应体积120μl利用表4中的酶切体系处理后的ppic9k载体具有snabⅰ和notⅰ的粘性末端。4.ppic9k和目的片段hdhtpx2的连接采用dnaligationkit(购自takara公司),将具有snabⅰ和notⅰ的粘性末端的ppic9k载体与具有相同粘性末端hdhtpx2的基因片段进行连接,反应体系如下:表5目的基因与载体连接体系ppic9k载体1μlhdhtpx2基因片段4μlligationsolutionⅰ5μl总反应体积10μl将反应液置于16℃连接过夜,次日,取5μl连接反应液转化至50μle.colidh5α感受态细胞中,涂布于含有氨苄霉素(50μg/ml)的lb琼脂平板上培养过夜。次日挑取单克隆,以hdhtpx2f1(seqidno.1)和hdhtpx2r1(seqidno.2)为上下游引物,如前所述用pcr法鉴定阳性克隆菌,交由上海生工公司进行dna核苷酸序列测定。结果显示连接正确,核苷酸的开放阅读框(orf)连续编码,得到ppic9k-hdhtpx2重组表达载体。实施例2ppic9k-hdhtpx2重组质粒在毕赤酵母gs115中的诱导表达1.ppic9k-hdhtpx2的线性化和在毕赤酵母中的表达测序正确的含表达载体的菌株划线培养,挑取单克隆摇菌培养,提取质粒后,由sacⅰ限制性内切酶(购自takara公司)线性化,反应体系如下:表6重组质粒线性化反应体系重组表达载体80μlsacⅰ限制性内切酶5μl10×l酶反应缓冲液12μl无菌miliq水23μl总反应体积120μl充分混匀,离心,于恒温金属浴37℃酶切过夜。反应结束后,用核酸共沉剂回收线性化后的酶切产物ppic9k-hdhtpx2。再将其用电击法转化至毕赤酵母gs115感受态细胞中,选取在25kda位置出现蛋白质条带的单克隆,进行表达条件的优化。2.重组质粒表达条件的优化(1)hdhtpx2在不同时间点的诱导1)挑选单菌落于10mlbmgy培养基中,28℃,230rpm振荡培养约20h;2)直至菌液发白,od600在2.0~6.0之间,23℃,2000g离心5min,弃上清收集细胞;3)加入等体积bmmy重悬细胞,28℃,230rpm振荡培养24h诱导表达,并每隔24h补充0.5%的甲醇至溶液总体积不变;4)在0h、6h、12h、24h、48h、72h、96h不同时间点中各取1ml发酵液作为诱导前样品,4℃,12000g离心10min,取900μl上清利用sds-page电泳分析蛋白的表达量。其中,bmgy生长用培养基:称量10g酵母提取物,20g胰蛋白胨于700ml水中,充分混匀,冷却至室温后加入1m磷酸钾缓冲液、10×ynb和10×gy各100ml,以及2ml的500×b,121℃高压灭菌20min,4℃保存。bmmy表达用培养基:称量10g酵母提取物,20g胰蛋白胨于700ml水中,充分混匀,冷却至室温后加入1m磷酸钾缓冲液、10×ynb和10×m各100ml,并加入2ml的500×b,121℃高压灭菌20min,4℃保存。实验结果:ppic9k-hdhtpx2重组质粒转化毕赤酵母gs115后,挑取单克隆菌株在10mlbmgy生长用培养基中培养至对数生长期,离心收集菌体,转入bmmy表达用生长培养基中加入0.5%甲醇诱导表达96h(每24h补充0.5%甲醇)。结果如图2所示(其中蛋白质markers购自thermo公司,以下相同,即本发明实验过程中用到的蛋白质markers均购自于thermo公司)。图2结果表明,甲醇诱导后在约25kda位置出现蛋白质条带,与表达的目的蛋白tpx2分子量相当。且随着诱导时间的延长蛋白在72h表达量最高。(2)hdhtpx2在不同甲醇浓度下的诱导1)挑取单菌落接种于10mlbmgy培养基中,28℃,230rpm振荡培养24h;2)直至菌液发白,od600在2.0~6.0之间,23℃,2000g离心5min,弃上清收集细胞;3)加入等体积bmmy重悬细胞,补充不同浓度的甲醇分别为0.5%、1.0%、2.0%、3.0%,28℃,230rpm振荡培养24h诱导表达;4)在不同甲醇浓度中各取1ml发酵液作为诱导前样品,4℃,12000g离心10min,取900μl上清应用sds-page对蛋白表达量进行分析。实验结果:ppic9k-hdhtpx2重组质粒转化的毕赤酵母gs115后,挑取单克隆菌株在10mlbmgy生长用培养基中培养至对数生长期,离心收集菌体,转入bmmy表达用生长培养基中分别加入0.5%、1.0%、2.0%、3.0%甲醇诱导表达24h。结果如图3所示:甲醇诱导后在约25kda位置出现蛋白质条带,与表达的目的蛋白tpx2分子量相当。且随着诱导时间的延长蛋白在0.5%甲醇浓度下表达量最高。(3)hdhtpx2在不同ph条件下的诱导1)挑选单菌落接种于10mlbmgy培养基中,28℃,230rpm振荡培养24h;2)直至菌液发白,od600在2.0~6.0之间,23℃,2000g离心5min,弃上清收集细胞;3)加入等体积bmmy重悬细胞,调整不同浓度的ph分别为4、5、6、7、8,28℃,230rpm振荡培养24h诱导表达;4)在不同ph中各取1ml发酵液作为诱导前样品,4℃,12000g离心10min,取900μl上清利用sds-page法对于蛋白表达量进行分析。实验结果:ppic9k-hdhtpx2重组质粒转化的毕赤酵母gs115后,挑取单克隆菌株在10mlbmgy生长用培养基中培养16h至对数生长期,离心收集菌体,转入ph为4、5、6、7、8的bmmy表达用生长培养基中加入0.5%甲醇诱导表达24h。结果如图4所示:甲醇诱导后在约25kda位置出现条带,与表达的目的蛋白tpx2分子量相当,ph7表达量最高。实施例3目的蛋白hdhtpx2的大量表达和纯化1.tpx2的大量表达1)从保种中取1ml菌液接种于25mlypd液体培养基,28℃,230rpm振荡培养16h;2)取5ml菌液接种于150mlbmgy培养基中,28℃,230rpm振荡培养24h;3)直至菌液发白,od600在2.0~6.0之间,23℃,2000g离心5min,弃上清收集细胞;4)加入等体积bmmy重悬细胞,28℃,230rpm振荡培养24h诱导表达,4℃,5000g离心10min,收集培养液上清。2.上柱前样品的制备4℃离心,收集诱导表达1l菌液的上清,透析缓冲液液透析3次,离心收集上清液和用于纯化的溶液经0.45μm膜过滤后备用。3.亲和层析柱纯化1)运行电脑与纯化仪,直到纯化仪指示灯不闪为止,用注射器对泵软管道进行排气;1)洗泵:用milliq水清洗预装柱(histraptmffcrude5ml)15ml;2)柱平衡:溶液c平衡histrap层析柱15ml;3)上样:以2ml/min的流速上柱,待曲线走势平稳后收集流穿样品;4)洗脱未结合蛋白:用15ml的溶液a洗脱未结合蛋白;5)洗脱并收集目的蛋白:目的蛋白用溶液a与溶液b各50%来洗脱并收集,取少量进行sds-page电泳鉴定;6)冲洗:用100%溶液b15ml冲洗histrap层析柱,主要是除去高浓度的杂蛋白;7)保存:用15ml超纯水洗泵,并保存在经过滤除菌的20%乙醇中。其中,溶液a:称量2.922g氯化钠、0.6808g咪唑、6.67g十二水和磷酸氢二钠以及0.212g二水磷酸二氢钠混溶于蒸馏水并定容至1l,ph为8.5,0.45μm滤膜后4℃保存。溶液b:称量29.22g氯化钠、68.08g咪唑、6.66g十二水和磷酸氢二钠以及0.212g二水磷酸二氢钠混溶于蒸馏水并定容至1l,ph为8.5,0.45μm滤膜后4℃保存。4.纯化后蛋白的透析脱盐将洗脱下的目的蛋白放入透析袋透析,4℃透析3次,每8h更换一次,换pbs缓冲液透析2次,最后从透析袋中取出蛋白样品,酶标仪测定蛋白浓度后4℃保存备用。实验结果:重组毕赤酵母hdhtpx2在bmmy中诱导表达24h后,离心收集上清,取少量进行sds-page电泳分析。结果表明hdhtpx2在纯化后得到清晰的条带。重组毕赤酵母hdhtpx2在bmmy中诱导表达24h后,4℃离心收集上清,用磷酸缓冲液透析上清3次,离心收集上清,经0.45μm滤膜过滤,上柱纯化备用。利用镍离子螯合亲和层析柱亲和纯化的原理,tpx2能特异性与镍离子螯合亲和层析柱结合,而杂蛋白不能结合在镍离子螯合亲和层析柱上,根据280nm检测紫外吸收曲线,判断流出组分为杂蛋白,洗脱组分为螯合目的蛋白tpx2。对纯化前和纯化后的蛋白进行sds-page电泳分析,电泳分析结果如图5所示,其中,图5中m为预染蛋白marker26614,标号1为纯化前hdhtpx2蛋白的表达条带,标号2为纯化后hdhtpx2蛋白的表达条带,蛋白经过纯化,呈现出清晰的条带。接下来,发明人通过bradford法测定纯化后的重组表达产物tpx2的浓度,测定重组表达产物清除羟自由基的能力及其对h2o2的还原作用进行了研究。以期获得活性好,稳定性高的重组表达蛋白,为以后作为抗病原微生物新药物和食品添加剂等的开发奠定基础。其中bradford蛋白浓度测定试剂盒、总超氧化物歧化酶(t-sod)测试盒(羟胺法)、羟自由基测定试剂盒均购自于南京建成生物工程研究所。实施例4重组表达产物hdhtpx2活性的测定1.应用bradford法测定重组表达产物hdhtpx2的浓度按照bradford蛋白浓度测定试剂盒说明书操作如下:蛋白标准品的制备:将10μl蛋白标准品10倍稀释,使终浓度达到为0.5mg/ml。蛋白浓度的测定:1)将标准品按0、1、2、8、12、16、20μl稀释至20μl,相当于标准品浓度为0、0.05、0.1、0.2、0.3、0.4、0.5mg/ml。2)加入200μlg250染色液,室温放置5min。3)测定a595nm制作标准曲线。4)根据标准曲线计算蛋白浓度。实验结果表明,采用bradford法测定bsa标准品得到的蛋白浓度标准曲线。计算公式为y=0.9672x+0.5501,r2=0.9965,计算得到tpx2蛋白纯品的浓度为13.9mg/l。2.重组表达产物hdhtpx2对羟自由基的清除作用按照羟自由基测定试剂盒(货号:a018,厂家:南京建成生物工程研究所)说明书中的描述测定重组表达产物hdhtpx2清除羟自由基能力,用维生素c(vc)做阳性对照,其原理是在接受电子受体后通过显色情况来说明oh量的多少,颜色越深oh量越多。结果如图6和图7所示,随着tpx2蛋白浓度的增大,tpx2蛋白对羟自由基清除率也增大(图7),tpx蛋白对羟自由基50%清除率的浓度为0.028mg/ml。用vc做阳性对照,随着vc浓度的增大,vc对羟自由基清除率呈上升趋势(图8)。vc对羟自由基的50%清除率的浓度为0.25mg/ml,与tpx2蛋白比较,tpx2蛋白对羟自由基的清除能力比vc强,约是vc的9倍。本发明根据皱纹盘鲍hdhtpx2的cdna序列特征,构建真核重组表达载体ppic9k-hdhtpx2,sacⅰ线性化后,转化毕赤酵母gs115菌株,诱导表达并纯化获得hdhtpx2的重组蛋白,鉴定重组蛋白抗氧化活性,研究发现hdhtpx2蛋白具有清除羟自由基的活性。本发明旨在获得皱纹盘鲍hdhtpx2的基因工程表达产品,并对其抗氧化活性进行测定,以期开发抗病原微生物的新药物或作为动物饲料添加剂使用。本发明获得了皱纹盘鲍hdhtpx2的毕赤酵母表达重组子ppic9k-hdhtpx2,并在毕赤酵母中成功重组表达获得皱纹盘鲍hdhtpx2基因工程产品,确认了hdhtpx2的抗氧化活性,为其作为抗病原微生物新药物和动物饲料添加剂的开发奠定了基础。本发明进一步研究了通过本发明记载的方法得到的皱纹盘鲍hdhtpx2的安全性评价以及对h2o2引起的细胞过氧化损伤的修复功能评价。通过细胞水平的安全性评价结果,本领域技术人员有理由相信,通过本发明得到的tpx2蛋白可以用作制备药物,通过对细胞过氧化损伤的修复评价,本领域技术人员可以将本发明制备得到的tpx2蛋白用作动物饲料添加剂,并为后续的应用奠定良好的基础。实验中用到的主要试剂及主要耗材如下:dpbs/modified购自hyclone公司;trypsin-edtasolution购自bbilifesciences公司;胎牛血清和双抗购自gibco公司;细胞毒性检测试剂mts及pms购自sigma公司其中,实验过程中用到的主要仪器设备如下:二氧化碳培养箱(galaxy170)购自eppendorf公司;光学倒置显微镜(dfc450c)购自leica公司;恒温金属浴(chb-t2-b)购自thermoq公司;酶标仪(infinite200pro)购自tecan公司。实施例5重组表达产物hdhtpx2安全性评价1.hdhtpx2对l929和l02细胞活性的影响采用mts/pms法测定细胞活性:将细胞培养消化后,种板。然后在含10%fbs及1%p/s的培养基中培养,观察。将培养基吸出,加入新的无fbs的培养基,100μl/孔,饥饿细胞12-16h。将原有的无fbs培养基从l929细胞和l02细胞中吸出弃掉,加入新的无fbs培养基,100μl/孔。向l929细胞和l02细胞加入用无fbs培养基稀释的不同浓度的tpx2蛋白,分别为:0μg/μl、6.25μg/μl、12.5μg/μl、25μg/μl、50μg/μl、100μg/μl,并添加等体积的无fbs培养基作空白对照,置于37℃,含5%co2浓度的培养箱进行培养24h观察;弃掉原有的无fbs培养基,加入120μl/孔的细胞增殖工作液,将培养板避光放入37℃含5%co2浓度的恒温培养箱中孵育45min,然后利用酶标仪测定490nm吸光值。(1)hdhtpx2对l929细胞活性的影响利用l929细胞检测重组蛋白对于正常细胞的毒性作用。l929细胞是小鼠成纤维细胞,该成纤维细胞是疏松结缔组织的主要细胞成分,细胞成梭形或者扁的星状,具有突起,可作为皮肤细胞研究模型通过检测重组蛋白对于l929细胞的毒性,评价对于皮肤细胞的毒性和保护作用。实验过程中,分别制备不同浓度的hdhtpx蛋白溶液,然后分别加入到培养好l929细胞(其中l929细胞购自于上海微蒙酶联试剂公司)在37℃,5%的co2细胞培养箱中孵育,使得孵育溶液中蛋白浓度分别为0,6.25μg/ml,12.5μg/ml,25μg/ml,50μg/ml以及100μg/ml。共同孵育24h后测定细胞成活率。图8结果表明,不同浓度的hdhtpx2蛋白加入l929细胞共孵24h后,hdhtpx2蛋白对于l929细胞活性没有毒害作用。(2)hdhtpx2对l02细胞活性的影响利用l02细胞(人正常肝脏细胞)检测重组蛋白对于正常细胞的毒性作用。l02细胞是人体正常的肝脏细胞。通过检测重组蛋白对于l02细胞的毒性,可以用来评价重组蛋白的肝脏毒性。分别制备不同浓度的hdhtpx2蛋白溶液,然后分别加入到培养好的l02细胞(其中l02细胞购自于中山大学)在37℃,5%的co2细胞培养箱中孵育,使得孵育溶液中蛋白浓度分别为0,12.5μg/ml,25μg/ml,50μg/ml以及100μg/ml。共同孵育24h后测定细胞成活率。图9结果表明,tpx2蛋白对l02细胞没有毒害作用。2.重组表达产物tpx2蛋白的溶血性实验为了验证通过本发明制备得到的hdhtpx2蛋白在动物饲料添加剂领域中的应用。将本发明制备得到的hdhtpx2蛋白与马血进行溶血实验。利用pbs溶液配制不同浓度的hdhtpx2蛋白,然后将等量的hdhtpx2蛋白与等量的4%的马血(购自索莱宝)混合,使得hdhtpx2蛋白在复合溶液中的浓度分别为6.125μg/ml,11.25μg/ml,22.5μg/ml,45μg/ml,90μg/ml,180μg/ml,360μg/ml,以及720μg/ml。37℃静置培养2h,之后用900g离心5min。取出200μl于96孔板上,用500nm的波长检测。分别用1%tritonx-100和pbs作为阳性对照和阴性对照。每个样品平行测定3次,经统计学分析与对照组间均无显著性差异,溶血率计算公式如下,实验结果见图10。溶血率(%)=(样品吸收-阴性对照吸收)/(阳性对照吸收-阴性对照吸收)×100%。结果如图9所示,随着tpx2蛋白浓度的增大,马血发生溶血均低于10%。在最大浓度为720μg/ml时,该蛋白不会引起马血细胞的溶血。实施例6重组表达产物hdhtpx2对h2o2引起的细胞损伤的修复采用mts/pms法测定经过h2o2稀释的hdhtpx2蛋白对于细胞活性的影响:将细胞培养消化后,种板。然后在含10%fbs及1%p/s的培养基中培养,观察。将培养基吸出,加入新的无fbs的培养基,100μl/孔,饥饿细胞12-16h。将原有的无fbs培养基从l929细胞和l02细胞中吸出弃掉,加入新的无fbs培养基,100μl/孔。向l929细胞和l02细胞加入用h2o2稀释的不同浓度的hdhtpx2蛋白,分别为:0μg/μl、6.25μg/μl、12.5μg/μl、25μg/μl、50μg/μl、100μg/μl。同时以加入等体积的无fbs的培养基作为空白对照,置于37℃,含5%co2浓度的培养箱进行培养3h观察;弃掉原有的无fbs培养基,加入120μl/孔的细胞增殖工作液,将培养板避光放入37℃含5%co2浓度的恒温培养箱中孵育45min,然后利用酶标仪测定490nm吸光值。1.hdhtpx2对h2o2引起的l929细胞损伤的保护作用采用mts/pms法测定tpx2对l929细胞增殖的影响,设置6个孔做平行样对照,并重复三次试验。以空白组为100%设置为对照值并与测定组比较。当tpx2作用l929细胞并与h2o2共孵3h时,tpx2蛋白能够保护l929细胞免受h2o2的损伤(图11)。该实验验证了tpx2蛋白对l929细胞具有一定的抗氧化保护作用。2.hdhtpx2对h2o2引起的l02细胞损伤的保护作用用mts/pms法测定tpx2对l02细胞的增殖的影响,设置6个孔做平行样对照,并重复三次试验。以空白组为100%设置为对照值并与测定组比较。当tpx2作用l02细胞并与h2o2共孵3h时,tpx2蛋白能够保护l02细胞免受h2o2的损伤(图12)。该实验验证了tpx2蛋白对l02细胞具有一定的抗氧化保护作用。通过本发明的方法制备得到的hdhtpx2蛋白在浓度为0-100μg/ml范围内,对于l929细胞和l02细胞均未表现出细胞毒性。通过本发明的方法制备得到的hdhtpx2蛋白在浓度为0-720μg/ml范围内,未与马血发生溶血现象,溶血率均小于10%。通过本发明的方法制备得到的hdhtpx2蛋白在浓度为0-100μg/ml范围内,对于过氧化氢引起的细胞损伤起到保护和修复作用。总之,通过本发明制备得到的hdhtpx2蛋白不仅表现出良好的酶活特性,而且在细胞水平表现出良好的安全性,同时未表现出溶血现象,可以将其作为动物饲料添加剂使用。而且能够对于h2o2引起的细胞损伤起到保护和修复作用,具有优良的生物学活性。以上所述,仅是本发明实施的较佳实施例,并非对本发明做任何形式上的限制,凡在本发明的精神和原则之内所做的修改、等同替换和改进等,均需要包含在本发明的保护范围之内。sequencelisting<110>福建省水产研究所<120>皱纹盘鲍硫氧还蛋白过氧化酶及其制备方法和应用<130>oicn170030<160>4<170>patentinversion3.3<210>1<211>594<212>dna<213>皱纹盘鲍(haliotisdiscushannai)hdhtpx2序列<400>1gcccaagtcggaaacctccaattgacaaaacctgcccctgaattcagtgcaaaggctatt60gtcaatggtgaattcaaagatgtcaaactgtcagactacagagggaaatatgttgtctta120tttttctaccctctagacttcacgtttgtctgcccaacagaaattattgcattcagcgat180cggtctgaagagttcaaaagcatcaactgtgaggtccttggatgttcaacagacagtgtg240tactcacatctagcatggatcaacaccccgaggaagcagggtggtcttggcaacatgaag300attcctctcctggcagacaagacaatggagatttcccgaaaatatggctgtctgaaggaa360gacgaaggagttgcattcagaggacttttcatcattgatgacaaggccaacctgcgccag420atcaccattaacgacctccctgttggacgctcagtggatgagaccctcagacttgttcag480gcattccagttcactgacaagcacggagaagtttgtcctgctggatggaaaccaggcgca540gacaccatgaagcccgaccccaagggcagccagaactacttctccaaggtcaac594<210>2<211>198<212>prt<213>皱纹盘鲍(haliotisdiscushannai)hdhtpx2氨基酸序列<400>2alaglnvalglyasnleuglnleuthrlysproalaproglupheser151015alalysalailevalasnglygluphelysaspvallysleuserasp202530tyrargglylystyrvalvalleuphephetyrproleuaspphethr354045phevalcysprothrgluileilealapheseraspargsergluglu505560phelysserileasncysgluvalleuglycysserthraspserval65707580tyrserhisleualatrpileasnthrproarglysglnglyglyleu859095glyasnmetlysileproleuleualaasplysthrmetgluileser100105110arglystyrglycysleulysgluaspgluglyvalalaphearggly115120125leupheileileaspasplysalaasnleuargglnilethrileasn130135140aspleuprovalglyargservalaspgluthrleuargleuvalgln145150155160alapheglnphethrasplyshisglygluvalcysproalaglytrp165170175lysproglyalaaspthrmetlysproaspprolysglyserglnasn180185190tyrpheserlysvalasn195<210>3<211>28<212>dna<213>人工序列<400>3catgtacgtagcccaagtcggaaacctc28<210>4<211>47<212>dna<213>人工序列<400>4atgcggccgctcaatggtgatggtgatgatggttgaccttggagaag47当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 基于酶循环的α-甲基酰基辅酶A消旋酶的检定法的制作方法
- 在植物修复中使用表达源自植物酰基辅酶a结合蛋白的转化植物的方法
- 酰基辅酶a胆甾醇基转移酶抑制剂的制作方法
- 酰基辅酶a-胆固醇酰基转移酶抑制剂的制作方法
- 作为酰基辅酶a胆固醇酰基转移酶(acat)抑制剂的新的n-芳基和n-杂芳基酰胺及脲衍生物的制作方法
- 烷基硫基-和芳基(杂酰基)硫基-取代对亚苯基二胺、它们的制备方法和在橡胶中的用途的制作方法
- 一种新的多肽——硫酯酶π36.52和编码这种多肽的多核苷酸的制作方法
- 一种新的多肽——人线粒体酰基辅酶a硫酯酶48和编码这种多肽的多核苷酸的制作方法
- 酰基辅酶a胆甾醇酰基转移酶抑制剂的制作方法
- 作为酰基辅酶甘油二酯酰基转移酶的抑制剂的取代的5-苯基氨基-1