一种定量检测芒果炭疽菌的方法与流程
本发明涉及微生物检测技术领域,尤其涉及一种定量检测芒果炭疽菌的方法。
背景技术:
芒果(mangiferaindical.)属漆树科芒果属常绿乔木,是热带亚热带地区重要的经济作物,芒果炭疽病是芒果生产中危害最为严重的病害之一,世界范围内通常认为其病原菌为胶孢炭疽菌[colletotrichumgloeosporioides(penz.)penz.&sacc.],又称盘长孢刺盘孢,属于半知菌类炭疽菌属,其有性阶段为子囊菌门小丛壳属围小丛壳菌[glomerelllacingulate(stonem.)spauldetschrenk]。1979年fitzell在澳大利亚首次报道尖孢炭疽菌[c.acutatumj.h.simmonds]也是芒果炭疽病病原菌。在中国,李继勇(1985)首次报道了这2种炭疽菌(colletotrichum)。芒果炭疽菌的这2种病原菌田间危害症状基本相似,非常不容易区分,其不同的生物学特性以及药剂敏感性差异可能是该病害日益难防治的原因之一。
炭疽菌属真菌常规形态学鉴定方法是以分生孢子和附着胞形态为主,培养特征为辅,以寄主范围为参考的综合特征来鉴别的。然而c.acutatum和c.gloeosporioides均为复合种群,种内的不同类群之间形态差异较大,常规的鉴定常将尖孢误鉴定为胶孢,两者区分起来费时费力且效果不太理想。
炭疽菌属真菌具有潜伏侵染的特性,一旦病菌成功侵染则会给以后的防治工作带来一定的难度,而常规方法只能在病害显症后鉴定,不利于田间病害的识别与防治。为了更好地开展芒果炭疽病的防治工作,应开展该病害的早期快速检测工作,在病害潜伏期便鉴别病菌的种类、评估其危害性、制定防治策略。millsetal.(1992)设计的胶孢炭疽菌(c.gloeosporioides)的特异性检测引物cgint/its4可以扩增获得467bp的特异性pcr条带。随后,sreeivasaprasadetal.(1996)则设计了尖孢炭疽菌(c.acutatum)的特异性检测引物caint2/its4可以扩增出490bp的特异性pcr条带。millsetal.(1992)和sreeivasaprasadetal.(1996)设计的检测引物均位于rdna-its序列区间内,是基于its序列的差异性进行的特异性检测分析。为此,我们也利用its1/its4以及cgint/caint2之间的序列相关性开展相关的多重巢式pcr检测,应用这两个特异性的引物可以检测并区分c.acutatum和c.gloeosporioides两种病原菌(张贺等,2013,热带作物学报)。
近年来,pcr方法在操作时间上以及检测的特异性和灵敏度方面较常规方法有较大提高,但是,pcr检测技术需要特殊的仪器设备且检测成本较高,而且它的检测时间也还是比较长(2~3小时),不适合田间大规模的快速应用。因此,在加强芒果炭疽菌的病原菌检测监测中,有效地开展田间炭疽病菌的检测,辨别危害芒果的优势炭疽菌种,针对性地采取有效防治措施,减少经济损失,迫切需要开发一种灵敏度高、操作简便、成本低廉且结果判断迅速的检测方法,在一定程度上可以取代pcr的检测方法。
dna环介导等温扩增技术(loop-mediatedisothermalamplificationofdna,lamp)克服以往基因扩增方法的不足,在等温条件下能够特异性、高效、快速地进行核酸的扩增,具有很多的优越性(notomi等,2000)。实时荧光核酸恒温扩增检测技术(real-timefluorescenceloop-mediatedisothermalamplificationassay,简称realamp)是将新一代的核酸恒温扩增技术和实时荧光检测技术相结合的一种新型核酸检测技术,可以定量检测病原物,具有高灵敏度、高特异性、低污染、反应稳定等优点。后续发展的多重实时荧光核酸恒温扩增检测技术(multiplexreal-timefluorescenceloop-mediatedisothermalamplificationassay,mrealamp)则可以进行多个靶标dna的高通量快速分析,是real-timepcr以外的另外一种定量分析手段。此外,sybrgreeni是目前lamp产物最灵敏的检测方法之一,但是在realamp中sybrgreeni的加入可能会抑制lamp的反应效率,因此,在实际操作中普遍采用syto-9荧光染料进行realamp反应进行定量分析,而把sybrgreeni染色颜色判断作为一种定性辅助判断。该方法通常是按如下步骤进行:步骤一、对被检标本进行预处理,快速提取被检标本的dna;步骤二、特异性引物的制备:确定待测标本的靶基因后,取得特异性引物2对,内引物和外引物各一对;步骤三、实时荧光核酸恒温扩增(realamp)反应:将经前处理的样品、引物、反应缓冲液与bstdna聚合酶混合,在63℃保温1.5小时进行循环链置换反应;步骤四、分析判断反应产物结果。
考虑到mrealamp的技术特点,结合芒果胶孢炭疽菌(c.gloeosporioides)和尖孢炭疽菌(c.acutatum)特异性检测引物扩增的序列都属于its序列,并且扩增的区间高度重合(overlap),通过序列分析我们发现在尖孢炭疽菌(c.acutatum)扩增区间内存在一个特异性的naei内切酶位点,因此,我们以ca和cg共同扩增的its序列区间设计通用引物,同步检测两种病原菌;利用ca的扩增序列具有的核酸内切酶naei酶切位点,酶解realamp的扩增产物就可以判断病原菌的种类。因此,在通常的realamp操作步骤中仅需要添加内切酶naei酶切分析即可区分两种芒果炭疽菌的病原菌种类。
本发明方法不仅可以定量检测芒果炭疽菌,而且可以区分不同的病原菌,对于后续的防治提供了有利的理论指导和技术支撑。
技术实现要素:
针对以上现有技术的不足,本发明提供一种定量检测芒果炭疽菌的方法,不仅能够定量检测芒果炭疽菌,且可以高效区分芒果胶孢炭疽菌和尖孢炭疽菌。
本发明采取的技术方案如下:
一种定量检测芒果炭疽菌的方法,包括以下步骤:
步骤一、对被检样品进行预处理,提取被检样品的dna;
步骤二、特异性引物的制备;
步骤三、荧光核酸恒温扩增检测技术realamp反应;
步骤四、采用realamp的外侧引物对f3/b3克隆该序列到pmd18-t载体,用于构建realamp标准曲线;
步骤五、结果判断。
所述步骤二为:在炭疽菌的its1-5.8s-its4的保守区间内,利用cgint/its、caint2/its4引物对扩增序列的重叠区域作为靶标设计出两对特异性引物;所述两对特异性引物包含内侧引物与外侧引物各一对,其中f3和b3为外侧引物,fip和bip为内侧引物,所述外侧引物f3为5′-aagtcgtaacaaggtctcc-3′,所述外侧引物b3为5′-cgttcttcatcgatgccag-3′,所述内侧引物fip为5′-ccgaagcaacggttaggtatgtgtaggtgaacctgcggag-3′,所述内侧引物bip为5′-ccgccggaggaaaccaaaaaccaagagatccgttgtt-3′;
优选的,所述步骤一为:
1)样品在液氮保护下加入pvpp研磨成粉后,加入ctab缓冲液,涡旋混匀后65±2℃处理30min-60min,颠倒混匀;
2)室温条件下离心取上清,加入等体积的氯仿/异戊醇,涡旋混匀静置分层后离心;如果抽提后界面还不清晰,使用氯仿抽提一次;
3)离心后取上清,加入65±2℃预热的10×ctab,颠倒混匀后冷却到室温,然后加入无水乙醇,放置不超过1h沉淀dna;
4)离心,弃上清,加入高盐te,65±2℃助溶后转入离心管;
5)加入rnasea,37±2℃水浴30-60min后加入等体积氯仿/异戊醇,涡旋后静置分层,离心;
6)取上清,加入等体积氯仿/异戊醇,涡旋,离心;如果抽提后界面还不清晰,使用氯仿抽提一次;
7)取上清,加入nacl或naac,加入无水乙醇,颠倒混匀后放置;
8)离心,用乙醇漂洗后吹干,加适量ddh2o溶解并调整浓度为0.1-0.5μg/μl,保存备用。
更优选的,所述步骤一为:
1)样品在液氮保护下加入pvpp研磨成粉后,按照0.2克对应1ml的比例加入ctab缓冲液,涡旋混匀后65℃处理30min-60min,每10min上下颠倒混匀一次;
2)室温条件下离心取上清,加入等体积的氯仿/异戊醇,涡旋混匀静置分层后,4℃、12000rpm条件下离心15min;如果抽提后界面还不清晰,使用氯仿抽提一次;
3)离心后取上清,加入1/10体积65℃预热的10×ctab,颠倒混匀后冷却到室温,然后加入2.5倍体积-20℃无水乙醇,-20℃放置不超过1h沉淀dna;
4)4℃、12000rpm条件下离心10min,弃上清,加入1-2ml的高盐te,65℃助溶后转入离心管;
5)每管加入100μlrnasea,37℃水浴30-60min后加入等体积氯仿/异戊醇,涡旋30s后静置分层,4℃、12000rpm条件下离心10min;
6)取上清,加入等体积氯仿/异戊醇,涡旋30s,4℃、12000rpm条件下离心10min;如果抽提后界面还不清晰,使用氯仿抽提一次;
7)取上清,加入1/5体积5mnacl或1/10体积3mnaac,加入2.5倍体积-20℃的无水乙醇,颠倒混匀后-20℃放置30-60min;所述naac的ph值为5.2;
8)4℃、12000rpm条件下离心10min,用70%乙醇漂洗两次后吹干,加适量ddh2o溶解并调整浓度为0.1-0.5μg/μl,4℃条件下保存备用。
优选的,所述步骤二中外引物f3和外引物b3的浓度均为5pmol/μl;内引物fip和内引物bip的浓度均为40pmol/μl。
优选的,所述步骤三为:
realamp25μl反应体系:1μl抽提的核酸dna作为模板,10×bstdnapolymersebuffer2.5μl、dntps1.4mm、甜菜碱0.8mm、mgso48mm、外引物0.2μm、内引物1.6μm、8u/μlbstdnapolymerase1μl、syto-9荧光染料0.2μm,补水至25μl,然后再加入等体系的石蜡油覆盖整个反应液防止挥发;
realamp反应前在反应管的内盖上加入1:10倍稀释的sybrgreeni荧光染料1μl;realamp反应在ese-quanttubescanner上进行,63℃反应90min后80℃反应10min终止反应;待反应结束后用手甩或者离心使sybrgreeni加入到lamp反应液中进行显色观察;
设置阳性对照反应时,用炭疽菌感染且表现症状的芒果叶片基因组总dna代替;设置阴性对照反应时,用te代替,将含有反应溶液的反应管置于63℃反应90min;反应结束后显示屏显示扩增曲线。
优选的,所述步骤四为:
芒果炭疽菌pcr检测反应体系为:10×pcrbuffer2.5μl、2.5mmdntps2μl、5u/μltaq聚合酶0.25μl、10pm的特异性引物对cgint/its4和caint2/its4各1μl、dna1μl,补水至25μl;
pcr反应的条件:94℃预变性3min,94℃变性30s,60℃退火30s,72℃延长30s,进行35次循环;72℃延长7min;
反应结束后,取5μl反应产物,1%琼脂糖凝胶电泳后染色观察结果;pcr扩增条带切胶回收连接pmd-18-t载体,10倍梯度稀释后作为模板用于评估realamp的检测灵敏度并由此构建芒果炭疽菌的realamp标准曲线。
优选的,所述步骤五为:
定量检测结果的判断:在ese-quanttubescanner反应结束后,仪器自动根据标准曲线显示定量结果;
定性检测结果的判断:反应结束后用手甩或者离心将反应管内盖上的sybrgreeni混入到反应液中,采用不开盖显色来判断结果,如反应液颜色为橙色,表示结果为阴性,如反应液颜色为绿色,表示结果为阳性;
定性和定量分析结束后,在realamp的反应液中加入naei内切酶,37℃酶切3hr后,2%的琼脂糖凝胶电泳检测分析:酶解开的是尖孢炭疽菌,酶解不开的是胶孢炭疽菌,部分酶切产物的则是两个病原菌的混合侵染。
与现有技术相比,本发明的有益效果是:
1、本发明利用实时定量荧光环介导等温扩增(realamp)技术快速检测芒果炭疽菌,一次反应即可区分两种不同的病原物,克服以往基因扩增方法的不足,具有特异性高、灵敏度高、易操作、用时短(只需2-3h)等优势;
2、不需要昂贵而精密的温度循环装置,ese-quanttubescanner即可完成realamp的反应和结果判断,节省成本;
3、采用不开盖检测不仅避免污染,不仅可以利用syto-9染料定量检测,还可以利用sybrgreeni染色直观判断结果,只需肉眼观察即可,适宜于广泛地推广应用;
4、以ca和cg共同扩增的its序列区间设计通用引物,并利用ca的扩增序列具有的核酸内切酶naei酶切位点,添加内切酶naei酶解realamp的扩增产物,实现两种病原菌同步检测。
附图说明
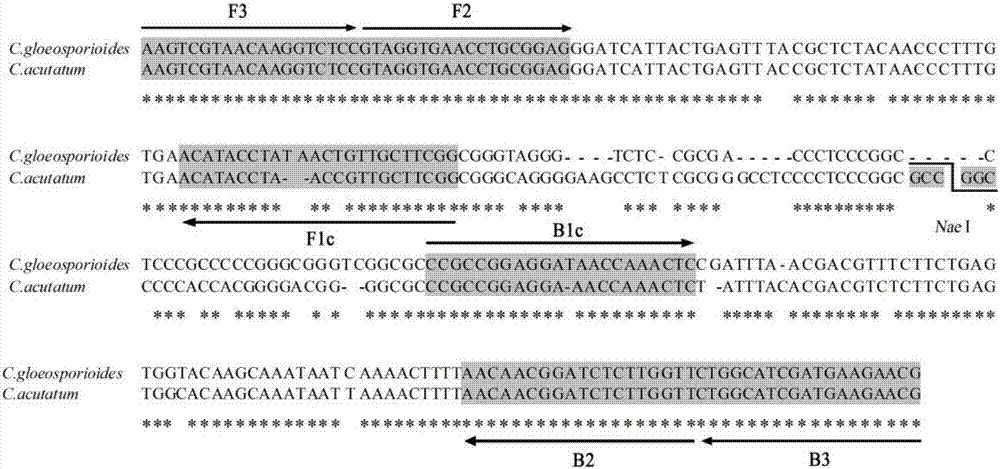
图1为芒果炭疽菌的2种病原菌的realamp引物设计示意图;
图2为芒果炭疽菌realamp特异性分析图;
图中,编号的1-8分别代表芒果尖孢炭疽菌、芒果胶孢炭疽菌、芒果枝枯菌、芒果蒂腐病、芒果拟茎点霉叶斑病菌、芒果畸形病、香蕉枯萎病菌race1和race4的dna以及阴性对照,“m”为markerdl2000;
图2-d为各个模板采用ese-quanttubescanner仪器进行realamp扩增反应后的扩增曲线;x轴表示扩增时间(min),y轴表示响应的荧光信号强度(mv)。
图3为核酸内切酶naei酶解区分芒果炭疽菌两种病原菌电泳图;
图4为realamp检测的灵敏度及其标准曲线构建图;
(a)以pmd18-t-cg质粒dna为模板进行realamp灵敏性分析,琼脂糖凝胶电泳图;
(b)采用cg特异性引物cgint/its4扩增不同浓度质粒dna的病原菌,琼脂糖凝胶电泳图;
(c)各浓度pmd18-t-cg质粒dnaese-quanttubescanner仪器进行realamp扩增反应后的扩增曲线。x轴表示扩增时间(min),y轴表示响应的荧光信号强度(mv)。
(d)芒果炭疽菌realamp扩增曲线的构建。不同浓度的起始模板dna浓度与相应的tt值之间的关系而构建,x轴表示起始模板浓度的对数值,y轴表示不同浓度模板扩增达到阈值所用的时间(tt)。
图5为芒果炭疽菌的realamp检测可行性分析图;
(a)田间随机分离的芒果尖孢炭疽菌在pda培养基上的菌落形态、分子孢子以及孢子梗;
(b)多重pcr同步检测两种病原菌的电泳图;
(c)realamp检测田间随机分离的8个菌株2%琼脂糖凝胶电泳图;
(d)对应的核酸内切酶naei处理(c)中realamp扩增产物的电泳图;
图6为田间部分芒果炭疽病样品的定量检测分析图;
(a)6个田间芒果尖孢炭疽菌的realamp检测结果电泳图;lane1:两个病原菌的质粒pmd18-t-cg、cadna混合样品作为+ck;lane2:-ck;lane3-8:随机6个田间采集样品;“m”markerdl2000;
(b)核酸内切酶naei处理(a)中1-8样品的电泳检测图。3、4、7三个样品为混合侵染,其余的属于cg;
(c)sybrgreeni染色法检测(a)中各个模板的realamp扩增产物,绿色是阳性,而橙色是阴性;
(d)各个样品采用ese-quanttubescanner仪realamp扩增反应后计算得到的病原菌dna含量。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。
本发明实施例所用的实验方法如无特殊说明,均为常规方法。
本发明实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
一种定量检测芒果炭疽菌的方法,包括以下步骤:
步骤一、对被检样品进行处理,快速提取被检样品的dna
1)样品在液氮保护下加入pvpp研磨成粉后,按照0.2克对应1ml的比例加入ctab缓冲液(2%ctab、100mmol/ltris-hcl、25mmol/ledta、2mnacl、ph8.0、2%巯基乙醇)涡旋混匀后65℃处理30min-60min,每10min上下颠倒混匀一次;
2)(室温)离心取上清,加入等体积的氯仿/异戊醇(24:1),涡旋混匀,静置分层后4℃、12000rpm离心15min;如果抽提后界面还不清晰,使用氯仿抽提一次;
3)离心后取上清,加入1/10体积65℃预热的10×ctab(10%ctab(w/v)),加入4%nacl(w/v),颠倒混匀后冷却到室温,然后加入2.5倍体积-20℃的无水乙醇,-20℃放置不超过1h沉淀dna;
4)4℃、12000rpm离心10min,弃上清,加入1-2ml的高盐te(1mnacl、10mmtris-cl、1mmedta,ph8.0),65℃助溶后转入2ml的离心管;
5)每管加入100μlrnasea(10mg/ml),37℃水浴30-60min后加入等体积氯仿/异戊醇(24:1),涡旋30s后静置分层,4℃、12000rpm离心10min;
6)取上清加入等体积的氯仿/异戊醇(24:1),涡旋30s,4℃、12000rpm离心10min(界面不清时重复氯仿抽提一次);
7)取上清加入1/5体积的5mnacl或1/10体积的3mnaac(ph5.2),加入2.5倍体积-20℃无水乙醇,颠倒混匀后-20℃放置30-60min;
8)4℃、12000rpm离心10min,用70%乙醇漂洗两次后吹干,加适量ddh2o溶解并调整浓度为0.1-0.5μg/μl,4℃保存备用。
步骤二、特异性引物的制备:
在炭疽菌的its1-5.8s-its4的保守区间内,利用cgint/its、caint2/its4引物对扩增序列的重叠区域作为靶标设计引物得到2对特异性引物,包含内侧引物(fip和bip)和外侧引物(f3和b3)各一对。由两对引物构成引物混合液,其中f3(5′-aagtcgtaacaaggtctcc-3′,即seqidno:1所示的核苷酸序列)和b3(5′-cgttcttcatcgatgccag-3′,即seqidno:2所示的核苷酸序列)为外侧引物,fip(5′-ccgaagcaacggttaggtatgtgtaggtgaacctgcggag-3′,即seqidno:3所示的核苷酸序列)和bip(5′-ccgccggaggaaaccaaaaaccaagagatccgttgtt-3′,即seqidno:4所示的核苷酸序列)为内侧引物,所述外引物f3和所述外引物b3的浓度分别为5pmol/μl;所述内引物fip和所述内引物bip的浓度均为40pmol/μl。所述引物序列见表1,lamp引物设计示意图见图1。
表1realamp特异性检测引物序列
步骤三、荧光核酸恒温扩增检测技术(realamp)反应
将经前处理的样品、引物、反应缓冲液与bstdna聚合酶混合,在63℃保温90min进行循环链置换反应。realamp是在ese-quanttubescanner上进行操作的,ese-quanttubescanner是一个热循环和荧光检测与一体的realamp扩增仪器,具有8个加热孔,仪器自身带有显示屏可以直接显示检测结果,还可以连接到电脑上由电脑控制。扩增结束后在显示屏上显示的扩增曲线有以下几个数值:
tt值(thresholdtime,tt)指每个反应管内的荧光信号到达设定的域值时所经历的时间,与荧光pcr中的ct值比较类似。
阈值(threshold)指设定的荧光信号值。荧光信号值是指反应管中仪器测定的荧光信号强度,用milli-volts(mv)表示。
realamp25μl反应体系:1μl抽提的核酸dna作为模板,10×bstdnapolymersebuffer2.5μl、dntps1.4mm、甜菜碱0.8mm、mgso48mm、外引物(b3和f3)0.2μm、内引物(fip和bip)1.6μm、bstdnapolymerase(8u/μl)1μl,syto-9荧光染料0.2μm,补水至25μl,然后再加入等体系的石蜡油覆盖整个反应液防止挥发。
realamp反应在ese-quanttubescanner(esegmbh,stockach,germany)上进行,63℃反应90min后80℃反应10min终止反应。
realamp反应前在反应管内盖上加入1μl1:10倍稀释的sybrgreeni荧光染料,待反应结束后瞬时离心将sybrgreeni加入lamp反应液中进行显色观察,避免开盖检测气溶胶污染。
设置阳性对照反应时,用炭疽菌感染后表现症状的的芒果叶片基因组总dna代替;设置阴性对照反应时,用te(100mmtris-hcl(ph8.0),50mmedta)代替,将含有配制好的反应溶液的反应管置于63℃反应90min。反应结束后显示屏上显示扩增曲线,x轴表示扩增时间,y轴显示荧光值。
步骤四、realamp标准曲线的构建
为了精确评估realamp的检测灵敏度并由此构建标准曲线,采用realamp的外侧引物f3/b3,该引物扩增的基因组dna序列覆盖了整个realamp的扩增区间,因此,克隆该序列到pmd18-t载体测序正确后的质粒命名为pmd18-t-cg,作为dna模板用于构建标准曲线。
芒果炭疽菌pcr检测反应体系为:10×pcrbuffer(mg2+)2.5μl,dntps(2.5mmeach)2μl,taq聚合酶(5u/μl)0.25μl,特异性引物(cgint/its4、caint2/its4)各1μl(10pm),dna1μl,补水至25μl;
pcr反应的条件:94℃预变性3min,94℃变性30s,60℃退火30s,72℃延长30s,进行35次循环;72℃延长7min。反应结束后,取5μl反应产物,以1%琼脂糖凝胶电泳后染色观察结果。pcr扩增条带切胶回收连接pmd-18-t载体后测序,将该质粒命名为pmd18-t-cg(1.2ng/μl),10倍梯度稀释后作为模板用于评估realamp的检测灵敏度并由此构建芒果炭疽菌的realamp标准曲线。标准曲线是根据不同稀释的模板pmd18-t-cg的起始质粒浓度与相应的tt值之间的关系而构建的,x轴表示起始模板浓度的对数值,y轴表示不同浓度模板扩增达到阈值所用的时间(tt)。
步骤五、区分两种病原菌及结果判断
定量检测结果的判断:直接在ese-quanttubescanner反应结束后,仪器自动根据标准曲线显示定量结果。
定性检测结果判断:为了适应田间的快速结果判断,反应结束后用手甩或者瞬时离心将反应管内盖上的sybrgreeni混入到反应液中,采用不开盖显色来判断结果,如反应液颜色为橙色,表示结果为阴性,如反应液颜色为绿色,表示结果为阳性。不开盖检测可以避免样品之间的交叉污染,而且可以作为定量检测结果之外的辅助判断方式。
尖孢炭疽菌(c.acutatum)扩增区间内存在一个特异性的naei内切酶位点(见图1),定性和定量分析结束后,在realamp的反应液中加入naei内切酶,37℃酶切3hr后,2%的琼脂糖凝胶电泳检测分析:酶切开的是尖孢炭疽菌(c.acutatum),酶切不开的是胶孢炭疽菌(c.gloeosporioides),部分酶切的则是两个病原菌的混合侵染。
实施例2、realamp的特异性分析
按照实施例1的步骤开展lamp检测的特异性分析,以芒果尖孢炭疽菌(colletotrichumacutatummca009)、芒果胶孢炭疽菌(colletotrichumgloeosporioidesmcg002)、芒果枝枯菌(botryodiplodiatheobromaezkn-1)、芒果蒂腐病(dothiorelladominicanadf-1)、芒果拟茎点霉叶斑病菌(phomopsismangiferaephm-2)、芒果畸形病(fusariumproliferatummmd-1)、香蕉枯萎病菌(fusariumoxysporumf.sp.cubense)race1和race4两个不同生理小种的dna以及阴性对照来测试realamp反应的特异性,结果见图2。
结果显示仅模板是芒果炭疽菌colletotrichum(包括c.gloeosporioides和c.acutatum)基因组dna的显色为绿色、表明为阳性,其余均为橙色、表明为阴性(见图2-c);
经2%琼脂糖凝胶电泳检测各个pcr管的产物,仅模板是芒果炭疽菌基因组dna(c.gloeosporioides和c.acutatum)显示有梯度条带,其余均无梯度条带,表明在realamp检测中只有阳性反应的才有梯度条带,而阴性反应的无梯度条带(见图2-a)。
参考mills等(1992)设计的胶孢炭疽菌(c.gloeosporioides)的特异性检测引物cgint/its4(5′-ggcctcccgcctccgggcgg-3′/5′-tcctccgcttattgatatgc-3′),以及sreeivasaprasad等(1996)设计的尖孢炭疽菌(c.acutatum)特异检测引物caint2/its4(5′-ggggaagcctctcgcgg-3′/5′-tcctccgcttattgatatgc-3′)扩增用于特异性分析的供试病原菌。胶孢炭疽菌(c.gloeosporioides)基因组dna用cgint/its4引物扩增出大小为467bp的单一条带,其余均无条带;而尖孢炭疽菌(c.acutatum)基因组dna用caint2/its4特异性引物扩增出大小为497bp的单一条带,其余均无条带(见图2-b)。
ese-quanttubescanner仪器进行realamp扩增反应后的扩增曲线有2条,相应编号对应的是胶孢炭疽菌(c.gloeosporioides)和尖孢炭疽菌(c.acutatum)基因组dna为模板的pcr管。lamp显色和电泳分析与mills等(1992)和sreeivasaprasad等(1996)设计的特异性检测结果一致,表明realamp检测的特异性(见图2)。
实施例3、核酸内切酶naei区分芒果炭疽菌两种病原菌c.gloeosporioides和c.acutatum
分别以芒果炭疽菌colletotrichum的两种病原菌,c.gloeosporioides和c.acutatum、c.gloeosporioides/c.acutatum混合dna以及水作为-ck为模板进行realamp扩增,反应结束后加入核酸内切酶naei,37℃水浴3hr后电泳检测分析核酸内切酶naei是否可以区分两种不同的病原菌。
结果显示dna为芒果炭疽菌两种病原菌c.gloeosporioides、c.acutatum以及cg+ca混合dna均可以扩增出梯形条带,而-ck则无扩增条带。c.acutatum为模板dna的反应液可以被naei完全酶切成119bp、116bp两条带,而cg/ca混合dna可以部分被酶切,c.gloeosporioides为模板dna的反应液则无法切开(图3-a)。
为了进一步说明naei区分芒果炭疽菌两种病原菌的可行性,采用外侧引物f3/b3pcr方法扩增图3-a的模板dna,分别采用内切酶naei处理后,电泳结果显示c.acutatum可以被完全酶切,电泳后出现“一”条电泳条带(naei酶切realamp扩增产物成138bp、135bp两条带,由于核酸大小相差太小电泳无法区分,因此电泳结果看起来只有一条带);cg/ca混合dna酶切后两条带,一条是cg的扩增产物,一条是被酶解的c.acutatumdna扩增产物(图3-b)。这些结果说明naei可以酶切c.acutatum的扩增产物,区分两种不同的病原菌。
实施例4、realamp灵敏性分析及标准曲线构建
以包含整个realamp扩增区间的质粒pmd-18-t-cg质粒dna为模板,10倍梯度系列将pmd-18-t-cg基因组dna从2.0×102ng/μl依次稀释至2.0×10-4ng/μl,以无菌水为阴性对照。
结果表明,质粒dna浓度在2.0×102~2.0×10-3ng/μl范围内的realamp反应产物经sybrgreeni染色后均显绿色,浓度为2.0×10-4ng/μl和阴性对照显橙色,表明realamp的检测下限为2.0×10-3ng/μl(见图4-c);
2%琼脂糖凝胶电泳检测各个realamp管的产物,质粒dna浓度范围在2.0×102~2.0×10-3ng/μl的产物电泳后eb染色,染色后显示有梯度条带,其余均无梯度条带(见图4-a),表明realamp下限为2.0×10-3ng/μl,浓度低于2.0×10-4ng/μl则检测不出。
采用cg特异性引物cgint/its4可以扩增从质粒dna浓度范围在2.0×102~2.0×10-1ng/μl之间的病原菌。realamp检测灵敏度大概是pcr扩增的100倍(图4-a,b)。
ese-quanttubescanner扩增反应后的扩增曲线显示realamp可以扩增6个数量级的模板dna(见图4-c)。不同浓度的起始模板dna与相应的tt值之间存在线性关系。以x轴表示起始模板浓度的对数值,y轴表示不同浓度模板扩增达到阈值所用的时间(tt),构建realamp检测的标准曲线y=-2.7929x+10.986(r2=0.9915)(见图4-d)。应用时,只需要知道扩增达到阈值所用的时间(tt),就能求出芒果炭疽菌的含量。
实施例5、realamp的可行性分析
为了测试realamp的可行性,随机从芒果上分离了8个炭疽菌,通过单孢分离用于实验测试。菌株的菌落形态及分生孢子大小、形态见图5。
一类是在pda培养基上菌落灰绿色至白色,气生菌丝绒毛状,部分菌株易在后期产生橘红色的分生孢子堆;分生孢子圆柱形、椭圆形,无色,单胞,两端钝圆,油滴有或无。大小9-23μm×3.8-4.7μm,将1、4、5、8号菌株初步鉴定为胶孢炭疽菌(c.gloeosporioides)。
另一类在培养基上菌落灰色,气生菌丝较密白色,后变淡灰色;分生孢子梭形、无色,单胞,含有油滴,大小8.2-12.3μm×2.5-3.7μm,将2、6、3、7号菌株初步鉴定为尖孢炭疽菌(c.acutatum)。
采用多重pcr检测方法,即在pcr反应中加入caint2/cgint/its4三种引物,同时扩增两种病原菌。对8个随机的炭疽菌dna进行扩增后结果显示2、6两个样品扩增出497bp条带属于ca,而其余样品扩增出467bp条带属于cg。同样,realamp与pcr一样,都可以扩增出条带,naei处理后,pcr扩增出497bp的尖孢炭疽菌(c.acutatum)被完全酶解成为“一条带”(naei酶切产物成为119bp、116bp两条带,但是核酸差异太小,电泳无法区分,因此电泳后看起来是一条电泳条带)。
常规鉴定方法需要病斑显症后才能对样品进行镜检、分离、纯化等工作,费时费力且准确度不高(4/8的错误率),而潜伏侵染期则难以开展鉴定工作。将常规鉴定方法与pcr技术相结合能够很好地解决病害鉴定难的问题。
实施例6、realamp田间实际样品检测分析
对采集自海南儋州、广西、四川等省区的芒果炭疽病样品进行realamp定量检测,设置阳性对照和阴性对照。此外,样品还采用了巢式pcr对比分析,第一轮pcr采用rdna的通用引物its1/its4进行扩增,pcr产物稀释100倍后取1μl为第二轮巢式pcr的模板,引物采用caint2/cgint/its4引物对。
结果表明,在随机的6个样品中,只有一个是阴性反应,其中3、4、7号孔的样品均为复合感染,占大约50%的比例(图6-a,b)。realamp的反应液加入sybrgreeni后,通过的颜色变化非常直观的显示检测结果,与syto-9荧光染料的定量检测结果互为补充,更加适合田间的实际应用;巢式pcr均能对芒果病害样品和健康的芒果组织扩增出约550bp的清晰条带,此条带作为多重巢式pcr检测的内参条带,realamp的检测结果与多重pcr的检测结果一致(图6-c)。
目前芒果园存在胶孢炭疽菌(c.gloeosporioides)和尖孢炭疽菌(c.acutatum)的混合感染。生产中主要以防治cg为主,但是ca在生物学、药剂敏感性以及对苯并咪唑类农药的抗性方面具有很大的差异,针对cg为主的防治方法可能是目前芒果炭疽菌防治效果差的原因之一。我们建立的一步法realamp检测方法能定量检测芒果炭疽菌、区分两种不同的病原菌,为后续的监测以及防治提供理论指导和技术支撑。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换。
- 还没有人留言评论。精彩留言会获得点赞!