联合EpCAM单链抗体和CCL19杀伤乳腺癌细胞的CAR载体及其构建方法和应用与流程
本发明属于医药生物领域,具体涉及联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体及其构建方法和应用。
背景技术:
乳腺癌做为一种威胁女性身心健康的常见肿瘤,其发病率约占全身恶性肿瘤的23%,死亡率占14%。目前乳腺癌的治疗方法主要包括手术、放疗、化疗或联合治疗,但治疗效果有限;基因治疗做为新型治疗手段,由于无法确定靶向致病基因,目前尚无突破性进展。其次,肿瘤异质性和肿瘤微环境的复杂性意味着依靠单一方法治愈乳腺癌的机会是微乎其微的。在多学科综合治疗的今天,新的治疗方式亟待提出。
lak细胞、dc、cik细胞都曾作为肿瘤的免疫治疗手段,但是以上各种治疗方法均缺乏特异性识别肿瘤相关抗原(tumorassociatedantigen,taa)和杀伤特定肿瘤靶细胞的能力;而肿瘤免疫编辑的过程又会使靶细胞表面的主要组织相容性复合物(mainhistocompatibilitycomplex,mhc)在肿瘤细胞表面表达下降,形成免疫逃逸,使肿瘤细胞可成功躲避t细胞攻击。
嵌合抗原受体(car)-t细胞疗法是通过基因工程技术在t细胞表面人为过表达能识别特定的肿瘤表面抗原的单链抗体可变区基因片段,从而使t细胞识别特定抗原、杀伤表达该抗原的靶细胞。同时,由于car-t细胞是采用抗体识别抗原模式,因此不受mhc的限制。
上皮特异性粘附分子(epcam,epithelialcelladhesionmolecule)是一种上皮细胞跨膜糖蛋白,参与wnt信号转导通路,调控靶基因转录,与细胞的粘附、迁移、增殖、分化等有关。最初是以一种肿瘤相关抗原而被发现的,由于epcam在多种肿瘤组织如卵巢癌、胃癌、结直肠腺癌、乳腺癌等中的表达升高而备受关注。研究发现,epcam的表达与卵巢肿瘤的进展及预后相关,可作为乳腺癌靶向治疗的靶点。
趋化因子的主要作用是趋化细胞的迁移,细胞沿着趋化因子浓度增加的信号向趋化因子源处的迁徙。有些趋化因子在免疫监视过程中控制免疫细胞趋化,如诱导淋巴细胞到淋巴结。这些淋巴结中的趋化因子通过与这些组织中的抗原提呈细胞相互作用而监视病原体的入侵。这些被称为稳态趋化因子,其产生无需刺激而分泌。人趋化因子c-c-基元配体19(ccl19)是趋化因子cc家族成员,其体外被证实可以通过ccl19/ccr7途径下调β-catenin蛋白表达,而β-catenin蛋白为一种经典的促癌蛋白,由此,可以推测ccl19可以直接作用于肿瘤细胞。
由此,如何有效避免肿瘤免疫逃逸,增强t淋巴细胞对乳腺癌细胞的杀伤,从而提高car-t免疫疗法抗乳腺癌的效果,成为car-t治疗的一个技术难题。
技术实现要素:
本发明目的是为了解决上述问题,本发明提供了能靶向epcam并联合ccl19杀伤乳腺癌细胞的car载体。本发明针对乳腺癌细胞特异性蛋白epcam避免肿瘤免疫逃逸机制;通过趋化因子ccl19增强t淋巴细胞对乳腺癌细胞的杀伤,从而提高car-t免疫疗法抗乳腺癌的效果。此外,还包括联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体的构建方法及其应用。
本发明提供的联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体具体技术方案如下:
联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体,包括嵌合抗原受体和载体,所述嵌合抗原受体连接在所述载体上,所述嵌合抗原受体包括两种特异性结构分别为:epcam单链抗体和趋化因子ccl19,所述epcam单链抗体的核苷酸序列如seqidno.2所示,所述趋化因子ccl19的核苷酸序列如seqidno.8所示。
在某些实施方式中,所述嵌合抗原受体的结构组成为cd8leader-epcamscfv-cd8α-cd28-cd137-cd3ζ-ires-ccl19。
在某些实施方式中,所述cd8leader可表达引导新合成的蛋白质进行跨膜转移的引导肽,所述cd8leader的核苷酸序列seqidno.1所示,
所述epcamscfv表示epcam单链抗体,
所述cd8α为跨膜区,连接胞外抗原结合域和胞内信号域,且核苷酸序列如seqidno.3所示,
所述cd28-cd137为共刺激结构域,所述cd28核苷酸序列如seqidno.4所示,所述cd137核苷酸序列如seqidno.5所示,
所述cd3ζ为信号转导域,核苷酸序列如seqidno.6所示;
所述ires为核糖体识别位点,是实现同一载体高效共表达两个基因的元件,核苷酸序列如seqidno.7所示;
所述ccl19表示趋化因子ccl19。
在某些实施方式中,所述载体包括puc19质粒、慢病毒载体。
在某些实施方式中,所述慢病毒载体为pcdh-cmv-mcs-ef1-puro。
本发明还提供了构建上述联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体的构建方法,步骤如下:
(1)将所述嵌合抗原受体保存在所述puc19质粒上;
(2)将含有步骤(1)中puc19质粒和所述慢病毒载体进行双酶切,将酶切产物分别经过琼脂糖凝胶电泳分离,获得双酶切后的含有所述嵌合抗原受体的目的片段和双酶切后慢病毒载体,
(3)将步骤(2)中的含有所述嵌合抗原受体的目的片段和步骤(2)中的慢病毒载体进行连接,将连接产物进行转化,提取质粒,获得含有嵌合抗原受体结构的重组质粒,所述重组质粒为联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体。在某些实施方式中,所述步骤(2)中的双酶切位点为ecori和noti,所述(3)中含有所述嵌合抗原受体的目的片段和慢病毒载体连接的摩尔比为5:1。
本发明还提供了联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体的应用,将上述的联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体进行慢病毒包装,经离心浓缩后获得高滴度的慢病毒悬液,所述慢病毒悬液用于感染t细胞,获得car-t细胞,所述car-t细胞通过识别特异性蛋白epcam和趋化因子ccl19靶向杀伤乳腺癌细胞。
在某些实施方式中,所述慢病毒包装采用三质粒包装系统,所述三质粒包装系统包括pspax2质粒、pmd2g质粒和所述联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体,所述pspax2质粒、所述pmd2g质粒、所述联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体的比例为27:3:20,所述慢病毒包装采用293t细胞作为慢病毒的包装细胞。
本发明具有以下有益效果:本发明针对治疗载体的car结构包括epcam单链抗体、趋化因子ccl19两个特异性结构;epcam单链抗体是根据多种乳腺癌细胞表面会表达肿瘤相关抗原epcam确定的特异性结构,该结构表达的anti-epcam一方面可靶向性杀伤肿瘤细胞;另一方面,通过趋化因子ccl19,可以增强t淋巴细胞对胃癌细胞的杀伤,从而提高car-t免疫疗法抗胃癌的效果。当t细胞通过病毒感染方式获得该载体并表达该car结构后,t细胞即可靶向性识别并杀伤乳腺癌细胞。
附图说明
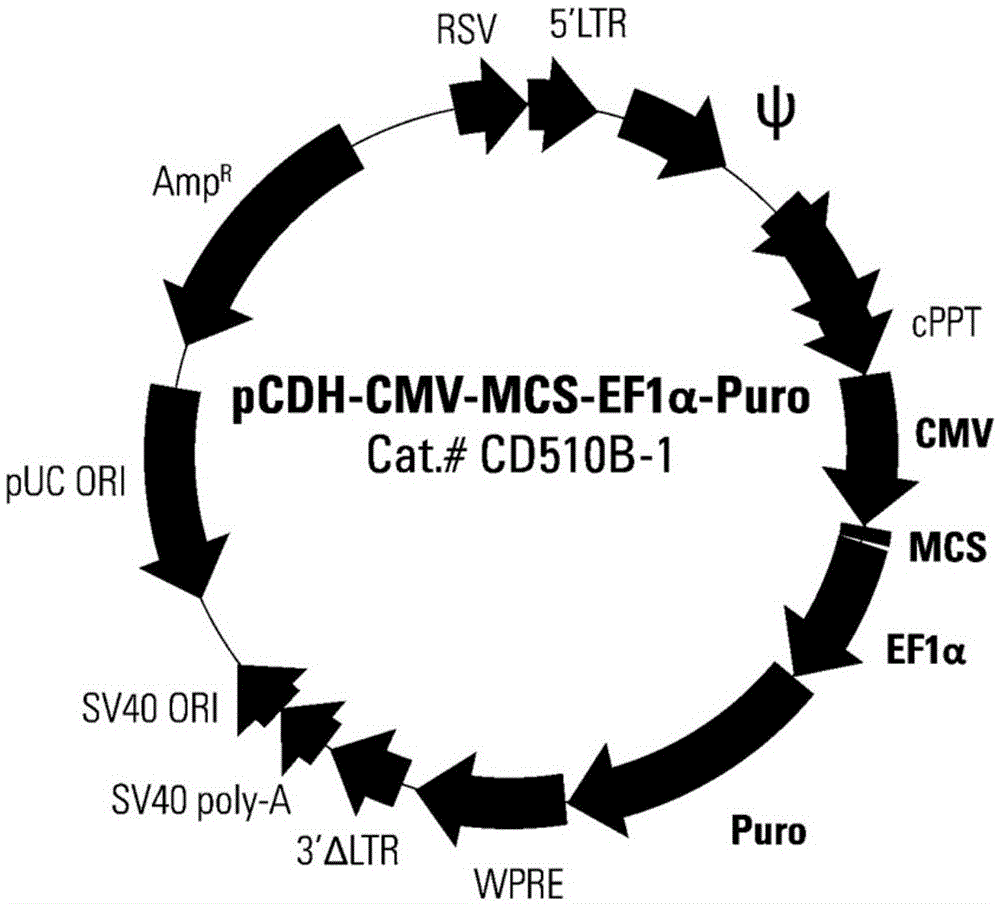
图1是本发明的慢病毒表达载体pcdh-cmv-mcs-ef1-puro结构示意图;
图2是本发明的car结构示意图;
图3是本发明的慢病毒表达载体pcdh-cmv-mcs-ef1-puroecori与noti双酶切产物琼脂糖凝胶电泳图;
图4是本发明的联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体ecori与noti双酶切产物琼脂糖凝胶电泳图;
图5是本发明的car-t细胞的流式细胞检测图;
图6是本发明的rtca检测car-t细胞对sk-br-3的杀伤效率曲线图;
图7是本发明的car-t细胞对sk-br-3杀伤24h后ifngamma因子的elisa检测柱状图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明进一步详细说明。
本发明提供了联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体,具体方案如下:包括嵌合抗原受体和载体,嵌合抗原受体连接在载体上,嵌合抗原受体包括两种特异性结构分别为:epcam单链抗体和趋化因子ccl19,epcam单链抗体的核苷酸序列如seqidno.2所示,趋化因子ccl19的核苷酸序列如seqidno.8所示。本发明提供的载体的car结构包括epcam单链抗体,epcam单链抗体是根据epcam在乳腺癌组织中高表达而确定的特异性结构,该结构表达的抗体anti-epcam负责识别乳腺癌组织中高表达的epcam可靶向性结合乳腺癌细胞,可有效避免肿瘤细胞mhc表达下调这一免疫逃逸机制。趋化因子ccl19可诱导免疫细胞浸润到肿瘤组织中发挥免疫功能同时可以抑制肿瘤内免疫抑制因子的释放,间接促进免疫细胞抗原提呈作用,并抑制血管形成,最终抑制肿瘤的生长,使重组t细胞表现出更强的肿瘤细胞杀伤能力,也同时增强自身免疫系统的抗肿瘤能力。
嵌合抗原受体的结构组成为cd8leader-epcamscfv-cd8α-cd28-cd137-cd3ζ-ires-ccl19(如图2所示)。cd8leader为cd8蛋白的引导肽部分,可以将蛋白定位于细胞外,核苷酸序列如seqidno.1所示;epcamscfv是根据乳腺癌组织高表达epcam设计的特异性抗原结合域;cd8α为跨膜区,连接胞外抗原结合域和胞内信号域,能将car结构锚定于t细胞膜上,核苷酸序列如seqidno.3所示;cd28-cd137为共刺激结构域,转导增殖信号并诱导细胞因子的产生,刺激t细胞活化,cd28核苷酸序列如seqidno.4所示,cd137核苷酸序列如seqidno.5所示;cd3ζ为信号转导域,当胞外区和目标抗原结合时,就会向胞内传导tcr样信号,激活t细胞,发挥靶向性杀伤肿瘤细胞的作用,核苷酸序列如seqidno.6所示,ires为核糖体识别位点,能招募核糖体对mrna进行翻译,当ires与外源cdna融合时,ires能独立地起始翻译,核苷酸序列如seqidno.7所示;ccl19可趋化t细胞浸润肿瘤组织,介导肿瘤免疫,并抑制肿瘤内免疫抑制因子的释放,间接促进免疫细胞抗原提呈作用,并抑制血管形成,最终抑制肿瘤的生长,核苷酸序列如seqidno.8所示。本发明中提到的car结构赋予了t细胞更强的增殖性,持久的生命力,使其表现出更强的肿瘤细胞杀伤能力。
载体包括puc19质粒、慢病毒载体。慢病毒载体为pcdh-cmv-mcs-ef1-puro。通过snapgene软件分析该载体并查找相关文献可知,pcdh-cmv-mcs-ef1-puro用ecori与noti双酶切插入片段。该表达载体包括:cmv启动子-是哺乳动物细胞特异性启动子,驱动能力较强;多克隆位点(mcs)-包含多个限制性酶切位点(restrictionsite),是外源基因插入的位置;wpre元件-可提高mrna的polya加尾效率,改进转移基因的表达效率;sv40polya序列-能有效终止转录以及为转录的mrna添加polya尾;杂交型rsv/5’ltr-含有启动子和增强子等调控元件,使其在293t细胞中高水平的表达全长病毒转录物;遗传要素(cppt,gag,env,ltrs)-用于包装、转导和稳定地将病毒表达结构整合到宿主的基因组dna中;sv40origin-使质粒在包装细胞中稳定增殖。
该慢病毒表达载体可作为使目的基因在几乎所有哺乳动物细胞包括非分裂细胞和分裂细胞中表达的最有效载体,其可容载外源基因片段大,转染效率较高,对t细胞也能达到满意的转染效果。
一、实验材料
1.慢病毒表达质粒pcdh-cmv-mcs-ef1-puro,慢病毒包装质粒pmd2g,载体质粒pspax2购自sbi;慢病毒表达质粒pcdh-cmv-mcs-ef1-puro结构如图1所示;
2.car结构序列由上海怡豪生物科技有限公司设计,由生工生物工程(上海)股份有限公司合成,以puc19质粒形式保存;
3.限制性核酸内切酶ecori、noti购自neb;
4.t4dnaligase、freeh2o购自宝生物;
5.感受态细胞购自trans;
6.胶回收试剂盒,质粒小提试剂盒购自天根生化科技有限公司;
7.293t细胞、sk-br-3细胞购自中科院细胞库;
8.fbs、dmem、1640培养基,pbs,opti-mem,lipofectamine2000购自gibco;
9.cd3单抗、cd28单抗、ch38蛋白、il-2购自于上海近岸蛋白质科技有限公司;
10.multiskango酶标仪+udrop超微量板、流式细胞仪购自thermofisher;
11.he120水平电泳槽、tanon凝胶成像仪购自tanon;
12.隔水式恒温培养箱、恒温培养摇床购自上海一恒科技有限公司;
13.bio-radmini-proteantetracell小型电泳系统购自bio-rad;
14.奥林巴斯显微镜购自奥林巴斯;
15.接种环、涂布棒购自洁特生物过滤股份有限公司;
16.注射器,0.45μm滤膜、各规格的培养皿,培养瓶,多孔培养板,各种规格离心管购自corning。
二、联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体的构建方法
(一)质粒提取
lb液体培养基的配制方法:电子天平称取5g液体培养基干粉于500ml锥形瓶,加100ml超纯水,锡箔纸封口后,于高压蒸汽灭菌锅中进行灭菌,冷却至40℃-50℃时,以1000:1加入0.2%氨苄青霉素(amp),小心混匀后,转入到干净的500ml试剂瓶中备用,储存条件为4℃。
lb固体培养基的配制方法:电子天平称取5g固体培养基干粉于500ml锥形瓶,加100ml超纯水,锡箔纸封口后,于高压蒸汽灭菌锅中进行灭菌,冷却至40℃-50℃时,以1000:1加入0.2%氨苄青霉素,小心混匀后,倒板,凝固后,贴封口膜储存于4℃。
从-80℃冰箱分别取出含有慢病毒表达质粒pcdh-cmv-mcs-ef1-puro和puc19质粒的甘油菌,分别取5μl接种于5mllb液体培养基(amp抗性)中,于恒温摇床振荡培养12-16h,条件为37℃,250rmp。
按照购自天根生化科技有限公司的质粒小提试剂盒(货号:dp103-03)的说明书进行质粒提取,获得慢病毒表达质粒pcdh-cmv-mcs-ef1-puro和含有epcam单链抗体和趋化因子ccl19的car结构的puc19质粒。
(二)酶切、连接、转化
将已提取的慢病毒表达质粒pcdh-cmv-mcs-ef1-puro和含有epcam单链抗体和趋化因子ccl19的car结构的puc19质粒同时进行ecori、noti双酶切,将酶切产物分别进行琼脂糖凝胶电泳,用凝胶成像仪观察并记录结果,检测结果见附图3。
用天根琼脂糖凝胶回收试剂盒(货号:dp209-02)说明书进行目的条带回收,将回收片段按car结构:pcdh-cmv-mcs-ef1-puro=5:1的摩尔比进行连接,并进行转化至感受态细胞,将转化后的感受态细胞滴于预热的固体培养基上,做好标记,37℃孵箱过夜。
(三)提质粒、酶切验证、测序
挑取部分菌落于5mllb液体培养基(amp抗性)中,于恒温摇床进行增菌培养并进行质粒抽提,质粒抽提之前取出500μl于1.5mlep管中,用作菌种保存,储存于-80℃;将抽提产物采用ecori、noti双酶切验证,取条带正确的质粒1μg送生工生物工程(上海)有限公司进行测序(如图4所示,图中目的片段为car结构),条带异常的质粒以及留存的菌液均丢弃。将测序结果正确的质粒进行抽提,测序结果错误的质粒及其菌液均丢弃。
三、联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体的应用
(一)浓缩病毒液的制备
采用三质粒包装系统进行慢病毒包装。三质粒分别为含有car结构的慢病毒表达质粒pcdh-cmv-mcs-ef1-puro,慢病毒包装质粒pmd2g,载体质粒pspax2。细胞为293t细胞。
具体实施步骤如下:
(1)转染前24h内进行铺板:一般选择传代次数在3代以内的细胞,根据细胞生长密度和状态调整细胞密度,生长密度达到80%的293t细胞进行铺板;
(2)待生长密度达60-90%,细胞状态良好,即可进行病毒包装;
(3)按照pspax2质粒、pmd2g质粒、联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体(重组质粒)的比例为27:3:20进行病毒包装,以6cm皿为例,所需的三质粒混合液配比如下:按照各质粒浓度确定质粒加入量。
重组质粒3μg
pmd2g0.5μg
pspax24μg
(4)转染试剂选择lipofectamine2000(4℃保存),加入量为2μl/μg质粒;
(5)将(3)中质粒混合物与(4)中转染试剂混合物混于一管中,室温静止20min后,加入换液细胞中,继续培养;
(6)分别收集48h、72h后培养上清,通过0.45μm滤膜过滤;
(7)将收集的病毒液采用peg8000浓缩法进行浓缩,并测定病毒滴度,储存于﹣80℃备用。
(二)病毒液感染t细胞
1、pbmc分离
1)用含有肝素的真空采血管收集约6ml人外周新鲜血液;
2)稀释:室温下加入等体积的pbs,轻轻吹打混匀;
3)加样:取50ml离心管,吸取6mlficoll(淋巴细胞分离液)于离心管中(ficoll与稀释前血液的体积比为1:1),离心管倾斜45°,将稀释后的血液在ficoll液面上方约1cm处沿管壁缓慢加至ficoll上面;
4)离心:18-20℃,2000rpm,30min,离心后从管底至液面分四层,依次为红细胞和粒细胞层、分层液层、单个核细胞层、血浆层;
5)回收:将移液管直接插入云雾层(或者先吸去上层的血浆),轻轻吸出云雾层,放入新的离心管中;
6)洗涤:加入至少于pbmc(外周血单个核细胞)体积3倍的pbs,18-20℃,2000rpm,10min,两次;
7)细胞计数:弃上清,加1ml淋巴细胞培养基,吹打混匀,制备成pbmc细胞悬液。采用血细胞计数板计数:取一滴pbmc悬液与一滴2%台盼蓝染液混匀后加于血细胞计数板中,在显微镜下计数4大格内细胞总数。细胞数/ml=4个大方格细胞总数/4×104×2(稀释倍数)。
2、t细胞的激活与慢病毒感染
(1)实验前准备:
1)anti-cd3单抗液配制:cd3单抗50μg溶于5mlpbs溶液中,配制成浓度为10μg/ml的溶液,溶解后按照每ep管400μl进行分装,并置于-80℃冰箱保存。(此浓度下每24孔板内加入175μl抗体溶液);
2)anti-cd28单抗液配制:cd28单抗50μg溶于5mlpbs溶液中,配制成浓度为10μg/ml的溶液,溶解后按照每ep管400μl进行分装,并置于-80℃冰箱保存。(此浓度下每24孔板内加入175μl抗体溶液);
3)ch-38蛋白液配制:ch38蛋白500μg溶于10mlpbs溶液中,配制成50μg/ml溶液,溶解后按照每ep管400μl进行分装,并置于-80℃冰箱保存。(此浓度下每24孔板内加入175μl抗体溶液);
4)il-2因子配制:il-2蛋白固体按1×107u/mg进行配制,每50μgil-2蛋白加入500μl的pbs溶液,配制成103u/μl的浓度,配制后按照每ep中加入32μl进行分装,并置于-80℃冰箱保存;
5)淋巴细胞培养基配制:takara-551h3淋巴细胞培养基每50ml加入30μl已分装的il-2溶液,0.5ml双抗,250μl自体血清。
(2)实验流程:
day﹣1:24孔板包被:取corning24孔板,以2孔为例,在2孔中各加入cd3单抗液175μl,cd28单抗液175μl,ch-38蛋白液175μl。加入后轻震荡混匀后,用封口膜将孔板封闭,放入4℃冰箱内过夜。细胞复苏:取液氮中的pbmc细胞,复苏;
day0:清洗包被板:取出昨日包被的24孔板,弃去上清,pbs清洗2次后,加入pbs待用;
pbmc铺板:收集pbmc细胞,计数并将浓度最终调整到0.7×106cells/ml,每孔中加入400μl细胞悬液,即每孔中加入2.8×105个cells;
病毒感染:以moi=30进行感染,配制1ml病毒培养基悬液,加入24孔板中,1000g离心30min,将离心机温度调节至32℃;
day1-day2:观察细胞状态;
day3:将24孔板中的所有细胞转移至加入10ml培养基的25cm2培养瓶中,观察细胞状态;
day4-day7:观察细胞状态以及细胞数量,若细胞开始明显扩增,并局部区域细胞密度较多,加入10ml培养基;
day8:此时25cm2培养瓶中的细胞已经长满,转移到加入20ml培养基的75cm2培养瓶中继续培养;
day9-day10:观察细胞状态,当细胞在75cm2培养瓶中处于充满状态时,停止继续生长,富集细胞并计算扩增比例,流式检测检测细胞分型,进行细胞杀伤检测或细胞冻存等后续实验。
四、car-t细胞的鉴定与检测
(一)流式细胞术检测car结构阳性表达率
1、检测细胞cd3、cd4、cd8阳性率
1)将取得的nc组细胞(未进行病毒感染)和样本组细胞(已进行病毒感染)使用pbs+2%bsa温和洗涤2次,离心条件为1500rpm、3min;
2)nc管中加入1000μlpbs+2%bsa,分装成5管,分别为nc、nc-cd3、nc-cd4、nc-cd8、nc-cd3/4/8,样本管中加入200μlpbs,标记为样本-cd3/4/8,分别加入cd3/4/8抗体5μl/20μl/20μl,温和混匀;
3)室温避光孵育30min后,1500rpm,3min,弃去废液;
4)加入200μlpbs+2%bsa,温和混匀重悬,1500rpm/3min,弃去废液;
5)加入100μlpbs+2%bsa,温和混匀重悬后即可上机检测;
如图5所示,cd3+细胞占所检测细胞总量的96.13%,cd4-cd8+细胞占cd3+细胞总量的52.51%,cd4+cd8-细胞占cd3+细胞总量的39.87%,符合t细胞的表型。
2、检测car结构阳性表达率
1)将取得的nc组细胞(未进行病毒感染)和样本组细胞(已进行病毒感染),使用pbs+2%bsa温和洗涤2次,1500rpm/6min,弃去废液;
2)nc管中加入200μlpbs,重悬;样本管中加入100μlpbs,重悬,再加入100μl一抗工作液(3μg/ml),混匀;
3)室温孵育1h,1500rpm/3min,弃去废液;
4)加入200μlpbs,温和混匀重悬,1500rpm/3min,弃去废液;
5)nc管中加入200μlpbs,重悬;样本管中加入200μlpbs,重悬,再加入5μl二抗工作液,混匀;
6)室温避光孵育1h后,1500rpm/3min,弃去废液,使用pbs+2%bsa温和洗涤3次,离心条件为1500rpm、3min,弃去废液;
7)加入100μlpbs,温和混匀重悬后上机检测。
如图5所示,car-t细胞占t细胞总量的53.47%。
(二)rtca实时细胞杀伤检测
1)以乳腺癌细胞sk-br-3为例,消化后制备成细胞悬液,吹打混匀后进行细胞计数;
2)将细胞悬液稀释成5×104cells/ml浓度,放置在冰上备用;
3)将rtca检测板取出,加入50μl培养基;
4)在rtca检测仪程序中编选本次试验的试验程序;
5)将rtca检测板置入检测仪中,观测程序中messege项是否正常,待正常后启动实验程序;
6)程序1运行完毕后取出检测板,在对应孔中加入肿瘤细胞悬液100μl,加入之前混匀每管细胞悬液;
7)细胞悬液加入后,将检测板置入培养箱中静置30min,使细胞自然沉降;
8)30min后,将检测板放入检测仪中,运行程序2;
9)24h后观察细胞生长曲线,待细胞处于对数生长期时,准备加入效应t细胞;
10)培养瓶中取出效应t细胞,离心,清洗,计数,按不同效靶比配制效应组细胞浓度;
11)暂停程序,取出检测板,对应位置加入效应细胞50μl,放回检测仪中,继续程序,每天观察。
图6为rtca检测联合epcam单链抗体和趋化因子ccl19的car-t细胞对sk-br-3细胞的杀伤效率,图中5:1表示:效应细胞:靶细胞=5:1;2.5:1表示:效应细胞:靶细胞=2.5:1;1:1表示:效应细胞:靶细胞=1:1;onlytumor表示:未加t细胞,仅有肿瘤细胞。如图所示,car-t细胞对肿瘤细胞有明显的杀伤效果,且其杀伤效果具有浓度依赖性,效应细胞比例越高,杀伤效果越好。
(三)elisa检测细胞因子分泌
1)用ddh2o稀释10×包被液buffer,按比例配制250×包被蛋白,例如2ml包被液buffer中加入8μl250×包被蛋白;
2)向corning9018elisa高亲和96孔板中加入100μl/孔1)中配制完成的包被液,密封放入4℃冰箱中,过夜;
3)使用pbst(0.05%tween20)对已包被的96孔板进行清洗,3次;
4)用ddh2o配制5×封闭液,200μl/孔加入,室温下封闭1h;
5)按瓶装标准品要求加入1×封闭液进行配制,进行7次倍比稀释,同时对样品(取rtca检测实验中的car-t细胞对sk-br-3杀伤24h后的上清液)进行5倍稀释;
6)pbst清洗封闭后的板子5次,加入标准品和稀释后的样品液,室温孵育2h或4℃过夜;
7)pbst清洗4次;
8)使用1×封闭液稀释250×检测抗体,100μl/孔中加入,室温孵育1h;
9)pbst清洗4次,使用1×封闭液稀释250×hrp,100μl/孔中加入,室温孵育30min;
10)pbst清洗5次,每孔中加入1×tmb试剂100μl,室温孵育15min;
11)加入50μl/孔终止液终止显色;
12)酶标仪450nm检测od值。
图7为car-t细胞对sk-br-3杀伤24h后ifngamma因子的elisa检测,图中5:1表示:效应细胞:靶细胞=5:1;2.5:1表示:效应细胞:靶细胞=2.5:1;1.25:1表示:效应细胞:靶细胞=1.25:1。car-t细胞与sk-br-3细胞共培养24h后,有明显的细胞因子ifngamma释放,效应细胞:靶细胞为5:1时,细胞因子ifngamma释放最多。
综上所述,本发明提供的联合epcam单链抗体和ccl19杀伤乳腺癌细胞的car载体应用于感染t细胞,获得car-t细胞可表达针对乳腺癌细胞表面的肿瘤相关抗原epcam的抗体anti-epcam,使得其能够靶向性结合乳腺癌细胞,更精准的识别并杀伤表达epcam肿瘤相关抗原的乳腺癌细胞,有效避免了脱靶效应的发生;同时,趋化因子ccl19可诱导免疫细胞浸润到肿瘤组织中发挥免疫功能同时可以抑制肿瘤内免疫抑制因子的释放,间接促进免疫细胞抗原提呈作用,并抑制血管形成,最终抑制肿瘤的生长,使重组t细胞表现出更强的肿瘤细胞杀伤能力,也同时增强自身免疫系统的抗肿瘤能力,当t细胞通过病毒感染方式获得该载体并表达该car结构后,t细胞即可靶向性识别并杀伤乳腺癌细胞。另外,本发明中提到的car结构赋予了t细胞更强的增殖性,持久的生命力,使其表现出更强的肿瘤细胞杀伤能力。
上述仅本发明较佳可行实施例,并非是对本发明的限制,本发明也并不限于上述举例,本技术领域的技术人员,在本发明的实质范围内,所作出的变化、改型、添加或替换,也应属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!