一种基于PDL1/PDL2超增强子的免疫检测点抑制剂的应用的制作方法
本发明属于医疗研究技术领域,具体涉及一种基于pdl1/pdl2超增强子的免疫检测点抑制剂的应用。
背景技术:
肿瘤细胞为了能够生长,必须逃逸免疫系统的监视,为了实现这个过程,肿瘤细胞表面表达多种能够逃过免疫细胞识别或是抑制免疫细胞功能的分子。pdl1和pdl2是pd-1的配体,pd-l1和pd-l2通过和免疫细胞主要是t细胞表面的pd-1结合,来抑制t细胞的功能,导致免疫系统无法有效清除肿瘤细胞。为了实现肿瘤细胞表面pdl1和pdl2的高表达,肿瘤细胞发展了多种途径,如蛋白稳定、rna稳定等。具体上,肿瘤细胞如何实现pdl1、pdl2或pdl1和pdl2同时高表达的机制还没有完全理解清楚,由于肿瘤的发生、发展和pdl1及pdl2的表达程度密切相关,因此肿瘤细胞能否大量诱导pdl1和pdl2的表达,将决定其能否发生和进一步的发展。通过抑制pd1、pdl1和pdl2的功能,可以增强免疫系统的功能,实现清除肿瘤细胞的目的,这也是现在临床治疗肿瘤最有效和热门的方法,免疫检测点抑制剂(pd-1受体及其配体pdl1或pdl2是免疫检测点的重要分子之一)。目前临床的肿瘤治疗,主要是针对pd-1或pdl1,肿瘤细胞中pdl1的表达,决定了病人对免疫检测点抑制剂的疗效。
但是,免疫检测点抑制剂由于是广谱地激活免疫系统,往往会导致免疫相关副作用的发生,特别严重的病人可能会发生心肌炎而死亡。因此,能否寻找到肿瘤细胞内特异的pdl1和pdl2激活机制,将有助于我们开发肿瘤特异的治疗策略,使肿瘤病人体内的免疫系统能特异地激活,产生肿瘤特异性免疫,从而避免免疫相关副作用的产生。
技术实现要素:
本发明要解决的技术问题是提供一种基于pdl1/pdl2超增强子的免疫检测点抑制剂的应用,抑制细胞表面pdl1和pdl2的高表达,减少pdl1或pd1抗体的用量,增加疗效和减少副作用。
为解决上述技术问题,本发明的实施例提供一种基于pdl1/pdl2超增强子的免疫检测点抑制剂的应用,用于抑制细胞表面pdl1和pdl2的高表达。
其中,所述的基于pdl1/pdl2超增强子的免疫检测点抑制剂用于抑制细胞表面pdl1和pdl2的mrna表达和蛋白表达。
其中,所述的基于pdl1/pdl2超增强子的免疫检测点抑制剂的应用,包括如下过程:
(1)pdl1/pdl2超增强子使细胞表面pdl1和pdl2高表达的验证
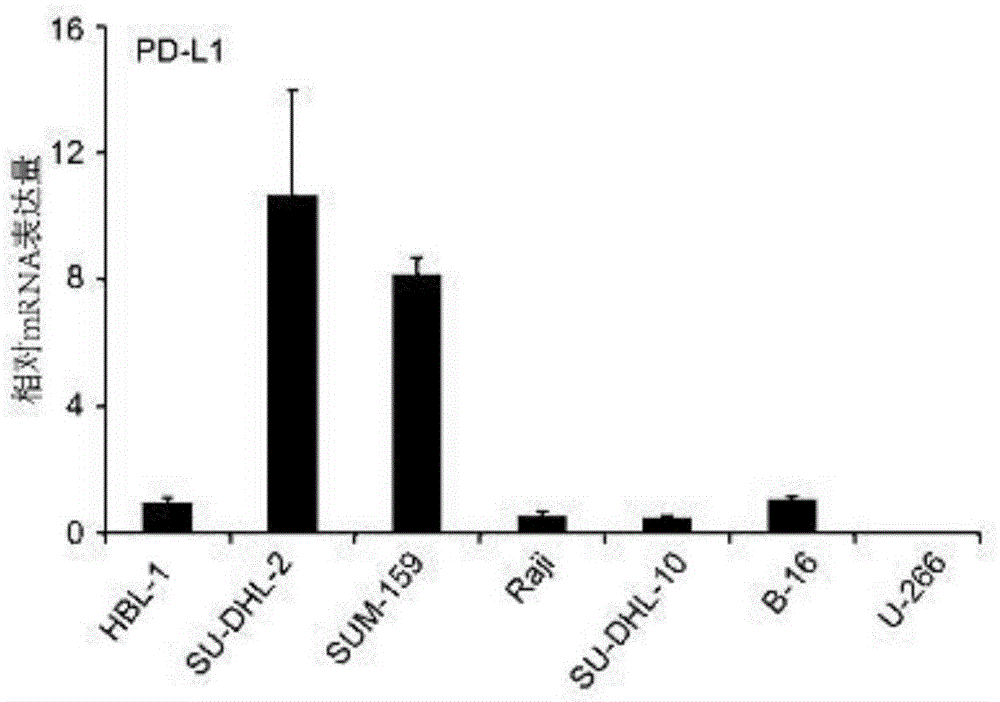
在基因水平上,通过实时定量pcr技术检测hbl、su-dhl-2、sum159、raji、su-dhl-10、b-16、u266细胞内pdl1及pdl2的拷贝数,发现sum159细胞较其他细胞系高表达pdl1及pdl2;
(1-1)实时定量pcr步骤:
(1-1-1)提取rna:
1、收集hbl、su-dhl-2、sum159、raji、su-dhl-10、b-16、u266细胞;
2、各加1mltrizol裂解细胞;
3、各加0.2ml氯仿,4℃下12000rpm离心15分钟分离两相;
4、提取水相层,加入等体积异丙醇,4℃下12000rpm离心15分钟沉淀rna;
5、加入1ml的75%乙醇,清洗沉淀的rna,4℃下7000rpm离心5分钟;
6、干燥后加入depc水溶解rna;
(1-1-2)逆转录:使用逆转录试剂盒revertaidfirststrandcdnasynthesiskit(thermo),体系如下:
(1-1-3)实时定量pcr实验:
(1-2)超增强子抑制剂jq1和ibet处理后,pdl1和pdl2表达受到抑制
(1-2-1)基因水平上
1、sum159细胞,分别用0.2um,0.5um的jq1处理,以及不处理组作为对照;
2、加药48h后,收集细胞,提取rna;
3、通过实时定量pcr检测sum159细胞内的pdl1和pdl2表达,发现拷贝数明显降低;
(1-2-2)蛋白水平上
1、sum159细胞,分别用0.5um,1um的jq1处理,2um,5um的ibet处理,以及不处理组作为对照
2、加药48h后,收集细胞,提取蛋白;
3、通过westernblot免疫印迹技术检测pdl1及pdl2蛋白的表达。
其中,步骤(1-2-2)中,westernblot免疫印迹技术包括如下实验步骤:
(1-2-2-3-1)收集细胞,用适当ripa裂解液裂解细胞提取蛋白,通过bca试剂盒测定蛋白浓度;
(1-2-2-3-2)电泳:配置12%的sds-page凝胶,保持样品蛋白上样量相同,进行上样电泳;
(1-2-2-3-3)转膜:在电流300ma的条件下转膜60min,使蛋白转移到pvdf膜上;
(1-2-2-3-4)封闭:加入5%的脱脂牛奶,在摇床上封闭60min;
(1-2-2-3-5)一抗孵育:pdl1单克隆抗体(abcam,ab213524),pdl2单克隆抗体(abcam,ab187662)或gapdh单克隆抗体(santacruz,sc-365062)均以1:1000的比例稀释,4℃孵育过夜;
(1-2-2-3-6)二抗孵育:一抗回收洗涤后,根据一抗来源,选择二抗,按照1:2000的比例稀释,室温孵育2h;
(1-2-2-3-7)显影:二抗洗涤干净后,使用ecl试剂盒,按照说明进行显影检测蛋白。
本发明的上述技术方案的有益效果如下:本发明通过基因编辑技术,或抑制使超增强子pdl1l2-se激活的信号通路,使肿瘤细胞无法高表达pdl1和pdl2,从而使肿瘤细胞无法产生免疫逃逸,激发机体的肿瘤特异性免疫反应,增加疗效的同时,降低副作用。本发明可以和免疫检测点抑制剂联合应用,减少pdl1或pd1抗体的用量,增加疗效和减少副作用。本发明也可以和化疗联用,增加疗效降低副作用。本发明还可以和放射疗法联用,增加疗效,降低副作用。
附图说明
图1为本发明中sum-159细胞高表达pdl1的示意图;
图2为本发明中sum-159细胞高表达pdl2的示意图;
图3为本发明中超增强子抑制剂jq1抑制pdl1和pdl2的mrna表达的示意图;
图4为本发明中超增强子抑制剂jq1和i-bet-762抑制pdl1和pdl2的蛋白表达的示意图;
图5为基因pdl1和pdl2之间存在一个超增强子的示意图;
图6为pdl1l2-se切除后,sum-159细胞内的pdl1和pdl2的表达显著下降的示意图;
图7为pdl1l2-se敲除的肿瘤细胞内,肿瘤细胞失去抵抗t细胞的杀伤能力的示意图;
图8为用超增强子抑制剂jq1处理肿瘤细胞会使肿瘤细胞失去抵抗t细胞的杀伤能力的示意图;
图9为抑制使pdl1l2-se超增强子活化的信号通路的示意图。
具体实施方式
为使本发明要解决的技术问题、技术方案和优点更加清楚,下面将结合附图及具体实施例进行详细描述。
本发明提供了一种基于pdl1/pdl2超增强子的免疫检测点抑制剂的应用,用于抑制细胞表面pdl1和pdl2的高表达,即:用于抑制细胞表面pdl1和pdl2的mrna表达和蛋白表达。
将pdl1/pdl2超增强子定义为pdl1l2-se,是在pdl1基因和pdl2基因中间存在的一段dna序列:hg19_dnarange=chr9:5498729-5502895,这段序列长度7709bp。
所述的基于pdl1/pdl2超增强子的免疫检测点抑制剂的应用,包括如下过程:
(1)pdl1/pdl2超增强子使细胞表面pdl1和pdl2高表达的验证
在基因水平上,通过实时定量pcr技术检测hbl、su-dhl-2、sum159、raji、su-dhl-10、b-16、u266细胞内pdl1及pdl2的拷贝数,发现sum159细胞较其他细胞系高表达pdl1及pdl2。
(1-1)实时定量pcr步骤:
(1-1-1)提取rna:
1、收集hbl、su-dhl-2、sum159、raji、su-dhl-10、b-16、u266细胞;
2、各加1mltrizol裂解细胞;
3、各加0.2ml氯仿,4℃下12000rpm离心15分钟分离两相;
4、提取水相层,加入等体积异丙醇,4℃下12000rpm离心15分钟沉淀rna;
5、加入1ml的75%乙醇,清洗沉淀的rna,4℃下7000rpm离心5分钟;
6、干燥后加入depc水溶解rna。
(1-1-2)逆转录:使用逆转录试剂盒revertaidfirststrandcdnasynthesiskit(thermo),体系如下:
(1-1-3)实时定量pcr实验:
(1-2)超增强子抑制剂jq1和ibet处理后,pdl1和pdl2表达受到抑制
(1-2-1)基因水平上
1、sum159细胞,分别用0.2um,0.5um的jq1处理,以及不处理组作为对照;
2、加药48h后,收集细胞,提取rna;
3、通过实时定量pcr检测sum159细胞内的pdl1和pdl2表达,发现拷贝数明显降低;
(1-2-2)蛋白水平上
1、sum159细胞,分别用0.5um,1um的jq1处理,2um,5um的ibet处理,以及不处理组作为对照
2、加药48h后,收集细胞,提取蛋白;
3、通过westernblot免疫印迹技术检测pdl1及pdl2蛋白的表达。
其中,westernblot免疫印迹技术包括如下实验步骤:
(1-2-2-3-1)收集细胞,用适当ripa裂解液裂解细胞提取蛋白,通过bca试剂盒测定蛋白浓度;
(1-2-2-3-2)电泳:配置12%的sds-page凝胶,保持样品蛋白上样量相同,进行上样电泳;
(1-2-2-3-3)转膜:在电流300ma的条件下转膜60min,使蛋白转移到pvdf膜上;
(1-2-2-3-4)封闭:加入5%的脱脂牛奶,在摇床上封闭60min;
(1-2-2-3-5)一抗孵育:pdl1单克隆抗体(abcam,ab213524),pdl2单克隆抗体(abcam,ab187662)或gapdh单克隆抗体(santacruz,sc-365062)均以1:1000的比例稀释,4℃孵育过夜;
(1-2-2-3-6)二抗孵育:一抗回收洗涤后,根据一抗来源,选择二抗,按照1:2000的比例稀释,室温孵育2h;
(1-2-2-3-7)显影:二抗洗涤干净后,使用ecl试剂盒,按照说明进行显影检测蛋白。
本发明除了提供了上述超增强子抑制剂抑制pdl1和pdl2表达的过程,还提供了如下过程:
(2)pdl1/pdl2超增强子的切除过程
首先通过数据库分析,发现在pdl1与pdl2之间一段dna序列(chr9:5498729-5502895)高度乙酰化,由于超增强子会引起乙酰化过程的发生,于是我们推测这一段序列可能存在超增强子,我们将其命名为pdl1l2-se。于是在dna序列:hg19_dnarange=chr9:5498729-5502895的上下游分别设计两个sgrna:sgrna-1、sgrna-2,构建了两个新的的crispr/cas9质粒。
(2-1)构建sgrna-crispr质粒
(2-1-1)
1、酶切载体
2、琼脂糖凝胶电泳;
3、切胶回收。
(2-1-2)sgrna引物退火
(2-1-3)连接
(2-2)构建稳转细胞系
(2-2-1)种板:转染前一天在六孔板里种sum159细胞,细胞密度保持在30%-50%左右;
(2-2-2)转染:
1、1ugsgrna-1和1ugsgrna-2crispr/cas9质粒同时加入50ulopti-mem无血清转染培养基中,同样地,1ugsgvector质粒加入50ulopti-mem无血清转染培养基中;
2、2ullipo2000加入50ulopti-mem无血清转染培养基中;
3、室通放置5min后,稀释的质粒与lipo2000混匀放置20min,后均匀滴加至六孔板内。
(2-2-3)药筛:转染48h后,加入浓度为2ug/ml的puromysin,连续加药,直至所剩细胞都带有gfp+荧光,停药换成完全培养基继续培养细胞。
(3)pdl1/pdl2超增强子切除后的验证过程
(3-1)genotyping:
(3-1-1)提取dna:收集细胞,胰酶消化离心后,加入50ulbufferl和1ulproteaseplus(bimike.com),55℃30min,95℃5min;
(3-1-2)pcramplification:
(3-1-3)琼脂糖凝胶电泳,显影观察条带位置。
(3-2)测序:将条带所在位置凝胶切下,收集在ep管中,附带上游引物,送由基因测序公司进行基因测序。
(4)pdl1/pdl2超增强子切除后,pdl1和pdl2低表达的验证过程
基因水平上,通过实时定量pcr实验:分别提取sgvector和sgpdl1l2-se的稳转细胞的rna(实验步骤同上),检测pdl1和pdl2的表达,发现sgpdl1l2-se组的pdl1和pdl2的拷贝数较sgvector组明显降低。
蛋白水平上,通过westernblot实验:分别提取sgvector和sgpdl1l2-se的稳转细胞的蛋白(实验步骤同上),检测pdl1的蛋白表达量,发现sgpdl1l2-se组的pdl1蛋白丰度较sgvector组明显降低。
本发明的原理为:研究发现肿瘤细胞通过激活超增强子pdl1l2-se,来激活肿瘤细胞内pdl1和pdl2的高表达,通过基因编辑技术在肿瘤细胞内切除pdl1l2-se后,肿瘤细胞内的pdl1和pdl2的表达明显下降。肿瘤细胞对t细胞的杀伤没有抵抗能力。因此通过基因编辑,或抑制pdl1l2-se超增强子活化的信号通路,可以特异地打开肿瘤特异性免疫反应。
其中,抑制使pdl1l2-se超增强子活化的信号通路的过程如下所述:
如图9所示,在sum-159细胞内,erk抑制剂azd203580能显著抑制pdl1表达,而ikk抑制剂ps-1145对pdl1的表达没有明显效果。说明erk信号通路对维持pdl1的表达,即维持pdl1l2-se的功能极为重要。实验过程:
将培养的sum-159细胞,接种到3.5cm的培养皿中,按图所视浓度,erk抑制剂azd203580或ikk抑制剂ps-1145抑制剂处理sum-159细胞48小时。提前蛋白,用wb检测pd-l1的表达。
为了研究肿瘤细胞使pdl1、pdl2高表达的机制,本发明先对多个肿瘤细胞系内的pdl1、pdl2的mrna进行了检测,发现sum-159细胞高表达pdl1(如图1所示),同时发现sum-159细胞也高表达pdl2(如图2所示)。
超增强子抑制剂jq1抑制pdl1和pdl2的mrna表达(如图3所示),超增强子抑制剂jq1和i-bet-762可以抑制pdl1和pdl2的蛋白表达(如图4所示),表明pdl1和pdl2在肿瘤细胞内的高表达可能和超增强子pdl1l2-se有关。
dna包裹的组蛋白出现大量h3k27ac修饰是超增强子的重要标准,通过数据库的h3k27ac修饰分析发现:基因pdl1和pdl2之间可能存在一个超增强子(我们称为pdl1l2-se)(如图5所示),用crispr-cag9技术,在sum-159细胞内,将pdl1l2-se切除后,sum-159细胞内的pdl1和pdl2的表达显著下降,如图6所示,其中,图6(a)表示敲除超增强子pdl1l2-se的策略图;图6(b)为基因型鉴定pdl1l2-se敲除成功的示意图;图6(c)所示为测序表明pdl1l2-se敲除成功;图6(d)示出敲除pdl1l2-se后,pd-l1和pd-l2的mrna表达显著下调;图6(e)示出敲除超增强子pdl1l2-se后,pd-l1的表达明显降低。
在pdl1l2-se敲除的肿瘤细胞内,肿瘤细胞失去抵抗t细胞的杀伤能力,如图7所示,图中箭头所指的是肿瘤细胞。
另外,用超增强子抑制剂jq1处理肿瘤细胞,同样会使肿瘤细胞失去抵抗t细胞的杀伤能力,如图8所示,图中箭头指的是肿瘤细胞。t细胞杀伤实验的过程为:培养的sum-159细胞,按5000个/孔接种到96孔板中。24小时后,加入25000个/孔的jurkatt细胞。48小时后,观察sum-159细胞形态,显微镜拍照。
本发明的结果表明pdl1l2-se超增强子在肿瘤细胞内的活化,使肿瘤细胞高表达pdl1和pdl2的关键,也是肿瘤细胞逃逸t细胞杀伤的关键,因此,在肿瘤细胞内敲除pdl1l2-se超增强子,或抑制此超增强子的活化,可以使肿瘤细胞失去抵抗t细胞的杀伤能力。
以上所述是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于转录组测序构建的棒状杆菌组成型表达载体启动子的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及gnd基因的表达载体的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及lrp基因的表达载体的制造方法与工艺
- 一株呕吐毒素降解菌及其应用的制造方法与工艺
- 一种具有家蚕血细胞特异性活性的启动子的鉴定方法与流程
- 一种改造的质粒复制子及其应用的制造方法与工艺
- 一种水稻种子特异性启动子Posseed及其应用的制造方法与工艺
- 一种在水稻幼穗特异表达的启动子及其应用的制造方法与工艺
- 一种表达外源基因的启动子及其应用的制造方法与工艺
- 可诱导的CRISPRon或CRISPRi小鼠胚胎干细胞及其应用的制造方法与工艺