一种Z-3-硫氰酸酯基丙烯酸酯化合物的绿色制备方法与流程
本发明涉及一种z-3-硫氰酸酯基丙烯酸酯化合物的绿色制备方法,特别涉及一种利用超声波辅助乳酸催化丙炔酸酯化合物、硫氰酸盐和水一步加成反应合成z-3-硫氰酸酯基丙烯酸酯化合物的方法,属于有机中间体合成
技术领域:
。
背景技术:
:z-3-硫氰酸酯基丙烯酸酯化合物不仅具有非常重要的生理活性,其含有的硫氰酸酯官能团、酯基、烯基团都是重要的可修饰官能团,是一类非常重要的药物及有机合成中间体化合物。现有技术中有酸性离子液体催化丙炔酸酯、硫氰酸盐和水的三组份反应来获得z-3-硫氰酸酯基丙烯酸酯化合物,如(greenchem.2018,20,3683),但是该反应还存在以下不足,限制其实际应用:1)酸性离子液体有毒,其制备过程也不环保,且成本高,无商业化产品。2)z-3-硫氰酸酯基丙烯酸酯化合物的产率为78~94%,反应中存在e式异构体以及丙炔酸酯的分解产物丙炔酸和未反应的丙炔酸酯原料,纯度不高。3)产物的分离需要使用易挥发有机溶剂萃取,产物的提纯需要通过硅胶柱层析分离,分离过程不仅复杂、成本高,还会产生环境污染。4)酸性离子液体循环5次,效率降低13%,使用成本较高。现有的酸性离子液体催化丙炔酸酯、硫氰酸盐和水的三组份反应合成z-3-硫氰酸酯基丙烯酸酯化合物的方法具体情况如下表:技术实现要素:针对现有技术中z-3-硫氰酸酯基丙烯酸酯化合物的合成及分离存在的技术问题,本发明的目的是在于提供一种利用无毒、廉价的乳酸催化丙炔酸酯化合物、硫氰酸盐和水一锅反应合成z-3-硫氰酸酯基丙烯酸酯化合物的方法,该方法产物选择性好、收率高,分离过程简单,低成本,环境友好,有利于工业化生产应用。为了实现上述技术目的,本发明提供了一种z-3-硫氰酸酯基丙烯酸酯化合物的绿色制备方法,该方法是在超声波作用下,乳酸催化丙炔酸酯化合物、硫氰酸盐和水进行加成反应,得到z-3-硫氰酸酯基丙烯酸酯化合物。优选的方案,丙炔酸酯化合物具有式1结构;所述z-3-硫氰酸酯基丙烯酸酯化合物具有式2结构:其中,r1选自h、c1~c10的烷基、卤素取代基或c1~c10的酯基;r2选自c1~c10的烷基、芳基或含取代基的c1~c10的脂肪烃基。上述式1及式2结构中,r1的选择范围较广,r1可以为氢。r1也可以为常见取代基团,如烷基、卤素取代基、酯基等。r1可以为c1~c10的烷基,如可以为直链烷基或带支链的烷基,也可以为c3~c7的环烷基,具体如甲基、乙基、异丁基、环己基等等。r1可以为氟、氯或溴等卤素取代基。r1可以为c1~c10的酯基,如甲氧酰基、乙氧酰基、丁氧酰基等。上述式1及式2结构中,r2选自脂肪烃基、含取代基的脂肪烃基或芳基等。r2可以选自c1~c10的烷基或c2~c10烯烃基,烷基可以为直链烷基或带支链的烷基,也可以为c3~c7的环烷基,具体如甲基、乙基、异丁基、环己基等等;c2~c10烯烃可以是含有一个或多个双键,一般含有一个双键。r2可以选自含取代基的c1~c10烷基或者含有取代基的c2~c10烯烃基;烷基可以为直链烷基,也可以为带支链的烷基或者为c3~c7的环烷基,在烷基主链上的任意碳原子上可以含有常见取代基,取代基可以为芳基、芳杂环基、卤素取代基、氰基、硝基、羟基等常见的取代基;具体来说芳基如苯基或苯环上含常见取代基的取代苯基,常见取代苯基如c1~c5短链烷基、c1~c5烷氧基、卤素取代基(氟、氯、溴等)、三氟甲基基或氰基等取代的苯基,取代基数量可以为一个或多个,取代基位置不限。芳杂环基如五元或六元杂环取代基,如呋喃、噻吩、吡啶等;卤素取代基如氟、氯、溴等;c2~c10烯烃基包含一个或多个双键,在任意一个碳原子上可以包含常见取代基(如上述含取代基的c1~c10烷基的取代基选自范围)。r2可以选自芳基,芳基可以为苯基、萘基,或者由苯基衍生的取代苯基,取代苯基如c1~c5短链烷基取代苯基、c1~c5烷氧基取代苯基、卤素取代苯基、三氟甲基取代苯基或氰基取代苯基等。优选的方案,所述硫氰酸盐可以为常见的硫氰酸钾、硫氰酸钠等易溶性盐。最优选为硫氰酸钾。优选的方案,丙炔酸酯化合物、硫氰酸钾、水及乳酸的摩尔比为1:1~2:1~2:2~5。最优选的摩尔比为1:1.2:1:4。优选的方案,所述加成反应的条件为:在室温下,超声功率为25~45w,超声频率为28khz~60khz,反应时间为15~40min。更进一步优选的超声功率为35w。更进一步优选的超声频率为40khz。在优选的超声条件辅助下进行乳酸催化丙炔酸酯化合物、硫氰酸盐和水的加成反应,不仅可以在缩短反应时间,还能提升转化率。优选的方案,加成反应完成后,向反应体系中加入水稀释,析出z-3-硫氰酸酯基丙烯酸酯产物,通过分液或者过滤,实现产物与乳酸水溶液的分离,得到z-3-硫氰酸酯基丙烯酸酯化合物产品。本发明采用水稀释反应混合产物,即可析出高纯度z-3-硫氰酸酯基丙烯酸酯化合物,不需要使用传统的有机溶剂萃取,硅胶柱层析分离方法,完全避免易挥发有机溶剂的使用。优选的方案,水加入量为乳酸质量的5倍以上。优选5倍质量以上的水,能保证z-3-硫氰酸酯基丙烯酸酯化合物顺利析出。本发明采用的乳酸在加成反应中同时作为催化剂和反应介质。本发明由丙炔酸酯化合物、硫氰酸盐(以硫氰酸钾为例)和水进行加成反应合成z-3-硫氰酸酯基丙烯酸酯化合物的路线如下:具体的反应原理如下反应式所示:乳酸首先活化丙炔酸酯化合物得到联烯中间体im2,硫氰酸根亲核进攻联烯中间体im2的β-碳原子后与乳酸形成分子间氢键,得到中间体im3;中间体im3从氢键的反方向捕获水分子电离产生的质子,得到反式加成产物z-3-硫氰酸酯基丙烯酸酯化合物。相对现有技术,本发明的技术方案带来的有益技术效果:1)本发明采用乳酸作为反应介质和催化剂,易循环使用,安全无毒,对环境友好,来源易得,价格低廉。2)本发明在室温条件下反应,条件温和。3)本发明对丙炔酸酯化合物的选择性广,官能团兼容性好,易于各种基团修饰。4)本发明使用超声波促进反应,在缩短反应时间的同时,原料转化率定量,产物选择性100%,反应中没有e式异构体生成。5)本发明仅需在反应混合物中加入乳酸质量5倍量的水,即可使产物分层析出,得到产物纯品,避免了现有技术中合成的z-3-硫氰酸酯基丙烯酸酯化合物分离提纯过程复杂的难题。6)本发明的乳酸可以回收并多次循环使用,循环5次,效率降低2%,保持较高的催化活性,相比酸性离子液体具有明显优势。7)本发明的z-3-硫氰酸酯基丙烯酸酯化合物具有重要生理活性的硫氰酸官能团以及可修饰烯基团、酯基等,为药物及有机物合成提供重要的有机中间体。附图说明图1为ethyl(z)-3-thiocyanatoacrylate的核磁氢谱图;图2为ethyl(z)-3-thiocyanatoacrylate的核磁碳谱图。具体实施方式以下具体实施例旨在进一步说明本
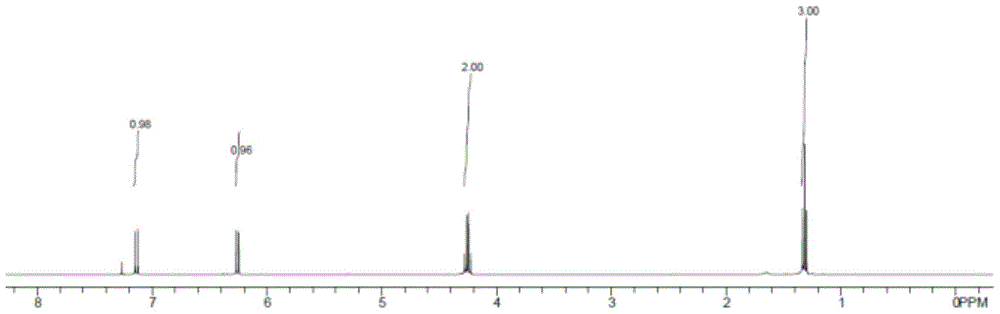
发明内容,而不是限制本发明权利要求的保护范围。对照实施例:以下对照实验组1~17均按以下反应方程式反应:具体操作步骤为:在20ml反应管中,依次加入丙炔酸乙酯(1当量,10mmol)、硫氰酸盐、水以及生物质酸,所得混合液在的超声反应装置中反应30min。反应结束后,加入18ml的水,即可得到目标产物,气相计算产率。上表中实验组1~3考察了各种硫氰酸源对丙炔酸乙酯、硫氰酸钾、水三组份加成反应的影响,从实验数据可以看出,廉价的硫氰酸钾相对硫氰酸钠或硫氰酸铵等可以明显提高三组份加成反应的效率。上表中实验组1及4~5考察了反应原料kscn用量对丙炔酸乙酯、硫氰酸钾、水三组份加成反应的影响,通过实验表明kscn的最佳摩尔用量为1.2当量;kscn用量过低时,目标产物的收率降低,而再进一步增加kscn,目标产物的收率不再增加。上表中实验组1及6~11考察了各种反应介质对丙炔酸乙酯、硫氰酸钾、水三组份加成反应的影响,从实验数据可以看出,在乳酸介质中反应相对其他反应介质,可以明显提高三组份加成反应的效率,且反应具有单一反应加成选择性。上表中实验组1及12~13考察了乳酸用量对丙炔酸乙酯、硫氰酸钾、水三组份加成反应的影响,通过实验表明乳酸的最佳摩尔用量为4当量;当乳酸用量高于4当量时,反应效率没有提高;当乳酸用量低于4当量时,目标产物的收率降低。上表中实验组1及14~17考察了超声辅助对对丙炔酸乙酯、硫氰酸钾、水共加成反应的影响,通过实验表明通过超声辅助反应,能够大大缩短反应时间,提高反应效率,特别是超声功率为35w/频率为40khz时,共加成反应效果最佳,可以在较短时间内获得最佳的目标产物收率。循环实验结果在20ml反应管中,依次加入丙炔酸乙酯(10mmol)、硫氰酸钾(12mmol,1.16g)、水(10mmol,0.18g),乳酸(40mmol,3.60g),所得混合液在35w/40khz的超声反应装置中反应30分钟。反应结束后,加入18ml水与乳酸形成乳酸水溶液,z-3-硫氰酸酯基丙烯酸乙酯不溶于乳酸水溶液,析出,分液,真空干燥计算重量。减压除去乳酸水溶液中的水,直接用于下次循环实验,所得产率数据如下。1234594%94%93%92%92%实施例1~16以下实施例1~16均按以下反应方程式反应:具体操作步骤为:在20ml反应管中,依次加入丙炔酸酯(10mmol)、硫氰酸钾(12mmol,1.16g)、水(10mmol,0.18g),乳酸(40mmol,3.60g),所得混合液在35w/40khz的超声反应装置中反应30分钟。反应结束后,加入18ml水与乳酸形成乳酸水溶液,z-3-硫氰酸酯基丙烯酸酯不溶于乳酸水溶液,析出,分液,真空干燥计算重量。实施例1原料:目标产物:ethyl(z)-3-thiocyanatoacrylate:产率:94%.1hnmr(400mhz,cdcl3)δ7.14(d,j=9.2hz,1h),6.25(d,j=9.2hz,1h),4.25(q,j=7.2hz,2h),1.32(t,j=6.8hz,3h).13cnmr(100mhz,cdcl3)δ166.2,138.1,119.9,112.3,61.6,14.0.实施例2原料:目标产物:methyl(z)-3-thiocyanatoacrylate:产率:95%.1hnmr(400mhz,cdcl3)δ7.15(d,j=9.2hz,1h),6.27(d,j=9.2hz,1h),3.80(s,3h).13cnmr(100mhz,cdcl3)δ166.6,138.4,119.5,112.2,52.4.实施例3原料:目标产物:tert-butyl(z)-3-thiocyanatoacrylate:产率:90%1hnmr(400mhz,cdcl3)δ7.04(d,j=9.2hz,1h),6.17(d,j=9.2hz,1h),1.50(s,9h).13cnmr(100mhz,cdcl3)δ165.6,136.5,121.6,112.7,83.0,28.0.实施例4原料:目标产物:phenyl(z)-3-thiocyanatoacrylate:产率:91%δ7.44–7.40(m,2h),7.34(d,j=9.6hz,1h),7.31–7.27(m,1h),7.15–7.13(m,2h),6.50(d,j=9.6hz,1h).13cnmr(100mhz,cdcl3)δ164.7,149.8,140.7,129.6,126.5,121.1,119.1,111.8.实施例5原料:目标产物:benzyl(z)-3-thiocyanatoacrylate:产率:92%1hnmr(400mhz,cdcl3)δ7.42–7.37(m,5h),7.17(d,j=9.2hz,1h),6.30(d,j=9.2hz,1h),5.23(s,2h).13cnmr(100mhz,cdcl3)δ166.0,138.7,134.7,128.7,128.6,128.5,119.6,112.1,67.3.实施例6原料:目标产物:phenethyl(z)-3-thiocyanatoacrylate:产率93%1hnmr(400mhz,cdcl3)δ7.44–7.40(m,2h),7.34(d,j=9.6hz,1h),7.31–7.27(m,1h),7.15–7.13(m,2h),6.50(d,j=9.6hz,1h).13cnmr(100mhz,cdcl3)δ164.7,149.8,140.7,129.6,126.5,121.1,119.1,111.8.实施例7原料:目标产物:2-hydroxyethyl(z)-3-thiocyanatoacrylate:产率:94%1hnmr(400mhz,cdcl3)δ7.19(d,j=9.2hz,1h),6.31(d,j=9.2hz,1h),4.32(t,j=4.8hz,2h),3.87(t,j=4.8hz,2h),1.94(brs,1h).13cnmr(100mhz,cdcl3)δ166.3,139.0,119.4,112.1,66.9,60.7.实施例8原料:目标产物:2-butoxyethyl(z)-3-thiocyanatoacrylate):产率:93%1hnmr(400mhz,cdcl3)δ7.15(d,j=9.2hz,1h),6.30(d,j=9.2hz,1h),4.33–4.31(m,2h),3.66–3.63(m,2h),3.45(t,j=6.8hz,2h),1.59–1.51(m,2h),1.39–1.30(m,2h),0.90(t,j=7.6hz,3h).13cnmr(100mhz,cdcl3)δ166.1,138.4,119.7,112.2,71.1,68.1,64.6,31.5,19.1,13.8.实施例9原料:目标产物:2-cyanoethyl(z)-3-thiocyanatoacrylate:产率:92%1hnmr(400mhz,cdcl3)δ7.26(d,j=9.2hz,1h),6.32(d,j=9.2hz,1h),4.40(t,j=6.4hz,2h),3.77(t,j=6.4hz,2h).13cnmr(100mhz,cdcl3)δ165.4,140.0,118.6,116.3,111.6,59.6,17.8.实施例10原料:目标产物:2-bromoethyl(z)-3-thiocyanatoacrylate:产率:96%1hnmr(400mhz,cdcl3)δ7.22(d,j=9.2hz,1h),6.31(d,j=9.2hz,1h),4.50(t,j=6.0hz,2h),3.54(t,j=6.0hz,2h).13cnmr(100mhz,cdcl3)δ165.6,139.4,119.1,111.8,64.7,27.9.实施例11原料:目标产物thiophen-2-ylmethyl(z)-3-thiocyanatoacrylate:产率:93%1hnmr(400mhz,cdcl3)δ7.35–7.33(m,2h),7.17(d,j=9.6hz,1h),7.12–7.10(m,1h),6.28(d,j=9.6hz,1h),5.23(s,2h).13cnmr(100mhz,cdcl3)δ165.9,138.7,135.5,127.6,126.6,125.3,119.5,112.2,62.1.实施例12原料:目标产物benzo[d][1,3]dioxol-5-yl(z)-3-thiocyanatoacrylate:产率:92%1hnmr(400mhz,cdcl3)δ7.16(d,j=9.2hz,1h),6.86–6.85(m,2h),6.81–6.79(m,1h),6.27(d,j=9.2hz,1h),6.00(s,2h),5.11(s,2h).13cnmr(100mhz,cdcl3)δ166.0,148.0,148.0,138.7,128.4,122.7,119.6,112.1,109.2,108.3,101.3,67.3.实施例13原料:目标产物cinnamyl(z)-3-thiocyanatoacrylate:colorlessoil.产率:93%1hnmr(400mhz,cdcl3)δ7.42–7.40(m,2h),7.37–7.29(m,3h),7.18(d,j=9.6hz,1h),6.71(d,j=16.0hz,1h),6.33–6.26(m,1h),6.31(d,j=9.6hz,2h),4.86(d,j=6.8hz,2h).13cnmr(100mhz,cdcl3)δ166.0,138.6,135.8,135.4,128.6,128.3,126.7,121.9,119.6,112.2,66.1.实施例14原料:目标产物(4-(prop-1-en-2-yl)cyclohex-2-en-1-yl)methyl(z)-3-thiocyanatoacrylate:产率:92%1hnmr(400mhz,cdcl3)δ7.15(d,j=9.2hz,1h),6.28(d,j=9.2hz,1h),5.71–5.80(m,1h),4.74–4.71(m,2h),4.58(s,2h),2.20–2.14(m,2h),2.10–2.02(m,2h),2.01–1.84(m,2h),1.74(s,3h),1.53–1.49(m,1h).13cnmr(100mhz,cdcl3)δ166.1,149.3,138.3,131.7,127.3,119.8,112.3,108.9,69.6,40.6,30.4,27.2,26.3,20.7.实施例15原料:目标产物:(e)-phenyl3-bromo-3-thiocyanatoacrylate:产率:93%1hnmr(400mhz,cdcl3)δ7.46–7.42(m,2h),7.33–7.29(m,1h),7.16–7.13(m,2h),7.02(s,1h).13cnmr(100mhz,cdcl3)δ162.7,149.7,137.3,129.7,126.8,120.9,119.4,106.3.hrmscalcd(ei)m/zforc10h6brno2s:实施例16原料:目标产物:diethyl2-thiocyanatofumarate:产率:92%1hnmr(400mhz,cdcl3)δ6.85(s,1h),4.43(q,j=7.2hz,2h),4.29(q,j=7.2hz,2h),1.41(t,j=7.2hz,3h),1.33(t,j=7.2hz,3h).13cnmr(100mhz,cdcl3)δ164.5,161.4,138.1,126.3,108.7,64.0,62.2,14.0,13.8。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1