维氏菌、白斑病毒和链球菌qPCR试剂盒及方法与流程
本发明属于生物检测技术领域,特别涉及一种维氏菌、白斑病毒和无乳链球菌qpcr试剂盒及方法。
背景技术:
维氏菌(维氏气单胞菌)是孤菌科、气单胞菌属,是嗜温、有动力的气单胞菌群,普遍存在于淡水、污水、淤泥、土壤和人类粪便中,对水产动物、畜禽和人类均有致病性,是一种典型人、兽、鱼共患病病原,可引起多种水产动物,如鱼、虾等的败血症和人类腹泻。往往给淡水养殖业造成惨重的经济损失,已引起国内外水产界、兽医学界和医学界学者的高度重视。
白斑综合症病毒(whitespotsyndromevirus,wssv)自1992年首次暴发以来对全球虾类养殖业造成严重危害,wssv除了能感染小龙虾以及大多数对虾品种之外,还能感染其它水产动物,如端足类、介形类、蟹类、桡足类、水蝇类等甲壳纲动物。这些动物中多数感染wssv而不出现特殊的病理症状,在海洋和淡水生态系统可充当wssv传播的中间宿主,给养殖小龙虾及野生甲壳纲动物资源构成严重威胁。
链球菌(无乳链球菌)是化脓性球菌的另一种常见的细菌,广泛存在于自然界,属于革兰氏染色阳性,双链或链锁状的球菌,可以感染小龙虾和鱼类,病鱼感染后体色发黑,吻端发红,体表黏液增多,失去食欲,静止于水底,或离群独自漫游于水面,有时做旋转游泳后再沉于水底。最明显的症状是发病鱼虾眼球突出,其周围充血,鳃盖内侧发红、充血或强烈出血。在夏季高温时期这些症状发展迅速,给养殖业造成严重危害。
多重实时荧光定量pcr(qpcr)技术是在实时荧光定量pcr基础上发展起来的一个新技术,它强调在同一个反应体系里同时扩增多个靶标。已有多项研究将多重实时荧光定量pcr技术应用于病毒及细菌检测领域,结果显示多重实时荧光pcr体系与单一扩增结果在灵敏度和特异性方面基本相同。但是到目前为止,尚无报道有同时检测氏气单胞菌、白斑病毒和无乳链球菌的试剂盒。发明一种维氏气单胞菌、白斑病毒和无乳链球菌的三重实时荧光定量pcr试剂盒及检测方法,在水产动物如鱼类、小龙虾等病原快速检测领域意义重大。
技术实现要素:
为解决现有技术的不足,本发明的目的在于提供一种维氏菌、白斑病毒和无乳链球菌qpcr试剂盒及方法,克服当前检测维氏气单胞菌、白斑病毒和无乳链球菌检测技术方面存在的缺陷和不足,分别提供三种致病原的检测引物。所述引物组可以可快速准确的检测维氏气单胞菌、白斑病毒和无乳链球菌。一个pcr反应可以同时检测三种病原,快速方便可用于多种致病菌的混合感染的病原鉴定,有利于开展流行病学调查,预防和控制疫情传播。
为了实现上述目标,本发明采用如下的技术方案:
本发明所述的维氏菌、白斑病毒和无乳链球菌qpcr试剂盒,包括以下引物对和探针:
检测维氏气单胞菌的引物对和探针ave-pro,所述检测维氏气单胞菌的引物对包括seqidno:1所示的上游引物ave-f和seqidno:2所示的下游引物ave-r,所述探针ave-pro的序列为seqidno:7所示;
检测白斑病毒的引物对和探针wssv-pro,所述检测白斑病毒的引物对包括seqidno:3所示的上游引物wssv-f和seqidno:4所示的下游引物wssv-r,所述探针wssv-pro的序列为seqidno:8所示;
检测无乳链球菌的引物对和探针stre-pro,所述检测无乳链球菌的引物对包括seqidno:5所示的上游引物stre-f和seqidno:6所示的下游引物stre-r,所述探针stre-pro的序列为seqidno:9所示。
本发明分别根据维氏气单胞菌、白斑病毒和无乳链球菌特异性序列,分别进行比对找到其特性序列设计pcr引物对、探针和pcr反应程序,从而实现对三种病原快速鉴定。所述pcr引物和探针对可用来特异性检测鉴定待测样品中是否含有维氏气单胞菌、白斑病毒和无乳链球菌;因此,所述引物对及探针在同时检测或鉴定维氏气单胞菌、白斑病毒和无乳链球菌中的应用,以及在维氏气单胞菌、白斑病毒和无乳链球菌检测试剂盒中的应用,均应在本发明的保护范围之内。
作为优选的,所述上游引物ave-f、下游引物ave-r、探针ave-pro、上游引物wssv-f、下游引物wssv-r、探针wssv-pro、上游引物stre-f、下游引物stre-r和探针stre-pro的终浓度为0.2mm到1mm。
作为优选的,所述探针ave-pro、探针wssv-pro和探针stre-pro的5'标记的荧光基团为fam、vic、hex、cy5中的一种,且各个探针的5'标记的荧光基团互不相同;所述探针ave-pro、探针wssv-pro和探针stre-pro的3'标记的淬灭基团为bq1、bq2中的一种。
作为优选的,该试剂盒中还包括有酶液和反应缓冲液,所述酶液由dna聚合酶组成,酶液和反应缓冲液直接采用市售的2xpremixextaq。所述pcr扩增反应所需试剂是指能够使得样本dna在上述引物对的作用下进行pcr扩增反应的试剂,现有技术中常规pcr扩增反应试剂均可用于本发明,上述所列举的仅仅只是优选项。
作为优选的,该试剂盒中还包括有阴性对照和阳性对照;所述阴性对照为用0.01mol/l、ph7.2的pbs缓冲盐水;所述阳性对照为维氏气单胞菌、白斑病毒和无乳链球菌pcr扩增产物分别与克隆载体pmd-18-tvector连接,转化大肠杆菌感受态dh5α,获得阳性克隆菌株,并制备质粒pmd18-ave,pmd18-wssv,pmd18-stre作为阳性对照。
本发明还提供了维氏菌、白斑病毒和无乳链球菌qpcr试剂盒的检测方法,其特征在于按照以下步骤进行:
(1)提取待测样本核酸,选用商品化的核酸提取试剂盒;
(2)配置扩增反应体系,体系为:17μlpcr扩增反应液,3μl待检核酸模,体系的总体积为20μl;
(3)荧光定量pcr扩增:将pcr管中配制好的扩增反应体系置于荧光定量pcr仪中进行扩增反应,并进行信号采集;
(4)结果判定:分别在相应通道查看扩增曲线,根据扩增曲线判读结果;维氏气单胞菌检测荧光曲线在第一通道查看,若该通道ct值小于36及s型荧光曲线说明维氏气单胞菌检测结果为阳性;白斑病毒的检测荧光曲线在第二通道查看,若该通道ct值小于36及s型荧光曲线说明白斑病毒检测结果为阳性;无乳链球菌的检测荧光曲线在第四通道查看,若该通道ct值小于36及s型荧光曲线说明无乳链球菌检测结果为阳性。
作为优选的,所述pcr扩增反应液包含10μl的2xpremixextaq,各0.5μl权利要求1中所述的引物和探针,2.5μl的无菌水。
作为优选的,所述扩增反应条件:95℃预变性30s;95℃变性5s后,60℃退火延伸30s并采集荧光信号40个循环。
本发明的优点在于:选择维氏气单胞菌16s基因、白斑病毒capsidprotein基因和无乳链球菌16s基因保守区作为检测靶序列,在多重序列比对的基础上分别设计合成三对引物对及3条检测探针。本发明的特异性引物和探针的三重实时荧光定量pcr检测方法能够实现同时检测并鉴别维氏气单胞菌、白斑病毒和无乳链球菌。本发明还涉及三种病原菌检测试剂盒,采用两步法荧光定量pcr进行检测,既可以节约时间的成本,又可以减少污染,特异性好、灵敏度高具有极高的应用价值。
附图说明
图1是实施例2中维氏气单胞菌特异性检测荧光曲线图;
图2是实施例2中白斑病毒特异性检测荧光曲线图;
图3是实施例2中无乳链球菌特异性检测荧光曲线图;
图4是实施例3中三重荧光定量pcr检测灵敏度实验荧光图;
图5是实施例4中维氏气单胞菌、白斑病毒和无乳链球菌基因组提取电泳图;
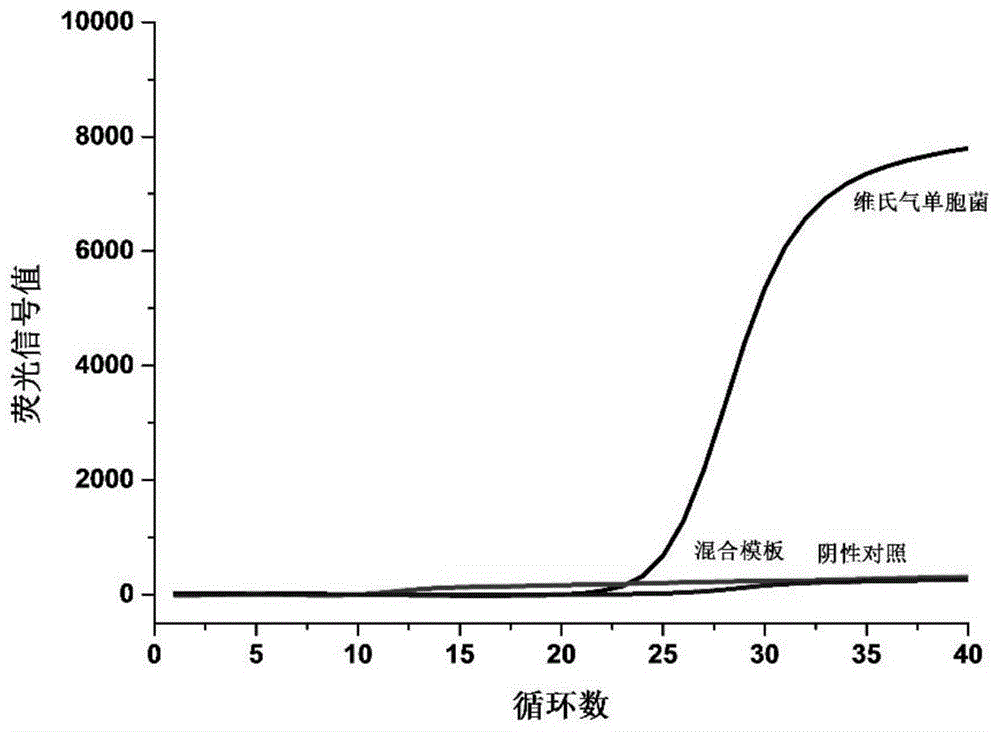
图6是实施例4中三重荧光定量pcr检测维氏气单胞菌、白斑病毒和无乳链球菌荧光曲线图。
具体实施方式
以下结合附图和具体实施例对本发明作具体的介绍。
实施例1:
一种维氏菌、白斑病毒和无乳链球菌qpcr试剂盒,包括有酶液和反应缓冲液,所述酶液由dna聚合酶组成,酶液和反应缓冲液直接采用市售的2xpremixextaq,还包括有阴性对照和阳性对照;所述阴性对照为用0.01mol/l、ph7.2的pbs缓冲盐水;所述阳性对照为维氏气单胞菌、白斑病毒和无乳链球菌pcr扩增产物分别与克隆载体pmd-18-tvector连接,转化大肠杆菌感受态dh5α,获得阳性克隆菌株,并制备质粒pmd18-ave,pmd18-wssv,pmd18-stre作为阳性对照。还包括以下引物对和探针:
检测维氏气单胞菌的引物对和探针ave-pro,所述检测维氏气单胞菌的引物对包括seqidno:1所示的上游引物ave-f和seqidno:2所示的下游引物ave-r,所述探针ave-pro的序列为seqidno:7所示;具体如下:
上游引物ave-f:5’gccttgcgcgattggatgaa3’;
下游引物ave-r:5’tcacagctggcagttattagctac3’;
检测探针ave-pro:famagccatgccgcgtgtgtgaabq1。
检测白斑病毒的引物对和探针wssv-pro,所述检测白斑病毒的引物对包括seqidno:3所示的上游引物wssv-f和seqidno:4所示的下游引物wssv-r,所述探针wssv-pro的序列为seqidno:8所示;具体如下:
上游引物wssv-f:5’tcaaaccccgtcacagacac3’;
下游引物wssv-r:5’attggtgacgaggccagatg3’;
检测探针wssv-pro:hexaccccttcaaggattctgctaggtbq1。
检测无乳链球菌的引物对和探针stre-pro,所述检测无乳链球菌的引物对包括seqidno:5所示的上游引物stre-f和seqidno:6所示的下游引物stre-r,所述探针stre-pro的序列为seqidno:9所示;具体如下:
上游引物stre-f:5’gaacgggtgagtaacgcgta3’;
下游引物stre-r:5’caactagctaatacaacgcaggtc3’;
检测探针stre-pro:cy5gcgggggataactattggaaacgatagcbq2。
所述上游引物ave-f、下游引物ave-r、探针ave-pro、上游引物wssv-f、下游引物wssv-r、探针wssv-pro、上游引物stre-f、下游引物stre-r和探针stre-pro的终浓度为0.2mm到1mm。
探针ave-pro在5'端修饰的荧光基团是fam,3'端修饰的猝灭基团是bq1;探针wssv-pro在5'端修饰的荧光基团是hex,3'端修饰的猝灭基团是bq1;探针stre-pro在5'端修饰的荧光基团是cy5,3'端修饰的猝灭基团是bq2;荧光基团可以是fam、hex、vic、cy5中的一种,但是本发明要求的权利不仅限于这4种固定荧光标记,也可以是其他荧光标记如texas、red等。探针在5'端修饰的荧光基团不同,3'端修饰的猝灭基团可以是相同,也可以是不同。
一种维氏菌、白斑病毒和无乳链球菌qpcr试剂盒的检测方法,按照以下步骤进行:
(1)提取待测样本核酸,选用商品化的核酸提取试剂盒,实验中使用的是青岛英赛特生物科技有限公司细菌核酸提取试剂盒;
(2)配置扩增反应体系,体系为:17μlpcr扩增反应液(具体包括10μl的2xpremixextaq,各0.5μl上文中所述的引物和探针,2.5μl的无菌水),3μl待检核酸模,体系的总体积为20μl;还可参照下表1:
(3)荧光定量pcr扩增:将pcr管中配制好的扩增反应体系置于荧光定量pcr仪中进行扩增反应,所述扩增反应条件:95℃预变性30s;95℃变性5s后,60℃退火延伸30s并采集荧光信号40个循环。
(4)结果判定:荧光定量pcr反应结束后,获得相应通道的扩增曲线图,观察特异性pcr反应体系内的检测荧光信号是否形成扩增曲线,荧光曲线有三种信号,有fam信号形成的s型扩增曲线并且该通道ct值小于36则说明该待检样本存在维氏气单胞菌,有hex信号形成的s型扩增曲线并且该通道ct值小于36则说明该待检样本存在白斑病毒,有cy5信号形成的s型扩增曲线并且该通道ct值小于36则说明该待检样本存无乳链球菌,通过一个荧光定量pcr反应就可以判断该样本的是或否存在维氏气单胞菌、白斑病毒和无乳链球菌。
实施例2:
维氏气单胞菌、白斑病毒和无乳链球菌三重荧光定量pcr检测特异性实验。
单独提取嗜水气胞菌、健康对虾及副溶血菌基因组dna后进行混合作为检测模板,同时分别用维氏气单胞菌、白斑病毒和无乳链球菌的阳性核酸做为模板,对引物组及探针单重特异性测定,结果单重pcr都扩增出对应的曲线,其他检测通道并未收集到荧光信号,同时用嗜水气胞菌、虾及副溶血菌基因组dna做为干扰模板均未出现扩增信号,见图1至图3。图1为维氏气单胞菌荧光定量pcr扩增曲线在第一通道出现fam荧光信号扩增曲线,图2为白斑病毒荧光定量pcr扩增曲线在第二通道出现hex荧光信号扩增曲线,图3为无乳链球菌荧光定量pcr扩增曲线在第四通道出现cy5荧光信号扩增曲线。
实施例3:
维氏气单胞菌、白斑病毒和无乳链球菌三重荧光定量pcr检测灵敏度实验。
用维氏气单胞菌、白斑病毒和无乳链球菌pcr扩增产物分别与克隆载体pmd-18-tvector连接,转化大肠杆菌感受态dh5α,获得阳性克隆菌株,并制备质粒pmd18-ave,pmd18-wssv,pmd18-stre作为阳性对照品分别,将维氏气单胞菌、白斑病毒和无乳链球菌阳性标准品pmd18-ave从质量浓度换算成摩尔浓度,进行10倍比梯度稀释。使用表1中的反应体系进行实时荧光pcr扩增,验证所建立的三重荧光定量pcr方法的灵敏度。
分别将阳性对照品质粒pmd18-ave,梯度稀释到104copies/μl、103copies/μl、100copies/μl和10copies/μl得浓度作为模板的扩增曲线如图4所示,除了10copies/μl浓度模板未获得有效扩增外,其他梯度浓度均收集到了荧光信号。因此,本体系能检测的模板最低浓度为100copies/μl。
实施例4:
维氏气单胞菌、白斑病毒和无乳链球菌三重荧光定量pcr检测方法及应用。
对4株维氏气单胞菌,2株白斑病毒和3株无乳链球菌荧光定量pcr检测,其具体方法如下:
(1)样本核酸提取:待提样本9例,包含4例维氏气单胞菌、2例白斑病毒和3株无乳链球菌,分别用商业化的细菌病毒核酸共提取试剂盒进行提取。图5为前7例样本核酸提取电泳图,a1到a4为维氏气单胞菌核酸电泳图,b1到b2为白斑病毒核酸电泳图;c1到c3电泳都出现条带,由图5可知9例样本核酸均提取成功。
(2)分别取3μl上一步提取的好的核酸和17μl的检测试剂盒中的pcr反应液,加入到pcr反应管中并用移液器吹打混匀后,置于荧光定量pcr仪上进行反应。将阳性的维氏气单胞菌、白斑病毒和无乳链球菌基因组进行混合后作为检测模板,取3ul混合模板和17μl的检测试剂盒中的pcr反应液,加入到pcr反应管中并用移液器吹打混匀,置于荧光定量pcr仪上进行反应。
(3)pcr扩增反应程序如下:预变性95℃30s;95℃变性5s后,60℃维持30s采集荧光信号40个循环;
(4)结果分析:通过荧光扩增曲线图ct值的大小来判断结果的阴阳性的,确定样品中是否含有维氏气单胞菌、白斑病毒和无乳链球菌。当扩增曲线图ct值≤36,并呈现明显指数增长时,结果表现为阳性;当扩增曲线图ct值>36或无ct值,结果表现为阴性;为了在判断检测结果阴阳性时具有参照,检测样本时需要给维氏气单胞菌、白斑病毒和无乳链球菌三重荧光pcr检测试剂盒设置阴性对照。
本发明实施例中,用于检测维氏气单胞菌、白斑病毒和无乳链球菌的荧光定量pcr仪包括但不限于:abi系列、bio-rad系列、rocheightcycler、杭州博日系列等。
把检测维氏气单胞菌、白斑病毒和无乳链球菌的基因组dna混合后作为模板,同时检测三种致病菌如图6所示,检测结果均为阳性,说明试剂盒可以同时检测维氏气单胞菌、白斑病毒和无乳链球菌,具有三重检测能力,检测结果符合预期。
序列表
<110>江西省水产科学研究所
青岛英赛特生物科技有限公司
<120>维氏菌、白斑病毒和链球菌qpcr试剂盒及方法
<141>2019-12-09
<160>9
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>artificialsequence
<400>1
gcggccccctggacaaagac20
<210>2
<211>24
<212>dna
<213>artificialsequence
<400>2
tcacagctggcagttattagctac24
<210>3
<211>20
<212>dna
<213>artificialsequence
<400>3
tcaaaccccgtcacagacac20
<210>4
<211>20
<212>dna
<213>artificialsequence
<400>4
attggtgacgaggccagatg20
<210>5
<211>20
<212>dna
<213>artificialsequence
<400>5
gaacgggtgagtaacgcgta20
<210>6
<211>24
<212>dna
<213>artificialsequence
<400>6
caactagctaatacaacgcaggtc24
<210>7
<211>20
<212>dna
<213>artificialsequence
<400>7
agccatgccgcgtgtgtgaa20
<210>8
<211>24
<212>dna
<213>artificialsequence
<400>8
accccttcaaggattctgctaggt24
<210>9
<211>28
<212>dna
<213>artificialsequence
<400>9
gcgggggataactattggaaacgatagc28
- 还没有人留言评论。精彩留言会获得点赞!