编码蜘蛛多肽P1的核酸及在制备抗弓形虫的药物中的应用的制作方法
本发明属于多肽药物研发技术领域,具体涉及一种编码蜘蛛多肽p1的核酸及在制备抗弓形虫的药物中的应用。
背景技术:
弓形虫(toxoplasmagondii)是一种单细胞真核寄生性原虫,广泛寄生于人和各种温血动物,由它所引起的弓形虫病是一种重要的人畜共患寄生虫病;全球大约有1/3的人口感染弓形虫。虽然我国弓形虫的人群平均感染率大约为7.9%,但是随着我国饲养宠物家庭数量的增多,人们饮食习惯的改变,弓形虫病的感染率有急剧上升的趋势。孕妇感染弓形虫后,可通过胎盘垂直把虫体传给胎儿,从而可致流产、早产、畸胎和死胎,对我国的优生优育工作造成严重影响。在免疫功能严重受损时,弓形虫脑炎是艾滋病等患者最常见的机会性疾病,往往引发致死性病变。家畜也受到弓形虫病的严重威胁,家畜的弓形虫感染率为10%-50%,这会给畜牧业造成重大损失。目前还没有预防弓形虫病的疫苗,治疗弓形虫病的药物主要有磺胺嘧啶、乙胺嘧啶、螺旋霉素、阿奇霉素、青蒿素、蒿甲醚等,但是仍然存在可选药物少、治疗周期长、复发率高、药物毒副作用大、产生抗药性等难题,特别是目前尚无杀灭弓形虫包囊内缓殖子和清除包囊的药物,这是抗弓形虫药物研发的重点和难点。
p1是从蜘蛛(lycosacoelestis)毒液中分离的一种由24个氨基酸组成的分子量为2900.37da,等电点为10.48的碱性线性多肽,包含8个赖氨酸且没有半胱氨酸残基。p1的生物学活性及其在抗弓形虫方面的作用还未见报道。
技术实现要素:
针对现有技术存在的空白,本发明提供一种编码蜘蛛多肽p1的核酸及在制备抗弓形虫的药物中的应用,目的是提供一种新的多肽在制备抗弓形虫的药物中的用途,以期获得所述的核酸分子编码蜘蛛多肽p1。
所述的核酸分子,编码序列由seq1所示核酸序列构成,为:atgaaaattaagtggtttaaagcaatgaaatctatagcaaaattcatcgcaaaagatcagctgaagaaacatctttga。
所述的蜘蛛多肽p1包括seq2所示氨基酸序列,在c末端残基有酰胺化修饰,为:kikwfkamksiakfiakdqlkkhl-conh2。
蜘蛛多肽p1用于制备抗弓形虫的药物的用途,能够降低弓形虫速殖子活性,抑制弓形虫速殖子侵入宿主细胞,抑制弓形虫速殖子在宿主细胞中的繁殖,控制弓形虫感染,减轻急性弓形虫病产生炎症所导致对宿主细胞的损害,直接导致弓形虫虫体解体和重要细胞器结构的改变。
所述的蜘蛛多肽p1是通过fmoc固相化学合成法合成的,利用高效液相色谱法进行纯化。
与现有技术相比,本发明的特点和有益效果是:
本发明中蜘蛛多肽p1用于制备抗弓形虫的药物,能够降低弓形虫速殖子活性,抑制弓形虫速殖子侵入宿主细胞,抑制弓形虫速殖子在宿主细胞中的繁殖,控制弓形虫感染,减轻急性弓形虫病产生炎症所导致对宿主细胞的损害,直接导致弓形虫虫体解体和重要细胞器结构的改变。
附图说明
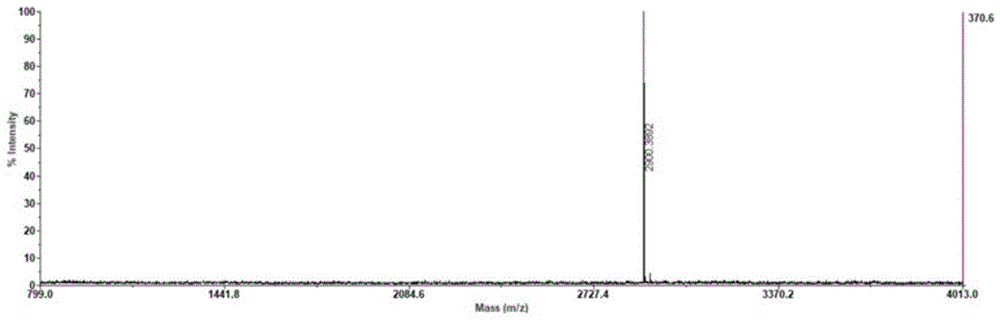
图1是本发明实施例制备的蜘蛛多肽p1的分子量质谱鉴定图;
图2是本发明实施例中不同浓度的蜘蛛多肽p1(2.5-40μμ)溶液分别和弓形虫速殖子共同孵育2h后切片的显微荧光图;
图3是本实施例的蜘蛛多肽p1在mtt实验中对人包皮成纤维细胞(hff)的细胞毒性作用图;
图4是本发明实施例的蜘蛛多肽p1抑制弓形虫速殖子侵入宿主细胞hff实验图;
图5是本发明实施例的蜘蛛多肽p1抑制弓形虫速殖子在宿主细胞hff中的繁殖实验图;
图6是本发明实施例的蜘蛛多肽p1的噬斑实验图;
图7是本发明的实施例的蜘蛛多肽p1对感染弓形虫的hff细胞分泌白介素-6和白介素-8的影响;
图8是本发明实施例的蜘蛛多肽p1干预弓形虫速殖子后的扫描电镜超微表膜构象图;
图9是本实施例的蜘蛛多肽p1干预弓形虫速殖子后的透射电镜观察其超微内部结构图。
具体实施方式
本发明实施例中编码蜘蛛多肽p1的基因序列如seq1所示,为:
atgaaaattaagtggtttaaagcaatgaaatctatagcaaaattcatcgcaaaagatcagctgaagaaacatctttga。
所述的蜘蛛多肽p1的氨基酸序列如seq2所示,为:
kikwfkamksiakfiakdqlkkhl-conh2,c末端残基有酰胺化修饰。
本发明实施例中蜘蛛多肽p1的合成及纯化:
通过fmoc固相化学合成法合成多肽p1,利用高效液相色谱法进行纯化,并通过质谱分析,检验其纯度达到98%以上,如图1所示,ms分子量鉴定为2900.37da(图1)。
实施例
本发明实施例将蜘蛛多肽p1用于制备抗弓形虫的药物的药效进行检测,包括以下指标:
1.对弓形虫速殖子活力的影响
用不同浓度的p1(2.5-40μμ)溶液分别和弓形虫速殖子共同孵育2h后,做成切片,置于荧光显微镜下观察各组荧光强度。设感染后仅培基处理组(dmem)为阴性对照组,可观察到阴性对照组荧光强度最强,p1各组随着作用浓度的增加荧光强度逐渐减弱,20和40μμ的p1处理组荧光几乎不可见(图2)。
实验结果表明本实施例的蜘蛛多肽p1能够降低弓形虫速殖子活性,且杀灭效果呈浓度依赖性递增。
2.mtt实验
采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(mtt)法,实验原理主要为:在活细胞的线粒体内存在着琥珀酸脱氢酶,它能够将外源性的黄色mtt溶液还原成不溶于水的紫蓝色结晶甲臢并沉积在细胞内,而死细胞的线粒体无此酶,因此不能使mtt还原,在一定细胞数目范围内,mtt结晶的形成与细胞数目成正相关,可用酶标仪在490nm或570nm波长处检测细胞的吸光度,并根据所测吸光度值(od值)来判断所剩活细胞的数目,od值越大所对应的细胞活性便越强;
(1)将培养瓶中的hff细胞进行消化并计数,按1×105个/孔接种于96孔板中,置于细胞培养箱中过夜,培养条件:37℃5%co2;
(2)待细胞增殖至80%左右后,弃上清,pbs清洗3次,随后加入不同浓度的p1(0-500μg/ml),每个浓度3个复孔,将96孔板放入37℃5%co2的细胞培养箱中孵育24h;
(3)将5×mtt用dmso稀释成1×备用;
(4)取出96孔板,弃去上清,用pbs清洗3次,每孔加入50μl1×mtt溶液,置于37℃温箱中孵育4h,使得mtt还原成甲臢;
(5)从温箱中取出96孔板,每孔加入150μldmso溶液溶解甲臢,将板放在摇床上摇10min;
(6)将板置于酶标仪上,检测每孔在570nm处的吸光度(od值);
(7)对od值进行处理并分析结果,算出细胞存活率,细胞存活率%=(实验组od值/空白对照组od值)×100%,p1对细胞的抑制率(即细胞毒性作用)=1-细胞存活率。如图3所示,即为p1对hff的细胞毒性作用,ic50=30.29μμ。
3.对弓形虫速殖子侵入率的影响
用不同浓度的p1预处理弓形虫速殖子,培养时间为2小时,磺胺嘧啶(sfz)作为阳性对照药。然后离心去除药物后,分别感染24孔板中已贴壁的hff细胞(弓形虫与宿主细胞的比值为20:1),细胞培养2小时后,弃每孔中培养基,用pbs洗2遍;吉姆萨染色;在放大40×10倍的光镜下随机计数200个细胞中,数出有多少个细胞感染了弓形虫,即为弓形虫的侵入率,该实验重复三次。感染后仅加dmem处理组为阴性对照组,磺胺嘧啶为阳性对照组(n=3,*p﹤0.05;**p﹤0.01;***p﹤0.001与阴性对照组比),如图4所示,1.25μμ的p1就具有明显的抑制弓形虫速殖子侵入宿主细胞hff。
4.对弓形虫速殖子繁殖力的影响
弓形虫速殖子加入到装有盖玻片的单层人包皮成纤维细胞hffs的培养皿中(弓形虫与宿主细胞的比值为20:1),培养2小时后,弃去培养基,去除未进入宿主细胞的弓形虫速殖子。分别用不同浓度的p1处理已感染弓形虫的宿主细胞,磺胺嘧啶(sfz)组作为阳性对照组,培养24或48小时后,取盖玻片染色镜检。计算100个纳虫泡内的虫体总数,同时分别记录含有1、2、4、8、16、32、64个弓形虫速殖子的纳虫泡数目,然后进行统计学分析,抑制率=(对照组繁殖率-实验组繁殖率)÷对照组繁殖率,阴性对照组为弓形虫感染后不加p1处理组(dmem),该实验重复三次。
吉姆萨染色后,通过光学显微镜观察发现,空白对照组纳虫泡中含较多的速殖子,而10μμ的p1处理组纳虫泡中含较少的速殖子(箭头所指为纳虫泡里的弓形虫速殖子)(图5b,d);同时,采用单因素方差分析(one-wayanova)统计,干预24小时10μμ(图5a)或干预48小时5μμ(图5c)的p1明显抑制了弓形虫速殖子在宿主细胞hff中的繁殖。针对纳虫泡中速殖子的个数,采用wilcoxon秩和检验法统计发现,如图5e-f所见,感染弓形虫的hff细胞用化合物干预24小时,p1(20μm)组中仅含有1个速殖子的纳虫泡数目是最多的,含有16个速殖子的纳虫泡数目最少;干预48小时,p1(20μm)组中仅含有1个速殖子的纳虫泡数目也最多,sfz和p1(10μm和20μm)组中不含有64个速殖子的纳虫泡,含有32个速殖子的纳虫泡数目最少的是p1(10μm)组。而阴性对照组(dmem)的结果恰好相反,含有1个速殖子的纳虫泡数目最少,含有16(干预24小时)和64(干预48小时)个速殖子的纳虫泡数目最多(n=3,*p﹤0.05,**p﹤0.01,***p﹤0.001与阴性对照组比)。这些结果说明,多肽p1抑制弓形虫速殖子的繁殖作用呈现浓度依赖性和时间依赖性。
5.噬斑实验
噬斑实验可以同时反映弓形虫的侵袭力和繁殖力,斑块的数量通过直接计数确定,而斑块的像素面积通过adobephotoshopcs7软件的magicwand工具量化。图6a中阴性对照组(dmem)和p1(10μm)组形成了肉眼可见白色斑块,而sfz(400μm)和空白对照组无斑块形成。图6b,c中数据显示sfz(400μm)组无斑块(***p<0.001);与阴性对照组相比(斑块数目:mean=38,sd=8.72;斑块面积:mean=983.3,sd=124.7),p1(10μm)组斑块面积显著下降(斑块数目:mean=30,sd=5.29;斑块面积:mean=680.0,sd=79.08)(**p<0.01);而p1(10μm)组斑块数目降低不明显。这些数据表明,p1和sfz均能控制弓形虫感染,但sfz在此实验中抑制效果更突出。
6.蜘蛛多肽p1对感染弓形虫的hff细胞分泌白介素-6和白介素-8的影响
hff细胞感染弓形虫速殖子后,用10μμ的p1作用48小时后,提取总rna,然后逆转录为cdna,通过qrt-pcr,检测白介素-6(il-6)和白介素-8(il-8)mrna的相对表达量。对照组为感染弓形虫速殖子后的hff细胞(t.g),未做处理的hff细胞(-),用p1处理的hff细胞(p1),用p1处理已感染弓形虫速殖子的hff细胞(p1+t.g)。
弓形虫速殖子感染宿主细胞后,诱导宿主细胞产生大量的致炎因子白介素-6和白介素-8。当用蜘蛛多肽p1处理感染了弓形虫速殖子的宿主细胞后,致炎因子白介素-6和白介素-8的分泌受到明显的抑制,如图7所示(n=3,*p﹤0.05,**p﹤0.01,***p﹤0.001与对照组比),表明p1可能有助于减轻急性弓形虫病产生炎症所导致对宿主细胞的损害。
7.p1对弓形虫速殖子表面构像的影响
通过扫描电镜(sem)观察用p1处理后的弓形虫速殖子的超微结构,看其表膜结构是否完整或改变。根据先前报道的方法操作,实验步骤如下:
(1)收集刚涨破细胞游离出来的弓形虫速殖子于ep管中,并置于离心机中离心(3000转/min,10min)。吸弃上清液,ep管中加入1mlpbs缓冲液,用微量移液枪吹打沉淀,使弓形虫悬液混匀。
(2)再往ep管中加入p1溶液,使其终浓度为10μm;对照组加dmem溶液。
(3)常温下多肽分子和弓形虫相互作用2小时后,将ep管置于离心机中离心(3000转/min,10min),吸弃上清液(除去反应溶液)。沉淀用pbs缓冲液漂洗2遍。
(4)然后加入4%戊二醛溶液,置于4℃冰箱中过夜。
(5)弓形虫样本采用梯度脱水:分别在30%,50%,70%,90%,95%乙醇中脱水一次,最后在100%酒精中脱水3次,每次10min。
(6)用临界点干燥法对样品进行干燥。
(7)用金属镀膜法将样品表面镀一层金。
(8)最后在扫描电镜下观察弓形虫表面结构。
p1干预速殖子后,通过扫描电镜观察其超微表膜构象:对照组中的速殖子形态正常,大小均一,虫体表面光滑、完整、具有典型新月形态结构(一端尖锐,另一端圆顿)。虫体中间部位还可见微孔,它是胞吞作用最主要的入口(图8a,b,箭头所示为微孔)。而p1组显微照片显示,弓形虫失去了新月形状,虫体大小不一,表面形成了深脊,凹痕和褶皱(图8c,d)。还有一部分速殖子因虫体破坏而崩解(图8e,星号所示为崩解速殖子)。另外还有一些速殖子虫体膨胀肿大(图8f,对勾所示为膨胀速殖子)。
8.多肽p1对弓形虫速殖子内部器官结构的影响
(1)收集刚涨破细胞游离出来的弓形虫速殖子于ep管中,并置于离心机中离心(3000转/min,10min)。吸弃上清液,ep管中加入1mlpbs缓冲液用微量移液枪吹打沉淀,使弓形虫悬液混匀。
(2)再往ep管中加入p1溶液,使其终浓度为10μm;对照组加dmem溶液。
(3)常温下多肽分子和弓形虫相互作用2h后,将ep管置于离心机中离心(3000转/min,10min),吸弃上清液(除去反应溶液)。沉淀用pbs缓冲液漂洗2遍。
(4)再将ep管置于离心机中离心(3000转/min,10min),沉淀加入4%戊二醛溶液固定。
(5)然后将样品置于100mm二甲胂酸盐缓冲液中洗涤两次,并在含有1%四氧化锇的100mm二甲胂酸中固定2小时(4℃)。
(6)样本在离心机中离心后,沉淀在蒸馏水中漂洗3遍,然后梯度脱水:分别在30%,50%,70%,90%,95%乙醇中脱水一次,最后在100%酒精中脱水3次,每次10min。
(7)将样品包埋在环氧树脂中,并使其在60℃下聚合48h。
(8)再将包埋树脂用超薄切片机切片,并用双醋酸铀和柠檬酸铅染色。
(9)最后置于透射电镜下观察。
p1干预速殖子后,通过透射电镜观察其超微内部结构:显微照片显示了对照组速殖子的纵向和横向视图(图9a)。对照组速殖子保持了正常的形态和细胞学特征,如完整的细胞膜(cm),细胞核(n),核膜(nm),圆锥体(c),微线体(mn),致密颗粒(dg),脂质体(lb)和高尔基复合体(go)。同时保持着新月形的尖形前端和顿圆的后端,它们都具有完整的核膜和细胞膜。还可以清晰地看见虫体内的线粒体,些许致密颗粒,核呈椭圆形状,染色质结构也正常。此外,微线体和圆锥体整齐排列在速殖子头部(图9b)。而p1组速殖子呈现出虫体解体和重要细胞器结构的改变,包括染色质浓缩和细胞质空泡化。另外寄生虫的细胞质体积减少,且大部分虫体完全丧失正常细胞结构,细胞膜、致密颗粒、棒状体、圆锥体、线粒体和微丝消失,仅留下均质的染色质以及被破坏的核膜(图9c-f)。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
序列表
<110>中南大学
<120>编码蜘蛛多肽p1的核酸及在制备抗弓形虫的药物中的应用
<141>2020-02-09
<160>2
<170>siposequencelisting1.0
<210>1
<211>78
<212>dna/rna
<213>artificialsequence
<400>1
atgaaaattaagtggtttaaagcaatgaaatctatagcaaaattcatcgcaaaagatcag60
ctgaagaaacatctttga78
<210>2
<211>24
<212>prt
<213>artificialsequence
<400>2
lysilelystrpphelysalametlysserilealalyspheileala
151015
lysaspglnleulyslyshisleu
20
- 还没有人留言评论。精彩留言会获得点赞!