苦瓜叶中总黄酮含量的检测方法与流程
本发明涉及药材质量的检测方法,具体涉及苦瓜叶中总黄酮含量的检测方法。
背景技术:
苦瓜叶为葫芦科苦瓜属一年生蔓性草本植物苦瓜(Momordica charantia L.)的干燥叶。性凉、味苦。具清热解毒、杀菌、止痢、止痛的功效,能治疗胃痛,痢疾,疔疮肿毒。苦瓜叶作为常用民间药,使用广泛,常用于治疗蚊虫叮咬后皮肤的红肿热痛、小儿痱子、热毒疮肿、杨梅疮、狗咬和鹅掌风。
苦瓜叶资源丰富,疗效确切,民间使用广泛,认可度高且方便易得,具有较好的开发价值。但是目前,国内外多对苦瓜果实进行多角度研究而其叶研究甚少,尚缺乏对苦瓜叶的质量评价方法和标准。
因此,为了确保苦瓜叶的质量和安全,需要一种检测方法,用于评估苦瓜叶的质量。
技术实现要素:
为解决上述问题,本发明提供了一种苦瓜叶中总黄酮含量的检测方法,包括以下步骤:
(1)标准曲线的建立
a、对照品溶液的制备:
取芦丁对照品,加乙醇配制成对照品溶液;
b、对照品溶液的测定:
取对照品溶液,依次加入5%亚硝酸钠溶液、10%硝酸铝溶液、氢氧化钠溶液,乙醇定容,在紫外分光光度仪中于506nm下测定吸光度,根据检测结果得到标准曲线;
(2)待测样品中总黄酮含量的测定:
c、供试品溶液的制备:
取待测苦瓜叶样品,60℃~90℃的石油醚回流提取,过滤,弃去滤液,重复一次,取残渣,60%~90%的乙醇超声或回流提取,过滤,用相应浓度的乙醇补足所失重量,得供试品溶液;
d、供试品溶液的测定:
取供试品溶液,以步骤b的方法进行测定,根据步骤(1)的标准曲线得到待测样品中总黄酮的含量。
进一步地,步骤a中,所述乙醇为50%乙醇。
进一步地,步骤b中,所述5%亚硝酸钠溶液与对照品溶液的体积比为1:1。
进一步地,步骤b中,所述10%硝酸铝溶液溶液与对照品溶液的体积比为1:1。
进一步地,步骤b中,所述氢氧化钠溶液与对照品溶液的体积比为10:1。
进一步地,步骤c中,所述乙醇为80%的乙醇。
进一步地,步骤c中,所述乙醇提取为回流提取。
进一步地,所述乙醇回流提取的时间为0.5~3小时,优选1.5小时。
进一步地,所述乙醇回流提取的温度为60℃~80℃。
进一步地,所述乙醇回流提取的温度为70℃。
进一步地,所述乙醇与待测苦瓜叶样品的体积质量比为100mL:1g~160mL:1g,优选140mL:1g。
本发明苦瓜叶中总黄酮含量的检测方法,通过多个工艺的筛选,可以准确、可靠、简便地检测苦瓜叶中总黄酮的含量,从而有效监控苦瓜叶药材的质量,为苦瓜叶的临床疗效提供了有效保障。
显然,根据本发明的上述内容,按照本领域的普通技术知识和惯用手段,在不脱离本发明上述基本技术思想前提下,还可以做出其它多种形式的修改、替换或变更。
以下通过实施例形式的具体实施方式,对本发明的上述内容再作进一步的详细说明。但不应将此理解为本发明上述主题的范围仅限于以下的实例。凡基于本发明上述内容所实现的技术均属于本发明的范围。
附图说明
图1苦瓜叶总黄酮紫外测定标准曲线。
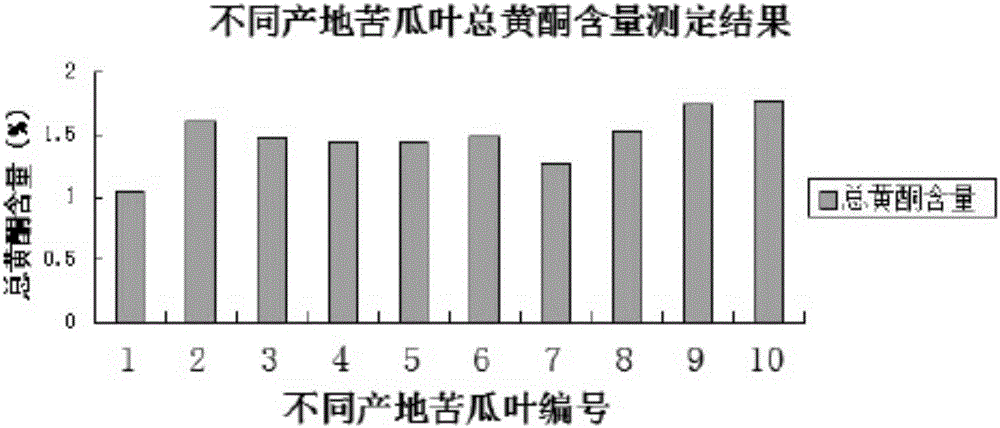
图2不同产地苦瓜叶总黄酮含量测定。
具体实施方式
下述实施例所用实验材料如下:
不同采收地点的样品于2011年8月前后分别采自四川省成都市、彭州市、简阳市、内江市、自贡市、宜宾市及河北保定,浙江嘉兴,广东佛山等地。采集新鲜叶,除去杂质,阴干即得。以上实验样品均经成都中医药大学药学院蒋桂华教授鉴定为葫芦科植物苦瓜Momordica charantia L.的干燥叶。样品采集地点、时间及生长环境见表1。
于2011年8月20日对口采于四川省彭州市敖平镇,经成都中医药大学药学院蒋桂华教授鉴定为葫芦科苦瓜属植物苦瓜Momordica charantia L.的干燥叶,作为对照药材;所用试剂均为分析纯。
表1不同产地苦瓜叶样品
仪器如下:
紫外分光光度计(日本岛津UV-1600型),真空干燥箱(上海森信实验仪器有限公司,DZG-6090型),十万分之一电子天平(德国SartoriusBP211D),超声波清洗器(昆山市超声仪器有限公司,KQ5200E型),电子天平(上海精密科学仪器有限公司,YP601N)等。
试药与试剂如下:
芦丁(中国药品生物制品检定所100080-201009);石油醚,乙醇,亚硝酸钠,硝酸铝,氢氧化钠等均为分析纯试剂。
实施例1
(1)总黄酮含量测定方法的考察
1对照品溶液
对照品溶液:取干燥至恒重的芦丁对照品适量,精密称定,置于100ml容量瓶,加入50%乙醇,定容,制成0.2mg/ml的芦丁溶液。
2检测波长考察
精密量取芦丁溶液1.0ml,置于25ml容量瓶中,加入5%亚硝酸钠溶液1.0ml,6min后加入10%硝酸铝溶液1.0ml,6min后加入1mol/L氢氧化钠试液10ml,15min后用50%乙醇定容。
将制好的芦丁溶液,放入紫外分光光度计,于200~600nm波长范围内扫描,结果显示,芦丁溶液在506nm处有最大吸收。因此,将测定波长定为506nm。
3线性关系考察
照一定梯度分别精密量取芦丁溶液适量,于25ml容量瓶中,显色,定容,测定吸光度A。以吸光度A为纵坐标,芦丁溶液浓度C为横坐标,绘制标准曲线。得线性方程A=32.173x+0.0066,R2=0.9977。在0.005~0.025mg/ml浓度范围内,吸光度值A与芦丁溶液浓度C呈良好的线性关系。结果见表2和图1。
表2吸光度值与对照品浓度关系
4精密度考察
精密量取芦丁溶液适量,7份,置于25ml容量瓶中,显色,定容,测定吸光度A。结果见表3。
表3精密度考察
实验结果显示,芦丁溶液的吸光度值A稳定,计算其RSD值,为0.12%,说明该精密度良好,可进行芦丁溶液的吸光度值A的测定。
5供试品溶液制备方法考察
5.1提取方法考察
取同一批次(表1中7号样)苦瓜叶样品粉末0.5g,6份,精密称定,置于250ml锥形瓶中,加石油醚(60~90℃)50ml,水浴回流1h,滤过,弃去滤液。重复一次。残渣加入不同提取溶剂50ml,称重,采用不同提取方法下提取1小时,用相应提取溶剂补至原重,过滤,取滤液4.0ml,置于25ml的容量瓶中,显色,加入提取溶剂定容,测定吸光度A,实验结果见表4。
表4供试品溶液提取方法考察
实验结果显示:回流提取所测定的吸光度A明显高于超声提取;随着乙醇浓度的升高,所测定的吸光度A也随之升高,在乙醇浓度为80%时达到顶峰,随后略有下降。80%乙醇回流提取时所测得的吸光度A最大,为0.870。因此,将苦瓜叶总黄酮的提取方法定为80%乙醇回流提取。
5.2回流温度考察
取同一批次(表1中7号样)苦瓜叶样品粉末0.5g,6份,精密称定,置于250ml锥形瓶中,加石油醚(60~90℃)50ml,水浴回流1h,滤过,弃去滤液。重复一次。残渣加入80%乙醇50ml,称重,在不同提取温度下提取1小时,用80%乙醇补至原重,过滤,取滤液4.0ml于25ml的容量瓶中,显色,用80%乙醇定容至25ml,测定吸光度,结果如表5。
表5提取温度考察
结果显示:70℃回流提取时所测定得到的吸光度A最大,故选择回流提取温度为70℃。
5.3提取时间考察
取同一批次(表1中7号样)苦瓜叶样品粉末0.5g,6份,精密称定,置于250ml锥形瓶中,加石油醚(60~90℃)50ml,水浴回流1h,滤过,弃去滤液。重复一次。残渣加80%乙醇50ml,称重,70℃回流提取不同时间,用80%乙醇补至原重,过滤,取滤液4.0ml于25ml的容量瓶中,显色,用80%乙醇定容至25ml,测定吸光度,结果如表6。
表6提取时间考察
实验结果显示:随着回流提取时间的延长,所测的吸光度A呈上升趋势,当回流提取时间为1.5h时,吸光度A最大,随后趋于平稳。即回流1.5h便可将苦瓜叶中黄酮类物质基本提取完全。因此,将苦瓜叶总黄酮含量测定的供试品提取时间定为1.5h。
5.4料液比考察
取同一批次(表1中7号样)苦瓜叶样品粉末0.5g,6份,精密称定,置于250ml锥形瓶中,加石油醚(60~90℃)50ml,水浴回流1h,滤过,弃去滤液。重复一次。残渣加80%乙醇不同体积,称重,70℃回流提取1.5h,用80%乙醇补至原重,过滤,取滤液4.0ml于25ml的容量瓶中,显色,用80%乙醇定容至25ml,测定吸光度,结果如表7。
表7料液比考察
结果显示:提取溶剂为50ml时已能充分提取苦瓜叶中的总黄酮,当提取溶剂为70ml时提取效率最高。
5.5本发明最佳的供试品溶液制备方法的确定
根据前述考察结果,确定本发明最佳的供试品溶液制备方法为:取苦瓜叶粉末0.5g,精密称定,置于250ml锥形瓶中,加石油醚(60~90℃)50ml,水浴回流1h,滤过,弃去滤液。重复一次。残渣加80%乙醇50ml,称重,70℃回流提取1.5h,用80%乙醇补至原重,过滤,即得供试品溶液。
6稳定性实验考察
取(表1中7号样)苦瓜叶药材粉末0.5g,精密称定,照“5.5”项下苦瓜叶总黄酮含量测定供试品溶液制备方法制备供试品溶液。平行精密量取供试品溶液4.0ml共6份,置于25ml容量瓶中,分别显色,80%乙醇定容,计时,每间隔10min测定一次吸光度值A。结果如表8。
表8苦瓜叶总黄酮测定稳定性试验
实验结果显示:60min内吸光度A无明显变化,在0.546~0.550之间。计算得RSD值为0.26%,说明在本实验条件下,供试品溶液显色60min内吸光度值A稳定,本实验稳定性良好。
7重复性试验考察
取同一批次(表1中7号样)苦瓜叶样品粉末0.5g,6份,精密称定,按“5.5”项下供试品溶液制备方法制备供试品溶液。取供试品溶液4.0ml于25ml的容量瓶中,显色,用80%乙醇定容至25ml,测定吸光度。计算苦瓜叶药材中总黄酮含量。结果如表9。
表9苦瓜叶总黄酮重复性试验
结果显示:1~6平行供试品溶液的吸光度为0.617~0.636,通过标准曲线方程计算得出1~6平行供试品总黄酮含量为1.19%~1.21%,平均含量为1.20%,计算得出其RSD值为0.68%,说明本实验重复性较好。
8回收率实验
取同一批次(表1中7号)苦瓜叶样品粉末0.5g,6份,精密称定,加入芦丁1mg,按“5.5”项下苦瓜叶总黄酮含量测定供试品溶液制备方法制备供试品溶液。取供试品溶液4.0ml于25ml容量瓶中,按显色条件显色,80%乙醇定容,测定吸光度,按回归方程计算苦瓜叶总黄酮含量,结果见表10。
表10苦瓜叶总黄酮回收率考察
实验结果显示:1~6号供试品的加样回收率为99.94%~100.44%,均值为100.13%,计算其RSD为0.22%,说明本实验方法加样回收率良好。
6.4苦瓜叶总黄酮含量测定
各取表1中10批苦瓜叶药材粉末0.5g,精密称定,照“5.5”项下苦瓜叶总黄酮含量测定供试品溶液制备方法制备供试品溶液。取供试品溶液4.0ml于25ml容量瓶中,按对照品溶液显色条件显色,80%乙醇定容,测定吸光度,按回归方程计算总黄酮含量,结果见表11和图2。
表11苦瓜叶总黄酮含量测定(n=2)
综上所述,本发明苦瓜叶中总黄酮含量的检测方法,通过多个工艺的筛选,可以准确、可靠、简便地检测苦瓜叶中总黄酮的含量,从而有效监控苦瓜叶药材的质量,为苦瓜叶的临床疗效提供了有效保障。
- 还没有人留言评论。精彩留言会获得点赞!