一种药物分子的同步控制方法及其应用与流程
本发明属于基因信息控制技术领域,具体涉及一种药物分子的同步控制方法及其应用。
背景技术:
癌症细胞严重威胁着人类健康,是全世界医学努力攻克的难题,癌症细胞具有扩散性和无序性,细胞扩散轨道难以控制,所以目前的治疗模型采取的方法是放疗和化疗。放疗是利用放射线治疗肿瘤的方法,放射线包括放射性同位素产生的α、β、γ射线和各类x射线治疗机或加速器产生的x射线、电子线、质子束及其他粒子束等。大约70%的癌症患者在治疗癌症的过程中需要用放射治疗,约有40%的癌症可以用放疗根治。但是放疗属于局部治疗,只对治疗部位的肿瘤有效,对于潜在的转移病灶和已经发生临床转移的癌症就难以发挥有效治疗。
化疗是一种全身治疗的手段,通过使用化学治疗药物杀灭癌细胞达到治疗目的。无论采用什么途径给药(口服、静脉和体腔给药等),化疗药物都会随着血液循环遍布全身的绝大部分器官和组织。因此,对一些有全身播撒倾向的肿瘤及已经转移的中晚期肿瘤,化疗都是主要的治疗手段。
然而,不管是放疗还是化疗方法,其在杀死癌细胞的同时也杀死了健康细胞,被治疗者常常会出现呕吐、腹泻、贫血、抵抗力下降等副作用,为了降低这些副作用,迫切需要研发药物分子对癌细胞的一对一控制的模型及方法。
技术实现要素:
本发明提供的一种药物分子的同步控制方法及其应用,实现药物分子对癌细胞的一对一同步控制,减少药物分子对健康细胞的损伤。
本发明的第一个目的是提供一种药物分子的同步控制方法,包括以下步骤:
s1,对随机游走的癌细胞以及自由扩散的药物分子分别建立数学模型,得到癌细胞概率浓度方程和药物分子概率浓度方程;
式(1)中,(x,y)表示平面位置坐标,p(x,y,t)表示癌细胞在平面有界区域内的浓度值,q(x,y,t)表示药物分子在平面有界区域内的浓度值,δp表示癌细胞自身的扩散作用,δq表示药物分子自身的扩散作用,d1表示癌细胞的扩散系数,d2表示药物分子的扩散系数,h表示药物分子的吸收系数,k表示癌细胞游走时受到的阻力系数,v(p,q)表示癌细胞与药物分子间的信号传递对癌细胞浓度的影响,u(p,q)表示癌细胞与药物分子间的信号传递对药物分子浓度的影响;
s2,找出药物分子和癌症细胞之间必存在的耦合作用,即对已建的癌细胞概率浓度方程和药物分子概率浓度方程确定耦合项满足:
式(2)中,d=d1+d2,ε1、ε2是我们要调节的系统参数,以实现精确控制的目的。为此,令ε1、ε2服从式(3)的演变规律:
式(3)中,m、n是两个定常数;
s3,将所述耦合方程分别带入癌细胞概率浓度方程和药物分子概率浓度方程,得到药物分子同步控制的反应扩散模型:
将式(3)和式(2)带入式(1)后我们得到最终的反应扩散模型为:
式(4)中
s4,利用式(4)所述的反应扩散模型进行药物分子与癌细胞的同步控制。
本发明的第二个目的是提供一种上述药物分子的同步控制方法在癌细胞化疗所用的药物剂量选择中的应用。
与现有技术相比,本发明提供的药物分子的同步控制方法具有以下有益效果:本发明提出的药物分子对癌细胞的一对一控制的模型及方法有效地降低化疗等方法的副作用,通过建立药物分子同步控制的反应扩散模型,实现药物分子对癌细胞的一对一同步控制,减少药物分子对健康细胞的损伤,在癌细胞化疗所用的药物剂量选择时,使药物的剂量应用更加科学,药物的选择和配置更加合理。解决了现有的放疗、化疗方法在杀死癌细胞的同时也杀死了健康细胞,由此产生较大副作用的问题。
附图说明
图1为在无耦合前提下,癌细胞和药物分子在平面的运动状态图;
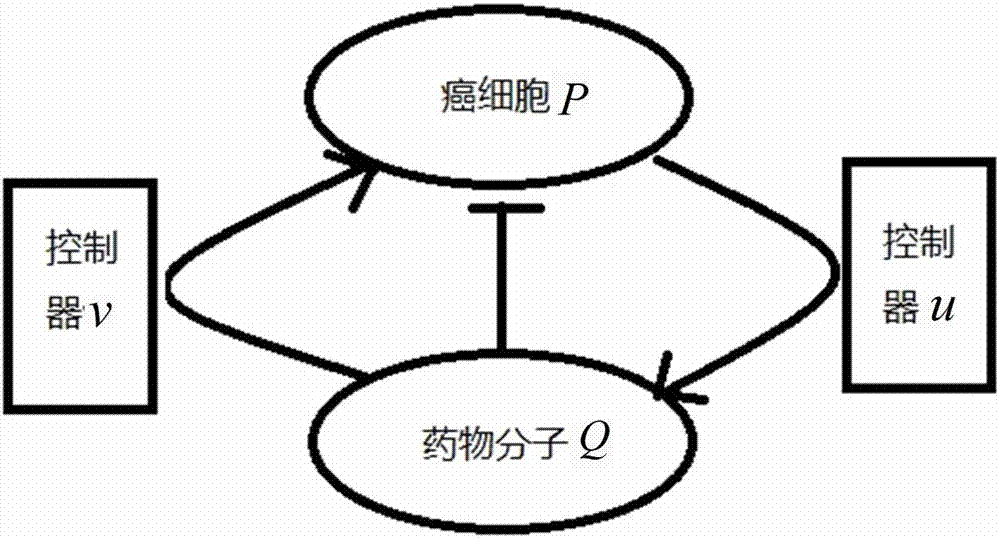
图2为癌细胞和药物分子之间的耦合作用简图;
图3为药物刚被注入时(t=0),癌细胞和药物分子在[0,100]×[0,100]上的浓度差图;
图4为药物被注入2s(t=2s)时,癌细胞和药物分子在[0,100]×[0,100]上的浓度差图;
图5为药物被注入5s(t=5s)时,癌细胞和药物分子在[0,100]×[0,100]上的浓度差图;
图6为药物被注入10s(t=10s)时,癌细胞和药物分子在[0,100]×[0,100]上的浓度差图。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明,但不应理解为本发明的限制。下面实施例中如未注明具体条件的实验方法,均按照本领域的常规方法和条件进行。
实施例1
本发明提供的一种药物分子的同步控制方法,以肿瘤癌细胞为例,包括以下步骤:
s1,对随机游走的癌细胞以及自由扩散的药物分子分别建立数学模型,得到癌细胞概率浓度方程和药物分子概率浓度方程。
我们在平面上对随机游走的癌细胞和自由扩散的药物分子进行动力学建模,结果如图1所示,图1为在无耦合前提下,癌细胞和药物分子在平面的运动状态图,癌细胞概率浓度方程和药物分子概率浓度方程参见式(1),癌细胞和药物分子间的动力学相互作用过程则表现为宏观上的信号传递过程,而癌细胞和药物分子之间信号的有效传递也就意味着癌症被有效治疗,这种有效治疗体现为两个动力系统(癌细胞的概率浓度方程和药物分子的概率浓度方程)的同步过程。
式(1)中,(x,y)表示平面位置坐标,p(x,y,t)表示癌细胞在平面有界区域内的浓度值,q(x,y,t)表示药物分子在平面有界区域内的浓度值,δp表示癌细胞自身的扩散作用,δq表示药物分子自身的扩散作用,d1表示癌细胞的扩散系数,d2表示药物分子的扩散系数,h表示药物分子的吸收系数,k表示癌细胞游走时受到的阻力系数,v(p,q)表示癌细胞与药物分子间的信号传递对癌细胞浓度的影响,u(p,q)表示癌细胞与药物分子间的信号传递对药物分子浓度的影响。需要说明的是,为简单起见,将(1)式等号左边的p(x,y,t)在等号右边记为p,(1)式等号左边的q(x,y,t)在等号右边记为q。
2013年诺贝尔生理学奖授予了发现细胞囊泡运输调控机制的3位科学家,被注入体内的药物分子正是由囊泡所包围,从而在正确的时间里被运输到正确的耙点位置,3位科学家初步解释了囊泡对于所运送货物的精确识别、定向运输以及目的地卸载的机制过程,此处囊泡的作用与动力学中耦合函数的作用是等同的,这也是我们对上述两个动力学系统添加耦合器的生物学背景,参见图2。
s2,基于药物分子和癌症细胞间存在的信号传递现象,找出药物分子和癌症细胞之间必存在的耦合作用(总体思路参见图2),对已建的癌细胞概率浓度方程和药物分子概率浓度方程添加了耦合方程:
式(2)中,d=d1+d2,ε1、ε2是我们要调节的系统参数,以实现精确控制的目的。为此,令ε1、ε2服从式(3)的演变规律:
式(3)中,m、n是两个定常数。
s3,将所述耦合方程分别带入癌细胞概率浓度方程和药物分子概率浓度方程,得到药物分子同步控制的反应扩散模型。
将式(3)和式(2)带入式(1)后我们得到最终的反应扩散模型为:
式(4)中
需要说明的是,上述式(1)-(4)中带有相同下标或者相同符号的相同字母代表相同含义,同时也具有取值范围,每个式子中不重复描述。
利用matlab软件对式(4)进行数值仿真,观察不同时间癌细胞和药物分子在[0,100]×[0,100]上的浓度差,结果如图3、图4、图5、图6所示。图3-6中是我们对癌细胞和药物分子浓度差随时间变化的模拟图,纵轴表示癌细胞和药物分子的浓度差(图3-6分别对应的时间为:t=0s、t=2s、t=5s、t=10s),随时间的增大,浓度差接近0,即随着药物被注入时间t的延长,癌细胞和药物分的浓度差值趋于0,也就是说通过耦合作用药物分子和癌症细胞达到了同步状态,也就是说我们的理论分析结果与癌细胞的精准治疗是吻合的,这也就是信号被有效传递的动力学机制。至此,我们通过同步控制的方法从动力学角度解释了这种耙向治疗的信号传递机制,图3-6的实验模拟结果也验证了我们这种理论的正确性。通过式(4)实现药物分子对癌细胞的一对一同步控制,减少药物分子对健康细胞的损伤,在癌细胞化疗所用的药物剂量选择时,使药物的剂量应用更加科学,药物的选择和配置更加合理。
尽管已描述了本发明的优选实施例,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例作出另外的变更和修改。所以,所附权利要求意欲解释为包括优选实施例以及落入本发明范围的所有变更和修改。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!