来那度胺的药物组合物及其制备方法和医药用途与流程
本发明属于药物制剂,具体涉及来那度胺的药物制剂及其制备方法。
背景技术:
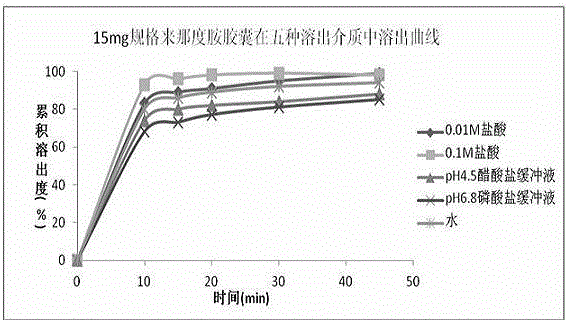
:来那度胺(Lenalidomide/Revlimid),化学名为3-(4-氨基-1,3-二氢-1-氧代-2H-异吲哚-2-基)-2,6-哌啶二酮,分子式C13H13N3O3,其分子量为259.2606。来那度胺是由美国Celgene生物制药公司开发的抗肿瘤药物,是沙利度胺的类似物,但比沙利度胺的副作用更小,且不引起新生儿畸形。临床上主要用于骨髓增生异常综合征(MDS)、多发性骨髓瘤(MM),白血病和套细胞淋巴瘤等的治疗,于2005年获得FDA获准上市。来那度胺是新一代免疫调节剂的代表药物,具有双重的作用机制。专利号为US7119106提供了来那度胺或其酸加成盐的药物组合物,以明胶溶液将甘露醇和乳糖混合物湿法制粒,然后与来那度胺及其他辅料压制成咀嚼片;或以淀粉糊作为粘合剂湿法制粒,然后压片;或把活性成分、微晶纤维素、月桂醇硫酸钠、硬脂酸镁干混后填充成明胶干填胶囊。专利号为CN200910098087.X提供了一种水难溶性药物的药物组合物及其制备方法,将来那度胺、PVP和尤特奇树脂溶于乙醇后喷在乳糖颗粒/小丸表面,然后混合硬脂酸镁等其他辅料填充胶囊或压制成片。专利号为CN201010139836.1提供了来那度胺普通口服固体制剂的制备方法,其由来那度胺、预混粉、交联羧甲基纤维素钠以及硬脂酸镁组成,以聚维酮溶于无水乙醇作为粘合剂进行湿法制粒,预混粉为重量比2:3的乳糖与微晶纤维素混合物。专利号为201310752093.9提供了一种用于治疗骨髓增生异常综合症的药物组合物,包括如下组分:来那度胺、载体、增溶剂、崩解剂、润滑剂、助流剂和粘合剂,通过采用干法制粒获得片剂或胶囊。专利号为201610122079.4提供了一种来那度胺药物组合物片剂及其制备方法,其由来那度胺晶体、乳糖、微晶纤维素、魔芋葡甘聚糖、β-环糊精、羧甲基淀粉钠、硬脂富马酸钠和粉状纤维素组成,并且需要采用高压电喷方法对来那度胺进行处理。但这些方法操作步骤长,制粒及干燥耗时较长、耗能较高,需要的设备较多、制备效率低、生产成本高;由于出现晶型变化或“粗化”现象而导致药物的溶出减慢;制粒孔隙率、比表面积等性质的重现性受影响因素较多,对药物溶出的稳定性的影响较大。技术实现要素:本发明的目的在于克服现有技术的不足之处而提供一种来那度胺的药物组合物,该药物组合物具有良好的稳定性和药物溶出度,生物利用度高。为实现上述目的,本发明采取的技术方案为:一种药物组合物,其包含来那度胺、稀释剂、崩解剂、润滑剂以及任选药学上可接受的载体。本发明所述药物组合物,其中所述任选药学上可接受的载体包括增溶剂、助流剂、矫味剂。本发明所述药物组合物,其中来那度胺采用微粉化处理,优选来那度胺平均粒径D(0.9)≤70μm,D(0.5)≤20μm;优选来那度胺平均粒径D(0.9)≤60μm,D(0.5)≤20μm,更优选50μm≤D(0.9)≤60μm,15μm≤D(0.5)≤20μm。本发明所述药物组合物,其中药物组合物的休止角为≤40°,优选休止角为≤38°,更优选休止角为≤35°。本发明所述药物组合物,按重量份数计,包含来那度胺1~8份、稀释剂30~80份、崩解剂1~5份、润滑剂0.1~1份。本发明所述药物组合物,按重量份数计,包含来那度胺1~5份、稀释剂35~75份、崩解剂1.2~2.4份、润滑剂0.4~0.8份;本发明所述药物组合物,按重量份数计,包含来那度胺1份、稀释剂37.4份、崩解剂1.2份、润滑剂0.4份。本发明所述药物组合物,按重量份数计,包含来那度胺3份、稀释剂73.8份、崩解剂2.4份、润滑剂0.8份。本发明所述药物组合物,按重量份数计,包含来那度胺5份、稀释剂71.8份、崩解剂2.4份、润滑剂0.8份。本发明所述药物组合物,其中所述稀释剂选自玉米淀粉、乳糖、木糖醇、甘露醇、山梨糖醇、磷酸钙、硫酸钙、碳酸钙和微晶纤维素中的任意一种或几种的混合物,优选乳糖和微晶纤维素的混合物。进一步地,乳糖和微晶纤维素的重量比为1.0~5.0:1,优选2.0~4.0:1,更优选3.4~3.7:1。本发明所述药物组合物,其中所述崩解剂选自交联聚维酮、交联羧甲基纤维素钠、低取代的羟丙基纤维素、羧甲基纤维钙、羧甲基淀粉钠、羟丙基淀粉和预胶凝淀粉中的任意一种或几种的混合物,优选交联羧甲基纤维素钠。本发明所述药物组合物,其中所述粘合剂选自水、乙醇、淀粉、聚维酮、羟丙基纤维素、甲基纤维素、羧甲基纤维素钠、明胶和阿拉伯胶中的任意一种或几种的混合物。本发明所述药物组合物,其中所述润滑剂选自硬脂酸、硬脂酸镁、硬脂酸钙和滑石粉中的任意一种或几种的混合物,优选硬脂酸镁。本发明所述药物组合物,其中所述增溶剂选自十二烷基硫酸钠、泊洛沙姆、β-环糊精及其衍生物、聚山梨酯和聚氧乙烯烷基醚中的任意一种或几种的混合物。本发明所述药物组合物,其中助流剂选自微粉硅胶、粉状纤维素、硅酸镁、硅酸钙和无水三硅酸镁中的任意一种或几种的混合物。本发明所述药物组合物,按重量份数计,包含来那度胺1-8份、乳糖25-60份、微晶纤维素5-20份、交联羧甲基纤维素钠1~5份、硬脂酸镁0.1-1份。本发明所述药物组合物,按重量份数计,包含来那度胺1-5份、乳糖29-60份、微晶纤维素8-16份、交联羧甲基纤维素钠1.2~2.4份、硬脂酸镁0.4-0.8份;本发明的一个具体实施方案中,按重量份数计,包含来那度胺1份、乳糖29.4份、微晶纤维素8份、交联羧甲基纤维素钠1.2份、硬脂酸镁0.4份。本发明的另一个具体实施方案中,按重量份数计,包含来那度胺3份、乳糖57.8份、微晶纤维素16份、交联羧甲基纤维素钠2.4份、硬脂酸镁0.8份本发明的另一个具体实施方案中,按重量份数计,包含来那度胺5份、乳糖55.8份、微晶纤维素16份、交联羧甲基纤维素钠2.4份、硬脂酸镁0.8份。本发明的另一个具体实施方案中,所述药物组合物含有以下组分:来那度胺5mg,无水乳糖147mg,微晶纤维素40mg,交联羧甲基纤维素钠6.0mg,硬脂酸镁2.0mg。本发明的另一个具体实施方案中,所述药物组合物含有以下组分:来那度胺10mg,无水乳糖294mg,微晶纤维素80mg,交联羧甲基纤维素钠12.0mg,硬脂酸镁4.0mg。本发明的另一个具体实施方案中,所述药物组合物含有以下组分:来那度胺15mg,无水乳糖289mg,微晶纤维素80mg,交联羧甲基纤维素钠12.0mg,硬脂酸镁4.0mg。本发明的另一个具体实施方案中,所述药物组合物含有以下组分:来那度胺25mg,无水乳糖279mg,微晶纤维素80mg,交联羧甲基纤维素钠12.0mg,硬脂酸镁4.0mg。本发明所述药物组合物,可进一步制成口服固体制剂,优选口服固体制剂为胶囊、片剂或颗粒剂。本发明所述药物组合物制成口服固体制剂时,每一单位制剂中含有临床应用中所需要的单位剂量。比如,本发明的每一胶囊剂中,可以含有1mg~30mg来那度胺,优选2.5mg~25mg,特别优选含有2.5mg、5mg、10mg、15mg、20mg或25mg来那度胺。本发明所述药物组合物制成口服固体制剂时,受试者口服后,可被快速吸收,达峰时间约为1小时,体内有较好的药动学行为。本发明还提供了将所述药物组合物用于治疗、预防和/或控制某些疾病或紊乱的方法,疾病或紊乱的例子包括但不限于骨髓增生异常综合征(MDS)、多发性骨髓瘤(MM),白血病或套细胞淋巴瘤。本发明的另一目的在于提供上述药物组合物的制备方法,包括如下步骤:1)将处方量来那度胺、稀释剂、崩解剂混合均匀;2)加入处方量润滑剂,混合均匀;其中所述来那度胺先进行微粉化,所述稀释剂为乳糖和微晶纤维素。本发明所述药物组合物的制备方法,具体包括:1)将来那度胺、微晶纤维素、崩解剂过筛处理;2)将处方量微晶纤维素加入料斗混合机中混匀;3)将处方量来那度胺、崩解剂及1/3处方量无水乳糖加入到料斗混合机中混匀;4)将2/3处方量无水乳糖加入到料斗混合机中混匀5)将处方量润滑剂加入到料斗混合机中混匀,得到混合物。其中,步骤1)中所述过筛选自60~70目筛,优选60目筛。其中,步骤2)、步骤3)、步骤4)、步骤5)中料斗混合机设定的转速为15rpm。其中,混合时间无具体要求,一般依原料用量及转速,通常步骤2)的混合时间为3~5分钟,步骤3)的混合时间为混合15~20分钟;步骤4)的混合时间为混合20~30分钟,步骤5)的混合时间为混合10~15分钟;优选步骤2)的混合时间为3分钟,步骤3)的混合时间为混合15分钟;步骤4)的混合时间为混合20分钟,步骤5)的混合时间为混合10分钟。进一步地,可将步骤5)所得的混合物进行压片,得到来那度胺片剂,优选地再将来那度胺片剂进行包衣,得到来那度胺包衣片剂。进一步地,将步骤5)所得的混合物填充明胶胶囊得到来那度胺胶囊剂。本发明还提供了所述药物组合物的溶出度测试方法,若无特别说明,本发明采用中国药典2015年版四部,溶出度与释放度测定法(通则0931第二法),以0.01mol/L盐酸溶液900ml为溶出介质,转速为每分钟50转,分别在10min,15min,20min,30min,40min和50min时取样,测定浓度并计算累积溶出度。本发明的有益效果是:(1)本发明药物组合物具有良好的稳定性,于30℃RH65%条件下存放18个月,活性物质的溶出度、含量及有关物质与0天相比并未见显著变化,保证了成品制剂在运输和贮存过程中质量安全可控。。(2)本发明药物组合物具有良好的药物溶出度,10分钟溶出度均大于80%,30分钟几乎完全溶出,提高了生物利用度。。(3)本发明药物组合物的制备方法,工艺简单、可操作性强,适宜工业化大生产;同时采用本发明制备方法获得的药物组合物,具有粉末流动性好,不同部位颗粒含量之间RSD≤3.0%,混合均匀度好。附图说明图1是10mg规格来那度胺胶囊在五种溶出介质中溶出曲线。图2是15mg规格来那度胺胶囊在五种溶出介质中溶出曲线。图3是25mg规格来那度胺胶囊在五种溶出介质中溶出曲线。图4是实施例8-11来那度胺胶囊在0.01M盐酸中的溶出曲线。具体实施方式为了进一步说明本发明,下面将结合具体实施例对本发明进行具体阐述,但本发明的保护范围并非限定于具体实施例。实施例1含有5mg活性成分的胶囊内容物组成及用量(200粒)组分用量来那度胺1.000g无水乳糖29.400g微晶纤维素8.000g交联羧甲基纤维素钠1.200g硬脂酸镁0.400g制备工艺:1)原辅料预处理:来那度胺经微粉化后过60目筛,微晶纤维素、交联羧甲基纤维素钠过60目筛处理。2)将处方量微晶纤维素加入到实验室料斗混合机中,设定转速15rpm,混合3分钟;3)将处方量来那度胺和交联羧甲基纤维素钠加入到实验室料斗混合机中,无水乳糖按照等量递增方法加入,设定转速15rpm,混合20分钟;4)将硬脂酸镁加入到实验室料斗混合机中,设定转速15rpm,混合5分钟;5)调整装量,按常规方法进行胶囊灌装。实施例2含有5mg活性成分的胶囊内容物组成及用量(200粒)组分用量来那度胺1.000g玉米淀粉29.400g微晶纤维素8.000g交联羧甲基纤维素钠1.200g硬脂酸镁0.400g制备工艺参照实施例1。实施例3含有10mg活性成分的胶囊内容物组成及用量(200粒)组分用量来那度胺2.00g无水乳糖54.80g微晶纤维素20.00g交联聚维酮2.40g硬脂酸镁0.8g制备工艺参照实施例1。实施例4含有10mg活性成分的胶囊内容物组成及用量(200粒)组分用量来那度胺2.00g无水乳糖58.80g微晶纤维素16.00g交联聚维酮2.40g硬脂酸镁0.8g制备工艺参照实施例1。实施例5含有15mg活性成分的胶囊内容物组成及用量(200粒)组分用量来那度胺3.000g无水乳糖57.800g微晶纤维素16.000g交联羧甲基纤维素钠2.400g硬脂酸镁0.800g制备工艺参照实施例1。实施例6含有15mg活性成分的胶囊内容物组成及用量(200粒)制备工艺参照实施例1。实施例7含有25mg活性成分的胶囊内容物组成及用量(200粒)组分用量来那度胺5.000g无水乳糖55.8g微晶纤维素16.000g交联羧甲基纤维素钠2.400g硬脂酸镁0.800g制备工艺参照实施例1。实施例8含有10mg活性成分的胶囊内容物组成及用量(2000粒)组分用量来那度胺20.0g无水乳糖588.0g微晶纤维素160.0g交联羧甲基纤维素钠24.0g硬脂酸镁8.0g制备工艺:1)原辅料预处理:来那度胺经微粉化后过60目筛,微晶纤维素、交联羧甲基纤维素钠过60目筛处理。2)将处方量微晶纤维素加入到实验室料斗混合机中,设定转速15rpm,混合3分钟;3)将处方量来那度胺,交联羧甲基纤维素钠和1/3处方量无水乳糖加入到实验室料斗混合机中,设定转速15rpm,混合15分钟;4)将2/3处方量无水乳糖加入到实验室料斗混合机中,设定转速15rpm,混合20分钟;5)将硬脂酸镁加入到实验室料斗混合机中,设定转速15rpm,混合10分钟;6)调整装量,按常规方法进行胶囊灌装。实施例9含有5mg活性成分的胶囊内容物组成及用量(2000粒)组分用量来那度胺10.0g无水乳糖294.0g微晶纤维素80.0g交联羧甲基纤维素钠12.0g硬脂酸镁4.0g制备工艺参照实施例8。实施例10含有15mg活性成分的胶囊内容物组成及用量(2000粒)组分用量来那度胺30.0g无水乳糖579.0g微晶纤维素160.0g交联羧甲基纤维素钠24.0g硬脂酸镁8.0g制备工艺参照实施例8。实施例11含有25mg活性成分的胶囊内容物组成及用量(2000粒)组分用量来那度胺50.0g无水乳糖558.0g微晶纤维素160.0g交联羧甲基纤维素钠24.0g硬脂酸镁8.0g制备工艺参照实施例8。实施例12含有10mg活性成分的胶囊内容物组成及用量(2000粒)组分用量来那度胺20.0g无水乳糖588.0g微晶纤维素160.0g交联羧甲基纤维素钠24.0g硬脂酸8.0g制备工艺参照实施例8。实施例13含有10mg活性成分的胶囊内容物组成及用量(15000粒)组分用量来那度胺0.150kg无水乳糖4.410kg微晶纤维素1.200kg交联羧甲基纤维素钠0.180kg硬脂酸镁0.060kg制备工艺参照实施例8。实施例14含有25mg活性成分的胶囊内容物组成及用量(15000粒)组分用量来那度胺0.375kg无水乳糖4.185kg微晶纤维素1.200kg交联羧甲基纤维素钠0.180kg硬脂酸镁0.060kg制备工艺参照实施例8。实施例15来那度胺粒径考察表1实施例16辅料用量考察表2表3表4表5实施例17长期稳定性考察将实施例8-11所得成品在包装条件下,于30℃/RH65%条件分别放置3、6、9、12、18月取样测定,考察产品稳定性。表6由表6可知,在长期稳定性试验中,本发明所述组合物,活性物质的溶出度、含量及有关物质检查与0天相比并未见显著变化,保证了成品制剂在运输和贮存过程中质量安全可控。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1