TFPR1蛋白及其编码基因与其在免疫调节中的应用的制作方法
本发明涉及生物
技术领域:
,尤其涉及TFPR1蛋白及其编码基因与其在免疫调节中的应用。
背景技术:
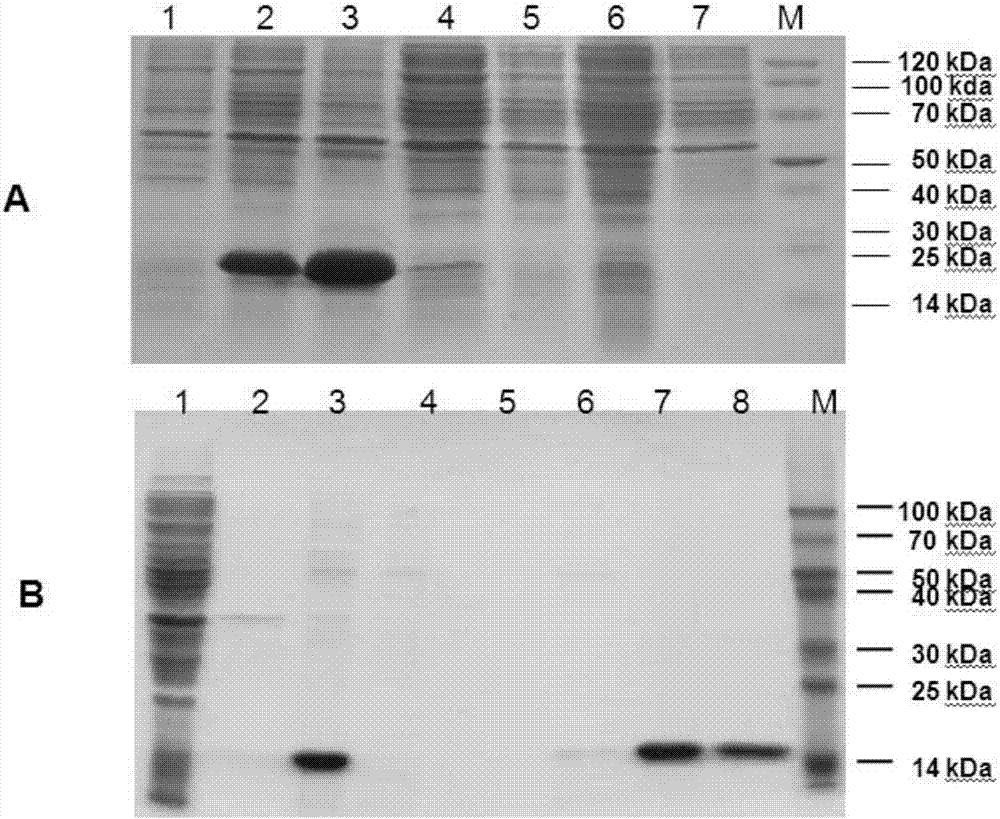
:疫苗接种是预防传染病的最有效的途径。传统疫苗主要包括减毒活疫苗和灭活疫苗,新型疫苗包括亚单位疫苗(subunitvaccine)、结合疫苗、合成肽疫苗、基因工程疫苗。新型疫苗纯度高、特异性强,但分子小,免疫原性相对较差,难以产生有效的免疫应答,需要佐剂来增强其免疫原性或宿主对抗原的保护性应答。由于机体对不同病原体的保护性免疫应答是不同的,研发能诱导针对不同病原保护性应答的疫苗需要不同的佐剂。一直广泛应用于人群疫苗的、美国FDA批准的铝盐佐剂对于许多新型疫苗佐剂活性较差,尤其是其诱导的细胞免疫较弱,对于小分子的抗原无佐剂活性,不能满足新型疫苗发展的需要。新型疫苗佐剂的组成形式多样,来源也不同,主要包括油/水乳剂型、颗粒型、微生物衍生物型佐剂等。迄今为止,已批准上市的新型疫苗佐剂仅有少数几种:MF59、AS04等。MF59是一种由Chiron公司研发的水包油乳剂,在高压条件下将鲨烯与Tween-80和Span85混合后进行微流化,进而形成均一的小滴状乳液,已在欧洲国家批准用于流感亚单位疫苗。该佐剂比铝盐具有更好的免疫效果,但不良反应增加。AS04是2005年2月葛兰素史克公司研发的,是一种乳剂,其新型佐剂系统AS04的乙型肝炎疫苗Fendrix获欧盟批准上市,安全性良好,但临床报道的局部不良反应与其他乙肝疫苗类似,包括注射部位疼痛、头痛和疲乏。这些油/水乳剂型的佐剂都在着较明显的不良反应。寻找一种需要剂量低、安全、有效的佐剂具有重要意义。Triflin是蛇毒中的一种主要成分,属于CAP家族蛋白,主要由两个部分组成,即N端的PR-1结构域及C端富含半胱氨酸结构域(cysteine-richdomain,CRD),二者之间由特定的连接区(hingeregion)组成。C-端的CRD区Cys在进化上十分保守,可形成8对二硫键,其中的10个Cys聚集于C端三分之一处,形成一个结构紧凑、功能重要的结构域,可能与阻断离子通道相关等功能相关。N端由进化高度保守的结构域PR-1组成,最初是在植物中发现,与植物抵抗各种病原生物感染密切相关,随后发现该保守结构广泛分布于各种生物中,功能不清。技术实现要素:本发明的一个目的是提供一种蛋白质。本发明提供的种蛋白质,命名为TFPR1,是如下(a)或(b)或(c):(a)氨基酸序列为序列表中序列2的蛋白质;(b)氨基酸序列为序列表中序列2第13-157的蛋白质;(c)将(a)或(b)所示的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且具有相同功能的由(a)或(b)所示的氨基酸序列衍生的蛋白质。上述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。上述序列表中的序列2由157个氨基酸残基组成。为了使1)中的TFPR1便于纯化,可在其氨基末端或羧基末端连接上如表1所示的标签,但不限于如下标签。表1为标签的序列标签残基序列Poly-Arg5-6(通常为5个)RRRRRPoly-His2-10(通常为6个)HHHHHHFLAG8DYKDDDDKStrep-tagII8WSHPQFEKc-myc10EQKLISEEDL上述2)中的TFPR1可人工合成,也可先合成其编码基因,再进行生物表达得到。上述2)中的TFPR1的编码基因可通过将序列表中序列1所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。编码上述蛋白的DNA分子也是本发明保护的范围。上述DNA分子为如下1)-3)中任一种DNA分子:1)编码区为序列表中序列1所示的DNA分子;2)在严格条件下与1)限定的DNA序列杂交且编码具有相同功能蛋白的DNA分子;3)与1)限定的DNA序列具有90%以上同源性,且编码具有相同功能蛋白的DNA分子。上述严格条件可为在6×SSC,0.5%SDS的溶液中,在65℃下杂交,然后用2×SSC,0.1%SDS和1×SSC,0.1%SDS各洗膜一次。含有上述DNA分子的重组载体、表达盒、转基因细胞系或重组菌也是本发明保护的范围;所述重组载体具体为将上述DNA分子插入表达载体,得到表达上述蛋白质的载体。在本发明的实施例中,表达载体为pET-TFPR1,将pET-His的BamHI和HindIII识别位点间的DNA替换为序列表中序列1所示TFPR1,保持pET-His的其它序列不变得到的重组载体,将该载体命名为重组载体pET-TFPR1。pET-TFPR1表达序列2所示的带有标签his的重组蛋白TFPR1。扩增上述DNA分子或其任意片段的引物对也是本发明保护的范围。上述的蛋白质、上述的DNA分子在制备免疫调节剂中的应用也是本发明保护的范围。上述免疫调节剂具有激活免疫细胞产生Th1型和/或Th2型细胞因子的功能;所述Th1型和/或Th2型细胞因子具体为IFNγ、IL-6和/或IL-10。其中,IFNγ、IL-6为Th1型细胞因子。上述的蛋白质、上述的DNA分子在作为抗原佐剂或疫苗佐剂中的应用也是本发明保护的范围。上述应用中,所述抗原为蛋白或多肽,所述疫苗为蛋白疫苗或多肽疫苗。上述应用中,所述佐剂具有如下1)和/或2)所示的功能:1)能诱导抗原产生体液免疫和/或细胞免疫;2)能诱导免疫细胞产生Th1型和/或Th2型细胞因子。本发明通过生物信息学分析,设计了仅保留免疫调节作用和佐剂活性的145Aa残基的TFPR1,经过大肠杆菌密码子优化后的基因TFPR1,并在大肠杆菌中高效表达了重组蛋白TFPR1。体外研究表明,TFPR1具有免疫调节作用,可以结合人和小鼠的抗原递呈细胞等多种免疫细胞,诱导Th1型为主的Th1/Th2型细胞因子的产生。体内研究表明,TFPR1可以有效增强多种不同类型的抗原(如蛋白抗原OVA、HBsAg以及合成多肽HIV-1多肽抗原PEP5)的免疫原性。TFPR1作为蛋白抗原的佐剂效果优于铝佐剂,可同时诱导体液和细胞免疫:与铝佐剂相比,其诱导的特异性抗体IgG和IgG1水平相近,但能诱导较高的水平的IgG2a,说明其能诱导Th1偏倚的Th1/Th2免疫应答;同时TFPR1可诱导细胞免疫。TFPR1作为多肽抗原的佐剂效果显著优于铝佐剂:TFPR1显著增强多肽抗原诱导的特异性体液和细胞免疫,而铝佐剂作用较弱。以上结果表明TFPR1是一种具有免疫调节活性的蛋白,有望作为新型佐剂应用与疫苗的研发与生产。附图说明图1为原核表达载体pET-TFPR1的酶切鉴定图2为重组蛋白TFPR1的诱导表达与纯化产物的SDS-PAGE鉴定图3为TFPR1的纯化与WB鉴定图4为TFPR1与小鼠脾细胞结合试验图5为TFPR1体外激活小鼠脾脏细胞细胞因子水平图6为TFPR1人PBMC体外结合试验和激活试验图7为TFPR1作为模式抗原OVA佐剂活性分析。图8为TFPR1作为HBsAg蛋白佐剂活性分析图9为TFPR1作为HIV-1多肽佐剂的活性分析图10为体内预存的抗TFPR1抗体对TFPR1佐剂活性的影响具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中主要试剂有:胰蛋白胨、酵母提取物购自Oxoid公司,质粒提取试剂盒购自北京全式金生物技术有限公司,限制性内切酶、T4连接酶购自TAKARA公司;最小截留分子量为3500Da的透析袋MD44-3.5(美国Viskase公司);异丙基-β-D-硫代半乳糖苷(IPTG)(Amresco,货号:0487);HighAffinityNi-ChargedResin(南京金斯瑞生物科技有限公司,货号:L00250);ECL发光液(货号:WBKLS0050)为Millipore公司产品;Bradford蛋白质定量试剂盒(天根生化科技有限公司,货号:PA102)。TMB显色液、终止液(万泰生物药业股份有限公司)。鼠抗His抗体(北京中杉金桥生物技术有限公司,货号:TA-02);HRP标记的山羊抗鼠IgG(货号:1036-05),IgG1(货号:1070-05),IgG2a(货号:1080-05)均为SouthernBiotech公司产品;抗His-FITC抗体(MiltenyiBiotech,货号:130-098-808),MouseIFN-γELISPOTSet(货号:551083),MouseIL-4ELISPOTSet(货号:551017),ELISPOTAECSubstrateset(货号:551951)均为BDBioscience产品。无内毒素卵白蛋白(InvivoGen,货号:vac-efova),2%氢氧化铝佐剂(InvivoGen,货号:Vac-alu-250),酵母表达的乙肝表面抗原(HBsAg)(天坛生物制品有限公司),HIV-1多肽PEP5PKVSFEPIPIHYCAPAGFAILKCNNKTF,HBsAg特异性多肽S28-39IPQSLDSWWTSL,纯度95%(北京赛百盛基因技术有限公司合成)。下述实施例中主要仪器有:水平电泳仪(北京六一仪器厂),超声波细胞粉碎机(SCIENTZ-ⅡD,宁波新芝生物科技股份有限公司),高速低温离心机(HITACHI,CR22GⅢ),垂直电泳仪、电转仪、电泳槽(北京六一仪器厂),核酸蛋白定量分析仪Nanodrop1000(Thermo公司),凝胶图像分析系统IS1000(美国AlphaIhnotech公司)。ELX-50型洗板机、ELX800型酶标仪(美国BIO-TEK公司);ELISPOTReader(CTL公司)。实施例1、蛋白TFPR1及其编码基因的获得及表达纯化1、蛋白TFPR1的获得经过生物信息学分析预测,设计一包含145个氨基酸残基的Triflin功能结构域,合成序列表中序列1,其所示的基因命名为TFPR1,并分别在5’和3’端加入BamHI和HindIII,委托南京金斯瑞生物技术有限公司全基因合成,获得克隆质粒pUC57-TFPR1(将序列表中序列1所示的TFPR1插入pUC57载体的EcoRV位点间得到。)。序列表中序列1所示的基因TFPR1编码的蛋白命名为TFPR1,该蛋白的氨基酸序列为序列表中的序列2自N末端第13位-157位氨基酸。2、重组载体的pET-TFPR1构建将全基因合成获得的重组载体pUC57-TFPR1经过BamHI和HindIII酶切,回收450bp酶切产物,与经过同样酶切的表达载体pET-His(GenePowerLabLtdShenzhenoffice)2900bp骨架利用SolutionⅠ连接酶16℃连接过夜,转化至DH5α感受态细胞,在含有氨苄青酶素的培养板中生长过夜;挑选克隆,抽提质粒,经BamHI和HindIII酶切鉴定,得到450bp的为阳性质粒(图1,泳道3为阳性)。将阳性质粒送去测序,该阳性质粒为将pET-His的BamHI和HindIII识别位点间的DNA替换为序列表中序列1所示TFPR1,保持pET-His的其它序列不变得到的重组载体,将该载体命名为重组载体pET-TFPR1。pET-TFPR1表达序列2所示的带有标签his的重组蛋白TFPR1。3、重组蛋白TFPR1的诱导表达及鉴定将上述重组载体pET-TFPR1和空载体pET-His分别转化E.coliBL21,得到重组菌BL21/pET-TFPR1(抽提质粒,经BamHI和HindIII酶切鉴定,得到2900bp和450bp的为阳性)和重组菌BL21/pET-His(抽提质粒,经BamHI和HindIII酶切鉴定,得到2900bp的为阳性)。将重组菌BL21/pET-TFPR1涂布于100μg/ml氨苄青霉素抗性的LB平板,培养12h后挑取单个菌落接种于相同抗性的LB培养基;次日1:50转接于含相同抗生素的LB培养基中,37℃,200rpm培养2.5h。于诱导样品加入IPTG至1mM,同时设未诱导(不加IPTG)对照,37℃、200rpm诱导不同时间。取1ml菌液于台式离心机(Sigma)12000离心1min收集菌体沉淀,尽量吸尽上清液,加入100μl蒸馏水重悬,并加入25μl5×SDS-PAGELoadingBuffer于沸水中加热10min,短暂离心后取10μl进行12%SDS-PAGE分析,以重组菌BL21/pET为对照。为观察目的蛋白以何种形式表达,取4mlBL21/pET-TFPR1诱导后产物以12000rpm离心1min收集菌体沉淀,加入1/10体积的蒸馏水悬后,再加入1mMPMSF,于冰浴中超声裂解菌体沉淀(功率300w,超声2s,间歇2s,共5min)12000rpm离心10min,留取超声上清液于-20℃保存备用,收集沉淀备用。产物进行12%SDS-PAGE电泳,电泳条件为:浓缩胶80V,时间30min;分离胶120V,时间为1.5h。结果如图2A所示,1.未诱导BL21/pET-TFPR1超声后产物;2.诱导BL21/pET-TFPR1超声后产物;3.诱导BL21/pET-TFPR1包涵体;4.诱导BL21/pET-TFPR1超声上清液;5.诱导BL21/pET-TFPR1包涵体洗液Ⅰ;6.诱导BL21/pET-TFPR1包涵体洗液Ⅱ;7.诱导BL21/pET-TFPR1包涵体洗液Ⅲ;M.14-120KDaMarker;可以看出,重组菌BL21/pET-TFPR1经过IPTG诱导4小时,收获菌体,经过超声破碎后SDS-PAGE电泳,得到了与预期大小一致的蛋白片段,约16kDa,目的条带主要存在于包涵体中(图2A第3泳道),上清中仅有少量表达(图2A第4泳道)。因此,TFPR1需要从包涵体中纯化并复性。4、重组蛋白TFPR1的大量表达与纯化取5μl重组菌BL21/pET-TFPR1加入5ml含100μg/ml氨苄青霉素的LB液体培养基,37℃、200rpm培养过夜;以1:100的比例转接至含有氨苄青霉素的500mlLB培养基中,当细菌浓度达到OD600为0.6时,加入终浓度为1mM的IPTG,继续孵育4h进行诱导表达,将诱导产物4℃、离心5min,8000rpm,收集菌体沉淀。向菌体沉淀中加入40ml蒸馏水,充分重悬后4℃、8000rpm离心10min,如此反复3次。然后用1/10体积的蒸馏水重悬后于冰浴中超声裂解(功率300w,超声2s,间歇2s,共30min)。4℃、12000rpm离心10min,留取沉淀,即为包涵体。将包涵体依次用包涵体洗液Ⅰ(0.5%TritonX-100,10mMEDTA)、Ⅱ(10%TritonX-100,10mMEDTA)、Ⅲ(10mMEDTA,2M脲)洗涤,每次洗涤后12000rpm离心10min;再将经过包涵体洗液Ⅲ洗涤后保留上清液为包涵体洗涤上清液,将沉淀用8M脲重悬后,于4℃冰箱放置过夜;4℃、12000rpm离心30min后,收集8M脲溶解的包涵体上清液。利用Ni2+亲和层析法(GenScript)纯化目的蛋白,将上述包涵体洗涤上清液用0.45μm的滤器过滤后上柱,调整流速为0.5-1ml/min;用6个柱体积的结合缓冲液(配方:500mmol/LNaCl,89.6mMNa2HPO4,10.4mMNa2HPO4,8mol/L脲,溶于水,pH7.8)洗柱;用4个柱体积的洗涤缓冲液(配方:500mmol/LNaCl,12mMNa2HPO4,88mMNa2HPO4,8mol/L脲,溶于水,pH6.0)洗柱;依次用6个柱体积的20mM、50mM、100mM、150mM、300mM咪唑洗脱缓冲液梯度洗脱蛋白,流速为0.5-1ml/min,分别收集洗脱缓冲液的洗脱液,进行SDS-PAGE电泳,观察目的蛋白的纯度。结果如图2B所示,1-8分别为超声上清液、包涵体洗涤上清液,8M脲溶解的包涵体上清液、穿柱液、结合缓冲液、20mM咪唑洗脱液、100mM咪唑洗脱液、300mM咪唑洗脱液,可以看出,当咪唑浓度在100-300mM时目的条带被洗脱下来,并且无杂带(图2B第7、8泳道)。收集100-300mM咪唑洗脱缓冲液洗脱液,即为变性重组蛋白TFPR1。5、复性后重组蛋白的纯度鉴定将上述变性重组蛋白TFPR1依次经过6M、4M、2M脲透析液(配方:体积比5%甘油,质量比1%甘氨酸,0.1mol/LTris,2mmol/LEDTA,脲素浓度分别为6、4和2mol/L,溶于水)、Laemmli缓冲液(体积比0.1%SDS,192mmol/L甘氨酸,25mmol/LTRIS-BASEUltraPure)及PBS溶液(137mmol/LNaCl,2.7mmol/LKCl,10mmol/LNa2HPO4,2mmol/LKH2PO4)透析进行复性,各缓冲液透析时间为12h,全过程均在4℃进行,PBS溶液透析得到的蛋白置于PEG6000中在4℃条件下进行浓缩,即为复性后重组蛋白TFPR1。将复性后重组蛋白TFPR1测定浓度,为0.3mg/ml;将复性后重组蛋白TFPR1进行SDS-PAGE电泳,结果如图3A所示,可以看出,复性重组蛋白TFPR1具有较高的纯度。复性蛋白SDS-PAGE电泳后,Westernblot鉴定,具体方法为:利用半干式电转仪80mA稳流电转40min,将蛋白转移至PVDF膜上,加入5%脱脂奶粉的TBS中室温封闭2h后,以1:1000稀释的小鼠抗his抗体,4℃孵育过夜。TBST漂洗5次后,以1:5000稀释的HRP标记山羊抗鼠IgG,室温孵育1h。TBST洗涤5次后,加入化学发光剂ECL,在暗室中曝光,观察结果。结果表明获得的蛋白大一小与预期一致,且未见杂带(图3B),表明获得了纯度较高的目的蛋白TFPR1。将复性后重组蛋白TFPR1用鲎试剂测定样品中内毒素的含量,结果其内毒素含量小于0.25EU/ml。实施例2、TFPR1作为免疫调节剂的应用1、TFPR1与小鼠脾细胞结合与激活试验无菌条件下分离BALB/c小鼠脾脏,分离单个核细胞,以流式细胞术分析蛋白与脾脏单个核细胞的结合,具体方法如下:将分离好的小鼠脾细胞调整为10×106/ml,每管加入50μL,并加入终浓度为10μg/ml的由实施例1的5制备的复性后重组蛋白TFPR1,混匀,室温孵育30min,然后以磷酸盐缓冲液(PBS)洗涤(1500rpm,6min),再加入FITC标记的抗His抗体(MiltenyiBiotec)。结果发现:TFPR1主要结合小鼠脾细胞中的具有抗原递呈作用的B细胞(图4B)和巨噬细胞(图4D),并结合一部分NK细胞(图4C),而不结合T细胞(图4A)说明TFPR1可能通过结合抗原递呈细胞,进而激活免疫细胞。进一步,以10μg/ml的由实施例1的5制备的复性后重组蛋白TFPR1与小鼠脾细胞共同孵育24h,收集上清,利用欣博盛生物科技有限公司细胞因子ELISA试剂盒(小鼠IFN-γELISA试剂盒,货号:EMC101g;小鼠IL-4ELISA试剂盒,货号:EHC006;小鼠IL-6ELISA试剂盒,货号:EMC004;小鼠IL-10ELISA试剂盒,货号:EMC005),方法根据产品说明书提供的方法检测复性后重组蛋白TFPR1刺激细胞上清的细胞因子,包括IFNγ、IL-4、IL-6和IL-10,观察重组蛋白对免疫细胞的激活作用。结果发现重组蛋白TFPR1激活免疫细胞产生以Th1型(IFNγ,IL-6)为主的细胞因子,以及调节型细胞因子IL-10(图5),而无Th2型细胞因子产生(未显示)。2、TFPR1与人PBMC结合与激活试验无菌条件下,利用Ficol分离人PBMC,以流式细胞术分析蛋白与脾脏单个核细胞的结合,利用ELISA方法(欣博盛公司产品,人IFN-γELISA试剂盒,货号:EHC102g;人IL-4ELISA试剂盒,货号:EHC006;人IL-6ELISA试剂盒,货号:EHC007;人IL-10ELISA试剂盒,货号:EHC009)检测蛋白刺激细胞上清的细胞因子,观察重组蛋白对免疫细胞的激活作用。方法与上述1基本相同,不同的是将小鼠脾细胞替换为人PBMC。利用流式细胞术观察(方法同上),发现TFPR1可以结合人血液中的T细胞(图6Aa)、B细胞(图6Ab)、单核细胞)(图6Ac)和NK细胞(图6Ad);并且有部分细胞为高水平结合,各种细胞中高结合细胞占所有结合细胞中的比例分别为T细胞11.39%,B细胞14.61%,单核细胞27.39%,NK细胞35.06%;以终浓度10μg/ml的浓度刺激人PBMC,结果发现TFPR1激活免疫细胞产生Th1型细胞因子为主。TFPR1在刺激后24小时后细胞培养上清中的以Th1型细胞因子IFNγ(图6Ba)和IL-6(图6Bb)为主,Th2型细胞因子IL-4则未检出(图6Bc),调节性细胞因子IL-10有轻度升高(图6Bd)。实施例3、重组蛋白TFPR1作为疫苗佐剂的应用1、动物免疫与分组雌性BALB/C小鼠,SPF级,5-6周龄,购买于军事医学科学院实验动物中心,随机分配到不同的实验组中,饲养于SPF级动物房。分别以无内毒素卵白蛋白OVA、酵母表达的乙肝表面抗原(HBsAg)、HIV-1多肽P5(PKVSFEPIPIHYCAPAGFAILKCNNKTFN)为模式抗原,观察TFPR1的佐剂活性。接种途径为肌肉,每只小鼠注射体积为200μL,在下述所有以铝佐剂作为佐剂对照的研究中,按照产品说明书推荐的优化剂量,铝佐剂和免疫原的体积比为1:9。(1)以OVA为模式抗原观察TFPR1的佐剂活性:将BALB/c小鼠5周龄随机分为4组,每组6只,实验组每只小鼠肌肉注射10μg由实施例1制备的重组蛋白TFPR1和10μgOVA的PBS(TFPR1+OVA),同时设铝佐剂+OVA(Alum+OVA)、OVA单独免疫(OVA)和PBS对照组,每只小鼠注射体积为200μL。接种间隔为3周,共接种3次。(2)以HBsAg为模式抗原观察TFPR1的佐剂活性:同OVA,不同之处是免疫的抗原为HBsAg,免疫剂量为1μg。接种间隔为3周,共接种2次。(3)以HIV-1多肽P5为模式抗原观察TFPR1的佐剂活性:同OVA,不同之处为多肽抗原的免疫剂量为20μg。接种间隔为3周,共接种2次。(4)小鼠体内预存抗TFPR1抗体时对其佐剂活性的影响:小鼠肌肉途径接种10μg的由实施例1制备的重组蛋白TFPR1,接种间隔为3周,共接种2次。在末次免疫3周后当在体内有较高抗体时,再以由实施例1制备的重组蛋白TFPR1和HBsAg(质量比为1:1)免疫小鼠,同周龄未免疫TFPR1的小鼠作为无预存抗体对照。免疫方案同HBsAg单独免疫。免疫两次后检测小鼠血清中的抗HBsAg抗体。2、ELISA法检测血清特异性抗体IgG,IgG1和IgG2a所有小鼠在免疫前和末次免疫后10天采集尾血,分离血清,用于检测血清中特异性抗体。分别以OVA,HBsAg和HIV-1多肽P5包被过夜,以不同稀释度的血清加入酶标板中,37℃孵育1小时;然后分别加入1/5000稀释的羊抗小鼠IgG,IgG1和IgG2a,37℃孵育45分钟;加入显色底物TMB显色15分钟,以2MH2SO4终止后,测定OD450/630,当被测样品OD值大于阴性标本OD450+2SD时判定为阳性,获得抗体效价。3、ELISPOT法检测疫苗诱导的细胞免疫应用ELISPOT方法检测特异性多肽刺激免疫小鼠脾脏单个核细胞产生IFN-γ(No.551083)和IL-4(No.551017)情况,判定佐剂增强抗原诱导的细胞免疫。在末次免疫后10天无菌处死小鼠,无菌取脾,制备单个细胞悬液,每孔加入1×106细胞,HBsAg和HIV-1多肽免疫小鼠分别以HBsAg多肽IPQSLDSWWTSL,HIV-1多肽P5PKVSFEPIPIHYCAPAGFAILKCNNKTFN10μg/ml浓度刺激,37℃,5%CO2培养48h;然后依次加入生物化抗细胞因子抗体,酶标记亲和素,显色底物AEC,终止反应后,待ELISPOT板完全干燥后读板,观察细胞免疫的水平。4、实验结果:(1)重组蛋白TFPR1显著增强OVA的免疫原性,效果优于铝佐剂小鼠末次免疫后10天检测血清中特异性抗体IgG,IgG1和IgG2a,结果发现TFPR1的具有较好的佐剂活性,血清中抗OVA抗体IgG(效价5600,图7A),IgG1(效价8000,图7B)和IgG2a(效价250,图7C)均高于OVA单独免疫组,但是其诱导的IgG2a水平高于铝佐剂组(效价83,图7C),表明TFPR1的佐剂活性优于铝佐剂。(2)重组蛋白TFPR1显著增强HBsAg的免疫原性,效果优于铝佐剂小鼠末次免疫后10天,利用ELISA方法检测血清中特异性抗HBsAg抗体,同样发现TFPR1的佐剂活性优于铝佐剂,虽然血清中特异性抗HBsAg抗体IgG(TFPR1vs铝佐剂:192000vs110080)和IgG1(TFPR1vs铝佐剂:179200vs136960)与铝佐剂相当(图8A和8B),但IgG2a水平高于铝佐剂(TFPR1vs铝佐剂:9467vs1955)(图8C)。进一步应用特异性HBsAg多肽刺激免疫后的小鼠脾细胞,发现与铝佐剂有显著不同,TFPR1诱导产生IFNγ(TFPR1vs铝佐剂:10vs4SFU/106脾细胞)为主4(图8D),说明TFPR1不但可以诱导体液免疫,也可诱导细胞免疫。(3)重组蛋白TFPR1显著增强HIV-1多肽(29肽)的免疫原性,效果显著优于铝佐剂小鼠在免疫后HIV-1多肽(29肽)采集血清,利用ELISA方法检测血清特异性性抗多肽抗体。结果发现,TFPR1对于多肽抗原的佐剂活性显著优于铝佐剂:无论IgG(TFPR1vs铝佐剂:249600vs4666),IgG1(TFPR1vs铝佐剂:316800vs19200)还是IgG2a(TFPR1vs铝佐剂:17400vs218)均显著高于铝佐剂(图9)。进一步以ELISPOT检测细胞免疫,发现TFPR1可以诱导IFNγ(TFPR1vs铝佐剂:35vs14SFU/106脾细胞)。以上结果表明,TFPR1作为多肽抗原的佐剂具有显著的优势,可以同时诱导多肽抗原产生体液免疫和细胞免疫。综合上述结果,TFPR1对于蛋白抗原和多肽抗原均具有很好的佐剂活性,其佐剂活性优于铝佐剂。(4)小鼠体内预先存在TFPR1的抗体不影响佐剂活性当小鼠在体内有较高水平抗体(20万)时,以TFPR1和HBsAg免疫小鼠,免疫两次后检测小鼠血清中的抗HBsAg抗体,结果发现,抗TFPR1抗体存在与否,抗HBsAg抗体水平并无统计学差异(IgG:20158vs10763,IgG1:17127vs3805,IgG2a:317vs168)(图10)。说明体内存在的抗TFPR1抗体并不影响其发挥佐剂活性。(5)重组蛋白TFPR1具有良好的安全性以上各组免疫小鼠在初次接种后10天内,每天观察小鼠的一般状况,发现注射局部无肿胀、溃疡,也未出现耸毛、精神萎靡、体重减轻等表现。免疫程序结束后处死小鼠,未发现肝脾肿大等现象。说明TFPR1具有较好的安全性。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺