一种联产琥珀酸和异戊二烯的基因工程菌及其构建方法与流程
本发明涉及一种联产琥珀酸和异戊二烯的基因工程菌及其构建方法,属于基因工程技术领域。
背景技术:
异戊二烯是一种重要的化工平台化合物,其95%用于合成橡胶;也是丁基橡胶的第二单体。此外,还可广泛应用于农药、医药、香料及粘结剂等领域。目前,异戊二烯的来源主要是通过石油基原料异戊烷、异戊烯脱氢法、化学合成法(包括异丁烯-甲醛法、乙炔-丙酮法、丙烯二聚法)和裂解C5馏分萃取蒸馏法。然而,随着化石资源的日益枯竭,原料来源是利用石油基原料制备异戊二烯的重要瓶颈问题。以可再生的生物质为原料,利用生物转化技术合成异戊二烯,因具有可持续性、环境友好、品质优异等优势,已成为国际上的研究热点。
目前,生物基异戊二烯的生物合成路线主要是以葡萄糖为原料,利用甲羟戊酸(MVA)或甲基赤藓糖-5-磷酸(MEP)途径合成异戊二烯(Jianming Yang,2012)。然而,不管是哪条合成路线,都会在合成异戊二烯的同时,产生二氧化碳,这样会造成碳转化率的损失,造成原料葡萄糖的浪费,增加合成成本,限制了该技术的发展和应用。此外,已有异戊二烯生物合成的报道多数是有氧发酵,由于异戊二烯与氧气混合,能形成爆炸性混合物,使其生物合成存在安全风险。
琥珀酸可用于食品添加剂,药物添加剂,去污剂添加物,发泡剂,离子螯合剂。目前,国际市场上工业用琥珀酸的年需求量超过15,000吨,售价在$5.90~8.80/kg(因纯度而异),市场潜力较大。目前,许多的化工产品都是以苯为原料的,但苯是石油化工产品,不具有可再生性。从长远考虑必须找到合适的可再生原料取代苯。利用生物技术,发酵合成琥珀酸是近年来得研究热点。葡萄糖经糖酵解途径生产磷酸烯醇式丙酮酸(PEP)和丙酮酸。PEP经羧化生成草酰乙酸,继而还原生成琥珀酸及延胡索酸,最后再经一步还原生成琥珀酸。常规利用代谢工程方法改造大肠杆菌以生产琥珀酸的方法是通过失活丙酮酸-甲酸裂解酶和乳酸脱氢酶以消除包括甲酸、乙酸、乙醇和乳酸等竞争途径。Millard等人通过在大肠杆菌JCL1208中过量表达PEP羧化酶,可以使琥珀酸产量提高3.5倍,但过量表达PEP激酶却没有任何效果。
在琥珀酸合成过程中,不管是利用PEP还是用丙酮酸合成,都需要利用一分子的二氧化碳。如果能联产异戊二烯和琥珀酸,使合成异戊二烯过程中释放的二氧化碳用于合成琥珀酸,就可避免碳原子的浪费。此外,在厌氧条件下,由于不存在外源电子受体,要以中间产物为 电子受体二自身得以氧化,要保证细胞内氧化还原平衡。即现有方法中碳原子利用最大化与氧化还原平衡之间存在矛盾,若要满足氧化还原平衡,底物中一半的碳原子会以PEP或(和)草酰乙酸的形式积累;若要满足碳最大化的流向目标产物,又需要额外添加NADH。然而,基于细胞代谢的复杂性,通过基因工程技术实现将异戊二烯合成过程中产生的二氧化碳用于琥珀酸的合成存在很大的不可预知性和不确定性,因此,目前尚没有联产异戊二烯和琥珀酸的报道。
技术实现要素:
为解决上述问题,本发明提供了一种联产琥珀酸和异戊二烯的基因工程菌及其构建方法,所采取的技术方案如下:
本发明的一个目的在于提供一种联产琥珀酸和异戊二烯的基因工程菌。该基因工程菌是在大肠杆菌中同时过表达异戊二烯合成途径所需酶的基因和丙酮酸羧化酶基因。
优选地,所述异戊二烯合成途径,是异戊二烯MVA合成途径或MEP合成途径。
优选地,所述基因工程菌是在大肠杆菌中共表达乙酰辅酶A酰基转移酶/羟甲基戊二酰辅酶A还原酶基因、3-羟-3-甲基戊二酰辅酶A合酶基因、甲羟戊酸激酶基因、甲羟戊酸-5-磷酸激酶基因、甲羟戊酸-5-二磷酸脱羧酶基因、异戊烯焦磷酸异构酶基因、异戊二烯合成酶基因和丙酮酸羧化酶基因。
更优选地,所述乙酰辅酶A酰基转移酶/羟甲基戊二酰辅酶A还原酶基因、3-羟-3-甲基戊二酰辅酶A合酶基因和异戊二烯合成酶基因连接于pACYCDuet-1质粒的多克隆位点上;所述甲羟戊酸激酶基因、甲羟戊酸-5-磷酸激酶基因、甲羟戊酸-5-二磷酸脱羧酶基因和异戊烯焦磷酸异构酶基因连接于pTrc质粒的多克隆位点上;所述丙酮酸羧化酶基因连接于pCOLADuet-1质粒上。
优选地,所述大肠杆菌,共表达1-脱氧-D-木酮糖-5-磷酸合成酶基因、5-磷酸脱氧木酮糖还原异构酶基因、异戊二烯合成酶基因和丙酮酸羧化酶基因。
更优选地,所述1-脱氧-D-木酮糖-5-磷酸合成酶基因、5-磷酸脱氧木酮糖还原异构酶基因和异戊二烯合成酶基因连接于pACYDuet-1质粒的多克隆表达位点上;所述丙酮酸羧化酶基因连接于pCOLADuet-1质粒上。
本发明的另一目的是提供一种所述基因工程菌的构建方法,该方法的步骤如下:
1)将乙酰辅酶A酰基转移酶基因/羟甲基戊二酰辅酶A还原酶基因mvaE、3-羟-3-甲基戊二酰辅酶A合酶基因mvaS以及异戊二烯合成酶基因isps4克隆到质粒pACYCDuet-1,构建重组质粒pACY-mvaE-mvaS-isps4;
2)将甲羟戊酸激酶基因ERG12、甲羟戊酸-5-磷酸激酶基因ERG8、甲羟戊酸-5-二磷酸脱羧酶基因ERG19以及异戊烯焦磷酸异构酶基因IDI1克隆到pTrcHis2B,得到重组质粒pTrc-low;
3)将丙酮酸羧化酶基因pyc克隆到质粒pCOLADUet-1上,得到重组质粒pCOLA-PYC;
4)将步骤1),2)和3)所得的重组质粒转化到大肠杆菌宿主细胞中,获得基因工程菌。
本发明还提供了另一种所述基因工程菌的构建方法,该方法的步骤如下:
1)将丙酮酸羧化酶基因pyc克隆到质粒pCOLADUet-1上,得到重组质粒pCOLA-PYC;
2)将1-脱氧-D-木酮糖-5-磷酸合成酶基因dxs、5-磷酸脱氧木酮糖还原异构酶基因dxr和异戊二烯合成酶基因isps4克隆到质粒pACYCDuet-1,构建重组质粒pACY-dxs-dxr-isps4;
3)将步骤1)和步骤2)所制备的重组质粒转化到大肠杆菌宿主细胞中,获得基因工程菌。
所述任一基因工程菌在发酵生产异戊二烯和琥珀酸中的应用也在本发明的保护范围之内。
所述应用的步骤如下:
1)将权利要求1所述基因工程菌接种到M9种子培养基中,在37℃、180rpm活化培养18-24h,获得种子菌液;
2)将步骤1)所得的种子菌液以10%的接种量接种到发酵培养基中,在转速300-800rpm,37℃的条件下培养至OD600为20-40,再添加总浓度为0.1-1.0mM的IPTG,关闭空气,通过氮气或二氧化碳,并利用氨水或碳酸钾控制pH在7.0,在厌氧25-37℃的条件下诱导表达。
本发明所涉及的各种基因中,所述乙酰辅酶A酰基转移酶基因/羟甲基戊二酰辅酶A还原酶基因、3-羟-3-甲基戊二酰辅酶A合酶基因优选来源于粪肠球菌(Enterococcus faecalis);所述甲羟戊酸激酶基因、甲羟戊酸-5-磷酸激酶基因、甲羟戊酸-5-二磷酸脱羧酶基因、异戊烯焦磷酸异构酶基因优选来源于酿酒酵母(Saccharomyces cerevisiae)。所述异戊二烯合成酶基因来源于银白杨(Populus alba);所述丙酮酸羧化酶基因,优选来源于枯草芽孢杆菌(Bacillus subtilis);所述1-脱氧-D-木酮糖-5-磷酸合成酶基因、5-磷酸脱氧木酮糖还原异构酶基因,优选来源于枯草芽孢杆菌(Bacillus subtilis)或大肠杆菌。
本发明所述宿主大肠杆菌优选大肠杆菌BL21(DE3)。
本发明获得的有益效果如下:
(1)没有碳的浪费,具有原子经济性。
(2)产品异戊二烯和琥珀酸都是具有很高附加值的产品,具有创造性。
(3)产品异戊二烯为气体,琥珀酸为液体,易于分离,具有规模化潜力。
(4)有助于细胞体内氧化还原平衡,提高目标产物总产率。
(5)本发明没有二氧化碳气体排放,绿色环保。
附图说明
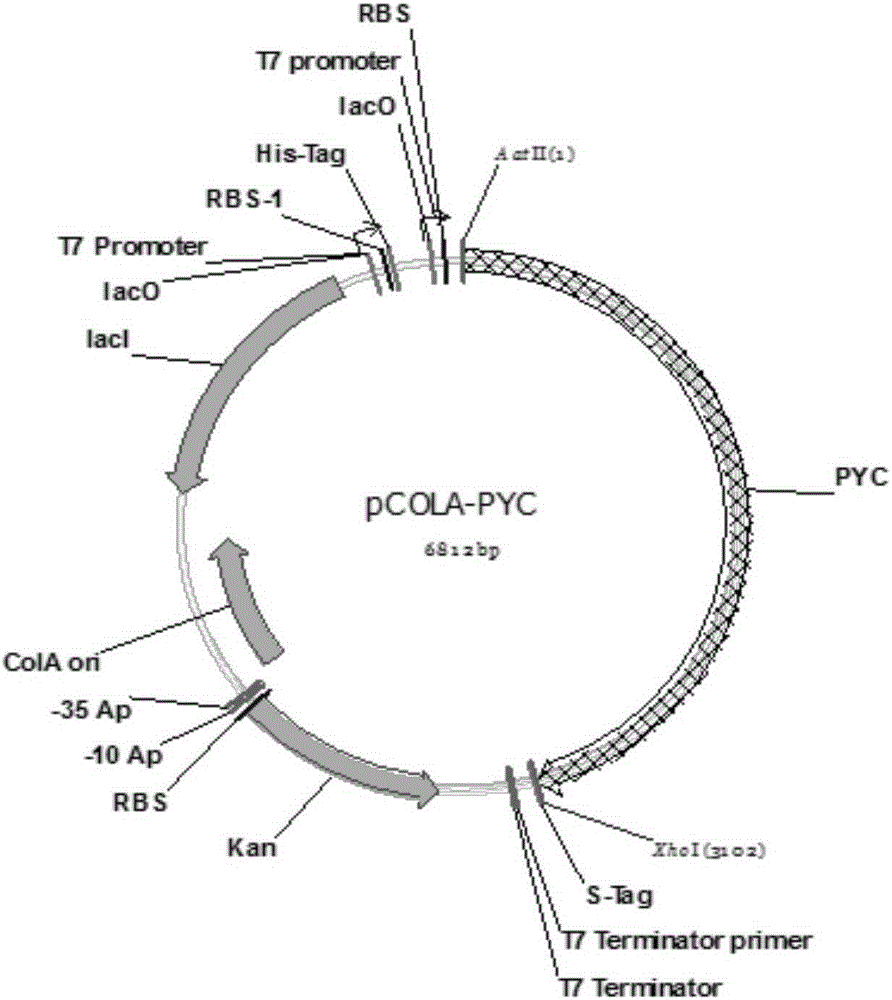
图1为pLWPYC1的质粒图谱。
具体实施方式
下面结合具体实施例对本发明做进一步说明,但本发明不受实施例的限制。
以下实施例中所用材料、试剂、仪器和方法,未经特殊说明,均为本领域中的常规材料、试剂、仪器和方法,均可通过商业渠道获得。
实施例1
(1)丙酮酸羧化酶基因的克隆、表达
以枯草芽孢杆菌的基因组(Bacillus subtilis subsp.subtilis str.168,NC_000964.3)为模板,扩增基因片段,同时连入酶切位点AatⅡ和XhoI。以PYC-F-AatⅡ:5’-ATCGGACGTCATGTTTGGTGACAAGGTAAAAG-3’
PYC-R-XhoI:5’-CCGCTCGAGTTATGCTTTTTCAATTTCAAGG-3’为引物,以枯草芽孢杆菌的DNA为模板进行扩增。扩增体系如表1所示:
表1 PCR扩增体系
PCR扩增程序:95℃预变性5min;95℃变性30s,53℃退火30s,72℃延伸2min,35个循环;72℃延伸10min。PCR产物纯化后,利用内切酶AatⅡ和XhoI进行双酶切,再连接到同样进行双酶切的pCOLADUet-1载体上,形成质粒pLWPYC1。
连接产物转化E.coli DH5α,然后涂布加有50μg·mL-1卡那霉素的LB固体平板,PCR筛选阳性克隆,从阳性克隆中提取重组质粒后,再通过限制性酶切和测序鉴定。
(2)E.coli重组菌株的构建
将来源于粪肠球菌(Enterococcus faecalis)的乙酰辅酶A酰基转移酶基因/羟甲基戊二酰辅酶A还原酶基因mvaE,3-羟-3-甲基戊二酰辅酶A合酶基因mvaS和来源于杨树(Populus alba)的的异戊二烯合成酶基因isps4(Gen Bank No.AB198180)连接到pACYCDuet-1质粒的多克隆位点上,具体连接方法参见文献(Bioresource Technology 104(2012)642–647),构建出MVA上游质粒(pACY-MvaE-MVAS-isps4)。将来源于酿酒酵母的甲羟戊酸激酶基因ERG12,甲羟戊酸-5-磷酸激酶基因ERG8,甲羟戊酸-5-二磷酸脱羧酶基因ERG19,异戊烯焦磷酸异构酶基因IDI1,连接到质粒pTrcHis2B上,具体连接方法参加文献(Bioresource Technology 104(2012)642–647),形成MVA下游质粒pTrc-low。将MVA上游质粒(pACY-MvaE-MVAS-isps4)和下游途径质粒pTrc-low及pLWPYC1共同热击转化到E.coli BL21(DE3)感受态细胞,涂布于加有氯霉素、卡那霉素和氨苄霉素抗生素的LB固体平板,通过PCR筛选获得阳性克隆,由此获得工程大肠杆菌LWPYC1。
将MVA上游(pACY-MvaE-MVAS-isps4)和下游途径(pTrc-ERG12-EGR8-ERG19-IDI1)共同热击转化E.coli BL21(DE3)感受态细胞,涂布于加有氯霉素和氨苄霉素抗生素的LB固体平板,由此获得工程大肠杆菌LWIP1作为对照菌。
(3)发酵产异戊二烯和琥珀酸
挑取步骤(2)获得的LWPYC1的白色单克隆(12h内长出的)在3ml LB(氯霉素Cm+氨苄霉素Amp+卡那霉素Kan,1‰)中,于37℃摇床培养活化。菌体浓度为1.0左右转接至30ml LB(Amp+Cm+Kan)中进行扩培,作为种子。
取扩培后的菌液按1%接种量接入100ml发酵培养基(K2HPO4·3H2O 0.98g;一水合柠檬酸0.21g;柠檬酸铁铵0.03g;MD牛肉粉0.9g;葡萄糖0.2g;MgSO4(1M)200ul;微量元素100μl((NH4)6Mo7O24·4H2O 7.4g/L,ZnSO4·7H2O 5.8g/L,H3BO449.4g/L,CuSO4·5H2O 5g/L,MnCl2·4H2O 31.6g/L);氨苄青霉素50μg/mL;氯霉素34μg/mL),37℃摇菌,菌体浓度长至1.0左右加入终浓度为0.5mM的IPTG,加瓶塞,进行厌氧发酵。30℃,180rpm摇菌。
对照菌LWIP1培养同LWPYC1,仅抗生素为(Amp+Cm)。
(4)产物检测
发酵24-48h后,抽上层气体进行GC-MS检测异戊二烯。取发酵液检测琥珀酸。琥珀酸的检测利用LC-MS进行。结果表明菌株LWPYC1可合成0.8g/L异戊二烯及1g/L的琥珀酸,异戊二烯和琥珀酸的总转化率之和达35.5%;对照菌LWIP1合成异戊二烯0.79g/L及200mg/L琥珀酸。转化率为11%。
实施例2
(1)E.coli重组菌株的构建
将经过密码子优化后的来源于杨树(Populus nigra)的异戊二烯合成酶基因ispS(GenBank accession No.HQ684728)和来源于枯草芽孢杆菌(Bacillus subtilis)的1-脱氧-D-木酮糖-5-磷酸合成酶基因dxs(Gene ID:938609)和1-脱氧-D-木酮糖-5-磷酸还原异构酶基因dxr(Gene ID:939636)连接到质粒pACYCDuet-1上,构建出质粒pAdxs2/dxr2/ispS,具体连接方法参加文献(Applied Microbiology and Biotechnology(2011)90:1915–1922)。将质粒pAdxs2/dxr2/ispS转化导入E.coli BL21(DE3)细胞中,构建出含有MEP途径的工程菌株ZYR4。将ZYR4制备成感受态细胞,再将质粒pLWPYC1转入感受态细胞,涂布于加有氯霉素和卡那霉素的LB固体平板,通过PCR筛选获得阳性克隆,由此获得工程大肠杆菌LWPYC2。以工程菌ZYR4作为对照菌。
(3)发酵产异戊二烯和琥珀酸
挑取步骤(2)获得的LWPYC2的白色单克隆(12h内长出的)在3ml LB(Cm+Kan,1‰)中,于37℃摇床培养活化。菌液浓度为1.0左右转接至30ml LB(Cm+Kan)中进行扩培,作为种子。
取扩培后的菌液按1%接种量接入100ml发酵培养基(K2HPO4·3H2O 0.98g;一水合柠檬酸0.21g;柠檬酸铁铵0.03g;MD牛肉粉0.9g;葡萄糖0.2g;MgSO4(1M)200ul;微量元素100μl((NH4)6Mo7O24·4H2O 7.4g/L,ZnSO4·7H2O 5.8g/L,H3BO449.4g/L,CuSO4·5H2O5g/L,MnCl2·4H2O 31.6g/L);氨苄青霉素50μg/mL;氯霉素34μg/mL),37℃摇菌,菌浓长至1.0左右加入终浓度为0.5mM的IPTG,加瓶塞,进行厌氧发酵。30℃,180rpm摇菌。对照菌ZYR4培养同LWPYC2,仅抗生素为氯霉素。
(4)产物检测
发酵24-48h后,抽上层气体进行GC-MS检测异戊二烯。取发酵液检测琥珀酸。琥珀酸的检测利用琥珀酸检测试剂盒(Oxaloacetate Assay Kit,sigma)进行。结果表明菌株LWPYC2可合成300mg/L异戊二烯及5g/L的琥珀酸;对照菌ZYR4合成异戊二烯280mg/L及400mg/L琥珀酸。
实施例3
M9种子培养基(/L):20g葡萄糖,6g Na2HPO4,3g KH2PO4,1g NH4Cl,0.5gNaCl,0.24g MgSO4,121℃高压蒸汽灭菌15min。
发酵培养基(/2L):19.6g K2HPO4·3H2O,4.2g citric acid·H2O,0.6g柠檬酸铁铵,0.8ml浓硫酸,40g葡萄糖,0.123mg(NH4)6Mo7O2·4H2O,0.097mg ZnSO4·7H2O,0.823mg H3BO4,0.083mg CuSO4·5H2O,0.527mg MnCl2·4H2O,4ml 1M MgSO4,1900ml蒸馏水。
挑取菌株LWPYC1单克隆到50ml M9种子培养基中,37℃、180rpm活化过夜(18-24h)。将种子按10%的接种量接种至含有2L发酵培养基的5L小型发酵罐中,通气量1.3VVM,转速400rpm,37℃培养至OD600约为20时,添加终浓度为0.1-1mM的IPTG,25℃-37℃诱导表达,通入二氧化碳,以碳酸钾和氢氧化钾调pH,控制pH在7.0,每隔8h补加一次IPTG。得到的异戊二烯产物通过GC-MS对其进行定性和定量分析。培养过程中对发酵液中残余葡萄糖进行检测,并通过变速流加浓度为800g/L的糖液,维持残糖浓度在0.5g/L以下。每4h取发酵液5ml,测定细胞OD600、葡萄糖浓度;每15min取尾气1ml,利用气相色谱检测产物异戊二烯和二氧化碳浓度。直到OD不再变化,产物不再产生为止。
结果表明菌株LWPYC1可合成6g/L异戊二烯及12g/L的琥珀酸,异戊二烯和琥珀酸的总转化率之和达24%,是对照菌的3倍。
实施例4
挑取菌株LWPYC1单克隆到50ml M9种子培养基中,37℃、180rpm活化过夜(18-24h)。将种子按10%的接种量接种至含有2L发酵培养基的5L小型发酵罐中,通气量1.3VVM,转速400rpm,37℃培养至OD600约为40时,添加终浓度为0.1-1mM的IPTG,25℃-37℃诱导表达,通入二氧化碳,以碳酸钾和氢氧化钾调pH,控制pH在7.0,每隔8h补加一次IPTG。得到的异戊二烯产物通过GC对其进行定性和定量分析。培养过程中对发酵液中残余葡萄糖进行检测,并通过变速流加浓度为800g/L的糖液,维持残糖浓度在0.5g/L以下。每4h取发酵液5ml,测定细胞OD600、葡萄糖浓度;每15min取尾气1ml,利用气相色谱检测产物异戊二烯和二氧化碳浓度。直到OD不再变化,产物不再产生为止。
结果表明菌株LWPYC1可合成10g/L异戊二烯及25g/L的琥珀酸,异戊二烯和琥珀酸的总转化率是对照菌的2.8倍。
虽然本发明已以较佳的实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明精神和范围内,都可以做各种的改动与修饰,因此,本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!