角度双加氧酶基因dpeA1A2及其应用的制作方法
本发明属于应用环境微生物和农业领域,涉及角度双加氧酶基因dpeA1A2及其应用。
背景技术:
化学农药是保障我国农业大丰收的重要手段之一,在农业生产中有非常重要的作用。农药是指应用于防治危害农作物的病虫、杂草等有害生物以及调节植物生长的化学试剂的总称。但是,由于长期以来剧毒、高残留、难降解农药的大量使用,我们面临着不断增加的土壤、地下水和大气农药污染的环境问题。而很多农药都是由中间体合成的,所以降解农药中间体具有广适性和高效性。农药污染降解技术可分为热降解、光降解、化学降解和生物降解。生物降解就是通过生物的作用将农药分解为小分子无毒或低毒化合物,并最终降解为水。其中微生物修复技术具有效率高、效果好、更绿色等特点,是农药修复技术的最好方法。
二苯醚和2-苯氧基苯甲酸(2-PBA)和常见的农药除草剂的中间体,也是重要的化学合成工业中间体。其衍生物和卤素取代物可以合成除草剂、杀虫剂等农药和药品等化工产品。获得二苯醚和2-PBA降解菌株和降解基因在治理除草剂残留,消除其药害技术研发中具有以下作用和功能,(一)通过现代生物工程技术将降解基因导入作物构建相应的除草剂抗性转基因作物,(二)通过现代微生物发酵技术将二苯醚和2-PBA农药中间体降解菌株和基因制成降解菌剂或酶制剂可以将土壤中二苯醚和2-PBA残留降解。此外,二苯醚和2-PBA降解基因还可用于化工染料中间体以及药物合成的生物转化,以及二苯醚化合物污染的生物修复。因此二苯醚和2-PBA降解基因在消除该类除草剂中间体药害、环境污染生物修复及生物转化领域中具有非常重要的理论和应用价值。
角度双加氧(Angular dioxygenase)是一种微生物特有的降解某些具有角度结构的芳烃污染物(如二噁英、咔唑、芴、二苯并噻吩、二苯醚类和二苯并呋喃等化合物)的方式。这些化合物的苯环上有一个C原子上连接了O、N原子(芴和二苯并噻吩连接的是C),形成一个夹角,因此这个C原子叫角度C原子。
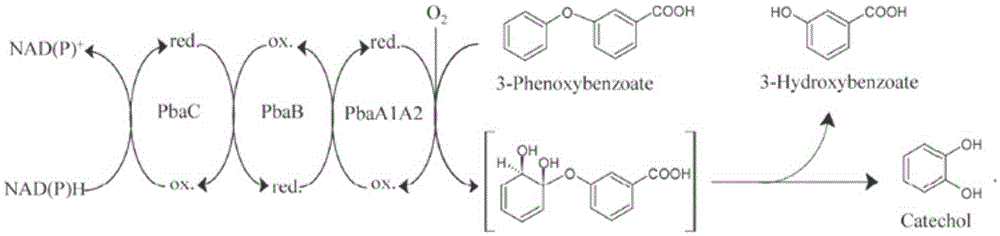
催化二苯醚类化合物3-苯氧基苯甲酸(3-PBA)醚键断裂的角度双加氧酶目前共报道了两个。一个是Pseudomonas pseudoalcaligenes POB310中的PobAB,属于I-型Rieske非血红素铁氧化酶(Rieske non-heme iron oxygenase,RHO)(Kweon et al.,2008),有2个组份:一个末端氧化酶 和一个FNRC-型还原酶(Dehmel et al.,1995),PobAB攻击二苯醚类化合物3-PBA的苯甲酸部分的1,6位碳原子,导致醚键断裂生成苯酚和原儿茶酸(见图1)。另一个是从Sphingobium wenxiniae JZ-1中发现的PbaA1A2BC,属于IV-型RHOs,有3个组分:一个末端氧化酶,一个[2Fe-2S]-型铁氧还蛋白和一个GR-型还原酶(Wang et al.,2014),PbaA1A2BC攻击3-PBA的苯部分的1′,2′位碳原子,导致3-苯氧基苯甲酸的醚键断裂生成邻苯二酚和3-羟基苯甲酸(见图2)。
能够降解二苯醚类化合物的侧面双加氧酶基因簇也有报道。1989年Frank Prefer等(Arch Microbioal)报道了Pseudomonas菌株中二苯醚的侧面双加氧途径,他们通过质谱及液相检测到了中间产物2,3-二羟基二苯醚,该物质随后水解成为苯酚及六元酮羧酸(见图3)。六元酮羧酸不被继续降解。同时他们发现Pseudomonas ET4菌中的2,3-二羟基联苯双加氧酶催化2,3-二羟基二苯醚的开环反应。
目前国内外已经报道了三个降解二苯醚类化合物的基因或基因簇,然而能够降解2-PBA的微生物尚未见报道。本发明首次发现了一株能降解2-PBA的鞘酯菌SC-3,并且通过研究首次克隆到降解2-PBA的基因簇,填补了国内外此领域的空白。本发明中降解二苯醚的作用基因和已报道的基因相似度低,降解后的产物和已报道的不同,是一类新型的降解二苯醚的基因。所以,鞘酯菌SC-3和其角度双加氧酶基因dpeA1A2是新颖的双效性农药中间体降解菌株和降解基因。
技术实现要素:
本发明的目的是提供二苯醚和2-PBA的角度双加氧酶基因dpeA1A2及其编码的蛋白质及其应用,该角度双加氧酶基因可用于构建降解二苯醚和2-PBA的转基因作物,也可用于土壤、水体中除草剂去除及化工染料和药物合成的生物转化。
本发明的另一目的是提供该基因的应用。
本发明的目的通过如下技术方案实现:
一株二苯醚和2-PBA的降解菌SC_3,于2015年7月8日保藏于中国典型培养物保藏中心,保藏编号为:CCTCC NO:M2015417。
通过稀释平板涂布法,从具有2-PBA降解效果的富集液中分离筛选到一株2-PBA降解菌株,命名为SC_3。此菌株即为本专利所用的菌株。菌株SC_3能在3天内完全降解100mg·L-1的2-PBA和二苯醚。菌株SC_3的细胞透射电子显微镜照片如图5所示。菌株SC_3在R2A、LB、NA和TSA平板上30℃生长良好,菌落呈黄色,边缘光滑,菌落凸起,革兰氏染色阴性, 短杆状细胞,好氧,有极生鞭毛。
SC_3的16S rRNA基因序列与Sphingobium属近缘关系最近,其中与Sphingobium abikonense KCTC 2864T相似性达97%。用邻接法将菌株SC_3与同源关系较近的菌种做成系统发育树(图6),在系统发育树上菌株SC_3和Sphingobiun属模式菌株聚类在一起,但形成了一个单独的分支。因此,结合菌落形态特性、生理生化特征以及16S rRNA基因系统发育树分析,菌株SC_3鉴定为Sphingobium属(Sphingobium phenoxybenzoativorans)。菌株保藏在中国典型培养物保藏中心,保藏编号为CCTCC NO:M2015417,保藏日期为2015年7月8日。
分析结果表明菌株SC-3的粗酶液可以降解二苯醚和2-PBA(图7)。
克隆降解二苯醚和2-PBA的角度双加氧酶的基因采取的策略为全基因组测序,通过对基因组信息分析及与已报道的芳烃化合物降解相关的双加氧酶基因比对来克隆目标基因。本发明的催化二苯醚化合物降解的双加氧酶DpeA1A2在氨基酸序列上应该和催化类似反应的已报道的双加氧酶有一定的相似性,因此拟通过用已经报道的双加氧酶氨基酸序列和菌株SC_3基因组比对,发现与这些双加氧酶氨基酸序列具有一定相似性的基因。利用目前已经报道的10个双加氧酶氨基酸序列和菌株SC_3基因组比对。结果发现菌株SC_3基因组有3个位置和已报道角度双加氧酶有相似性,对这3个位置的DNA序列进一步分析,将包含可能的双加氧酶基因的序列(基因前后各留2-3kb)克隆到广宿主载体pBBR1MCS-5导入突变菌株及没有二苯醚降解能力的菌株Sphingobium wenxinae JZ-1中,测定转化子是否获得降解二苯醚能力(见图5)。
用上面的策略获得了能够降解二苯醚和2-PBA的转化子,最后确定编码角度双加氧酶的基因命名为dpeA1A2。这是首次克隆到能降解二苯醚和2-PBA的基因。该基因由SEQ ID NO.1所示的大小为1383bp的角度双加氧酶大亚基编码基因dpeA1、SEQ ID NO.2所示的大小为561bp的角度双加氧酶小亚基编码基因dpeA2以及二者之间的连接序列GATG组成。
本发明报道的催化二苯醚化合物开环的双加氧酶DpeA1A2是由DpeA1与DpeA2两个亚基组成的一个角度双加氧酶,其基因和酶氨基酸序列和催化机制不同于上述报道的三种催化二苯醚降解的双加氧酶。DpeA1与已报道的二苯醚双加氧酶大亚基PobA、PbaA1和BphA1在氨基酸水平上的同源性分别只有37%、36%、37%。DpeA2与已报道的二苯醚双加氧酶小亚基PobB、PbaA2和BphA2在氨基酸水平上的同源性分别只有33%、35%、40%。在催化机制上,DpeA1A2在二苯醚其中一个苯环的1,2位双加氧导致苯环裂解,生成产物6-氧代-2,4-己二烯酸苯酚酯(见图4)。
本发明所述的角度双加氧酶基因dpeA1A2编码的角度双加氧酶蛋白DpeA1A2,由氨基酸序列为:SEQ ID NO.3所示的角度双加氧酶大亚基DpeA1和SEQ ID NO.4所示的角度双加氧酶小亚基DpeA2组成。
DpeA1A2BC全酶由SEQ ID NO.3所示的角度双加氧酶大亚基DpeA1、SEQ ID NO.4所示的角度双加氧酶小亚基DpeA2、SEQ ID NO.10所示的铁氧还蛋白DpeB以及SEQ ID NO.14所示的还原酶DpeC组成。
所述的DpeA1A2BC全酶的编码基因,由SEQ ID NO.1所示的角度双加氧酶大亚基编码基因dpeA1、SEQ ID NO.2所示的角度双加氧酶小亚基编码基因dpeA2、SEQ ID NO.9所示的铁氧还蛋白编码基因dpeB以及SEQ ID NO.13所示的还原酶dpeC组成。
含有所述的角度双加氧酶大亚基编码基因dpeA1或角度双加氧酶小亚基编码基因dpeA2的重组表达载体。
含所述的角度双加氧酶大亚基编码基因dpeA1或角度双加氧酶小亚基编码基因dpeA2的基因工程菌。
本发明所述降解菌SC_3在降解二苯醚和2-PBA中的应用。
所述的DpeA1A2BC全酶在降解二苯醚和2-PBA中的应用。
所述的DpeA1A2BC全酶在去除土壤、水体中二苯醚和2-PBA中的应用。
所述的DpeA1A2BC全酶的编码基因在降解二苯醚和2-PBA中的应用。
本发明的有益效果如下:
1.本发明用全基因组测序及基因比对方法成功的从菌株SC-3(CCTCC NO:M2015417)中克隆出角度双加氧酶酶基因dpeA1A2。在GenBank比对结果表明该基因为一个新的基因,全长(从起始密码子到终止密码子)为1948,编码647个氨基酸。
2.本发明提供的DpeA1A2BC全酶能在72hr内完全降解100mg·L-1的二苯醚和2-PBA,dpeA1A2可用于构建降解二苯醚和2-PBA转基因作物,也可用于去除土壤、水体中除草剂及药物合成的生物转化,具有非常重要的理论和应用价值。
附图说明
图1 PobAB催化二苯醚类化合物3-苯氧基苯甲酸醚键断裂的示意图
图2 PbaA1A2BC催化二苯醚类化合物3-苯氧基苯甲酸醚键断裂的示意图
图3侧面双加氧酶基因BphAaAbAcAd催化二苯醚降解示意图
图4角度双加氧酶基因dpeA1A2催化二苯醚降解示意图
图5角度双加氧酶基因dpeA1A2克隆的策略图
图6纯化后的DpeA1、DpeA2、DpeB和DpeC的SDS-PAGE电泳图谱
图7 DpeA1A2BC全酶催化降解二苯醚的LC/MS图谱
A:二苯醚的LC-MS图谱
B:DpeA1A2BC全酶催化降解二苯醚的降解产物苯酚的LC-MS图谱
C:DpeA1A2BC全酶催化降解二苯醚的降解产物6-氧代-2,4-己二烯酸苯酚酯的LC-MS图谱
图8 DpeA1A2BC全酶催化降解2-PBA的LC/MS图谱
A:2-PBA的LC-MS图谱
B:DpeA1A2BC全酶催化降解2-PBA的降解产物6-氧代-2,4-己二烯酸苯酚酯的LC-MS图谱
C:DpeA1A2BC全酶催化降解二苯醚的降解产物苯酚的LC-MS图谱
图9 DpeA1A2BC全酶降解2-PBA的生化反应途径。
生物材料保藏信息
鞘酯菌SC-3(Sphingobium phenoxybenzoativorans.sp.nov.SC_3),保存在中国典型培养物保藏中心,地址为中国武汉武汉大学,保藏编号为CCTCC NO:M2015417,保藏日期为2015年6月30日。
具体实施方式
实施例1.角度双加氧酶基因dpeA1A2的克隆
1.1细菌基因组总DNA的提取
SC-3(CCTCC NO:M2015417)大量培养后,采用CTAB法提取高纯度、大片段的SC-3的基因组总DNA,溶于TE缓冲液(pH8.0)中,置于-20℃保藏,具体方法参考F·奥斯伯等编的《精编分子生物学实验指南》。
1.2重组质粒的构建
通过PCR分别扩增包含疑似2-PBA(二苯醚)降解基因簇的片段,酶连到广宿主质粒pBBR1MCS-5上,构建重组质粒。通过基因组分析与序列比对,筛选出三个疑似目标双加氧酶基因进行功能验证实验,最后发现其中一个基因负责2-PBA和二苯醚的降解。
以SC_3基因组DNA作为模板,设计引物用来扩增疑似双加氧酶基因片段。所用引物如下表:
表1功能验证实验所使用的引物
PCR扩增体系:2×GC Buffer 25μL,dNTPs(2.5mmol·L-1)8μL,引物(25pmol·μL-1)各1μL,SC_3总DNA(约50ng·μL-1)2μL,LA-Taq DNA聚合酶(5U·μL-1)0.5μL,加H2O至50μL。
PCR反应条件:94℃5min;94℃30s,62℃30s,72℃1kb min-1,30个循环;72℃5min。
用Xba I和Hind III双酶切PCR产物及pBBR1MCS-5质粒。酶切反应体系如下:PCR产物/质粒40μL,Xba I和Hind III各2.5μL,10×M buffer 5μL。37℃过夜酶切后加入10μL10×Loading buffer终止反应。使用TAKARA胶回收试剂盒回收双酶切的DNA片段及质粒;随后将回收质粒和DNA片段16℃酶连过夜,构建功能验证质粒pBBR1、pBBR2和pBBR3;酶连产物转化至感受态E.coli DH5α中;所得转化菌株命名DH5α(pBBR1)、DH5α(pBBR2)和DH5α(pBBR3)。
1.3重组菌株的构建
将供体菌DH(pBBR1)、DH(pBBR2)和DH(pBBR3)、受体菌Sphingobium wenxiniae JZ-1和Sphingomonas sp.RW1、辅助菌E.coli HB101(PRK600)分别接入含有相应抗生素的LB液体培养基中,培养至对数期,离心后用无菌水重悬菌体按供体菌:受体菌:辅助菌=1:2:1的体积比在离心管中混合均匀。将无菌滤膜放置在无抗性的LB平板上,随后吸取混合菌液200μL加至滤膜上,30℃静置培养4天后,用液体LB洗下滤膜上的菌体,震荡混匀,取100μL菌液涂 布于选择性抗性LB平板(Str和Gm)上。培养4天挑取转入质粒的接合子在Gm和Sm双抗平板上划线纯化以备后续的降解功能验证试验。
1.4不同表达菌株对2-PBA和二苯醚降解功能验证
将DH5α(pBBR1/pBBR3/pBBR5)、Sphingobium wenxie JZ-1(pBBR1/pBBR3/pBBR5)和Sphingomonas sp.RW1(pBBR1/pBBR3/pBBR5)分别从LB平板上挑取单菌落接种至对应双抗性的100mL的LB液体培养基中,于150rpm的摇床中培养至对数生长期后,离心并用无菌水重悬菌体后分别接入100mg·L-1的2-PBA及二苯醚无机盐培养基中,DH5α于37℃,其它菌株于30℃培养。培养72h后2-PBA样品直接用0.45μm滤膜过滤,二苯醚样品需用三氯甲烷等体积萃取后过0.22μm滤膜。制备的样品用于HPLC和LC-MS的检测。液相检测发现,导入重组质粒pBBR3的重组菌Sphingobium wenxie JZ-1(pBBR3)和Sphingomonas sp.RW1(pBBR3)都能够降解2-PBA和二苯醚,并且在降解过程中也生成产物苯酚和6-氧代-2,4-己二烯酸苯酚酯(图4-8);而转入pBBR1和pBBR5的重组菌株都不能降解2-PBA和二苯醚。结果表明重组导入的第三段双加氧酶基因簇使这类菌株获得了2-PBA、二苯醚的降解功能,因此初步确定该基因簇应该就是编码2-PBA和二苯醚角度双加氧酶的基因,将其命名为dpeA1A2。但是,导入重组质粒pBBR3的大肠杆菌重组菌株E.coli DH5α(D3)却不能降解2-PBA和二苯醚),推测有可能是因为大肠杆菌中缺少这个双加氧酶催化作用所需要的配套电子传递链组分即铁氧还蛋白和铁氧还蛋白还原酶,从而不能为这个双加氧酶的末端氧化酶组分传递电子所致。
实施例2.角度双加氧酶基因dpeA1A2在BL21(pET-29a(+))中的高效表达
由于导入dpeA1A2基因的大肠杆菌重组菌株E.coli DH5α(dpeA1A2)不能降解2-PBA和二苯醚,我们怀疑大肠杆菌中缺少这个双加氧酶催化作用所需要的配套电子传递链组分即铁氧还蛋白和铁氧还蛋白还原酶导致其不能降解目的底物。另外,基因比对也未在dpeA1A2基因周围发现相关的电子传递链基因。因此,我们通过基因比对方式找到相关电子传递链基因并与dpeA1A2一起在BL21(pET-29a(+))中进行高效表达验证其功能。
2.1dpeA1A2及电子传递链基因的扩增
以菌株SC_3基因组为模板,以相应引物通过高保真酶分别扩增dpeA1A2及可能的铁氧还蛋白dpeB和还原酶基因dpeC序列。
扩增dpeA1基因的正向引物如SEQ ID NO.5所示,反向引物如SEQ ID NO.6所示。
扩增dpeA2基因的正向引物如SEQ ID NO.7所示,反向引物如SEQ ID NO.8所示。
扩增铁氧还蛋白编码基因dpeB的正向引物如SEQ ID NO.11所示,反向引物如SEQ ID NO.12所示。
扩增还原酶编码基因dpeC的正向引物如SEQ ID NO.15所示,反向引物如SEQ ID NO.16所示。
PCR体系:
5×Prime STAR HSBuffer(Mg2+)10.0μL
dNTP(2.5mmol·L-1)4.0μL
正向引物(25pmol·μL-1)1.0μL
反向引物(25pmol·μL-1)1.0μL
PrimeSTAR DNA Polymerase(2.5U·μL-1)0.5μL
模板DNA(约50ng·μL-1)2.0μL
ddH2O 31.5μL
总体系50μL
PCR反应条件:
2.2表达载体的构建
PCR产物纯化回收后用Nde I和Hind III双酶切dpeA2基因,dpeA1、dpeB和dpeC基因均用Nde I和Xho I进行双酶切。酶切体系(50μL)如下:
PCR产物:30μL
Nde I:2.5μL
Hind III:2.5μL
10×HBuffer:5μL
ddH2O:10μL
37℃酶切8h后,切胶回收相应DNA,与同样双酶切的pET29a质粒16℃酶连过夜。酶连体系(10μL)如下:
pET29a:1.5μL
DNA片段:7μL
T4连接酶:0.5μL
Buffer:1μL
随后将酶连产物转化BL21(DE3)感受态细胞,涂布于50mg·L-1Km抗性的LB平板上,37℃培养至单菌落长出。挑取单菌落LB试管扩培后,PCR验证片段是否插入并测序验证片段是否正确。将构建的重组载体菌分别命名为BL29DpeA1、BL29DpeA2、BL29DpeB和BL29DpeC。
2.3重组菌的诱导表达和纯化
重组菌株BL29DpeA1、BL29DpeA2、BL29DpeB和BL29DpeC分别于50mg·L-1Km抗性的LB平板上划线纯化,随后挑取单菌落接种至50mg·L-1Km的5ml LB试管中37℃、200rpm培养12h,按1%接种量接种至400mL的LB液体培养基,37℃、200rpm培养至OD6000.6后,加入0.5mM的FeCl3和IPTG 16℃低温诱导12h。4℃,12,000g条件离心10min收集菌体,然后用20mL PBS缓冲液重悬(pH 7.0)菌体,冰上超声波破碎菌体30min。随后于4℃,12,000g离心20min收集上清。上清通过SDS-PAGE检测确认蛋白诱导后用于进一步的纯化。上述过程自超声波破碎起均在低温下操作。纯化蛋白电泳图谱见图6。
2.4 DpeA1A2BC全酶对2-PBA和二苯醚的降解活性测定
采用1mL的体系测定角度双加氧酶全酶DpeA1A2BC对2-PBA和二苯醚的降解活性,具体体系如下:0.5mM 2-PBA(或二苯醚)、2μg DpeA1、2μg DpeA2、1.8μg DpeB、4.2μg DpeC、1mM NADH+、0.5mM Fe2+和1mM Mg2+,缓冲体系为20mM PBS(pH7.0);同时设置三个对照组:对照组1:0.5mM 2-PBA(或二苯醚)、1.8μg DpeB、1mM NADH+、0.5mM Fe2+、1mM Mg2+,缓冲体系为20mM PBS(pH7.0);对照组2:0.5mM 2-PBA(或二苯醚)、4.2μg DpeC、1mM NADH+、0.5mM Fe2+、1mM Mg2+,缓冲体系为20mM PBS(pH7.0);对照组3:0.5mM 2-PBA(或二苯醚)、1.8μg DpeB、4.2μg DpeC、1mM NADH+、0.5mM Fe2+和1mM Mg2+,缓冲体系为20mM PBS(pH7.0)。将加好的反应体系放置于30℃水浴锅内反应2h,然后沸水3min终止反应。将样品冷冻干燥后加入等体积的甲醇溶解样品,HPLC检测底物浓度变化并通过LC-MS鉴定降解产物。酶活力单位定义为:一分钟内消耗1nmol底物所需要酶的量,以U表示。通过液相测定及质谱鉴定发现,只有添加DpeA1A2BC全酶的组才能降解2-PBA和二苯醚,降解产物液相和质谱图见图7和图8。DpeB和DpeC单组分以及DpeB和DpeC双组份条件下均不能降解2-PBA和二苯醚。
- 还没有人留言评论。精彩留言会获得点赞!