蛋白质制造方法与流程
本发明属于蛋白质纯化领域。更具体地,本发明涉及纯化抗体和抗体片段的方法。
背景技术:
在治疗学领域中,蛋白质和抗体及抗体衍生的分子的使用在不断地发生并且显示其重要性,并因此并行发展了对受控制造工艺的需求。治疗性蛋白质的商业化需要其的大量生产。为此,蛋白质经常在宿主细胞中表达,随后在其制备成可施用的形式之前进行回收和纯化。
取决于要表达的蛋白质,宿主细胞的选择可以是哺乳动物宿主细胞(通常是cho(中国仓鼠卵巢)细胞)或细菌宿主细胞。在第一种情况下,蛋白质通常被分泌到回收的培养物上清液中,然后处理该溶液以进行蛋白质纯化。
当宿主细胞是革兰氏阴性原核细胞时,常常优选的表达系统涉及新合成的蛋白质,其积聚在周质空间内并从周质空间分离出来。在这种情况下,一旦达到所需的蛋白质表达水平,就将该细胞收获和加工。然后通过使收获的细胞进行蛋白质提取方法来回收蛋白质,这涉及将蛋白质从周质释放到溶液中,随后除去细胞碎片和其它杂质。细胞收获到蛋白质释放的这些步骤通常包括在所谓的初级回收中。然后将所得的含蛋白质的溶液加工以进行蛋白质纯化。用于周质表达的优选革兰氏阴性原核细胞通常是大肠杆菌(escherichiacoli)菌株或荧光假单胞菌(pseudomonasfluorescens)细胞。
从复杂混合物的蛋白质纯化根据靶蛋白质进行调整。在抗体和抗体衍生产物的情况下,纯化通常涉及经由色谱法的第一产物捕获步骤,其提供第一次纯化和显著浓度的产物。该第一步之后通常是一个或多个进一步的色谱步骤,其用于减少污染物诸如宿主细胞杂质、培养基、纯化过程相关的杂质和产物相关的杂质。
近年来,将不同的蛋白质(包括抗体和抗体衍生的片段)与具有特定功能的另一种分子偶联已经变得越来越普遍,这被应用于诊断和治疗用途,仅举几个例子,可以是将抗体靶向至特定的一组细胞,或者可以是抗体将药物靶向至其特定的作用位点,或者该分子可以被预定为增加抗体在动物体内的半衰期。后者对于抗原结合抗体片段易于从动物的循环系统中迅速清除的情况尤其如此。
不同的分子可以通过蛋白质中的反应性基团与蛋白质偶联,反应性基团可以天然存在于蛋白质中,或通过蛋白质工程人工引入。通常,用于与第二分子的蛋白质结合的有利反应性基团是存在于未配对半胱氨酸残基中的硫醇基团。在这个意义上,抗体铰链是用于位点特异性反应的常见区域,因为它们含有半胱氨酸残基,并且远离抗体的可能参与抗原结合的其它区域。例如,硫醇基团的与聚乙二醇(peg)的反应或peg化是众所周知的位点特异性peg化方法,其中可以使用多种硫醇特异性试剂。
然而,在天然蛋白质中,半胱氨酸残基通常参与二硫键桥或负责与金属或其它蛋白质的相互作用。因此,为了实现位点特异性结合,这些反应性基团需要处于正确的构象,即它们的硫醇基团是游离的,以使其能够进行反应。例如,veronese等人bioconjugatechemistry2007nov-dec;18(6):1824-30中描述了在单个半胱氨酸残基处的g-csf的peg化,其中在瞬时变性条件下进行peg化。在现有技术中还尝试优化方法以获得处于最佳构象的蛋白质以使其能够随后与所需分子反应。例如,wo2007/003898描述了在纯化fab'之后引入的特定的diareduction步骤,以制备其用于随后与peg反应。在许多情况下,例如fab',期望选择性地影响用于缀合的一个或多个靶半胱氨酸而不还原蛋白质中存在的其它半胱氨酸。例如,在这种情况下,fab'在重链和轻链恒定区之间具有天然的链间二硫键,因此为了选择性地还原抗体其它位置(例如铰链)的靶半胱氨酸,还原需要小心进行,使得二硫链保持完整并且避免与链间半胱氨酸的反应。通常,这是通过使用被认为是轻度的还原条件来实现的。然而,鉴于还原是常见的化学反应,即使在所述轻度还原条件下,存在于复合混合物中的不同化合物仍然能够在还原环境中反应,从而导致可影响随后的蛋白质纯化的改变的性质,例如但不限于结合行为。因此,现有技术中描述的还原步骤在蛋白质被纯化后马上进行。随后,所需的蛋白质缀合物必须从未反应的蛋白质或其它不需要的缀合物中纯化。该偶联反应过程的效率直接关系到生产效率和相关制造成本。
鉴于上述情况,本领域还需要提供用于蛋白质制造的改进方法,特别是在制备的蛋白质将要与第二分子偶联的情况下。
附图说明
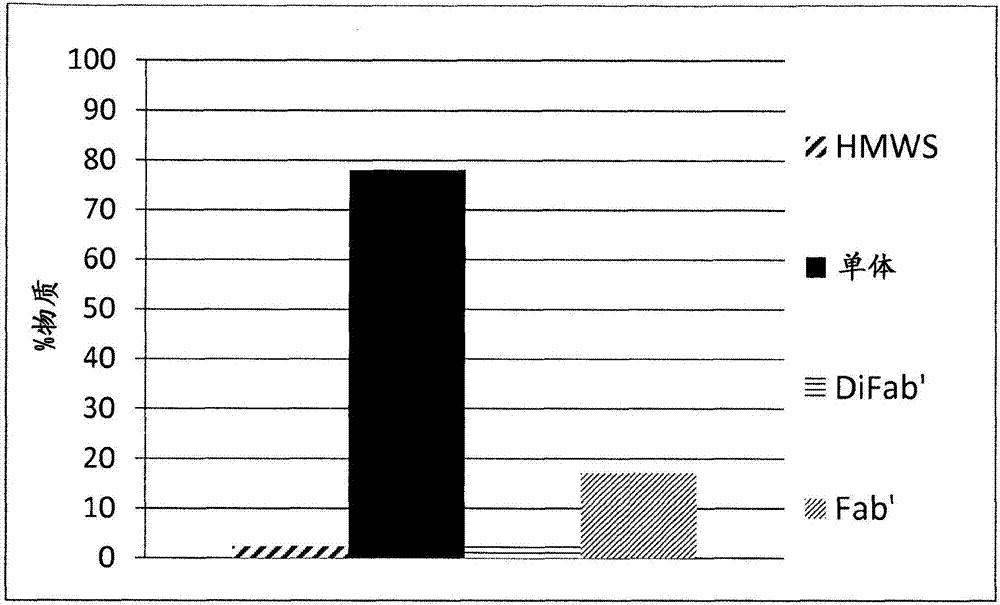
图1显示了从回收自从表达fab'1的细胞获得的大肠杆菌周质提取物进行的两个平行纯化过程的fab'1的peg化反应获得的样品的尺寸排阻hplc分析。一个过程在对照条件下进行,即没有谷胱甘肽,而在第二过程中,将蛋白质在捕获蛋白质的第一色谱步骤到最后的色谱步骤中保持在1mm谷胱甘肽的存在下。hmws是指高分子量物质或聚集体的量,单体是指与peg偶联的fab'1的量,difab'是指fab'1二聚体的量,fab'是指剩余未结合的fab'1的量。
图2显示了从回收自从表达cdp870fab'的细胞获得的大肠杆菌周质提取物并随后在捕获蛋白质的第一色谱步骤到最后的色谱步骤中在1mm谷胱甘肽的存在下保持蛋白质的情况下进行纯化的cdp870fab'的peg化反应获得的样品的尺寸排阻hplc分析。hmws是指高分子量物质或聚集体的量,单体是指与peg偶联的cdp870fab'的量,difab'是指cdp870fab'fab'2二聚体的量,fab'是指剩余未结合的量。
图3显示了从回收自大肠杆菌周质提取物回收并且根据现有技术方法纯化的fab'1的peg化反应获得的样品的尺寸排阻hplc分析。hmws是指高分子量物质或聚集体的量,单体是指与peg偶联的fab'1的量,difab'是指fab'1二聚体的量,fab'是指剩余未结合的fab'1的量。
发明详述
本发明通过提供用于制备蛋白质的新方法来解决上述需求,特别是在所述蛋白质将要偶联至另一分子的情况下,特别是在用于获得例如用于治疗目的的蛋白质的工业蛋白质制造中。
在第一个实施方案中,本发明提供了用于制备蛋白质的方法,包括:
a)在宿主细胞中表达蛋白质,
b)从含有宿主细胞和其它污染物的混合物中纯化所述蛋白质,其中所述纯化包括至少一个色谱步骤,并且其中向所述混合物中加入还原剂,并且将蛋白质在第一色谱步骤直到最后的色谱步骤的过程中保持在所述还原剂的存在下。
通常,第一色谱步骤用作蛋白质捕获步骤,存在本领域技术人员可使用的不同的色谱步骤,例如使用具有适当官能团的珠状树脂或膜作为用于亲和色谱、阳离子色谱、阴离子色谱、混合模式色谱、疏水色谱或疏水电荷诱导色谱的固相的色谱。产物捕获通常以结合和洗脱模式进行,其中目标蛋白质与固相的结合允许诸如污染蛋白质的杂质流过色谱介质,而目标蛋白质仍然与固相结合。然后用洗脱缓冲液从固相中回收目标结合蛋白,所述洗脱缓冲液破坏目标蛋白质与所述固相结合的机制。最合适的产物捕获步骤将基于要纯化的蛋白质的性质来确定,例如当制造全长抗体时的常用产物捕获步骤是基于蛋白a的亲和色谱。
在本发明的具体实施方案中,所述第一色谱步骤是阳离子交换色谱步骤,其中目标蛋白质与色谱介质结合,随后被洗脱到含有该蛋白质的第一洗脱液中。
在本发明方法的另一个具体实施方案中,还原剂存在于所述阳离子交换色谱期间使用的缓冲液中。更具体地,还原剂存在于装载缓冲液、洗涤缓冲液和洗脱缓冲液中。
如前面部分所述,第一色谱步骤之后通常是一个或多个后续的色谱步骤,以帮助除去进一步的杂质,通常是残留的加工和产物相关的杂质。通常这种步骤将采用非亲和色谱步骤,其使用用于凝胶过滤色谱、阳离子色谱、阴离子色谱、混合模式色谱、疏水色谱或疏水电荷诱导色谱的具有适当官能团的固相。这些可以在结合和洗脱模式或流通模式下操作。在流通模式中,杂质结合固相或在固相中具有降低的迁移率,而靶蛋白被回收在洗脱液或流通级分中。
在本发明的另一个具体实施方案中,第一色谱步骤之后是阴离子交换色谱步骤,以捕获杂质并产生含有蛋白质的流通部分。
在本发明方法的另一个具体实施方案中,还原剂存在于在捕获杂质并产生含有蛋白质的流过部分的所述阴离子交换色谱期间使用的缓冲液中。更具体地,还原剂存在于装载缓冲液和洗脱缓冲液中。
在本发明方法的另一个具体实施方案中,从混合物中纯化蛋白质的步骤包括其是阳离子交换色谱的第一色谱步骤(其中洗脱含有蛋白质的第一洗脱液),以及其是阴离子交换色谱以产生含有蛋白质的流通部分的第二色谱步骤。
在本发明方法的另一个具体实施方案中,在所述阳离子交换色谱期间和所述阴离子交换色谱期间存在还原剂。更具体地说,所述还原剂存在于所述阳离子交换色谱和所述阴离子交换色谱期间使用的缓冲液中。在另外的实施方案中,在色谱步骤之间进行一个或多个超滤或渗滤(uf/df)步骤。在工业规模的蛋白质制造中,这通常使用用于产物浓缩和缓冲液交换目的而进行的基于膜的切向流过滤步骤来进行。这些膜通常是低蛋白质结合的并且具有特定的标称分子量截留值以防止产物损失,例如这些包括具有10kda标称分子量截留值的聚醚砜(pes)膜(来自palllifesciences的t系列omegapes膜)或具有10kda标称分子量截留值的再生纤维素(来自palllifesciences的delta再生纤维素膜)。
纯化策略可以包括以各种组合的任何这些步骤以适合靶蛋白的物理化学性质。可以根据本发明的方法使用的特定纯化策略是在wo2012/013682中公开的,其全部内容并入本文。
在本发明方法的另一特定实施方案中,从混合物中纯化蛋白质的步骤包括其是阳离子交换色谱的第一色谱步骤(其中洗脱含有蛋白质的第一洗脱液),施加于第一洗脱液的第一超滤或渗滤步骤,其是阴离子交换色谱以产生含有蛋白质的流通部分的第二色谱步骤;以及施加于流通部分的第二超滤或渗滤步骤。更具体地,在所述阳离子交换色谱(其中洗脱含有蛋白质的第一洗脱液)期间,施加于第一洗脱液的第一超滤或渗滤步骤期间,以及其是阴离子交换色谱以产生含有蛋白质的流通部分的第二色谱步骤期间使用的所有缓冲液中存在还原剂。
在可选择的实施方案中,从混合物中纯化蛋白质的步骤包括其是阳离子交换色谱的第一色谱步骤(其中洗脱含有蛋白质的第一洗脱液),施加于第一洗脱液的第一超滤或渗滤步骤,以结合和洗脱模式操作的第二色谱步骤(其中洗脱含有蛋白质的第二洗脱液)。优选地,在所述阳离子交换色谱(其中洗脱含有蛋白质的第一洗脱液)期间以及在施加于第一洗脱液的第一超滤或渗滤步骤(其中蛋白质在还原剂的存在下回收并施加于所述第二色谱步骤)期间使用的所有缓冲液中存在还原剂,其中在来自所述第二色谱步骤的洗脱液中回收的蛋白质基本上不含还原剂。
存在本领域技术人员可使用的许多还原剂。最合适的还原剂可以凭经验确定,例如通过确定回收的蛋白质样品中靶硫醇的还原状态,例如使用如lyons等人1990,proteinengineering3,703中所述的游离硫醇测定法。最适合的还原剂也可以通过测定回收的蛋白质样品中不期望的二硫键内和二硫键间断裂的量,或者通过测量回收的所需反应蛋白质分子的量(例如通过分析尺寸排阻或反相hplc(高效液相色谱))来选择。尺寸排阻hplc基于分子尺寸分离颗粒,其中大分子相对于较小的分子更快地流过柱。另一方面,反相hplc以疏水相互作用的原理进行操作,其中分子与固定相的结合与在与固定相上的配体缔合后分子的非极性区段周围的接触表面积成比例;对于极性较小的分子,保留时间更长。在这两种情况下,二硫键的存在或不存在导致具有不同洗脱特征谱的物质。
在本发明方法的第二个实施方案中,还原剂选自谷胱甘肽,β-巯基乙醇,β-巯基乙胺,三(2-羧乙基)膦半胱氨酸及其组合。
在本发明方法的第三个实施方案中,还原剂为0.1mm至100mm的谷胱甘肽。可以根据待制造的蛋白质来调节还原剂的量。在本发明的另一个具体实施方案中,所述还原剂为0.1mm至20mm,0.1mm至10mm,0.5mm至5mm,优选0.5mm至2mm的谷胱甘肽。
为了避免疑义,本文所述的术语谷胱甘肽是指由cas号70-18-8定义的单体或还原型谷胱甘肽。
在本发明方法的第四个实施方案中,还原剂从回收的蛋白质中除去。
存在本领域技术人员已知的用于从溶液中除去还原剂的不同的方法,其中任何一种可适用于本方法,包括渗滤、凝胶过滤、透析或另外的色谱步骤。在本发明方法的替代实施方案中,通过渗滤从蛋白质样品中除去还原剂。
在本发明方法的第五个实施方案中,蛋白质与另一个分子偶联。
将蛋白质偶联至另一分子的该方法通常在溶剂例如诸如磷酸盐、柠檬酸盐或乙酸盐的水性缓冲溶液中进行。通常这是通过凝胶过滤将蛋白质渗滤或转移到其中的缓冲液。反应通常可以在任何合适的温度下进行,例如在约5℃至约70℃,例如在室温下,即在20℃,21℃或22℃下进行。缓冲液可任选地含有螯合剂如edta,egta,cdta或dtpa。可选地或另外地,缓冲液可以是螯合缓冲液,例如柠檬酸,草酸,叶酸,bicine,tricine或tris。该分子通常以相对于蛋白质浓度的至少等摩尔浓度(即至少1:1)使用。通常,该分子将以相对于蛋白质浓度过量的浓度使用。通常,该分子的使用量为1.1至100倍摩尔过量,优选1.1、1.5、2、3、5、10或50倍摩尔过量。合适浓度的其它实例包括1.2、1.25、1.3和1.4倍摩尔过量。或者,当2个或更多个蛋白质与单个分子偶联时,所述分子可以不是过量的,例如分子与蛋白质的比例可以为0.1至1,优选为0.5。反应的持续时间可以由本领域技术人员根据经验确定,并且通常为1至20小时。在一个实施方案中,反应在17小时的时间内进行。
必要时,与另一分子偶联的所需蛋白质可以通过常规方法例如通过色谱技术如离子交换、尺寸排阻或疏水相互作用色谱从任何起始材料或在过程中产生的其它产物分离。因此,在一个实施方案中,本发明的方法还包括另外的步骤,其中回收偶联至另一分子的蛋白质。
所述偶联可以通过一个或多个半胱氨酸发生。本领域技术人员可以经验地确定可用于偶联的蛋白质中的半胱氨酸的数量,例如通过确定在用还原剂处理蛋白质后产生的游离硫醇的数量。确定游离硫醇数目的方法是本领域公知的,参见例如lyons等人,1990,proteinengineering,3,703。或者,本领域技术人员可以分析由上述反应产生的所得物质,例如通过分析型反相或尺寸排阻hplc。或者,可以通过使用各种遗传工程或蛋白质工程技术来修饰蛋白质,以将半胱氨酸引入蛋白质用作偶联位点。因此,用于偶联的半胱氨酸可以天然存在于蛋白质中,和/或可以通过重组dna技术工程化至蛋白质中。因此,可用于偶联的半胱氨酸的数量和位置可以根据蛋白质的预期用途和所需的缀合分子的数目来特别地控制。
在本发明方法的第六个实施方案中,蛋白质通过与蛋白质上的半胱氨酸残基的共价结合而与另一个分子偶联。
在本发明方法的可选择的实施方案中,蛋白质通过半胱氨酸残基与两个或更多个分子偶联。
在第七个实施方案中,本发明的方法还包括回收偶联至另一分子的蛋白质的步骤。
在本发明方法的第八个实施方案中,蛋白质是抗体或其抗原结合片段。
在本发明方法的第九个实施方案中,所述抗原结合片段是fab'。
在另一替代实施方案中,所述fab'特异性结合tnfα。在另一更具体的实施方案中,特异性结合tnfα的所述fab'是如wo01/094585中所公开的cdp870,其全部内容并入本文。
在本发明方法的第十个实施方案中,所述抗体或抗原结合片段中的所述半胱氨酸位于抗体铰链中。
本领域技术人员知道,取决于期望的效果,可以将所述抗体或抗原结合片段偶联到不同的分子上。因此,所述抗体或抗原结合片段可以例如与抗肿瘤剂、药物、毒素或生物活性肽偶联。另一方面,所述抗体或抗原结合片段可以与惰性实体结合,以增加在循环中的半衰期,例如天然存在的蛋白质例如白蛋白或合成聚合物如聚乙二醇(peg)。
在本发明方法的第十一个实施方案中,所述分子是聚乙二醇(peg)分子。
peg分子由环氧乙烷的聚合产生,并且可在300da到10,000,000da的宽范围的分子量内商购获得。根据本发明的特定实施方案的peg分子可以是直链或支链的,商购或根据已知方法化学合成。虽然具有不同分子量的peg分子可用于不同的应用,并且由于链长度影响而具有不同的物理性质如粘度,但它们的化学性质并不显著不同。聚合物尺寸可以特别地基于产物的预期用途例如定位于某些组织例如肿瘤或延长循环半衰期的能力来选择(关于综述参见chapman,2002,advanceddrugdeliveryreviews,54,531-545)。因此,例如,当产物期望离开循环并穿透组织,例如以用于治疗肿瘤时,可能有利的是使用小分子量聚合物,例如分子量为约5,000da。对于产物保留在循环中的应用,使用较高分子量的聚合物可能是有利的,例如具有在25,000da至40,000da的范围内的分子量。
peg分子可商购获得或可以合成为聚亚烷基二醇化合物或其衍生物,具有或不具有偶联剂或用偶联或活化部分衍生化(例如,具有硫醇,三氟甲磺酸酯,三氟乙磺酸酯,氮丙碇,环氧乙烷或优选具有马来酰亚胺部分,例如peg-马来酰亚胺)。其它合适的聚亚烷基二醇化合物包括但不限于:马来酰亚氨基单甲氧基peg,活化的peg聚丙二醇,但也包括以下类型的带电荷或中性聚合物:葡聚糖,多聚乙酰神经氨酸或其它基于碳水化合物的聚合物,氨基酸聚合物,以及生物素和其它亲和试剂衍生物。附着peg部分通常被称为聚乙二醇化(peg化),并且是指蛋白质与peg分子反应的过程,其中作为这种反应的结果,所述peg分子与所述蛋白质共价结合。
关于一般性的附着peg部分,参考“poly(ethyleneglycol)chemistry,biotechnicalandbiomedicalapplications”,1992,j.miltonharris(ed),plenumpress,newyork;“poly(ethyleneglycol)chemistryandbiologicalapplications”,1997,j.miltonharrisands.zalipsky(eds),americanchemicalsociety,washingtondc和“bioconjugationproteincouplingtechniquesforthebiomedicalsciences”,1998,m.aslamanda.dent,grovepublishers,newyork。
当考虑聚乙二醇化和聚乙二醇化蛋白时,必须考虑该过程的多个方面,例如蛋白质上的附着位点,peg试剂的活化类型,接头的性质(永久或可切割)、长度和形状,以及peg试剂的长度、形状和结构。聚乙二醇化可以是随机的,其中靶向蛋白质上的氨基,并且导致多种聚乙二醇化物质的复杂混合物。或者,peg化可以是位点特异性的,通常经由n-末端和半胱氨酸特异性反应。半胱氨酸残基可天然存在于天然蛋白质中。或者,遗传引入的半胱氨酸用于将peg分子引导至分子中精确测定的位点。因此,可用于聚乙二醇化的半胱氨酸的数量和位置可以根据蛋白质的预期用途和所需的peg分子的数目来特异性地控制。多种硫醇特异性试剂是可用的,例如马来酰亚胺,二硫化吡啶,乙烯基砜,硫醇试剂等。由于形成的键联的稳定性,马来酰亚胺-peg试剂通常是优选的选择。
在本发明方法的另一个实施方案中,peg分子通过马来酰亚胺基团与蛋白质上的单个半胱氨酸共价结合。
在具体实施方案中,peg分子通过马来酰亚胺基共价结合至存在于抗体或其抗原结合片段的铰链区中的单个半胱氨酸。
在本发明方法的第十二个实施方案中,所述peg分子是40,000peg-马来酰亚胺。
在具体实施方案中,所述peg分子是支链的40,000peg-马来酰亚胺。更具体地,所述peg分子具有2个分支。
在第十三实施方案中,根据本发明第十一或第十二实施方案的方法还包括回收蛋白质,其中所述蛋白质经由半胱氨酸偶联至所述peg分子。
在根据本发明第十二实施方案的方法的特定实施方案中,回收与所述peg分子偶联的蛋白质,并通过本领域已知的方法例如进一步的色谱步骤从未偶联的蛋白质和peg分子进一步纯化该蛋白质。
在另一个具体实施方案中,与所述peg分子偶联的蛋白质是抗体或其抗原结合片段,更特别地,所述蛋白质是fab'。
在本发明方法的具体实施方案中,抗体或其抗原结合片段与多于一个peg分子结合。在另一个实施方案中,抗体或其抗原结合片段在一条或两条重链上、或在一条或两条轻链上、或在重链和轻链上被聚乙二醇化。
在本发明的另一个具体实施方案中,与peg分子偶联的抗体或其抗原结合区是在重链、轻链或两者上与peg分子偶联的fab'。在优选的实施方案中,蛋白质是通过抗体铰链区上的半胱氨酸偶联到peg分子的fab'。在某些实施方案中,聚乙二醇化的抗体具有至少24kd的流体动力学大小。在其它实施方案中,peg的大小可以为20至60kd(包括端点)。在另外的实施方案中,peg连接的抗体具有至少200kd的流体动力学大小。在本发明的其中抗体连接到peg部分的实施方案中,相对于缺乏peg部分的抗体,聚乙二醇化的抗体可具有增加的体内半衰期。
在替代实施方案中,本发明涉及制备与peg分子偶联的抗体或其抗原结合片段的方法,包括:
a)在宿主细胞表达抗体或其抗原结合片段的条件下培养宿主细胞,和
b)从含有宿主细胞和其它污染物的混合物中纯化所述抗体或其抗原结合片段,其中所述纯化包括至少一个色谱步骤,并且其中向所述混合物中加入还原剂,并且将所述抗体或其抗原结合片段在第一色谱步骤直到最后的色谱步骤的过程中保持在所述还原剂的存在下,
c)将peg添加至抗体或其抗原结合片段,和
d)回收与peg偶联的所述抗体或其抗原结合片段。
或者,本发明涉及纯化蛋白质的方法,其中所述蛋白质在宿主细胞表达蛋白质的条件下在宿主细胞中表达,所述方法包括从含有宿主细胞和其它污染物的混合物中纯化所述蛋白质,其中所述纯化包括至少一个色谱步骤,并且其中向所述混合物中加入还原剂,并且将所述蛋白质在第一色谱步骤直到最后的色谱步骤的过程中保持在所述还原剂的存在下。
可以根据本发明的方法制造的抗体或抗体片段可以通过培养用编码重组抗体片段的一种或多种表达载体转染的真核宿主细胞来制备。真核宿主细胞优选为哺乳动物细胞,更优选为中国仓鼠卵巢(cho)细胞。
哺乳动物细胞可以在将支持其生长和表达重组蛋白的任何培养基中培养,优选培养基是不含动物来源的产物如动物血清和蛋白胨的化学上确定的培养基。存在本领域技术人员可以使用的不同的细胞培养基,其包含以适当浓度存在以使细胞生长和产生蛋白质的维生素、氨基酸、激素、生长因子、离子、缓冲液、核苷、葡萄糖或等效能源的不同组合。另外的细胞培养基组分可以在本领域技术人员已知的细胞培养周期期间的不同时间以适当浓度包含在细胞培养基中。
哺乳动物细胞培养可以在任何合适的容器(例如摇瓶或生物反应器)中进行,根据所需的生产规模,其可以以或不以分批模式操作。这些生物反应器可以是搅拌槽或空气提升反应器。各种大规模生物反应器是可用的,其容量为大于1,000l至50,000l,优选5,000l至20,000l,或至10,000l。或者,还可以使用较小规模的生物反应器,例如2l至100l,来根据本发明的方法制备抗体或抗体片段。
可以根据本发明的方法制造的抗体或其抗原结合片段通常存在于哺乳动物宿主细胞培养物(通常为cho细胞培养物)的上清液中。对于其中目标蛋白(例如抗体或其抗原结合片段)分泌在上清液中的cho培养方法,通过本领域已知的方法通常通过离心法收集所述上清液。
因此,在本发明的具体实施方案中,该方法包括在蛋白质纯化之前离心和上清液回收的步骤。在另一特定实施方案中,所述离心是连续离心。为了避免疑义,上清液表示由细胞培养物离心产生的位于沉积细胞上方的液体。
或者,宿主细胞优选是原核细胞,优选革兰氏阴性细菌。更优选地,宿主细胞是大肠杆菌细胞。用于蛋白质表达的原核宿主细胞在本领域中是公知的(terpe,k.(2006).overviewofbacterialexpressionsystemsforheterologousproteinproduction:frommolecularandbiochemicalfundamentalstocommercialsystems.applmicrobiolbiotechnol72,211-222.)。宿主细胞是经遗传工程改造以产生目标蛋白质如抗体片段的重组细胞。重组大肠杆菌宿主细胞可以衍生自任何合适的大肠杆菌菌株,包括mc4100,tg1,tg2,dhb4,dh5α,dh1,bl21,k12,xl1blue和jm109。一个例子是用于重组蛋白质发酵的常用宿主菌株,大肠杆菌菌株w3110(atcc27,325)。还可以通过培养修饰的大肠杆菌菌株,例如代谢突变体或蛋白酶缺陷型大肠杆菌菌株来产生抗体片段。
可以根据本发明的方法纯化的抗体片段通常存在于大肠杆菌宿主细胞的周质或宿主细胞培养物上清液中,这取决于蛋白质的性质,生产规模和使用的大肠杆菌菌株。将蛋白质靶向至这些区室的方法是本领域公知的(makrides,s.c.(1996).strategiesforachievinghigh-levelexpressionofgenesinescherichiacoli.microbiolrev60,512-538)。将蛋白质引导到大肠杆菌周质的适当信号序列的实例包括大肠杆菌phoa,ompa,ompt,lamb和ompf信号序列。蛋白质可以通过依赖于天然分泌途径或通过诱导外膜的有限渗漏以引起蛋白质分泌(其例子是使用pelb前导序列,蛋白质a前导序列,共表达细菌素释放蛋白、丝裂霉素诱导的细菌素释放蛋白以及向培养基中加入甘氨酸,以及共表达kil基因用于膜透化)来靶向至上清液。最优选地,在本发明的方法中,重组蛋白质在宿主大肠杆菌的周质中表达。
重组蛋白在大肠杆菌宿主细胞中的表达还可以在可诱导系统的控制之下,由此重组抗体在大肠杆菌中的表达受诱导型启动子的控制。适用于大肠杆菌的许多诱导型启动子是本领域熟知的,并且取决于启动子,重组蛋白的表达可以通过变化的因素例如温度或生长培养基中特定物质的浓度来诱导。诱导型启动子的实例包括可用乳糖或非水解性乳糖类似物异丙基-b-d-1-硫代吡喃半乳糖苷(iptg)诱导的大肠杆菌lac、tac和trc启动子,和分别由磷酸盐、色氨酸和l-阿拉伯糖诱导的phoa、trp和arabad启动子。可以通过例如诱导剂的添加或当诱导为温度依赖性时温度的变化来诱导表达。当通过向培养物中加入诱导剂来实现重组蛋白表达的诱导时,取决于发酵系统和诱导剂可以通过任何合适的方法加入诱导剂,例如通过单次或多次快速加入或通过进料逐渐加入诱导剂。应当理解,在诱导剂的添加和蛋白质表达的实际诱导之间可能存在延迟,例如在诱导剂是乳糖的情况下,在诱导蛋白质表达出现之前可能存在延迟,虽然在乳糖之前使用了任何预先存在的碳源。
可以在将支持大肠杆菌的生长和重组蛋白的表达的任何培养基中培养大肠杆菌宿主细胞培养物(发酵液)。培养基可以是任何化学确定的培养基,例如描述于duranyo,c.g.d.m.c.l.-s.j.(2004).studiesontheexpressionofrecombinantfuculose-1-phosphatealdolaseinescherichiacoli.processbiochem39,1677-1684中的培养基。
取决于所需的生产规模,大肠杆菌宿主细胞的培养可以在任何合适的容器如摇瓶或发酵罐中进行。可提供各种大型发酵罐,容量为大于1,000升至约100,000升。优选使用1,000至50,000升的发酵罐,更优选为1,000至25,000,200,000,15,000,12,000或10,000升的发酵罐。也可使用小型发酵罐,容量为0.5至1,000升。
大肠杆菌的发酵可以在任何合适的系统例如连续、分批或补料分批模式中进行,这取决于蛋白质和所需的产率。分批模式可以在需要时快速加入营养素或诱导剂。或者,可以使用补料分批培养,并且培养物在诱导前以分批模式在最大比生长速率下生长,该最大比生长速率可以使用最初存在于发酵罐中的营养物和用于控制生长速率的一种或多种营养补料方案来维持直到发酵完成。补料分批模式也可以在诱导前使用以控制大肠杆菌宿主细胞的代谢并允许达到较高的细胞密度。
如果需要,宿主细胞可以从发酵培养基中进行收集,例如,可以通过离心、过滤或浓缩从样品中收集宿主细胞。
在一个实施方案中,根据本发明的方法包括在提取蛋白质之前离心和细胞回收的步骤。
对于其中目标蛋白质(例如抗体片段)存在于宿主细胞的周质空间中的大肠杆菌发酵方法,需要从宿主细胞中释放蛋白质。释放可以通过任何合适的方法实现,例如通过机械或压力处理的细胞裂解,冻融处理,渗透压休克,提取剂或热处理。蛋白质释放的这样的提取方法是本领域公知的。因此,在具体实施方案中,本发明的方法在蛋白质纯化之前包含另外的蛋白质提取步骤。在更具体的实施方案中,所述蛋白质提取步骤在还原剂的存在下进行。
在根据本发明的方法的另一个实施方案中,还包括从细胞培养基中回收宿主细胞,使用在还原剂存在下进行的蛋白质提取步骤收获蛋白质,回收由蛋白质提取步骤产生的含蛋白质的混合物,以及从混合物中纯化所述蛋白质,其中所述纯化包括至少一个色谱步骤,并且其中向所述混合物中加入还原剂,并且将所述蛋白质在第一色谱步骤直到最后的色谱步骤的过程中保持在所述还原剂的存在下。
在根据本发明的方法的另一个实施方案中,根据上述实施方案的所述蛋白质提取步骤期间存在的还原剂可以与本发明的方法的蛋白质纯化步骤期间存在的还原剂相同或不同。
在优选的实施方案中,将提取缓冲液加入到样品中,然后对样品进行热处理步骤。热处理步骤优选如us5,655,866中详细描述的那样。热处理步骤通过促进除去其它与抗体相关的材料来使得可以获得可溶的、正确折叠和组装的抗体片段的样品。
热处理步骤通过使样品经受所需的高温来进行。最优选地,热处理步骤在30℃至70℃的范围内进行。可以根据需要选择温度,并且可以取决于用于纯化的抗体的稳定性来选择温度。在另一个实施方案中,温度在40℃至65℃的范围内,或优选在40℃至60℃的范围内,更优选在45℃至60℃的范围内,甚至更优选在该范围内50℃至60℃的范围内,最优选为55℃至60℃,58℃至60℃或59℃。因此,最低温度为30℃、35℃或40℃,最高温度为60℃、65℃或70℃。
热处理步骤优选进行较长时间。热处理的时间长度优选为1至24小时,更优选为4至18小时,进一步优选为6至16小时,最优选为10至14小时,或10至12小时,例如12小时。因此,热处理的最短时间为1、2或3小时,最长时间为20、22或24小时。
在具体实施方案中,热处理在50℃至60℃下进行10至16小时,更优选在59℃下进行10至12小时。本领域技术人员将理解,可以选择温度和时间来适应所涉及的样品和正在产生的抗体的特征。
在提取步骤之后,可以将含有目标蛋白质例如抗体片段的混合物进行离心和/或过滤的步骤。
在另一个具体实施方案中,本发明的方法可以包括在提取步骤之后并且在从所述混合物纯化蛋白质之前调节含有目标蛋白质的混合物的ph值的步骤。
在根据本发明的蛋白质制造方法的另一个实施方案中,在所述热处理步骤过程中还存在还原剂。在具体实施方案中,添加到样品中的提取缓冲液含有所述还原剂。在这个意义上,在所述热处理步骤过程中存在的还原剂可以与根据本发明的方法的蛋白质纯化期间存在的还原剂相同或不同。
在本发明方法的另一个具体实施方案中,在热处理步骤期间存在的还原剂选自谷胱甘肽,β-巯基乙醇,β-巯基乙胺,三(2-羧乙基)膦半胱氨酸及其组合。
在本发明方法的另一个具体实施方案中,在热处理步骤期间存在的还原剂为0.1mm至100mm的谷胱甘肽。可以根据待制造的蛋白质来调节还原剂的量。在本发明的另一个具体实施方案中,所述谷胱甘肽以0.5mm至80mm,1mm至50mm,1mm至25mm,优选1mm至10mm的量存在。
定义
本文所用的术语“抗体”是指单克隆或多克隆抗体。本文所用的术语“抗体”包括但不限于由本领域已知的重组技术产生的重组抗体。“抗体”包括任何物种特别是哺乳动物物种的抗体;例如任何同种型的人抗体,包括iga1,iga2,igd,igg1,igg2a,igg2b,igg3,igg4,ige和igm及其修饰的变体,非人灵长类动物抗体,例如来自黑猩猩、狒狒、恒河猴或食蟹猴;啮齿动物抗体,例如来自小鼠,大鼠或兔子;山羊或马抗体;和骆驼科动物抗体(例如来自骆驼或美洲驼,如nanobodiestm)及其衍生物;或鸟类物种的抗体,如鸡抗体或鱼类物种的抗体如鲨鱼抗体。术语“抗体”也指“嵌合”抗体,其中至少一个重链和/或轻链抗体序列的第一部分来自第一物种,重链和/或轻链抗体序列的第二部分来自第二物种。本文的目标嵌合抗体包括衍生自非人灵长类动物(例如旧大陆猴,例如狒狒,恒河猴和食蟹猴)的可变结构域抗原结合序列和人恒定区序列的“灵长类化”抗体。“人源化”抗体是含有源自非人抗体的序列的嵌合抗体。在大多数情况下,人源化抗体是人抗体(受体抗体),其中受体高变区的残基被来自非人物种(例如小鼠,大鼠,兔,鸡或非人灵长类动物)(供体抗体)的具有所需的特异性、亲和力和活性的高变区(或互补决定区(cdr))的残基替代。在大多数情况下,在cdr外的人(受体)抗体的残基(即在框架区(fr)中)另外被相应的非人残基替代。此外,人源化抗体可以包含在受体抗体或供体抗体中未发现的残基。进行这些修饰以进一步改善抗体性能。人源化降低了非人抗体在人中的免疫原性,从而有助于将抗体用于治疗人类疾病。人源化抗体和产生它们的几种不同的技术是本领域公知的。术语“抗体”还指人抗体,其可以作为人源化的替代产生。例如,可以产生在免疫时能够在不产生内源性鼠抗体的情况下产生人抗体的完整库的转基因动物(例如小鼠)。例如,已经描述嵌合和种系突变小鼠中抗体重链连接区(jh)基因的纯合缺失导致内源抗体产生的完全抑制。将人种系免疫球蛋白基因阵列转移到这种种系突变小鼠中将导致在用特定抗原免疫携带人种系免疫球蛋白基因的转基因动物后产生特异性抗所述抗原的人抗体。用于生产这种转基因动物的技术和用于从这些转基因动物分离和产生人抗体的技术是本领域已知的。或者,在转基因动物例如小鼠中,只有编码小鼠抗体可变区的免疫球蛋白基因被相应的人可变免疫球蛋白基因序列替代。编码抗体恒定区的小鼠种系免疫球蛋白基因保持不变。以这种方式,抗体效应子在转基因小鼠的免疫系统中起作用,因此b细胞发育基本上不变,这可能导致体内抗原性攻击后改善的抗体反应。在已经从这样的转基因动物中分离出编码特定目标抗体的基因后,可以用人恒定区基因替代编码恒定区的基因,以获得完全人抗体。用于在体外获得人抗体/抗体片段的其它方法基于展示技术,例如噬菌体展示或核糖体展示技术,其中使用至少部分人造产生或来自供体的免疫球蛋白可变(v)结构域基因库的重组dna文库。用于产生人抗体的噬菌体和核糖体展示技术是本领域公知的。人抗体也可以从分离的人b细胞中产生,所述人b细胞用目标抗原离体免疫,随后融合以产生杂交瘤,其然后可以就最佳的人抗体进行筛选。本文所用的术语“抗体”也指糖基化抗体。
本文所用的术语“抗体片段”是指包含本领域已知的至少一个重链或轻链免疫球蛋白结构域并与抗原结合的抗体分子。根据本发明的抗体片段的实例包括fab,fab',f(ab')2和fv和scfv片段;以及双抗体;三抗体;四抗体;微抗体;结构域抗体;(dab),例如sdab,vhh和vnar片段,单链抗体;由抗体片段或抗体形成的双特异性、三特异性、四特异性或多特异性抗体,包括但不限于fab-fv或fab-fv-fv构建体。如上所定义的抗体片段是本领域已知的。
本文所用的术语“色谱”是指由于混合物的各溶质在移动相的影响下迁移通过固定介质的速率不同而将混合物中的目标溶质与混合物中的其它溶质分离的方法。
本文所用的术语“阴离子交换色谱”是指其中固相带正电荷(例如具有连接至其的一个或多个带正电荷的配体例如季氨基)的色谱法。市售的阴离子交换树脂包括deae纤维素,qaesephadextm和fastqsepharosetm(gehealthcare)。
本文所用的术语“阳离子交换色谱”是指其中固相带负电荷(例如具有一个或多个带负电荷的配体,例如羧酸盐或磺酸盐基团)的色谱法。市售的阳离子交换树脂包括羧甲基纤维素,固定在琼脂糖上的磺丙基(sp)和固定在琼脂糖上的磺酰基。
本文所用的术语“洗涤缓冲液”是指在洗脱目标多肽分子之前用于洗涤或重新平衡离子交换树脂的缓冲液。方便地,洗涤缓冲液和装载缓冲液可以是相同的,但这不是必需的。
本文所用的术语“装载缓冲液”是指用于将目标蛋白质装载到固相上的缓冲液。
本文所用的术语“洗脱缓冲液”是指用于从固相中洗脱目标蛋白质的缓冲液。这可以通过使用洗脱缓冲液的添加剂和/或电导率和/或ph范围来实现,使得目标多肽从色谱的固相中洗脱出来。
本文所用的术语“超滤”是指压力驱动的过程,其中混合物例如溶液(例如含有目标蛋白质)为了浓缩或纯化目的而移动通过膜。超滤膜通常具有1至50nm的平均孔径,其在反渗透和微滤膜的平均孔径之间。孔径通常通过其保留某些分子量的蛋白质的能力来定量,并且通常以kda的标称分子量截留(nmwco)来引用。超滤基于不同物质响应于给定的压力驱动力而过滤穿过膜的速率的差异分离溶质。因此,混合物或溶液中的溶质基于尺寸差异而分离。超滤常常在用于蛋白质浓缩、缓冲液交换和脱盐、蛋白质纯化、病毒清除和澄清的下游处理中使用。术语“超滤”包括切向流过滤(tff),其中混合物如溶液沿着超滤膜水平经过。术语“超滤”不包括高性能切向流过滤(hptff),其中溶质不仅基于尺寸而是基于尺寸和电荷分离。
本文所用的术语“渗滤”是指用于基本上替换来自含有蛋白质、肽、核酸和其它生物分子的溶液的盐或溶剂浓度的超滤膜技术类型。该方法选择性地使用可渗透膜过滤器来基于其分子大小分离溶液和悬浮液的组分。较小分子如盐、溶剂和水自由通过超滤膜,其保留较大的分子。通常在缓冲液中的蛋白质样品穿过保留蛋白质并允许缓冲液交换的膜而进行渗滤。随着时间的推移,含有蛋白质的原始缓冲液被新的缓冲液所替代。
或者,根据实验规模,使用凝胶过滤(例如在重力流下操作的sephadexg-25脱盐柱)作为用新的缓冲液替代原始缓冲液的工具可能是有意义的。在这种情况下,当比树脂孔大的分子被所述树脂孔排斥并且比扩散到树脂孔中并因此被保留且较慢地移动通过固相的较小分子更快地穿过固相时,发生缓冲液替换。在树脂平衡缓冲液中洗脱的级分中收集较大的分子例如所需的蛋白质。
本文所用的术语“聚乙二醇化”是指蛋白质共价结合peg分子。
实施例
实施例1
fab'1(含有用于位点特异性peg化的单铰链硫醇的fab'抗体片段)在大肠杆菌w3110宿主细胞中表达为异源蛋白质,该异源蛋白质通过加入调节至ph7.4的100mmtris/10mm-edta缓冲液并在57.5℃下进行热处理而从宿主细胞的周质空间释放出来。通过离心除去细胞材料,并通过加入乙酸调节含有异源蛋白质的细胞提取物至ph4.5。然后使用离心和0.2μm过滤的组合来澄清经ph调节的细胞提取物。然后将澄清的提取物(进料流)用水稀释,以达到约6.0ms/cm的电导率。
然后将含有fab'1的进料流装载到来自gehealthcare的captostm阳离子交换柱(具有通过葡聚糖接头附着的磺酸盐阳离子交换配体(离子容量0.11-0.14mmolna+/ml)的高度交联的刚性琼脂糖珠(平均粒径90μm))上。在用6倍柱体积的用乙酸调节至ph4.5的50mm乙酸钠缓冲液装载进料流之前,柱已被平衡。
装载后,使用用乙酸调节至ph4.5的50mm乙酸钠缓冲液洗涤柱,直到洗去所有未结合的物质。含有fab'1的级分使用用乙酸调节至ph4.5的190mmnacl和50mm乙酸钠洗脱。
使用具有10kda标称分子量截留值的聚醚砜基超滤膜(t系列膜(pallcorporation))将所得含fab'1的洗脱液进行超滤,导致约五分之一体积的浓度并针对大约8倍体积的调节至ph8.2的20mmtris缓冲液进行渗滤。
将fab'1库装载到来自gehealthcare的captoqtm阴离子交换色谱柱(具有通过葡聚糖接头附着的季铵阴离子交换配体(离子容量0.16-0.22mmolcl-/ml)的高度交联的刚性琼脂糖珠(平均粒径90μm))上。在用调节至ph8.2的20mmtris缓冲液装载蛋白质之前,柱已被平衡。
装载柱后,使用调节至ph8.2的20mmtris缓冲液洗涤柱。在从装载和洗涤步骤得到的流通级分中回收fab'1。
将得到的含有fab'1的阴离子交换色谱洗脱液装载到来自gehealthcare的pd-10脱盐柱(使用粒径范围为85-260μm、排除极限为5000da的sephadextmg25基质的凝胶过滤色谱)上,使用调节至ph4.5的20mm乙酸钠缓冲液作为预平衡、装载后洗涤和洗脱缓冲液。
回收fab'1洗脱液,将具有20kda的2个分枝的40kdapeg-马来酰亚胺(3-双(甲基聚氧乙烯-氧)-1-([3-(6-马来亚氨基-1-氧代己基)氨基]丙氧基)丙烷,nofcorporation,tokyo,japan)以1:2的fab'1-peg摩尔比加入,并使其在18-22℃反应17小时。
如使用尺寸排阻hplc测定的peg化效率导致43%fab'1-peg单体的产生(图1)。
实施例2
cdp870fab'在大肠杆菌w3110宿主细胞中表达为异源蛋白,该异源蛋白质通过加入调节至ph7.4的100mmtris/10mm-edta缓冲液并在59℃下进行热处理而从宿主细胞的周质空间释放出来。通过离心除去细胞材料,并通过加入乙酸调节含有异源蛋白质的细胞提取物至ph4.5。然后使用离心和0.2μm过滤的组合来澄清经ph调节的细胞提取物。
然后将澄清的提取物(进料流)用水稀释,以达到约4ms/cm的靶电导率,并补充1mm谷胱甘肽。
然后将含有cdp870fab'的进料流装载到来自gehealthcare的captostm阳离子交换柱(具有通过葡聚糖接头附着的磺酸盐阳离子交换配体(离子容量0.11-0.14mmolna+/ml)的高度交联的刚性琼脂糖珠(平均粒径90μm))上。在用6倍柱体积的含有1mm谷胱甘肽的50mm乙酸钠缓冲液(用乙酸调节至ph4.5)装载进料流之前,柱已被平衡。
装载后,使用用乙酸调节至ph4.5的含有1mm谷胱甘肽的50mm乙酸钠缓冲液洗涤柱,直到洗去所有未结合的物质。cdp870fab'级分使用含有1mm谷胱甘肽的50mm乙酸钠和250mmnacl(用乙酸调节至ph4.5)洗脱。
使用具有10kda标称分子量截留值的聚醚砜基超滤膜(t系列膜(pallcorporation))将所得含cdp870fab'级分的洗脱液进行超滤,导致约一半体积的浓度并渗滤到含有1mm谷胱甘肽的20mmtris缓冲液(调节至ph8.5的缓冲液)中。将7倍体积的缓冲液用于渗滤。
将库装载到来自gehealthcare的captoqtm阴离子交换色谱柱(具有通过葡聚糖接头附着的季铵阴离子交换配体(离子容量0.16-0.22mmolcl-/ml)的高度交联的刚性琼脂糖珠(平均粒径90μm))上。在用调节至ph8.5的含有1mm谷胱甘肽的20mmtris缓冲液装载蛋白质之前,柱已被平衡。
装载后,使用调节至ph8.5的含有1mm谷胱甘肽的20mmtris缓冲液洗涤柱。在从装载和洗涤步骤得到的流通级分中回收cdp870fab'。将得到的含有cdp870fab'的阴离子交换色谱洗脱液装载到来自gehealthcare的pd-10脱盐柱(使用粒径范围为85-260μm、排除极限为5000da的sephadextmg25基质的凝胶过滤色谱)上,使用用乙酸调节至ph4.5的20mm乙酸钠缓冲液作为预平衡、装载后洗涤和洗脱缓冲液。
回收含有cdp870fab'的洗脱液,将具有马来酰亚胺接头的具有20kda的2个分枝的40kdapeg(双(甲氧基聚(乙二醇))的马来酰亚胺丙酰胺,改性的赖氨酸,nektartherapeuticscorporation,california,usa)以1:2.8的peg摩尔比过量加入,并使其在18-22℃反应。
如使用尺寸排阻hplc测定的peg化效率导致78.1%的cdp870fab'-peg单体的产生(图2)。
实施例3
cdp870fab'在大肠杆菌w3110宿主细胞中表达为异源蛋白,该异源蛋白质通过加入调节至ph7.4并含有1mm谷胱甘肽的100mmtris/10mm-edta缓冲液并在59℃下进行热处理而从宿主细胞的周质空间释放出来。通过离心除去细胞材料,并通过加入乙酸调节含有异源蛋白质的细胞提取物至ph4.5。然后通过0.2μm过滤澄清经ph调节的细胞提取物。
然后将澄清的提取物(进料流)用水稀释至4ms/cm的目标电导率,并补充1mm谷胱甘肽。
然后将澄清的提取物(进料流)用水稀释,以达到约4ms/cm的靶电导率,并补充1mm谷胱甘肽。
然后将含有cdp870fab'的进料流装载到来自gehealthcare的captostm阳离子交换柱(具有通过葡聚糖接头附着的磺酸盐阳离子交换配体(离子容量0.11-0.14mmolna+/ml)的高度交联的刚性琼脂糖珠(平均粒径90μm))上。在用6倍柱体积的含有1mm谷胱甘肽的50mm乙酸钠缓冲液(用乙酸调节至ph4.5)装载进料流之前,柱已被平衡。
装载后,使用用乙酸调节至ph4.5的含有1mm谷胱甘肽的50mm乙酸钠缓冲液洗涤柱,直到洗去所有未结合的物质。cdp870fab'级分使用含有1mm谷胱甘肽的50mm乙酸钠和250mmnacl(用乙酸调节至ph4.5)洗脱。使用具有10kda标称分子量截留值的聚醚砜基超滤膜将所得的含cdp870fab'的洗脱液进行超滤,导致约三分之一体积的浓度并针对9倍体积的含有1mm谷胱甘肽的20mmtris缓冲液(调节至ph8.5的缓冲液)进行渗滤。将cdp870fab'库装载到来自gehealthcare的captoqtm阴离子交换色谱柱(具有通过葡聚糖接头附着的季铵阴离子交换配体(离子容量0.16-0.22mmolcl-/ml)的高度交联的刚性琼脂糖珠(平均粒径90μm))上。在用调节至ph8.5的含有1mm谷胱甘肽的20mmtris缓冲液装载蛋白质之前,柱已被平衡。装载后,使用调节至ph8.5的含有1mm谷胱甘肽的20mmtris缓冲液洗涤柱。在从装载和洗涤步骤得到的流通级分中回收cdp870fab'。
使用具有10kda标称分子量截留值的聚醚砜基超滤膜将得到的含有cdp870fab'的洗脱液进行超滤,并渗滤到ph4.5的20mm乙酸钠中用于peg化。
具有20kda的2个分枝的40kdapeg-马来酰亚胺(双(甲氧基聚(乙二醇))的马来酰亚胺丙酰胺,改性的赖氨酸,nektartherapeuticscorporation,california,usa)以1:1.4和1:2的cdp870fab':peg摩尔比加入到回收的蛋白质,并使其在18-22℃反应17小时。
如通过反相hplc色谱法测定的peg化效率显示1:1.4和1:2的cdp870fab':peg比率的分别74%和74.4%的cdp870fab'-peg单体的产生。
实施例4
fab'1(含有用于位点特异性peg化的单铰链硫醇的fab'抗体片段)在大肠杆菌w3110宿主细胞中表达为异源蛋白质,该异源蛋白质通过加入调节至ph7.4的含有10mm谷胱甘肽的100mmtris/10mm-edta缓冲液并在57.5℃下进行热处理而从宿主细胞的周质空间释放出来。通过离心除去细胞材料,并通过加入乙酸调节含有异源蛋白质的细胞提取物至ph4.5。然后使用离心和0.2μm过滤的组合来澄清经ph调节的细胞提取物。
然后将澄清的提取物(进料流)用水稀释,以达到约6.0ms/cm的电导率范围(稀释因子为约4)。然后将含有fab'1的进料流装载到来自gehealthcare的captostm阳离子交换柱(具有通过葡聚糖接头附着的磺酸盐阳离子交换配体(离子容量0.11-0.14mmolna+/ml)的高度交联的刚性琼脂糖珠(平均粒径90μm))上。在用6倍柱体积的用乙酸调节至ph4.5的含有1mm谷胱甘肽的50mm乙酸钠缓冲液装载进料流之前,柱已被平衡。
装载后,使用用乙酸调节至ph4.5的含有1mm谷胱甘肽的50mm乙酸钠缓冲液洗涤柱,直到洗去所有未结合的物质。含有fab'1的级分使用用乙酸调节至ph4.5的含有1mm谷胱甘肽的190mmnacl和50mm乙酸钠洗脱。
使用具有10kda标称分子量截留值的聚醚砜基超滤膜(t系列膜(pallcorporation))将所得含fab'1的洗脱液进行超滤,导致约五分之一体积的浓度并针对8倍体积的含有1mm谷胱甘肽的20mmtris缓冲液(调节至ph8.2的缓冲液)进行渗滤。
将fab'1库装载到来自gehealthcare的captoqtm阴离子交换色谱柱(具有通过葡聚糖接头附着的季铵阴离子交换配体(离子容量0.16-0.22mmolcl-/ml)的高度交联的刚性琼脂糖珠(平均粒径90μm))上。在用调节至ph8.2的含有1mm谷胱甘肽的20mmtris缓冲液装载蛋白质之前,柱已被平衡。
装载柱后,使用调节至ph8.2的含有1mm谷胱甘肽的20mmtris缓冲液洗涤柱。在从装载和洗涤步骤得到的流通级分中回收fab'1。
将得到的含有fab'1的阴离子交换色谱洗脱液装载到来自gehealthcare的pd-10脱盐柱(使用粒径范围为85-260μm、排除极限为5000da的sephadextmg25基质的凝胶过滤色谱)上,使用调节至ph4.5的20mm乙酸钠缓冲液作为预平衡、装载后洗涤和洗脱缓冲液。
回收fab'1洗脱液,将具有20kda的2个分枝的40kdapeg-马来酰亚胺(3-双(甲基聚氧乙烯-氧)-1-([3-(6-马来亚氨基-1-氧代己基)氨基]丙氧基)丙烷,nofcorporation,tokyo,japan)以1:2的fab'1-peg摩尔比加入,并使其在20℃反应17小时。
如使用尺寸排阻hplc测定的peg化效率导致71.5%fab'1-peg单体的产生(图1)。
实施例5
fab'1(含有用于位点特异性peg化的单铰链硫醇的fab'抗体)在大肠杆菌w3110宿主细胞中表达为异源蛋白质,该异源蛋白质通过加入调节至ph7.4的100mmtris/10mm-edta缓冲液并在57.5℃下进行热处理而从宿主细胞的周质空间释放出来。通过离心除去细胞材料,并通过加入乙酸调节含有异源蛋白质的细胞提取物至ph4.5。然后使用离心和0.2μm过滤的组合来澄清经ph调节的细胞提取物。
然后将澄清的提取物(进料流)用水稀释,以达到约6.0ms/cm的电导率。然后将含有fab'1的进料流装载到来自gehealthcare的captostm阳离子交换柱(具有通过葡聚糖接头附着的磺酸盐阳离子交换配体(离子容量0.11-0.14mmolna+/ml)的高度交联的刚性琼脂糖珠(平均粒径90μm))上。在用6倍柱体积的用乙酸调节至ph4.5的50mm乙酸钠缓冲液装载进料流之前,柱已被平衡。
装载后,使用用乙酸调节至ph4.5的50mm乙酸钠缓冲液洗涤柱,直到洗去所有未结合的物质。含有fab'1的级分使用用乙酸调节至ph4.5的190mmnacl和50mm乙酸钠洗脱。
使用具有10kda标称分子量截留值的聚醚砜基超滤膜将所得含fab'1的洗脱液进行超滤,导致约五分之一体积的浓度并用8倍体积的调节至ph8.2的20mmtris缓冲液进行渗滤。将fab'1库装载到来自gehealthcare的captoqtm阴离子交换色谱柱(具有通过葡聚糖接头附着的季铵阴离子交换配体(离子容量0.16-0.22mmolcl-/ml)的高度交联的刚性琼脂糖珠(平均粒径90μm))上。在用调节至ph8.2的20mmtris缓冲液装载蛋白质之前,柱已被平衡。
装载柱后,使用调节至ph8.2的20mmtris缓冲液洗涤柱。在从装载和洗涤步骤得到的流通级分中回收fab'1。
然后通过使用相同的膜和含有2mmedta和1mm2-巯基乙胺的0.1m磷酸盐缓冲液(调节至ph6.8)的在6.5小时内的渗滤减少回收的含有fab'1的阴离子交换色谱洗脱液。
在相同的膜上进行到调节至4.5的20mm乙酸钠缓冲液中的进一步的超滤/渗滤,以除去还原剂,从而用于peg化。
具有20kda的2个分枝的40kdapeg-马来酰亚胺(3-双(甲基聚氧乙烯-氧)-1-([3-(6-马来亚氨基-1-氧代己基)氨基]丙氧基)丙烷,nofcorporation,tokyo,japan)以1:1.25的fab':peg重量比加入到回收的fab'1蛋白质,并使其在18-22℃反应17小时。
如使用尺寸排阻hplc测定的peg化效率导致77.4%的fab'1-peg单体(图3)。
- 还没有人留言评论。精彩留言会获得点赞!