一种抗PD1单克隆抗体、其药物组合物及其用途的制作方法
本发明属于肿瘤治疗和分子免疫学领域,涉及一种抗pd1抗体、其药物组合物及其用途。具体地,本发明涉及一种抗pd1的单克隆抗体。
背景技术:
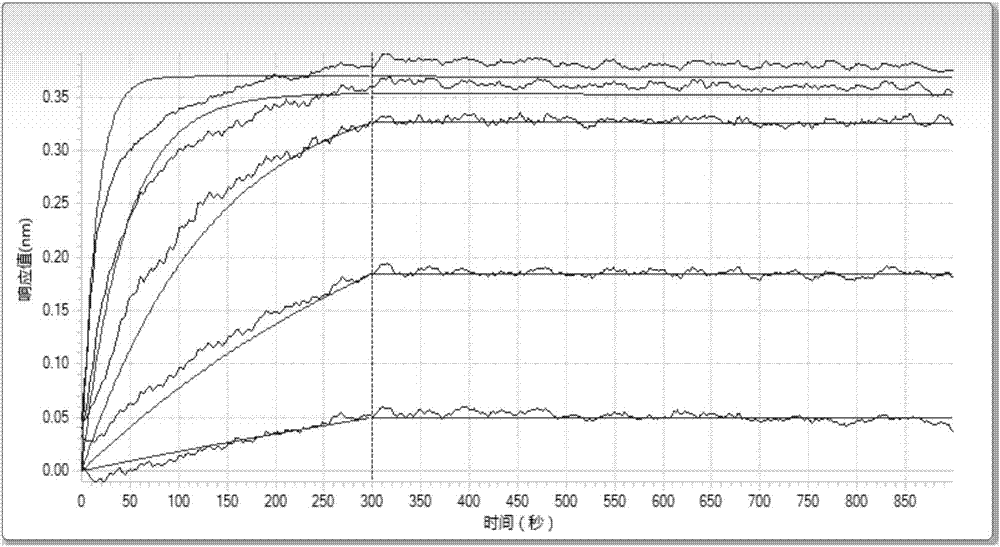
:跨膜受体pd1(programmedcelldeath1,程序性细胞死亡因子1,亦简称为pd-1)是cd28基因家族成员之一,在活化的t细胞,b细胞以及骨髓系细胞都有表达。pd1的受体pdl1和pdl2均属于b7超家族,其中pdl1多种细胞都有表达,包括t细胞,b细胞以及内皮细胞和上皮细胞,pdl2则仅表达于抗原呈递细胞如树突状细胞和巨噬细胞。t细胞对清除病毒感染起着非常重要的作用,但t细胞抗病毒反应通常与免疫病理相关。pd1在负调节t细胞的活化过程中起着非常重要的作用,pd1介导的对t细胞负调节作用可减少促进感染过程中所引起的组织损伤,但是阻断或抑制pd1的负调节作用可导致自身免疫性疾病,例如,pd1基因敲除小鼠能更有效的清除胰腺病毒感染,但是却导致了更严重的肝脏损伤(isaietal.,2003,j.exp.med.198:39-50)。另外,高表达pd1的肿瘤一般形成很难被检测到的癌症(hamanishietal.,2007,proc.natl.acad.sci.usa104:3360-5)。一种实施有效的方法是通过体内注射抗体对pd1的表达进行调控。由于pd1抗体的广谱抗肿瘤前景和惊人的药效,业界普遍认为针对pd1通路的抗体将导致治疗多种肿瘤治疗的突破性的进展:用于治疗非小细胞性肺癌,肾细胞癌,卵巢癌,黑色素瘤(hometm.b.,parisig.,etal.,anti-pd1therapyinmelanoma.seminoncol.2015jun;42(3):466-473),白血病以及贫血病(heldsa,heinea,etal.,advancesinimmunotherapyofchronicmyeloidleukemiacml.currcancerdrugtargets.2013sep;13(7):768-74)。pd1抗体在2012年和2013年的美国癌症协会(aacr)年会以及美国临床肿瘤协会(asco)年会上揭晓了其前所未有的临床药效的数据后,即成为全球制药行业最炙手可热的在研新药。目前,尚需要开发新的具有更好的结合效率的抗pd1抗体,以有效地阻断pd1与pdl1的结合。技术实现要素:本发明人经过深入的研究和创造性的劳动,利用哺乳动物细胞表达系统表达出重组的pd1作为抗原免疫小鼠,经小鼠脾脏细胞与骨髓瘤细胞融合获得杂交瘤细胞。发明人通过进行对大量样本的筛选,得到了杂交瘤细胞株lt003(保藏编号为cctccno:c2015105)。本发明人惊奇地发现,杂交瘤细胞株lt003能够分泌产生与pd1特异性结合的特异性单克隆抗体(命名为14c12),并且该单克隆抗体能够十分有效地阻断pd1与pdl1的结合。进一步地,本发明人创造性地制得了抗pd1的人源化抗体(命名为14c12h1l1)。本发明人还惊奇地发现,本发明的抗体14c12、14c12h1l1能有效地结合人t细胞,并且激活t细胞,诱导人淋巴细胞分泌ifn-γ和il-2。本发明的抗体14c12、14c12h1l1具有用于制备防治肺癌、黑色素瘤、肾肿瘤、卵巢癌、白血病等癌症以及贫血病的药物的潜力。由此提供了下述发明:本发明的一个方面涉及单克隆抗体或其抗原结合片段,其中,所述单克隆抗体的重链可变区(vh)包含:氨基酸序列为seqidno:9-11的cdr;和/或所述单克隆抗体的轻链可变区(vl)包含:氨基酸序列为seqidno:12-14的cdr。在本发明的一些实施方式中,所述的单克隆抗体或其抗原结合片段,其中,所述单克隆抗体的重链可变区的氨基酸序列选自seqidno:2和seqidno:6;和/或所述单克隆抗体的轻链可变区的氨基酸序列选自seqidno:4和seqidno:8。在本发明的一个实施方案中,所述的单克隆抗体或其抗原结合片段,其中,所述单克隆抗体包括:(1)如seqidno:2所示的vh和如seqidno:4所示的vl;(2)如seqidno:6所示的vh和如seqidno:8所示的vl。轻链和重链的可变区决定抗原的结合;每条链的可变区均含有三个高变区,称互补决定区(cdr)(重链(h)的cdr包含hcdr1、hcdr2、hcdr3,轻链(l)的cdr包含lcdr1、lcdr2、lcdr3;其由kabat等人命名,见sequencesofproteinsofimmunologicalinterest,fifthedition(1991),第1-3卷,nihpublication91-3242,bethesdamd)。通过本领域技术人员所熟知的技术手段,例如通过vbase2数据库分析上面的(1)-(2)项中的单克隆抗体序列的cdr区的氨基酸序列:本发明的抗体14c12、14c12h1l1具有相同的cdr:其重链可变区的3个cdr区的氨基酸序列如下:hcdr1:gfafssyd(seqidno:9),hcdr2:isgggryt(seqidno:10),hcdr3:anrygeawfay(seqidno:11);其轻链可变区的3个cdr区的氨基酸序列如下:lcdr1:qdinty(seqidno:12),lcdr2:ran(seqidno:13),lcdr3:lqydefplt(seqidno:14)。在本发明的一些实施方式中,所述的单克隆抗体或其抗原结合片段,其中,所述单克隆抗体或其抗原结合片段选自fab、fab'、f(ab')2、fd、fv、dab、互补决定区片段、单链抗体(例如,scfv)、人源化抗体、嵌合抗体或双抗体。在本发明的一些实施方式中,所述的单克隆抗体或其抗原结合片段,其中,所述的单克隆抗体以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的kd结合pd1蛋白;优选地,所述kd通过fortebio分子相互作用仪测得。在本发明的一些实施方式中,所述的单克隆抗体或其抗原结合片段,其中,所述的单克隆抗体以小于大约100nm,例如小于大约10nm、1nm、0.9nm、0.8nm、0.7nm、0.6nm、0.5nm、0.4nm、0.3nm、0.2nm、0.1nm或更小的ec50结合pd1蛋白。具体地,所述ec50通过间接elisa方法测得。在本发明的一些实施方式中,所述的单克隆抗体或其抗原结合片段,其中,所述的单克隆抗体以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的kd结合pd1蛋白。在本发明的一些实施方式中,所述的单克隆抗体或其抗原结合片段,其中,所述的单克隆抗体包括非-cdr区,且所述非-cdr区来自不是鼠类的物种,例如来自人抗体。在本发明的一些实施方式中,所述的单克隆抗体或其抗原结合片段,其中所述单克隆抗体是有杂交瘤细胞株lt003产生的单克隆抗体,所述杂交瘤细胞株lt003保藏于中国典型培养物保藏中心(cctcc),保藏编号为cctccno:c2015105。在本发明的一些实施方式中,所述的单克隆抗体或其抗原结合片段,其用于预防和/治疗和/或辅助治疗和/或诊断肿瘤或者贫血病;具体地,所述肿瘤选自黑色素瘤、肾肿瘤、前列腺癌、膀胱癌、结肠直肠癌、胃肠道癌、肝癌、非小细胞性肺癌、卵巢癌和白血病。在本发明的一些实施方式中,所述的单克隆抗体或其抗原结合片段,其用于:阻断pd1与pd1的配体结合,调节(例如下调)pd1活性或水平,解除pd1对机体免疫抑制,或者提高t淋巴细胞中ifn-γ和/或il-2表达;具体地,所述pd1的配体为pdl1或pdl2,优选为pdl1。在本发明的一个具体的实施方案中,本发明的单克隆抗体仅阻断pd1与pdl1的结合。本发明的另一方面涉及一种分离的核酸分子,其包含能够编码抗体重链可变区的核酸序列,其中,所述抗体的重链可变区包含:氨基酸序列为seqidno:9-11的cdr;具体地,所述抗体的重链具有seqidno:2或seqidno:6所示的氨基酸序列;更具体地,所述核酸分子具有seqidno:1或seqidno:5所示的核苷酸序列。本发明的再一方面涉及一种分离的核酸分子,其包含能够编码抗体轻链可变区的核酸序列,其中,所述抗体轻链可变区包含氨基酸序列为seqidno:12-14的cdr;具体地,所述抗体轻链可变区具有seqidno:4或seqidno:8所示的氨基酸序列;更具体地,所述核酸分子具有seqidno:3或seqidno:7所示的核苷酸序列。本发明的再一方面涉及一种载体,其包本发明中任一项所述的分离的核酸分子。本发明的再一方面涉及一种宿主细胞,其包含本发明中任一项所述的分离的核酸分子,或者本发明的载体。本发明的再一方面涉及一种制备本发明中任一项所述的单克隆抗体或其抗原结合片段的方法,其包括在合适的条件下培养本发明的宿主细胞,以及从细胞培养物中回收所述单克隆抗体或其抗原结合片段的步骤。本发明的再一方面涉及杂交瘤细胞株lt003,其保藏于中国典型培养物保藏中心(cctcc),保藏编号为cctccno:c2015105。本发明的再一方面涉及一种偶联物,其包括单克隆抗体或其抗原结合片段以及偶联部分,其中,所述单克隆抗体为本发明中任一项所述的单克隆抗体或其抗原结合片段,所述偶联部分为可检测的标记;具体地,所述偶联部分为放射性同位素、荧光物质、发光物质、有色物质或酶。本发明的再一方面涉及一种试剂盒,其包括本发明中任一项所述的单克隆抗体或其抗原结合片段,或者包括本发明的偶联物;具体地,所述试剂盒还包括第二抗体,其特异性识别所述单克隆抗体或其抗原结合片段;任选地,所述第二抗体还包括可检测的标记,例如放射性同位素、荧光物质、发光物质、有色物质或酶。本发明的再一方面涉及本发明中任一项所述的单克隆抗体或其抗原结合片段或者本发明的偶联物在制备试剂盒中的用途,所述试剂盒用于检测pd1在样品中的存在或其水平。本发明的再一方面涉及一种药物组合物,其包含本发明中任一项所述的单克隆抗体或其抗原结合片段或者本发明所述的偶联物;可选地,其还包括药学上可接受的载体和/或赋形剂。本发明的再一方面涉及本发明中任一项所述的单克隆抗体或其抗原结合片段或者本发明的偶联物在制备预防和/或治疗和/或辅助治疗和/或诊断肿瘤或者贫血病的药物中的用途;具体地,所述肿瘤选自黑色素瘤、肾肿瘤、前列腺癌、膀胱癌、结肠直肠癌、胃肠道癌、肝癌、非小细胞性肺癌、卵巢癌和白血病。本发明的再一方面涉及本发明中任一项所述的单克隆抗体或其抗原结合片段或者本发明的偶联物在制备如下药物中的用途:阻断pd1与pd1的配体结合的药物,调节(例如下调)pd1活性或水平的药物,解除pd1对机体免疫抑制的药物,或者提高t淋巴细胞中ifn-γ和/或il-2表达的药物;具体地,所述pd1的配体为pdl1或pdl2,优选为pdl1。本发明的再一方面涉及一种在体内或体外方法,包括施加细胞以有效量的本发明中任一项所述的单克隆抗体或其抗原结合片段或者本发明的偶联物的步骤,所述方法选自如下:阻断pd1与pd1的配体结合的方法,调节(例如下调)pd1活性或水平的方法,解除pd1对机体免疫抑制的方法,或者提高t淋巴细胞中ifn-γ和/或il-2表达的方法;具体地,所述pd1的配体为pdl1或pdl2,优选为pdl1。在本发明的一个具体的实施方案中,所述体外方法是非治疗目的的或诊断目的的。干扰素γ(ifnγ),主要由自然杀伤细胞(nk),自然杀伤t细胞(nkt)先天产生,和由cd4th1细胞和cd8细胞毒性t淋巴细胞这些效应t细胞经由特定抗原刺激后产生。ifnγ作为一种重要的先天性和获得性免疫细胞因子在对抗或抑制病毒,某些细菌和原虫性疾病感染起着重要作用。同时,ifnγ能激活巨噬细胞,诱导ⅱ类主要组织相容性复合体(mhc)的表达激活免疫反应控制肿瘤的发展(schoenbornjr,wilsoncb.regulationofinterferon-γduringinnateandadaptiveimmuneresponses.advancesinimmunology2007;96:41-101)。本发明的体外实验中,抗体anti-pd1抗体能诱导ifnγ的分泌激活免疫反应。白细胞介素2(il-2)由t细胞产生,是调节t细胞亚群的生长因子,也是调控免疫应答的重要因子,并可促进活化b细胞增殖,参与抗体反应、造血和肿瘤监视。重组的人il-2已经被美国fda批准用于治疗恶性肿瘤(包括黑色素瘤、肾肿瘤等),同时正在进行治疗慢性病毒感染的临床研究(chavez,a.r.,etal.,pharmacologicadministrationofinterleukin-2.annnyacadsci,2009.1182:p.14-27)。体外实验中,本发明的pd1抗体可特异地解除pd1对机体免疫抑制,激活t细胞,诱导il-2产生,在抗肿瘤及寄生虫等疾病的基因治疗中有广泛应用前景。本发明的再一方面涉及一种预防和/或治疗和/或辅助治疗和/或诊断肿瘤或者贫血病的方法,包括给予受试者有效量的本发明中任一项所述的单克隆抗体或其抗原结合片段或者本发明所述的单克隆抗体偶联物的步骤;具体地,所述肿瘤选自黑色素瘤、肾肿瘤、前列腺癌、膀胱癌、结肠直肠癌、胃肠道癌、肝癌、非小细胞性肺癌、卵巢癌和白血病。在本发明中,除非另有说明,否则本文中使用的科学和技术名词具有本领域技术人员所通常理解的含义。并且,本文中所用的细胞培养、分子遗传学、核酸化学、免疫学实验室操作步骤均为相应领域内广泛使用的常规步骤。同时,为了更好地理解本发明,下面提供相关术语的定义和解释。如本文中所使用的,当提及pd1蛋白(programmedcelldeathprotein1,ncbigenbank:np_005009.2)的氨基酸序列时,其包括pd1蛋白的全长,或者pd1的胞外片段pd1ecd或者包含pd1ecd的片段;还包括pd1ecd的融合蛋白,例如与小鼠或人igg的fc蛋白片段(mfc或hfc)进行融合的片段。然而,本领域技术人员理解,在pd1蛋白的氨基酸序列中,可天然产生或人工引入突变或变异(包括但不限于置换,缺失和/或添加),而不影响其生物学功能。因此,在本发明中,术语“pd1蛋白”应包括所有此类序列,及其天然或人工的变体。并且,当描述pd1蛋白的序列片段时,其不仅包括序列片段,还包括其天然或人工变体中的相应序列片段。如本文中所使用的,当提及pdl1蛋白(programmeddeath-ligand1,ncbigenebankid:np_054862.1)的氨基酸序列时,其包括pdl1蛋白的全长,或者pdl1的胞外片段pdl1ecd或者包含pdl1ecd的片段;还包括pdl1ecd的融合蛋白,例如与小鼠或人igg的fc蛋白片段(mfc或hfc)进行融合的片段。然而,本领域技术人员理解,在pdl1蛋白的氨基酸序列中,可天然产生或人工引入突变或变异(包括但不限于置换,缺失和/或添加),而不影响其生物学功能。因此,在本发明中,术语“pdl1蛋白”应包括所有此类序列以及其天然或人工的变体。并且,当描述pdl1蛋白的序列片段时,包括pdl1序列片段,还包括其天然或人工变体中的相应序列片段。如本文中所使用的,术语ec50是指半最大效应浓度(concentrationfor50%ofmaximaleffect),是指能引起50%最大效应的浓度。如本文中所使用的,术语“抗体”是指,是指通常由两对多肽链(每对具有一条“轻”(l)链和一条“重”(h)链)组成的免疫球蛋白分子。抗体轻链可分类为κ和λ轻链。重链可分类为μ、δ、γ、α或ε,并且分别将抗体的同种型定义为igm、igd、igg、iga和ige。在轻链和重链内,可变区和恒定区通过大约12或更多个氨基酸的“j”区连接,重链还包含大约3个或更多个氨基酸的“d”区。各重链由重链可变区(vh)和重链恒定区(ch)组成。重链恒定区由3个结构域(ch1、ch2和ch3)组成。各轻链由轻链可变区(vl)和轻链恒定区(cl)组成。轻链恒定区由一个结构域cl组成。抗体的恒定区可介导免疫球蛋白与宿主组织或因子,包括免疫系统的各种细胞(例如,效应细胞)和经典补体系统的第一组分(c1q)的结合。vh和vl区还可被细分为具有高变性的区域(称为互补决定区(cdr)),其间散布有较保守的称为构架区(fr)的区域。各vh和vl由按下列顺序:fr1、cdr1、fr2、cdr2、fr3、cdr3、fr4从氨基末端至羧基末端排列的3个cdr和4个fr组成。各重链/轻链对的可变区(vh和vl)分别形成抗体结合部位。氨基酸至各区域或结构域的分配遵循kabatsequencesofproteinsofimmunologicalinterest(nationalinstitutesofhealth,bethesda,md.(1987and1991)),或chothia&lesk(1987)j.mol.biol.196:901-917;chothia等人(1989)nature342:878-883的定义。术语“抗体”不受任何特定的产生抗体的方法限制。例如,其包括,特别地,重组抗体、单克隆抗体和多克隆抗体。抗体可以是不同同种型的抗体,例如,igg(例如,igg1,igg2,igg3或igg4亚型),iga1,iga2,igd,ige或igm抗体。如本文中所使用的,术语抗体的“抗原结合片段”是指包含全长抗体的片段的多肽,其保持特异性结合全长抗体所结合的相同抗原的能力,和/或与全长抗体竞争对抗原的特异性结合,其也被称为“抗原结合部分”。通常参见,fundamentalimmunology,ch.7(paul,w.,ed.,第2版,ravenpress,n.y.(1989),其以其全文通过引用合并入本文,用于所有目的。可通过重组dna技术或通过完整抗体的酶促或化学断裂产生抗体的抗原结合片段。在一些情况下,抗原结合片段包括fab、fab'、f(ab')2、fd、fv、dab和互补决定区(cdr)片段、单链抗体(例如,scfv)、嵌合抗体、双抗体(diabody)和这样的多肽,其包含足以赋予多肽特异性抗原结合能力的抗体的至少一部分。在一些情况下,抗体的抗原结合片段是双抗体,即,双价抗体,其中vh和vl结构域在单个多肽链上表达,但使用太短的连接体以致不允许在相同链的两个结构域之间配对,从而迫使结构域与另一条链的互补结构域配对并且产生两个抗原结合部位(参见,例如,holligerp.等人,proc.natl.acad.sci.usa90:6444-6448(1993),和poljakr.j.等人,structure2:1121-1123(1994))。可使用本领域技术人员已知的常规技术(例如,重组dna技术或酶促或化学断裂法)从给定的抗体(例如本发明提供的单克隆抗体14c12、14c12h1l1)获得抗体的抗原结合片段(例如,上述抗体片段),并且以与用于完整抗体的方式相同的方式就特异性筛选抗体的抗原结合片段。在本文中,除非上下文明确指出,否则当提及术语“抗体”时,其不仅包括完整抗体,而且包括抗体的抗原结合片段。如本文中所使用的,术语“单抗”和“单克隆抗体”是指,来自一群高度同源的抗体分子中的一个抗体或抗体的一个片断,也即除可能自发出现的自然突变外,一群完全相同的抗体分子。单抗对抗原上的单一表位具有高特异性。多克隆抗体是相对于单克隆抗体而言的,其通常包含至少2种或更多种的不同抗体,这些不同的抗体通常识别抗原上的不同表位。单克隆抗体通常可采用kohler等首次报道的杂交瘤技术获得(nature,256:495,1975),但也可采用重组dna技术获得(如参见u.s.p4,816,567)。如本文中所使用的,术语“人源化抗体”是指,人源免疫球蛋白(受体抗体)的全部或部分cdr区被一非人源抗体(供体抗体)的cdr区替换后得到的抗体或抗体片段,其中的供体抗体可以是具有预期特异性、亲和性或反应性的非人源(例如,小鼠、大鼠或兔)抗体。此外,受体抗体的构架区(fr)的一些氨基酸残基也可被相应的非人源抗体的氨基酸残基替换,或被其他抗体的氨基酸残基替换,以进一步完善或优化抗体的性能。关于人源化抗体的更多详细内容,可参见例如,jonesetal.,nature,321:522525(1986);reichmannetal.,nature,332:323329(1988);presta,curr.op.struct.biol.,2:593596(1992);和clark,immunol.today21:397402(2000)。如本文中所使用的,术语“分离的”或“被分离的”指的是,从天然状态下经人工手段获得的。如果自然界中出现某一种“分离”的物质或成分,那么可能是其所处的天然环境发生了改变,或从天然环境下分离出该物质,或二者情况均有发生。例如,某一活体动物体内天然存在某种未被分离的多聚核苷酸或多肽,而从这种天然状态下分离出来的高纯度的相同的多聚核苷酸或多肽即称之为分离的。术语“分离的”或“被分离的”不排除混有人工或合成的物质,也不排除存在不影响物质活性的其它不纯物质。如本文中所使用的,术语“载体(vector)”是指,可将多聚核苷酸插入其中的一种核酸运载工具。当载体能使插入的多核苷酸编码的蛋白获得表达时,载体称为表达载体。载体可以通过转化,转导或者转染导入宿主细胞,使其携带的遗传物质元件在宿主细胞中获得表达。载体是本领域技术人员公知的,包括但不限于:质粒;噬菌粒;柯斯质粒;人工染色体,例如酵母人工染色体(yac)、细菌人工染色体(bac)或p1来源的人工染色体(pac);噬菌体如λ噬菌体或m13噬菌体及动物病毒等。可用作载体的动物病毒包括但不限于,逆转录酶病毒(包括慢病毒)、腺病毒、腺相关病毒、疱疹病毒(如单纯疱疹病毒)、痘病毒、杆状病毒、乳头瘤病毒、乳头多瘤空泡病毒(如sv40)。一种载体可以含有多种控制表达的元件,包括但不限于,启动子序列、转录起始序列、增强子序列、选择元件及报告基因。另外,载体还可含有复制起始位点。如本文中所使用的,术语“宿主细胞”是指,可用于导入载体的细胞,其包括但不限于,如大肠杆菌或枯草菌等的原核细胞,如酵母细胞或曲霉菌等的真菌细胞,如s2果蝇细胞或sf9等的昆虫细胞,或者如纤维原细胞,cho细胞,cos细胞,nso细胞,hela细胞,bhk细胞,hek293细胞或人细胞等的动物细胞。如本文中使用的,术语“特异性结合”是指,两分子间的非随机的结合反应,如抗体和其所针对的抗原之间的反应。在某些实施方式中,特异性结合某抗原的抗体(或对某抗原具有特异性的抗体)是指,抗体以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的亲和力(kd)结合该抗原。如本文中所使用的,术语“kd”是指特定抗体-抗原相互作用的解离平衡常数,其用于描述抗体与抗原之间的结合亲和力。平衡解离常数越小,抗体-抗原结合越紧密,抗体与抗原之间的亲和力越高。通常,抗体(例如,本发明的单克隆抗体14c12、14c12h1l1)以小于大约10-5m,例如小于大约10-6m、10-7m、10-8m、10-9m或10-10m或更小的解离平衡常数(kd)结合抗原(例如,pd1蛋白)。可以使用本领域技术人员知悉的方法测定kd,例如使用fortebio分子相互作用仪测定。如本文中所使用的,术语“单克隆抗体”和“单抗”具有相同的含义且可互换使用;术语“多克隆抗体”和“多抗”具有相同的含义且可互换使用;术语“多肽”和“蛋白质”具有相同的含义且可互换使用。并且在本发明中,氨基酸通常用本领域公知的单字母和三字母缩写来表示。例如,丙氨酸可用a或ala表示。如本文中所使用的,术语“杂交瘤”和“杂交瘤细胞株”可互换使用,并且当提及术语“杂交瘤”和“杂交瘤细胞株”时,其还包括杂交瘤的亚克隆和后代细胞。例如,当提及杂交瘤细胞株lt003时,其还指杂交瘤细胞株lt003的亚克隆和后代细胞。如本文中所使用的,术语“药学上可接受的载体和/或赋形剂”是指在药理学和/或生理学上与受试者和活性成分相容的载体和/或赋形剂,其是本领域公知的(参见例如remington'spharmaceuticalsciences.editedbygennaroar,19thed.pennsylvania:mackpublishingcompany,1995),并且包括但不限于:ph调节剂,表面活性剂,佐剂,离子强度增强剂。例如,ph调节剂包括但不限于磷酸盐缓冲液;表面活性剂包括但不限于阳离子,阴离子或者非离子型表面活性剂,例如tween-80;离子强度增强剂包括但不限于氯化钠。如本文中所使用的,术语“有效量”是指足以获得或至少部分获得期望的效果的量。例如,预防疾病(例如肿瘤)有效量是指,足以预防,阻止,或延迟疾病(例如肿瘤)的发生的量;治疗疾病有效量是指,足以治愈或至少部分阻止已患有疾病的患者的疾病和其并发症的量。测定这样的有效量完全在本领域技术人员的能力范围之内。例如,对于治疗用途有效的量将取决于待治疗的疾病的严重度、患者自己的免疫系统的总体状态、患者的一般情况例如年龄,体重和性别,药物的施用方式,以及同时施用的其他治疗等等。发明的有益效果本发明的单克隆抗体特别是14c12h1l1能够很好地特异性与pd1结合,并且能够十分有效地阻断pd1与pdl1的结合,特异地解除pd1对机体免疫抑制,激活t淋巴细胞。其中,pd1抗体14c12h1l1对ifn-γ和il-2分泌的诱导效果明显强于对照抗体5c4(5c4:pd1antibody,来源于medarex公司:alanj.korman,etal.,humanmonoclonalantibodiestoprogrammeddeath1(pd1)andmethodsfortreatingcancerusinganti-pd1antibodiesaloneorincombinationwithotherimmunotherapeutics,unitedstatespatent,patentno.us8008449b2)。具有用于制备防治非小细胞性肺癌,肾细胞癌,卵巢癌,黑色素瘤,白血病以及贫血病的药物的潜力。附图说明图1:单克隆人源化抗体14c12h1l1的sds-page检测结果。从左至右的4个泳道的样品及其上样量依次为:1.非还原型蛋白电泳上样缓冲液样品抗体,1μg;2.还原型蛋白电泳上样缓冲液样品抗体,1μg;marker,5μl;3.bsa,1μg。图2:抗体14c12的动力学特征参数检测结果。图3:抗体14c12h1l1的动力学特征参数检测结果。图4:抗体5c4的动力学特征参数检测结果。图5:间接elisa检测抗体14c12h1l1和5c4与pd1的结合。图6:竞争elisa检测抗体14c12h1l1和5c4与pdl1竞争结合pd1。图7:抗体14c12h1l1与293t-pd1细胞表面的靶标pd1蛋白结合ec50。图8:抗体14c12h1l1与t细胞表面抗原pd1的结合活性。图9:抗体14c12h1l1对混合淋巴细胞的ifn-γ分泌的影响。图10:抗体14c12h1l1对混合淋巴细胞的il-2分泌的影响。图11:抗体14c12h1l1对混合pbmc、mda-mb-231和raji细胞共培养所诱导的细胞因子il-2的分泌的影响。杂交瘤细胞株lt003,其于2015年6月16日保藏于中国典型培养物保藏中心(cctcc),保藏编号为cctccno:c2015105,保藏地址为中国.武汉.武汉大学,邮编:430072。实施例1:杂交瘤细胞株lt003的获得以及单克隆抗体14c12的制备1.杂交瘤细胞株lt003的建立用pd1-mfc(pd1:programmedcelldeathprotein1,ncbigenbankid:np_005009.2)融合蛋白作为抗原,取免疫balb/c小鼠(购自广东医学实验动物中心)的脾细胞与小鼠骨髓瘤细胞融合成杂交瘤细胞,参考目前已确立的方法(例如,stewart,s.j.,“monoclonalantibodyproduction”,inbasicmethodsinantibodyproductionandcharacterization,eds.g.c.howardandd.r.bethell,bocaraton:crcpress,2000)。用pd1-mfc作为抗原包被酶标板,进行间接elisa法筛选,得到分泌与pd1特异性结合的新的抗体的杂交瘤细胞。通过竞争elisa筛选出能够分泌与配体pdl1-hfc融合蛋白(pdl1:programmeddeath-ligand1,ncbigenebankid:np_054862.1)竞争结合pd1的单克隆抗体的杂交瘤细胞株,经过有限稀释法得到稳定的杂交瘤细胞株,并经过有限稀释法得到lt003稳定细胞株(其分泌的单克隆抗体命名为14c12)。杂交瘤细胞株lt003(pd1-14c12),其于2015年6月16日保藏于中国典型培养物保藏中心(cctcc),保藏编号为cctccno:c2015105,保藏地址为中国.武汉.武汉大学,邮编:430072。2.单克隆抗体14c12的制备用含10%的低igg胎牛血清的imdm培养基对本发明lt003细胞株进行培养,7天后收集细胞培养上清进行纯化制备获得抗体14c12。实施例2:单克隆抗体14c12的轻链和重链序列的获得按照培养细胞细菌总rna提取试剂盒(tiangen,货号dp430)的方法,从实施例1制得的杂交瘤细胞株lt003中提取mrna。按照invitrogeniiifirst-strandsynthesissystemforrt-pcr试剂盒说明书合成cdna,并进行pcr扩增。pcr扩增产物直接进行ta克隆,具体操作参考peasy-t1cloningkit(transgenct101)试剂盒说明书进行。将ta克隆的产物直接进行测序,测序结果如下:重链可变区的dna测序结果:(354bp)gaggtcaaactggtggagagcggcggcgggctggtgaagcccggcgggtcactgaaactgagctgcgccgcttccggcttcgcctttagctcctacgacatgtcatgggtgaggcagacccctgagaagcgcctggaatgggtcgctactatcagcggaggcgggcgatacacctactatcctgactctgtcaaagggagattcacaattagtcgggataacgccagaaatactctgtatctgcagatgtctagtctgcggtccgaggatacagctctgtactattgtgcaaaccggtacggcgaagcatggtttgcctattggggacagggcaccctggtgacagtctctgcc(seqidno:1)其编码的蛋白序列:(118aa)evklvesggglvkpggslklscaasgfafssydmswvrqtpekrlewvatisgggrytyypdsvkgrftisrdnarntlylqmsslrsedtalyycanrygeawfaywgqgtlvtvsa(seqidno:2)轻链可变区的dna测序结果:(318bp)gacattaagatgacacagtccccttcctcaatgtacgctagcctgggcgagcgagtgaccttcacatgcaaagcatcccaggacatcaacacatacctgtcttggtttcagcagaagccaggcaaaagccccaagaccctgatctaccgggccaatagactggtggacggggtccccagcagattctccggatctggcagtgggcaggattactccctgaccatcagctccctggagtatgaagacatgggcatctactattgcctgcagtatgatgagttccctctgacctttggagcaggcacaaaactggaactg(seqidno:3)其编码的蛋白序列:(106aa)dikmtqspssmyaslgervtftckasqdintylswfqqkpgkspktliyranrlvdgvpsrfsgsgsgqdysltissleyedmgiyyclqydefpltfgagtklel(seqidno:4)2.重组抗体14c12(re)的制备将14c12(re)的重链cdna序列(其可变区序列如seqidno:1所示)和轻链的cdna序列(其可变区序列如seqidno:3所示)分别克隆到puc57simple(金斯瑞公司提供)载体中(酶切位点:xbai&bamhi),分别获得puc57simple-14c12h和puc57simple-14c12l质粒。分别将质粒puc57simple-14c12h和puc57simple-14c12l进行酶切(hindiii&ecori),电泳回收得到的重链轻链分别亚克隆到pcdna3.1载体中,提取重组质粒共转染293f细胞。细胞培养7天后,将培养液通过高速离心、微孔滤膜抽真空过滤后,上样至hitrapmabselectsure柱,用elutionbuffer一步洗脱蛋白,回收目标样品并用hitrapdesalting换液至pbs后进行纯化获得重组抗体14c12(re)。重组抗体14c12(re)经elisa结合活性验证具有与抗体14c12相当的结合活性,可以用于进行下一步抗体人源化设计。实施例3:人源化抗体14c12h1l1的重链和轻链序列的设计1.人源化抗体14c12h1l1的轻链和重链序列的设计根据pd1蛋白的三维晶体结构(shinoharat,etal.,structureandchromosomallocalizationofthehumanpd1gene(pdcd1).genomics1995,23(3):704–6)以及实施例2获得的抗体14c12的序列,通过计算机模拟抗体模型,根据模型设计突变,得到抗体14c12h1l1的可变区序列(重链恒定区为iggamma-1chaincregion,accession:p01857,轻链恒定区为igkappachaincregion,accession:p01834),可变区序列如下:重链可变区的dna序列:(354bp)gaagtgcagctggtcgagtctgggggagggctggtgcagcccggcgggtcactgcgactgagctgcgcagcttccggattcgcctttagctcctacgacatgtcctgggtgcgacaggcaccaggaaagggactggattgggtcgctactatctcaggaggcgggagatacacctactatcctgacagcgtcaagggccggttcacaatctctagagataacagtaagaacaatctgtatctgcagatgaacagcctgagggctgaggacaccgcactgtactattgtgccaaccgctacggggaagcatggtttgcctattgggggcagggaaccctggtgacagtctctagt(seqidno:5)其编码的蛋白序列:(118aa)evqlvesggglvqpggslrlscaasgfafssydmswvrqapgkgldwvatisgggrytyypdsvkgrftisrdnsknnlylqmnslraedtalyycanrygeawfaywgqgtlvtvss(seqidno:6)轻链可变区的dna序列:(321bp)gacattcagatgactcagagcccctcctccatgtccgcctctgtgggcgacagggtcaccttcacatgccgcgctagtcaggatatcaacacctacctgagctggtttcagcagaagccagggaaaagccccaagacactgatctaccgggctaatagactggtgtctggagtcccaagtcggttcagtggctcagggagcggacaggactacactctgaccatcagctccctgcagcctgaggacatggcaacctactattgcctgcagtatgatgagttcccactgacctttggcgccgggacaaaactggagctgaag(seqidno:7)其编码的蛋白序列:(107aa)diqmtqspssmsasvgdrvtftcrasqdintylswfqqkpgkspktliyranrlvsgvpsrfsgsgsgqdytltisslqpedmatyyclqydefpltfgagtklelk(seqidno:8)实施例4:人源化抗体14c12h1l1的制备和sds-page电泳检测将14c12h1l1的重链cdna(其可变区序列为seqidno:5,重链恒定区为iggamma-1chaincregion,accession:p01857)和轻链的cdna(其可变区序列为seqidno:7,轻链恒定区为igkappachaincregion,accession:p01834)分别克隆到puc57simple(金斯瑞公司提供)载体中(酶切位点:xbai&bamhi),分别获得puc57simple-14c12h1和puc57simple-14c12l1质粒,并分别亚克隆到pcdna3.1载体中(酶切位点:xbai&bamhi),提取重组质粒共转染293f细胞。细胞培养7天后,将培养液通过高速离心、微孔滤膜抽真空过滤后,上样至hitrapmabselectsure柱,用elutionbuffer一步洗脱蛋白,回收目标样品并用hitrapdesalting换液至pbs后进行纯化获得重组抗体14c12h1l1。进行sds-page电泳检测。结果如图1所示,还原型蛋白样品目标蛋白大约在24.5kd和49kd处,非还原型蛋白样品目标蛋白大约在147kd处。实施例5:抗体的动力学参数测定使用fortebio分子相互作用仪测定抗体14c12及人源化14c12h1l1与抗原pd1结合的动力学参数。1.用tev蛋白酶酶切pd1-mfc蛋白,并过柱纯化获得pd1抗原。2.抗原pd1(抗原浓度为1μg/ml)经生物素标记后固定于sa传感器表面,于pbst中平衡后,分别与抗体14c12、14c12h1l1和5c4结合,抗体用pbst从200nm往下三倍稀释,于pbst中解离。抗体14c12、14c12h1l1和5c4的动力学参数见表1,动力学特征参数检测结果分别如图2、图3和图4所示。结果表明,14c12和14c12h1l1与抗原均有较好的亲和力,且亲和力均强于对照抗体5c4。表1:抗体14c12动力学参数kd为亲和力常数;kon为抗原抗体结合速率;kdis为抗原抗体解离速率;kd=kdis/kon。实施例6:间接elisa方法检测抗体与抗原pd1的结合活性采用间接elisa方法分别测定14c12h1l1和5c4分别与pd1的结合活性。方法具体如下:酶标板中加入pd1-mfc孵育,4℃过夜,用1%的bsa37℃封闭2h后,分别加入抗体,37℃孵育30min,加入hrp标记羊抗人igg(h+l)二抗(jackson,109-035-088),用tmb(neogen,308177)进行显色反应5min,并在酶标仪中检测450nm波长吸光度。检测抗体14c12h1l1和5c4与抗原pd1结合结果如图5所示。由图5可见,抗体14c12h1l1和5c4均能有效地结合pd1蛋白,并且其结合效率呈剂量依赖关系,各剂量的荧光强度见表2。通过对结合的抗体14c12h1l1和5c4进行荧光定量分析,曲线模拟14c12h1l1和5c4抗体的结合效率ec50分别为0.032nm和0.043nm。表2:抗体14c12h1l1和5c4分别与pd1结合的荧光强度实施例7:竞争elisa方法检测抗体与pdl1竞争结合抗原pd1的活性采用竞争elisa方法分别测定人源化抗体14c12h1l1以及5c4与pdl1的竞争结合抗原pd1。方法具体如下:用pd1-mfc包被酶标板4℃过夜,1%bsa封闭2h后,分别将不同浓度的抗体14c12h1l1和5c4分别与pdl1-mfc混合10min(稀释浓度见表3),37℃孵育30min后加入相应的抗人和抗鼠酶标二抗37℃孵育30min。在酶标仪上检测450nm的吸光值。检测抗体14c12h1l1和5c4与抗原pd1结合结果如图6所示。由图6可见,抗体14c12h1l1能有效地与pdl1竞争结合pd1蛋白,并且其结合效率呈剂量依赖关系,各剂量的荧光强度见表3。通过对结合的抗体14c12h1l1和5c4进行荧光定量分析,曲线模拟抗体14c12h1l1和5c4的结合效率ec50分别为:1.322nm和1.199nm。表3:抗体14c12h1l1和5c4与pdl1竞争结合pd1实施例8:流式细胞仪方法检测抗体与细胞表面抗原pd1的结合活性首先构建表达pd1抗原的宿主细胞293t,然后用本发明中制备的人源化抗体14c12h1l1(见实施例4)对改宿主细胞进行标记。然后采用流式细胞术分析验证抗体14c12h1l1对细胞表面天然构象的抗原特异性的结合能力。1.表达pd1抗原的宿主细胞293t的构建具体步骤如下:表达pd1抗原的宿主细胞293t的构建:按照lipofectamin转染试剂盒(购自invitrogen公司)方法将包含pd1的载体plenti6.3-pd1(载体plenti6.3购自invitrogen公司)转染293t细胞,经筛选获得稳定表达pd1的克隆群体293t-pd1。2.抗体对293t-pd1细胞表面抗原的结合抗体标记和流式细胞仪检测:采用常规胰酶消化方法上述步骤获得的表达pd1抗原的宿主细胞293t-pd1,并使每个收集管细胞数为2×105,用pbs(1%bsa)配制浓度分别为50nm,10nm,5nm,1nm,0.1nm,0.01nm的pd1抗体稀释液,冰上与表达pd1的293t细胞孵育2小时,每管加入100μlfitc羊抗人igg(1:500)冰上孵育1小时用pbs洗3次后加入300μlpbs重悬细胞,在流式细胞仪上用fitc通道检测荧光信号。人源化抗体14c12h1l1与293t-pd1细胞的结合结果如图7所示。由图7可见,14c12h1l1抗体能有效地结合宿主细胞293t-pd1表面的靶标pd1蛋白,并且其结合效率呈剂量依赖关系,各剂量的荧光强度见表4。通过对结合的14c12h1l1抗体进行荧光定量分析,曲线模拟14c12h1l1抗体的结合效率ec50为1.89nm。表4:流式细胞仪检测14c12h1l1结合pd1宿主细胞293t-pd1表面抗原的荧光强度分析浓度(nm)0.010.1151050荧光强度8.3220.31174.62579.41686.49669.54实施例9:流式细胞仪方法检测抗体与t细胞表面抗原pd1的结合活性采用ficoll-paqueplus(gehealthcarelotno.:171440-02)分离pbmc,从pbmc中分离得到cd4+细胞,用pha(上海疾控生物科技有限公司,50μl/ml)刺激三天后用pbs洗一次,加入不同浓度的抗体,冰上孵育1.5h。孵育完成后,用pbs洗涤一次,加入fitc-标记抗人二抗igg(jacksonimmunoresearchlot.102155)。冰上避光孵育1h后,用pbs洗涤一次并用流式细胞仪检测。人源化抗体14c12h1l1与t细胞的结合结果如图8所示。由图8可见,14c12h1l1抗体能有效地结合t细胞表面的靶标pd1蛋白,并且其结合效率呈剂量依赖关系。实施例10:混合淋巴细胞反应:细胞因子ifn-γ,il-2的分泌采用ficoll-paqueplus(gehealthcarelotno.:171440-02)分离pbmc,将分离出来的pbmc加入il-4(peprotechk2513,1000u/ml)和gm-csf(peprotechh1513,1000u/ml)诱导6天后,加入tnf-α(peprotechg1513,200u/ml)诱导3天获得dc细胞。pbmc中分离得到t细胞,将获得的dc细胞与t细胞按1:10的比例混合培养,同时加入不同比例的抗体14c12h1l1、5c4和higg(higg做为同型对照)培养5-6天后,采用elisa试剂盒检测ifn-γ(购自达科为公司)和il-2(购自达科为公司)的分泌量。dc细胞和t细胞混合培养后ifn-γ和il-2的分泌检测结果分别如图9、图10所示:14c12h1l1抗体能有效地诱导混合淋巴细胞分泌ifn-γ和il-2,并且其分泌量与抗体14c12h1l1呈剂量依赖关系。抗体14c12h1l1对ifn-γ和il-2分泌量的诱导效果均强于对照抗体5c4。实施例11:il-2的分泌将分离得到的pbmc(方法同实施例10)用pha(上海疾控生物科技有限公司,50μl/ml)刺激3天后,96孔板中加入刺激成熟的pbmc(5×104cells/孔),raji细胞(上海中科院)(5×104cells/孔)和mda-mb-231细胞(atcc)(1×104cells/孔),加入100nm14c12h1l1或对照抗体5c4或higg(higg为同型对照)混合均匀共培养。3天后,采用elisa试剂盒检测il-2(购自达科为公司)的分泌量,具体操作按照试剂盒说明书进行。细胞混合培养后的il-2的分泌检测结果如图11所示。由图11可见,14c12h1l1抗体能有效地诱导pbmc分泌il-2,抗体14c12h1l1对il-2分泌的诱导效果显著强于对照抗体5c4。尽管本发明的具体实施方式已经得到详细的描述,本领域技术人员将会理解。根据已经公开的所有教导,可以对那些细节进行各种修改和替换,这些改变均在本发明的保护范围之内。本发明的全部范围由所附权利要求及其任何等同物给出。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1