一种亚麻刺盘孢的P450氧化酶及其基因序列的制作方法
本发明属于酶基因工程及酶工程领域,具体涉及一种来源于亚麻刺盘孢霉菌(Colletotrichum lini)的P450氧化酶及其基因序列,能对DHEA进行7α,15α-双羟化。
背景技术:
去氢表雄酮(DHEA)是自然界生物体内重要的活性物质,具有抗衰老及蛋白同化作用,对生命的代谢活动具有重要的调节作用,而且可用于合成多种重要的甾体激素类药物。其衍生物3β,7α,15α-三羟基雄甾-5-烯-17-酮(7α,15α-diOH-DHEA)是“第四代”口服避孕药主要成分屈螺酮的重要中间体。其中屈螺酮与低剂量的炔雌醇配伍,是一种新型的女用口服避孕药称优思明,优思明自2000年已成为全球销量第一的女用口服避孕药。7α,15α-diOH-DHEA作为一种具有重要药理作用和药用价值的羟基甾体化合物,应用前景十分看好,倍受药理学家的重视,是当前药物研究中的热点领域之一。由于传统的化学法制备7α,15α-diOH-DHEA具有反应条件苛刻、产物得率低及环境污染严重等缺点;而利用微生物特有的酶转化甾体化合物,不仅反应步骤少、选择性高,而且反应条件温和、操作简便、成本低、公害少。因此微生物转化作为目前获得甾体微生物激素的新型方法之一,受到人们广泛关注。
甾体微生物转化,可视为微生物对外源甾体化合物的解毒过程,由P450酶系催化完成。目前,甾体化合物微生物羟化机理的研究主要集中在细胞色素P450及其电子传递系统等方面。细胞色素P450酶来源广泛,在植物、动物、真菌和细菌中均发现有P450,而且同一生物体可含有几十或上百种P450;同时还具有功能多样性,可催化多种类型的反应,如羟化、杂原子氧化、过氧化、脱烷基化、脱氨基作用、环氧化、还原反应、脱卤反应等20多种反应。
利用C.lini ST-1可以选择性地催化底物DHEA生成产物7α,15α-diOH-DHEA。该过程主要是由细胞色素P450酶系所介导的,具体是经细胞色素P450氧化酶(CYP)催化反应进行,同时也需要细胞色素还原酶(CPR)协助完成电子传递,并由辅酶NADPH提供电子。而野生菌C.lini ST-1的P450氧化酶和还原酶的表达量均很低,从而极大地限制了双羟产物7α,15α-diOH-DHEA的生成,这已成为DHEA双羟化反应中的关键限制因素之一。而由于该菌株的遗传背景不清楚,其双羟化DHEA的P450酶基因不确定,有关其P450酶系的报道也十分有限,极大地限制了对野生菌C.lini ST-1的理性改造和对其羟化酶的认知。因此研究C.lini ST-1的P450酶具有非常重要的理论价值和实践意义。
技术实现要素:
本发明的目的在于提供一种来自于C.lini ST-1的新型P450氧化酶的氨基酸序列以及其编码该蛋白的核苷酸序列,提供包含本发明基因的质粒及包含本表达质粒的宿主细胞,并利用宿主细胞(重组菌)诱导表达该P450氧化酶后能有效转化DHEA为7α,15α-diOH-DHEA。在Cytochrome P450Homepage(http://drnelson.uthsc.edu/CytochromeP450.html)进行比对,发现该P450氧化酶与CYP68J3的同源性达57%,根据细胞色素P450国际命名委员会提出的命名法,可推测其属于CYP68J亚家族,故暂时命名该蛋白为CYP68J,其编码基因为cyp 68J。该基因cyp 68J的获得为C.lini ST-1双羟化DHEA的P450关键酶研究以及后续对野生菌进行理性改造奠定了理论基础。
C.lini ST-1菌株由本实验室筛选,该菌于2012年4月24号保藏在位于北京市朝阳区北辰西路1号院3号的中国科学院微生物研究所中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为CGMCC No.6051,分类命名为亚麻刺盘孢霉(Colletotrichum lini)。
本发明的技术方案是:
由C.lini ST-1总RNA通过反转录PCR获得其cDNA序列,以cDNA序列为模板扩增目的编码基因SEQ ID NO:1,将该基因以pPIC3.5K为质粒构建重组表达质粒pPIC3.5K-cyp 68J,以毕赤酵母GS115为表达宿主,实现C.lini ST-1的P450氧化酶(CYP68J)的高效表达。
所述的完整的目的基因推导的CYP68J氨基酸序列为SEQ ID NO:2。
所述的C.lini ST-1菌株P450氧化酶基因cyp 68J的克隆及表达方法:
(1)C.lini ST-1总RNA的提取
C.lini ST-1菌株在产酶培养基(葡萄糖15g/L,酵母膏15g/L,玉米浆3g/L,NaCl 1.16g/L,KH2PO4 2.72g/L,FeSO4 0.03g/L)中培养2-3天,培养温度30℃。真空抽滤收集菌体,并用无菌水洗涤2-3次,将湿菌体置于预冷的研钵中,加入1mL TriZol试剂,低温匀浆2min;匀浆液转移至1.5mL离心管中,加入0.2mL氯仿,剧烈震荡30s后,室温放置3min,12000rpm,4℃离心10min;吸取上层水相转移至干净的离心管中,加入1/2倍无水乙醇(v/v),混匀;用移液器将混合液转至吸附柱中,室温下静置2min,12000rpm离心3min,倒掉收集管中废液;将吸附柱放回收集管中,加入500μL RPE溶液,静置2min,于10000rpm离心30s,倒掉收集管中废液;并重复该步骤一次。将吸附柱放回收集管中,10000rpm离心2min;将吸附柱置于干净的1.5mL离心管中,在吸附膜中央加入30-50μL DEPC处理水,静置5min,12000rpm离心2min,将所得到的RNA溶液用于后续试验。
(2)反转录反应获得cDNA序列
以总RNA为模板,使用AMV反转录酶进行反转录反应合成cDNA第一条链。反转录反应按如下条件进行:42~60℃保温15~30min,99℃下5min灭活AMV反转录酶,然后于5℃保存5min。
(3)C.lini ST-1菌株P450氧化酶基因的克隆
前期通过蛋白质组学技术获得了有关C.lini ST-1菌株的部分蛋白质信息,其中有部分为P450氧化酶。根据鉴定得到的蛋白信息设计引物扩增目的基因,引物序列如下:
引物P1:CGCTACGTAATGGCTTCTTATGCGCCC
引物P2:CCGGAATTCTTAACAATCCAACGATTCCAAAT
以反转录获得的cDNA序列为模板,以上述核昔酸序列作为引物,PCR扩增P450氧化酶的编码基因。PCR反应在50μL的体系中进行,反应条件为:94℃预变性3min后开始循环;94℃变性30s,64℃退火30s,72℃延伸1min 40s,共30个循环;72℃终延伸10min。PCR产物进行琼脂糖凝胶电泳后割胶回收,与pMD19-T载体连接后转化大肠杆菌JM109,在含有氨苄抗性(100mg/L)的LB平板上筛选阳性转化子。挑取阳性转化子接入LB液体培养基,37℃培养12-16h,提取质粒,该质粒命名为pMD19T-cyp 68J,并对该质粒进行序列测定。
将测序获得的基因cyp 68J所编码的蛋白序列在NCBI数据库中进行比对分析,发现与已报道的希金斯刺盘孢(Colletotrichum higginsianum)的P450氧化酶同源性最高,相似性达93%。但是由于隶属于不同的菌种,且其具体氨基酸序列不同,因此判断此基因cyp 68J编码的P450氧化酶为一种新型的P450酶。
(4)重组表达质粒的构建
本研究所采用的表达质粒是毕赤酵母胞内表达质粒pPIC3.5K,是整合型的表达质粒,将质粒pPIC3.5K与pMD19T-cyp 68J分别进行双酶切后割胶回收,用T4连接酶在16℃连接过夜,连接产物转化E.coli JM109感受态细胞,在含氨苄抗性(100mg/L)的LB平板培养过夜,筛选阳性转化子,进行富集培养后提取质粒,命名为pPIC3.5K-cyp 68J。
(5)重组菌的筛选及诱导表达
将重组质粒pPIC3.5K-cyp 68J用合适的限制性内切酶进行单酶切线性化后,电转至毕赤酵母GS115感受态细胞,在HIS4营养缺陷平板上筛选阳性转化子GS115/pPIC3.5K-cyp 68J。挑取转化子至YPD液体培养基30℃培养16h,转接至BMGY培养基富集培养18-30h,随后转接至BMMY培养基进行诱导表达。诱导表达一定时间后,收集细胞破碎菌体,提取胞内蛋白进行SDS-PAGE分析。
(6)重组菌的筛选及诱导表达
将转化子GS115/pPIC3.5K-cyp 68J转接至BMMY培养基诱导表达10-20h,加入1-5g/L的DHEA进行转化,转化24-72h后,取样进行HPLC分析。计算DHEA的转化率以及7α,15α-diOH-DHEA的摩尔得率。
附图说明
图1为酵母重组菌胞内蛋白SDS-PAGE图谱(目的蛋白大小约为60KD)
M:标准蛋白分子量;泳道1为毕赤酵母GS115全蛋白样品;泳道2为GS115/pPIC3.5K转化子全蛋白样品;泳道3为GS115/pPIC3.5K-cyp 68J转化子全蛋白样品。
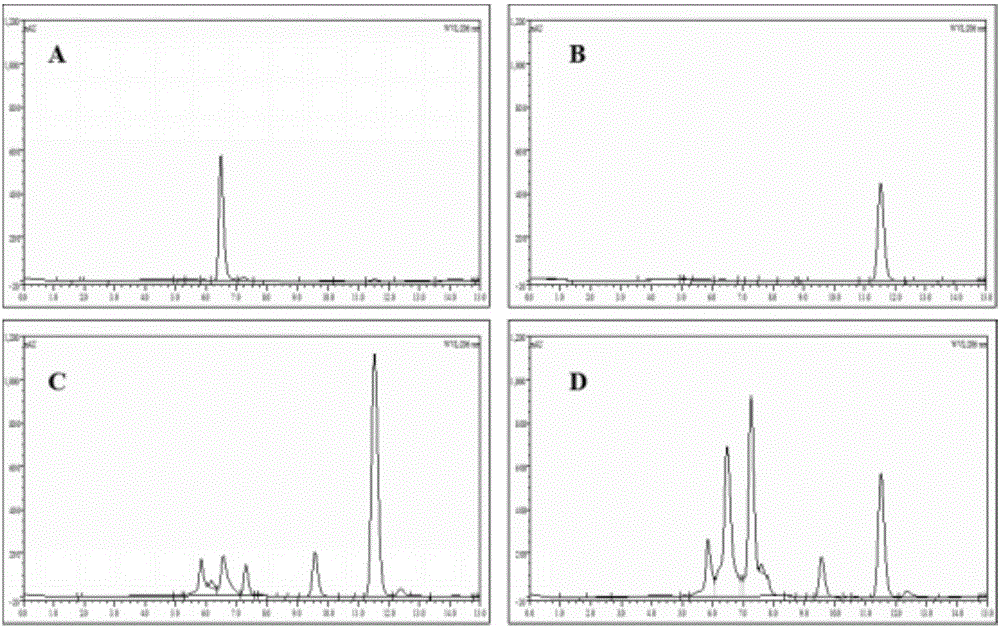
图2为酵母重组菌转化底物DHEA结果的HPLC分析图
A为7α,15α-diOH-DHEA标样;B为DHEA标样;C为GS115/pPIC3.5K转化子转化DHEA的样品;D为GS115/pPIC3.5K-cyp 68J转化子转化DHEA的样品。
具体实施方式
实施例1亚麻刺盘孢(Colletotrichum lini)ST-1总RNA的提取
将C.lini ST-1菌株在30℃条件下于产酶培养基(葡萄糖15g/L,酵母膏15g/L,玉米浆3g/L,NaCl 1.16g/L,KH2PO4 2.72g/L,FeSO4 0.03g/L)中培养2天。真空抽滤收集菌体,并用无菌水洗涤3次,将湿菌体置于预冷的研钵中,加入1mL TriZol试剂,低温匀浆2min;匀浆液转移至1.5mL离心管中,加入0.2mL氯仿,剧烈震荡30s后,室温放置3min,12000rpm,4℃离心10min;吸取上层水相转移至干净的离心管中,加入1/2倍无水乙醇(v/v),混匀;用移液器将混合液转至吸附柱中,室温下静置2min,12000rpm离心3min,倒掉收集管中废液;将吸附柱放回收集管中,加入500μL RPE溶液,静置2min,于10000rpm离心30s,倒掉收集管中废液;并重复该步骤一次。将吸附柱放回收集管中,10000rpm离心2min;将吸附柱置于干净的1.5mL离心管中,在吸附膜中央加入50μL DEPC处理水,静置5min,12000rpm离心2min,将所得到的RNA溶液用于后续试验。
实施例2反转录反应获得cDNA序列
以总RNA为模板,使用AMV反转录酶进行反转录反应合成cDNA第一条链。反转录反应按如下条件进行:42~60℃保温15~30min,99℃下5min灭活AMV反转录酶,然后于5℃保存5min。
实施例3C.lini ST-1菌株P450氧化酶基因的克隆
引物P1:CGCTACGTAATGGCTTCTTATGCGCCC
引物P2:CCGGAATTCTTAACAATCCAACGATTCCAAAT
以反转录获得的cDNA序列为模板,以上述核昔酸序列作为引物,PCR扩增P450氧化酶的编码基因。PCR反应在50μL的体系中进行,反应条件为:94℃预变性3min后开始循环;94℃变性30s,64℃退火30s,72℃延伸1min 40s,共30个循环;72℃终延伸10min。PCR产物进行琼脂糖凝胶电泳后割胶回收,与pMD19-T载体连接后转化大肠杆菌JM109,在含有氨苄抗性(100mg/L)的LB平板上筛选阳性转化子。挑取阳性转化子接入LB液体培养基,37℃培养12h,提取质粒,该质粒命名为pMD19T-cyp 68J,并对该质粒进行序列测定。
实施例4重组表达质粒的构建
将毕赤酵母胞内表达质粒pPIC3.5K与pMD19T-cyp 68J分别进行双酶切后割胶回收,用T4连接酶在16℃连接过夜,连接产物转化E.coli JM109感受态细胞,在含氨苄抗性(100mg/L)的LB平板培养过夜,筛选阳性转化子,进行富集培养后提取质粒,命名为pPIC3.5K-cyp 68J。
实施例5重组菌的筛选及诱导表达
将重组质粒pPIC3.5K-cyp 68J用限制性内切酶Sac I进行单酶切线性化后,电转至毕赤酵母GS115感受态细胞,在HIS4营养缺陷平板上筛选阳性转化子GS115/pPIC3.5K-cyp 68J。挑取转化子至YPD液体培养基30℃培养16h,转接至BMGY培养基富集培养18-30h,随后转接至BMMY培养基进行诱导表达。诱导表达一定时间后,收集细胞破碎菌体,提取胞内蛋白进行SDS-PAGE分析。
实施例6重组菌转化DHEA的分析
将转化子GS115/pPIC3.5K-cyp 68J在BMMY培养基中诱导表达12h后,加入2g/L的DHEA进行转化能力的分析。转化50h后取样进行HPLC检测,计算得到DHEA转化率为75.6%,7α,15α-diOH-DHEA的摩尔得率为44.9%。
实施例7
按照本专利的方法分别对以下专利所报道的P450酶基因在毕赤酵母中进行外源表达:
(1)公开号为CN103642763A的专利所报道的P450酶CYP X基因;
(2)本专利所报道的P450酶基因cyp 68J。
将构建的含有上述基因的重组毕赤酵母依次记为重组菌①、重组菌②,分别进行诱导表达以及转化DHEA的能力分析,方法同实施例5、实施例6,计算DHEA的转化率和7α,15α-diOH-DHEA的摩尔得率。结果如表1所示。
表1实施例7得到的重组菌转化DHEA的结果
- 还没有人留言评论。精彩留言会获得点赞!