一种噁唑烷酮类抗菌药物镁盐的晶型A及其制备方法和应用与流程
本发明属于医药领域,具体涉及一种噁唑烷酮类抗菌药物镁盐的晶型A及其制备方法和应用。
背景技术:
近年来,各类抗菌药物的耐药菌的迅速发展已经严重威胁到人类的健康,2011年世界卫生组织为此警告世界将进入“后抗生素时代”。各国已经意识到研发新型抗菌药物的重要性,美国于2012年批准了《FDA安全与创新法案》,其第八部分即为《鼓励开发抗生素法案》(GAIN法案)。今年国家卫计委等14个部委联合下发了《关于印发遏制细菌耐药国家行动计划(2016-2020年)的通知》,应对细菌耐药带来的挑战被首次提升到国家层面的高度,作为抗击细菌耐药问题的一个重要措施,支持和鼓励新型抗菌药物的研发再次成为焦点。
欧洲专利EP2940024A1公开一种新型的噁唑烷酮类抗菌药物,化合物结构如式(1)所示:
研究结果显示,式(1)所示的噁唑烷酮类抗菌药物具有较同类药物更强的抗菌活性,尤其是抗多耐药菌活性,详见专利EP2940024A1中描述。式(1)药物的药用形式包括游离酸及其可药用盐类,如钠盐、镁盐及钙盐等盐类。
众所周知,在固体药物中普遍存在多晶型现象,晶型是影响药物质量和疗效的重要因素之一。近年来,国内制药企业开始逐渐重视对药物晶型的研究,了解固体药物的晶型有助于解决下列问题:保证固体原料药和制剂在生产运输贮存过程中的稳定性;通过多晶型药物的生物利用度筛选,增进药品的疗效;保证各生产批次的原料药和制剂晶型的一致性。
欧洲专利EP2940024A1公开了式(1)游离酸和式(3)钠盐的制备方法,但并未公开式(2)镁盐(M=Mg)的制备方法及其晶型。我们发现按照此化合物专利制备的游离酸和钠盐均为无定型产品,而无定型产品溶剂残留容易超标,稳定性相对较差,因此有必要开发式(1)可药用盐的晶型产品。
技术实现要素:
本发明提供了一种噁唑烷酮类抗菌药物镁盐的晶型A及其制备方法和应用,该晶型A同无定型相比,具有更好的稳定性,有机溶剂残留更低。
本发明是通过以下方式实现的:
一种噁唑烷酮类抗菌药物镁盐的晶型A,在X-射线衍射图谱中包含以下2θ反射角测定的特征峰:12.6±0.2°、16.8±0.2°、17.4±0.2°、18.9±0.2°、20.7±0.2°、21.5±0.2°、22.7±0.2°、24.3±0.2°、24.9±0.2°、26.4±0.2°、27.3±0.2°、28.2±0.2°、31.2±0.2°。
所述的噁唑烷酮类抗菌药物镁盐的晶型A的结构式如式(2):
稳定性试验和残留溶剂检测表明,相对于申请人按照EP2940024A1的方法制备得到的噁唑烷酮类抗菌药物钠盐以及无定型的镁盐,式(2)镁盐的晶型A具有更好的稳定性和更低的溶剂残留。
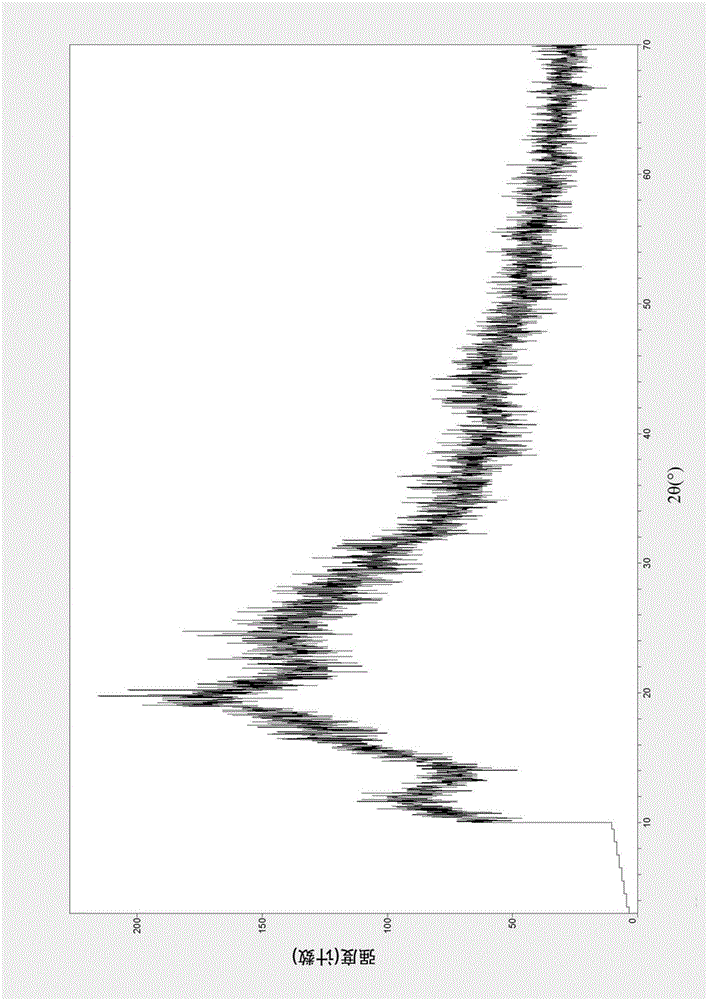
作为优选,所述的晶型A的X-射线衍射图谱如附图1所示。
本发明还提供一种如上述的噁唑烷酮类抗菌药物镁盐的晶型A的制备方法,包括以下步骤:
1)将噁唑烷酮类抗菌药物钠盐溶于水中,并加入有机溶剂稀释,得到溶液I;所述的有机溶剂为丙酮、乙腈、四氢呋喃、二氧六环、C1~C3烷基醇中的一种;
2)将无机镁盐溶于水中得到溶液II,将溶液II加入到溶液I中,静置析晶,过滤、干燥,得到所述的晶型A。
其中,所述的噁唑烷酮类抗菌药物钠盐可以参考欧洲专利EP 2940024A1中的制备方法制备得到,其结构式如式(3)所示:
所述制备方法的反应方程式如下:
我们通过研究发现,如果溶剂体系为单纯的水,得到的镁盐为无定型产品,晶型A产品只能在水和有机溶剂的混合体系中得到,而溶液I中有机溶剂和水必须控制在一定的比例范围内,否则钠盐容易析出或得到镁盐的无定型产品。
作为优选,所述的噁唑烷酮类抗菌药物钠盐对映体纯度大于99%,含有的6个非对映异构体在内的杂质总和小于1%。
作为优选,所述的噁唑烷酮类抗菌药物钠盐对映体纯度大于99.5%。
作为优选,所述的有机溶剂I为甲醇。
作为优选,所述的溶液I中有机溶剂与水的体积比为0.5~3。
作为优选,所述的无机镁盐为硫酸镁或氯化镁,可以为无水物或水合物。
本发明还提供一种如上述的噁唑烷酮类抗菌药物镁盐的晶型A在制备抗生素药物中的应用。
作为优选,所述的药物包含噁唑烷酮类抗菌药物镁盐的晶型A以及一种或多种可药用的惰性无毒载体。所述的惰性无毒载体可以根据本领域技术人员已有的知识进行选择,包括药学上所用的稀释剂、香味剂、增溶剂、润滑剂以及包裹剂等,例如磷酸镁、滑粉糖、乳糖、果胶、淀粉和明胶等。
同现有技术相比,该噁唑烷酮类抗菌药物镁盐的晶型A在周围环境中很稳定,并且溶剂残留量小,可以用于制备药物组合物;在该制备方法所述的工艺参数范围内,重复多个批次,重现性极好。
附图说明
图1为实施例1制备的噁唑烷酮类抗菌药物镁盐的晶型A的X-射线衍射图谱;
图2为实施例7制备的噁唑烷酮类抗菌药物镁盐无定型产品的X-射线衍射图谱。
具体实施方式
参照下列实施例说明本发明的特定实施方案,这些实施例是用以阐明本发明,而非以任何方式限制本发明。
式(3)的噁唑烷酮类抗菌药物钠盐按欧洲专利EP2940024A1合成。
实施例1
室温下将式(3)钠盐(10.43g,0.02mol)溶于水(50mL)中,再加入甲醇(25mL)搅拌。将硫酸镁(2.41g,0.02mol)溶于水(50mL)中,加入到上述钠盐溶液中。静止析晶,抽滤,真空干燥,所得固体进行粉末X-射线衍射,结果如图1所示。
实施例2
将式(3)钠盐(10.43g,0.02mol)溶于水(50mL)中,升温到60℃,再加入甲醇(150mL)搅拌。将硫酸镁七水合物(4.93g,0.02mol)溶于水(50mL)中,加入到上述钠盐溶液中,60℃搅拌保温1小时。冷却,静止析晶,抽滤,真空干燥,所得固体进行粉末X-射线衍射。
实施例3
室温下将式(3)钠盐(10.43g,0.02mol)溶于水(50mL)中,再加入四氢呋喃(35mL)搅拌。将氯化镁(1.91g,0.02mol)溶于水(50mL)中,加入到上述钠盐溶液中。静止析晶,抽滤,真空干燥,所得固体进行粉末X-射线衍射。
实施例4
将式(3)钠盐(10.43g,0.02mol)溶于水(50mL)中,升温到70℃,再加入乙腈(75mL)搅拌。将氯化镁六水合物(4.07g,0.02mol)溶于水(50mL)中,加入到上述钠盐溶液中,70℃搅拌保温1小时。冷却,静止析晶,抽滤,真空干燥,所得固体进行粉末X-射线衍射。
实施例5
室温下将式(3)钠盐(10.43g,0.02mol)溶于水(50mL)中,再加入二氧六环(30mL)搅拌。将硫酸镁(2.41g,0.02mol)溶于水(50mL)中,加入到上述钠盐溶液中。静止析晶,抽滤,真空干燥,所得固体进行粉末X-射线衍射。
实施例6
室温下将式(3)钠盐(10.43g,0.02mol)溶于水(50mL)中,再加入乙醇(50mL)搅拌。将硫酸镁七水合物(4.93g,0.02mol)溶于水(50mL)中,加入到上述钠盐溶液中。静止析晶,抽滤,真空干燥,所得固体进行粉末X-射线衍射。
实施例7
室温下将式(3)钠盐(10.43g,0.02mol)溶于水(50mL)中。再将硫酸镁(2.41g,0.02mol)溶于水(50mL)中,加入到上述钠盐溶液中。静止析晶,抽滤,真空干燥,所得固体进行粉末X-射线衍射,结果如图2所示。
性能试验1X-射线粉末衍射光谱:
测定仪器:EMPYREAN型衍射仪,PANALYTICAL
测定条件:
图1为实施例1制备的噁唑烷酮类抗菌药物镁盐的晶型A的X-射线衍射图谱,测定数据列于表1。
表1噁唑烷酮类抗菌药物镁盐的晶型A的X-衍射测定数据
实施例2~6所制备的噁唑烷酮类抗菌药物镁盐的晶型A的X-射线衍射图谱与图1相同。图2为实施例7制备的噁唑烷酮类抗菌药物镁盐的无定型的X-射线衍射图谱。
性能试验2噁唑烷酮类抗菌药物镁盐的晶型A和镁盐无定型以及按欧洲专利EP2940024A1合成的噁唑烷酮类抗菌药物钠盐的质量比较
根据中国药典2015年版四部通则〈0861残留溶剂测定法〉及指导原则〈9001原料药物与制剂稳定性试验指导原则〉相关规定对实施例1制得的噁唑烷酮类抗菌药物镁盐的晶型A和实施例7制得的噁唑烷酮类抗菌药物镁盐的无定型以及按欧洲专利EP2940024A1合成的噁唑烷酮类抗菌药物钠盐进行溶剂残留检测和加速试验,结果如表2:
表2镁盐晶型A和镁盐无定型以及钠盐的质量比较
试验结果表明,本申请的方法得到的镁盐晶型A无论在稳定性还是溶剂残留方面,效果都明显得到了改善。
- 还没有人留言评论。精彩留言会获得点赞!