一种低异味产杆菌肽地衣芽胞杆菌及其构建方法和应用与流程
本发明涉及微生物基因工程领域,尤其是一种低异味产杆菌肽地衣芽胞杆菌及其构建方法和应用。
背景技术:
杆菌肽为淡黄色或类白色粉末,是由10种氨基酸、12个氨基酸残基构成的多肽类抗生素,可有效抑制革兰氏阳性病原菌和部分革兰氏阴性菌,被广泛添加于饲料中。
目前,杆菌肽通过微生物发酵法生产,主要生产菌株为地衣芽胞杆菌(Bacillus licheniformis)。杆菌肽发酵过程中具有强烈的臭味,严重影响环境,且异味物质附着在杆菌肽产品表面,影响产品质量。鉴于现有的大多数地衣芽胞杆菌生产杆菌肽的产量均较低,不利于投入工业化生产,因此,现有的关于杆菌肽的研究都集中在提高杆菌肽产量以追求经济效益的最大化,而并未见到关于解决如何去除杆菌肽发酵生产中臭味的相关研究。
在微生物发酵过程中,通常采用的除臭方式为:采用除臭剂对发酵过程中的臭味气体进行吸附去除。但是,这种除臭方式不仅需要大量的除臭剂,增加了投入成本,并且,除臭剂需要放置于发酵罐内,容易造成发酵液染菌,造成重大经济损失。随着人们对环境安全和产品品质的日益关注,杆菌肽发酵异味问题亟待解决。
技术实现要素:
本发明旨在提供一种低异味产杆菌肽地衣芽胞杆菌及其构建方法,将此菌株应用在杆菌肽生产中,可实现高产杆菌肽的同时显著减小发酵异味的目的。
一种低异味产杆菌肽地衣芽胞杆菌的构建方法,包括以下步骤:
1)根据地衣芽胞杆菌(Bacillus licheniformis)DW2基因组DNA序列中的ptb基因的上、下游序列,设计ptb基因的上、下游同源臂引物;并以地衣芽胞杆菌DW2的基因组DNA为模板,分别以ptb基因的上、下游同源臂引物进行PCR扩增得到ptb基因的上游同源臂和ptb基因的下游同源臂,再利用重叠延伸PCR方法将ptb基因的上游同源臂和ptb基因的下游同源臂拼接在一起,得到融合基因序列A;
2)采用限制性内切酶XbaⅠ和BamH I对步骤(1)得到的融合基因序列A进行双酶切,得到酶切基因序列A;同时,采用限制性内切酶XbaⅠ和BamH I对质粒T2(2)-ori进行双酶切,得到酶切质粒T2(2)-ori,并将酶切基因序列A连接到酶切质粒T2(2)-ori中,得到ptb基因敲除质粒T2(2)-ori-ptb;
3)通过电转化将步骤2)得到的ptb基因敲除质粒T2(2)-ori-ptb转入地衣芽胞杆菌(Bacillus licheniformis)DW2中,经卡那霉素抗性筛选得到阳性转化子,抽质粒进行菌落PCR验证,将验证成功的阳性转化子在45℃条件下转接培养数次后,进行菌落PCR检测,得到ptb基因的上游臂或ptb基因的下游臂与地衣芽孢杆菌DW2基因组DNA产生单交换的阳性单交换结合子菌株;
4)挑选ptb基因的上游臂与地衣芽孢杆菌DW2基因组DNA产生单交换的阳性单交换结合子菌株与ptb基因的下游臂与地衣芽孢杆菌DW2基因组DNA产生单交换的阳性单交换结合子菌株混合接种于37℃、不含有卡那霉素的培养基中经过数次转接培养,PCR法筛选得到敲除ptb基因的地衣芽胞杆菌(Bacillus licheniformis)DW2△ptb;
其中,步骤(1)和步骤(3)中所述的地衣芽胞杆菌DW2已于2011年10月12日保藏于位于中国武汉武汉大学的中国典型培养物保藏中心,保藏编号为CCTCC NO:M2011344;
所述地衣芽胞杆菌DW2的基因组DNA序列中的ptb基因为SEQUENCE LISTING中所示。
基于本发明人已开发出杆菌肽生产水平已完全能够满足工业化生产、且达到行业领先水平的地衣芽胞杆菌DW2菌株,并且,考虑到人们对环境安全和产品品质日益关注以及企业对杆菌肽市场占有率的更高要求,本发明人就如何解决杆菌肽生产中臭味问题以提高杆菌肽品质和环境问题作为出发点提出了本发明的技术方案。并且,本发明的技术方案是通过基因工程手段改造杆菌肽生产菌株来解决杆菌肽生产中异味问题的,突破了本领域技术人员在解决除臭问题方面的常规思维;并且,本发明通过对高产杆菌肽的地衣芽胞杆菌DW2菌株进行基因敲除来构建工程菌,得到的地衣芽胞杆菌DW2△ptb在保证依然具有高产杆菌肽目的的前提下,在杆菌肽发酵过程中主要臭味物质-支链短链脂肪酸(简称BCFAs,包括异戊酸、异丁酸等)的合成量明显降低,例如:异丁酸、异戊酸等的合成量分别降低33%、37%,异味显著减少,具有重要的应用价值。本申请的构建方法得到的菌株之所以能够降低异丁酸、异戊酸等的合成量,其原因可能在于:所述的地衣芽胞杆菌DW2中的ptb基因为磷酸丁酰转移酶的编码基因,而磷酸丁酰转移酶又是BCFAs形成的限速酶,因此,地衣芽胞杆菌DW2中的ptb基因的敲除,限制了BCFAs的合成,从而,使得异丁酸、异戊酸等的合成量显著降低。
本发明另一目的在于提供一种根据上述低异味产杆菌肽地衣芽胞杆菌的构建方法构建得到的地衣芽胞杆菌DW2△ptb。其中,根据上述低异味产杆菌肽地衣芽胞杆菌的构建方法构建得到的一株地衣芽胞杆菌DW2△ptb,其保藏在位于中国武汉武汉大学的中国典型培养物保藏中心,保藏编号CCTCC NO:M 2016598,保藏日期为2016年10月28日。
本发明的目的之三在于将上述低异味产杆菌肽地衣芽胞杆菌的构建方法构建得到的敲除ptb基因的地衣芽胞杆菌DW2△ptb应用于抗菌肽生产中。
附图说明
图1为步骤2)得到的ptb基因敲除质粒T2(2)-ori-ptb双酶切验证结果琼脂糖凝胶图;其中,泳道1为未酶切的质粒T2(2)-ori;泳道2为ptb基因敲除已敲除ptb基因的质粒T2(2)-ori-ptb;泳道3为双酶切T2(2)-ori-ptbT2-ptb的条带;泳道M为DNA marker(从上到下的条带对应的分子量依次为:5000bp,3000bp,2000bp,1500bp,1000bp,750bp,500bp,250bp,100bp)。
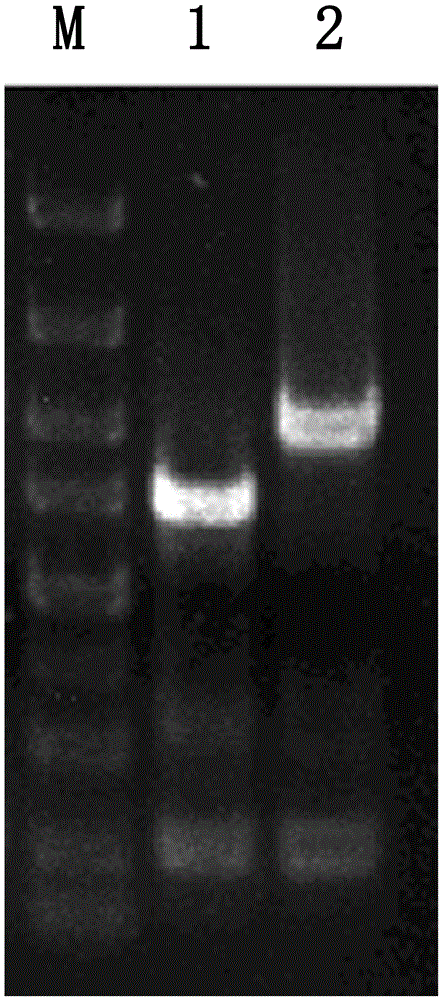
图2为地衣芽胞杆菌工程菌DW2Δptb菌落PCR验证图,其中,泳道M为DNA marker(从上到下的条带对应的分子量依次为:5000bp,3000bp,2000bp,1500bp,1000bp,750bp,500bp,250bp,100bp);泳道1为以地衣芽胞杆菌DW2为模板,用验证引物ptbYZ-F、ptbYZ-R 进行菌落验证的条带;泳道2为以地衣芽胞杆菌DW2Δptb为模板,用验证引物ptbYZ-F、ptbYZ-R进行菌落验证的条带。
具体实施方式
一种低异味产杆菌肽地衣芽胞杆菌的构建方法,包括以下步骤:
1)根据地衣芽胞杆菌(Bacillus licheniformis)DW2基因组DNA序列中的ptb基因的上、下游序列,设计ptb基因的上、下游同源臂引物;并以地衣芽胞杆菌DW2的基因组DNA为模板,分别以ptb基因的上、下游同源臂引物进行PCR扩增得到ptb基因的上游同源臂(通常为450-550bp)和ptb基因的下游同源臂(通常为450-550bp),再利用重叠延伸PCR方法将ptb基因的上游同源臂和ptb基因的下游同源臂拼接在一起,得到融合基因序列A;
2)采用限制性内切酶XbaⅠ和BamH I对步骤(1)得到的融合基因序列A进行双酶切,得到酶切基因序列A;同时,采用限制性内切酶XbaⅠ和BamH I对质粒T2(2)-ori进行双酶切,得到酶切质粒T2(2)-ori,并将酶切基因序列A连接到酶切质粒T2(2)-ori中,得到ptb基因敲除质粒T2(2)-ori-ptb;
3)通过电转化将步骤2)得到的ptb基因敲除质粒T2(2)-ori-ptb转入地衣芽胞杆菌DW2中,经卡那霉素抗性筛选得到阳性转化子,抽质粒进行菌落PCR验证,将验证成功的阳性转化子在45℃条件下转接培养数次后,进行菌落PCR检测,得到ptb基因的上游臂或ptb基因的下游臂与地衣芽孢杆菌DW2基因组DNA产生单交换的阳性单交换结合子菌株;
4)挑选ptb基因的上游臂与地衣芽孢杆菌DW2基因组DNA产生单交换的阳性单交换结合子菌株与ptb基因的下游臂与地衣芽孢杆菌DW2基因组DNA产生单交换的阳性单交换结合子菌株混合接种于37℃、不含有卡那霉素的培养基中经过数次转接培养,PCR法筛选得到敲除ptb基因的地衣芽胞杆菌(Bacillus licheniformis)DW2△ptb;
其中,步骤1)和步骤3)中所述的地衣芽胞杆菌DW2已于2011年10月12日保藏于位于中国武汉武汉大学的中国典型培养物保藏中心,保藏编号为CCTCC NO:M2011344;
所述地衣芽胞杆菌DW2的基因组DNA序列中的ptb基因为SEQUENCE LISTING中所示。
一种低异味产杆菌肽地衣芽胞杆菌的构建方法的具体实施方式如下:
1、步骤1)的具体操作步骤为:
采用冷冻保藏的地衣芽胞杆菌DW2为出发菌。根据基因测序测得的地衣芽胞杆菌DW2的基因组DNA序列中的磷酸丁酰转移酶基因(简称ptb基因)的上下游序列,设计了上游同源臂引物:ptbF1、ptbR1,和下游同源臂引物:ptbF2、ptbR2。以地衣芽胞杆菌DW2的基因组DNA为模板,以ptb基因的上、下游同源臂引物进行PCR扩增得到ptb基因的上游同源臂518bp和ptb基因的下游同源臂507bp,并利用重叠延伸PCR方法将ptb基因的上游同源臂和ptb基因的下游同源臂拼接在一起,得到融合基因序列A(融合基因序列A的大小为1035bp)。其中,所述的ptbF1、ptbR1、ptbF2、ptbR2的具体序列分别为:
ptbF1:GCTCTAGAGCTTTTGCCGCAGCCTTCAT、
ptbR1:CCGACAGCCGTGCTATTACTGAAGCACGACAAGAGGAGGAAT;
ptbF2:ATTCCTCCTCTTGTCGTGCTTCAGTAATAGCACGGCTGTCGG、
ptbR2:CGGGATCCCGTGGAATCAGTATCCGCAATC。
扩增ptb基因上游同源臂的PCR体系的组成成分为:Buffer 5μl、dNTP 2.5μl、Fastpfu 0.5μl、ptbF1 1μl、ptbR1 1μl、Bacillus licheniformis DW2基因组DNA 1μl、水14μl;PCR体系的反应条件为:95℃5min;95℃30sec;55℃30sec;72℃30sec;循环30次;72℃5min;10℃5min。
扩增ptb基因下游同源臂的PCR体系的组成成分为:Buffer 5μl、dNTP 2.5μl、Fastpfu 0.5μl、ptbF2 1μl、ptbR2 1μl、Bacillus licheniformis DW2基因组DNA 1μl、水14μl;PCR体系的反应条件为:95℃5min;95℃30sec;55℃30sec;72℃30sec;循环30次;72℃5min;10℃5min。
所述重叠延伸PCR方法以ptb基因的上游同源臂和ptb基因的下游同源臂共同作为模板,以ptbF1和ptbR2作为引物。重叠PCR体系的反应条件为:95℃5min;95℃30sec;50℃30sec;72℃30sec;循环8次;72℃5min;95℃30sec;55℃30sec;72℃1min;循环30次;72℃5min;10℃5min。
2、步骤2)的具体操作步骤为:
采用限制性内切酶XbaⅠ和BamHⅠ对步骤1)得到的融合基因序列A进行双酶切,得到酶切基因序列A(酶切基因序列A大小为1025bp),双酶切体系的组成成分为:XbaⅠ5μl、BamHⅠ5μl、10×M buffer 10μl、融合基因序列A 40μl,补水至总体积100μl。双酶切体系的反应条件为:30℃5小时。同时,采用限制性内切酶XbaⅠ和BamHⅠ对质粒T2(2)-ori进行双酶切,得到酶切质粒T2(2)-ori,其中,质粒T2(2)-ori的构建方法与申请公布号为CN 103937735 A的中国专利中所述的质粒T2(2)-ori的构建方法相同;双酶切体系的组成成分为:XbaⅠ5μl、BamHⅠ5μl、10×M buffer 10μl、质粒T2(2)-ori 20μl,补水至总体积100μl;双酶切体系的反应条件为:30℃5小时。并将酶切基因序列A连接到酶切质粒T2(2)-ori中,得到连接产物(连接产物的基因序列为:酶切质粒T2(2)-ori+酶切基因序列A)。其中,连接体系的组成成分为T2(2)-ori双酶切回收产物1μl、酶切后的基因片段3μl、10×T4DNA ligase buffer 1μl、T4DNA ligase 0.5μl、水4.5μl;连接条件为:温度16℃,时间8小时。再将连接产物转入E.coli DH5α中。根据连接产物的基因序列的上、下游序列设计一对引物:T2-F和T2-R。挑转化子以T2-F和T2-R为引物进行菌落PCR验证,验证成功的转化子(大小为1325bp)挑菌接种至含20μg/mL卡那霉素的培养基中进行菌种培养,抽质粒并测序验证,得到ptb基因敲除质粒T2(2)-ori-ptb。ptb基因敲除质粒T2(2)-ori-ptb采用XbaⅠ和BamHⅠ双酶切验证结果(如图1所示,ptb基因敲除质粒T2(2)-ori-ptb(泳道2)相对于质粒T2(2)-ori(泳道1)来说,插入了1025bp基因片段;ptb基因敲除质粒T2(2)-ori-ptb经XbaⅠ和BamHⅠ双酶切后的溶液中会含有双酶切融合基因序列A后得到的酶切后基因片段(该片段大小为1025bp)和空质粒酶切后的基因片段(该片段大小为4272bp),因此,经双酶切的质粒T2(2)-ori-ptb会在1025bp位置出现电泳条带)。其中T2-F和T2-R的序列为:
T2-F ATGTGATAACTCGGCGTA
T2-R GCAAGCAGCAGATTACGC。
所述的限制性内切酶Xba I和BamH I购自北京全式金生物技术有限公司。T4DNA ligase为商用的DNA连接酶,10×T4DNA ligase buffer为配套的连接酶缓冲液。T4DNA ligase以及10×T4DNA ligase buffer均购自宝生物工程(大连)有限公司。
3、步骤3)的具体操作步骤为:
首先,制备大肠杆菌感受态细胞,具体步骤为:将大肠杆菌菌种从甘油管以体积比1%接种于5ml LB培养基,于37℃,250r/min振荡培养过夜;1%接种于50mL LB培养基,37℃振荡培养2-4h;将菌液置冰上10min,使菌液冷却,倒入50mL离心管中,4℃5000r/min离心3min,弃上清;用20mL预冷的CaCl2(0.1mol/L)洗涤沉淀,4℃5000r/min离心3min,弃上清;用1.5mL预冷的CaCl2(0.1mol/L)重悬沉淀,分装于无菌1.5mL离心管中,置-70℃保存备用。
然后,将质粒T2(2)-ori-ptb转入大肠杆菌感受态细胞中,具体步骤为:取100μL大肠杆菌感受态细胞与质粒T2(2)-ori-ptb混合,冰上吸附15min;将离心管放到44℃循环水浴中热激90s;快速将离心管转移到冰浴中,使细胞冷却5min;每管加800μL LB培养基,37℃,150r/min培养45min;取200μL涂布在含有20μg/mL卡那霉素的抗性平板上;平板37℃培养,正置30min后倒置培养12-16h,可出现菌落。
接着,对大肠杆菌中的质粒T2(2)-ori-ptb进行提取,具体步骤为:5mL菌液,离心收集,用STE洗涤一次,加入100mL SolutionⅠ溶液重悬菌体,置于冰上5min;加入200mL SolutionⅡ,快速颠转混匀,置于冰上5min;加入150mL SolutionⅢ混匀,置于冰上5min;12000r/min离心5min,取上清;加入500mL苯酚/氯仿震荡,12000r/min离心5min,取上清;加入2倍无水乙醇-20℃沉淀2h,12000r/min离心5min,弃上清;沉淀用70%乙醇洗一遍,去上清,干燥后溶于20-40mL RNase(20μg/mL)中。
再接着,制备地衣芽胞杆菌DW2的感受态细胞:地衣芽胞杆菌菌株Bacillus licheniformis DW2于5mL的LB培养基中,37℃,200r/min过夜培养;菌液用生长培养基稀释20倍后,37℃,200rpm~250rpm,培养2~3h后OD600达到0.8~1.0;将菌液放置于冰上,预冷10min,倒入50mL离心管中,置冰上放置15min后,4℃5000g离心5min,收集菌体;用预冷的电转化培养基重悬沉淀,洗涤菌体4次;用1/40体积的电转化培养基悬浮菌体,分装于1.5mL无菌离心管(约60μL/管),即为感受态细胞。
再接着,将质粒T2(2)-ori-ptb转入地衣芽胞杆菌DW2的感受态细胞内,具体步骤为:60μL感受态细胞加1μl从大肠杆菌中提取出来的质粒T2(2)-ori-ptb(50ng/uL)于预冷的2mm电转杯中放置1~1.5分钟;电击21kV/cm,时间4.5~5ms;立即加入1mL恢复培养基;37℃培养3h后,涂布含20μg/mL卡那霉素的LB平板,过夜培养,筛选阳性转化子,挑阳性转化子抽质粒,并以T2-F和T2-R为引物进行菌落PCR验证,扩增出1325bp条带的菌落即为阳性转化子。
最后,将阳性转化子在45℃条件下转接培养3次,每次培养12h;并以ptbYZ-F和T2-R为引物进行菌落PCR检测单交换菌株,扩增出1420bp或1994bp长度的条带,即证明为单交换菌株。
其中,ptbYZ-F的具体序列为:TCGTTGATTGTCGCTCCC。
(4)步骤4)的具体操作步骤为:
将步骤3)得到的PCR检测出现1420bp条带的单交换菌株和步骤3)得到的PCR检测出现1994bp条带的单交换菌株混合接种培养,37℃,转接培养6次,每次8-12h,转接传代的同时进行双交换验证,双交换验证具体步骤:37℃,180rpm培养10h后,稀释106倍,涂布于LB平板,37℃,培养12-14h,取同一菌落分别在LB平板和20μg/mL卡那霉素抗性平板划线,选择LB平板生长、卡那霉素抗性不长的菌落以ptbYZ-F、ptbYZ-R为验证引物做菌落PCR,其中,ptbYZ-F、ptbYZ-R的具体序列为:
ptbYZ-F:TCGTTGATTGTCGCTCCC、
ptbYZ-R:AAACCGCAAATGGAATGG。菌落PCR验证双交换菌株(验证正确的双交换菌株即为地衣芽胞杆菌DW2△ptb。菌落PCR验证结果如图2所示,地衣芽胞杆菌DW2△ptb菌落PCR扩增后的产物大小为1467bp,地衣芽胞杆菌DW2菌落PCR产物大小为2041bp),将得到的双交换菌株抽总DNA,再用ptbYZ-F、ptbYZ-R引物进行PCR重复验证。
本发明另一目的在于提供一种根据上述低异味产杆菌肽地衣芽胞杆菌的构建方法构建得到的地衣芽胞杆菌DW2△ptb。其中,根据上述低异味产杆菌肽地衣芽胞杆菌的构建方法构建得到的一株地衣芽胞杆菌DW2△ptb,其保藏在位于中国武汉武汉大学的中国典型培养物保藏中心,保藏编号CCTCC NO:M 2016598,保藏日期为2016年10月28日。
本发明的目的之三在于将上述低异味产杆菌肽地衣芽胞杆菌的构建方法构建得到的敲除ptb基因的地衣芽胞杆菌DW2△ptb应用于抗菌肽生产中。其具体发酵生产步骤可采用现有的地衣芽孢杆菌生产杆菌肽的生产步骤。
所述的地衣芽胞杆菌DW2△ptb的具体发酵生产步骤以及结果检测如下:
(1)发酵实验条件为:在平板上活化菌种,挑菌接至含有50mL液体LB的250mL三角瓶中,37℃,180rpm培养10h,随后以5%的接种量接种至发酵培养基中,37℃,240rpm培养48h。其中,液体LB为:10g/L蛋白胨,5g/L酵母浸粉,10g/L氯化钠,pH7.2-7.4 250mL三角瓶装液量为50mL;发酵培养基为:100g/L豆粕;45g/L玉米淀粉;6g/L CaCO3;1g/L(NH4)2SO4;接种量:5%;
(2)发酵液预处理:取1.8mL发酵液于2mL离心管中,12000rpm离心10min后上清转移至另外一个2mL离心管中,4℃保存备用。
(3)BCFAs标准曲线的制作:预先准备好不同浓度的BCFAs溶液(异丁酸:0.475g/L、0.95g/L、1.425g/L、1.9g/L、2.375g/L、2.85g/L、3.325g/L、3.8g/L、4.275g/L、4.75g/L;异戊酸:0.465g/L、0.93g/L、1.395g/L、1.86g/L、2.325g/L、2.79g/L、3.255g/L、3.72g/L、4.185g/L、4.65g/L),与等量的正丁醇混合后,进行气相色谱分析。根据报告峰面积得到BCFAs浓度的标准曲线。
(4)气相色谱法检测BCFAs:以异丁酸或者异戊酸的浓度为横坐标,样品与内标峰面积比值为纵坐标,绘制出标准曲线,并计算出标准曲线方程。待测样品经气相检测后得到异丁酸和异戊酸的峰面积后,按照异丁酸和异戊酸标准曲线方程计算其浓度。与原始菌地衣芽胞杆菌DW2相比,工程菌DW2△ptb在杆菌肽发酵过程中可以显著降低BCFAs合成水平,异丁酸和异戊酸合成量分别降低33%、37%,异丁酸合成量由2.10g/L降低至1.44g/L,异戊酸合成量由1.01g/L降低至0.67g/L,异味显著减少。
(5)高效液相色谱法测定发酵液中杆菌肽效价:高效液相色谱测定中的样品、标准品的制备步骤,高效液相色谱测定中的流动相的配置、色谱条件,以及发酵液杆菌肽效价的具体计算方式均与申请公布号为CN 103937735A的中国专利相同。
(6)采用本发明所构建的地衣芽胞杆菌DW2△ptb进行发酵产生的发酵液的杆菌肽效价为938u/g(采用原始地衣芽胞杆菌DW2进行发酵产生的发酵液的抗菌肽效价1080u/g)。
SEQUENCE LISTING
<110> 绿康生化股份有限公司
<120> 一株低异味产杆菌肽地衣芽胞杆菌工程菌
<130> 2016
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 957
<212> DNA
<213> Bacillus licheniformis DW2 ptb 基因序列
<400> 1
ttgcatgata tagtgggcgg atgtttgcta agaaaggtgg gtactatgaa gctgaaacaa 60
ttattgcaaa aagcggcgga gcttgacaat aaaacggtcg ccgtcgcaca tgcagaagat 120
gacgaagtgc tgcaagcagt caaacttgcg gtcgacaaac aatttgcccg gttcttgctg 180
attgggcaca gagaaaagat caggcatatg atgacagaac agaacatttc aaaacggcac 240
gtggatatca ttcattcgga atcgccggcg gattcggcga gaattgccgt tcaagctgtc 300
aaaagcggca atgctgatgt tctcatgaag gggaatgtcc cgacagccgt gctattaaaa 360
gccgttttga ataaagagta cgggctccgt tcctcgcatg tactgtcaca tgtagcagct 420
tttgaagtca gcgggtttga gaggctgatt tatgtaacag atgcggcaat gaatatcagc 480
cccaagcttg atgagctgaa acaaatttta gaaaacgcag tcggcgtggc gagagcggtc 540
ggcgtgcaaa tgccgaaagc cgcttgcctc gccgcggtgg aaacggtgaa tcccgcaatg 600
gaagcgacat taaatgcagc tgccttgacg cagatgaatc atcggggcca aatcaaaaat 660
tgcatcgttg acgggcctct tgctttggat aacgcgatct caccgcttgc cgcccggcat 720
aaaaacattt ctggaatcgt tgcgggcgag gctgacatcc tgcttgttcc ttcaattgaa 780
acaggcaatg tcctttacaa atcattgatt cattttgcgg gtgcgaaagt gggagccatt 840
ttggcagggg caaaagcgcc catcgccttg acaagcaggg ccgattccgc agaaaacaag 900
ctgtattcga ttgctttggc gctgtgtacg tctgaagcac gacaagagga ggaataa 957
- 还没有人留言评论。精彩留言会获得点赞!