水稻线粒体不育基因及其应用的制作方法
本发明涉及水稻育种技术领域,具体而言,涉及一种水稻线粒体不育基因及其应用。
背景技术:
70年代我国应用三系法培育杂交水稻获得成功,并在生产上大面积推广种植,实现了我国水稻单产的第二次飞跃。1976-2005年,我国杂交水稻累计种植面积52.5亿亩,增收稻谷约6.5亿吨,因此杂交水稻的发展是提高粮食产量、解决粮食安全问题的重要途径(袁隆平,2008)。三系杂交水稻利用的基础是细胞质雄性不育,自从野败型细胞质雄性不育系被发现与大面积推广应用以来,上世纪70年代到80年代中期,育种家培育出多达60多种细胞质源来源于野败型、云南滇型(Dian I和DianⅡ)、红莲型、冈型、K型和马协型等,尽管细胞质源和败育特点有较大差异,可分为孢子体不育和配子体不育两种类型(朱英国,2000)。其中,云南滇型、包台型和红莲型为配子体不育系,野败型、D型、K型和冈型等为孢子体败育类型,大部分的配子体败育恢保关系一致,而大部分孢子体败育类型的恢保关系一致,配子体败育和孢子体败育类型的恢保关系相反。
在配子体细胞质雄性不育系中,已经克隆验证了包台型细胞质雄性不育基因orf79和红莲型细胞质雄性不育基因orfH79,两个不育基因为等位变异,有97%的序列同源性(Wang et al.2006;Peng et al.2010),滇型不育系也鉴定到orf79等位变异基因。对于孢子体型细胞质雄性不育系,罗荡平等用全线粒体基因组表达分析的方法鉴定出野败型不育基因WA352,该基因由3个线粒体基因组片段和一个来源不明片段组成,其他孢子体细胞质不育类型,如印水型、矮败型、冈型、爪哇型、马协型、K型均含有不育基因WA352(Luo et al.2013)。
目前,国际公认细胞质雄性不育类型主要为野败、红莲、包台三种类型,其中前面两种不育细胞质都来源于普通野生稻。20世纪70年代,国内外育种家还利用普通野生稻为细胞质供体培育了其他13种细胞质类型,如崖城野生稻细胞质、田东野生稻细胞质等(朱英国,2000),因此,从野生稻中挖掘细胞质是培育新型细胞质雄性不育系的一个重要途径。东乡野生稻为多年生野生稻,是迄今为止发现的世界上分布最北的野生稻,被国内外誉为“野生植物大熊猫”(黄依南等,2012),上世纪80年代,江西省农科院水稻所利用东乡野生稻作为细胞质供体培育出雄性不育系国际油粘A,但一直没有找到对该新型不育系育性恢复良好的恢复源,因此,没有得到推广和利用。近年来,江西省超级水稻研究发展中心以东乡野生稻为细胞质供体培育了新型东野不育系D1A,并以D1A为细胞质来源,分别与培矮64、天丰B、K17B、协青早B、II-32B、2454B、岳4B、9311等回交,获得一批新东野不育系,该类型不育系为孢子体不育系,分子标记鉴定该不育系不含有已克隆的孢子体不育基因WA352。无花粉败育,败育彻底,育性极易稳定,且保持谱广,绝大多数栽培品种可为其保持系。同时,在同质野生稻中找到恢复系,并实现同质野生稻恢复系恢复基因的栽培稻转育,最高恢复率达到85.1%。利用该含强恢复系品种,我们也在筛选优良恢复系并配制杂交组合。因此,它的败育特点、分子机理和恢保关系与目前推广的其他不育系完全不同,为一种新型孢子体不育类型,命名为D1型。该不育系的研究及应用推广作为一种互补类型极大地丰富杂交水稻类型,对促进杂交水稻的可持续发展具有重要价值。
然而,D1细胞质不育基因至今还未得到克隆。克隆D1型不育基因对于了解无花粉型细胞质雄性不育败育机理,创建新型D1型细胞质雄性不育系和恢复系,培育D1型杂交水稻水稻品种,进一步利用水稻杂种优势,提高水稻产量具有重要作用。
有鉴于此,特提出本发明。
技术实现要素:
本发明公开了一种水稻线粒体不育基因及其编码序列,并通过该基因序列设计特异性分子标记可快速高效的从野生稻中筛选鉴定出D1型细胞质用做新D1型细胞质不育系的培育。它通过比较基因组学,鉴定出一个D1型细胞质不育系的线粒体基因组特异序列,基因预测及表达差异分析鉴定出不育相关ORFs,并构建植物转化载体转化保持系验证及不育功能。
为了实现本发明的上述目的,特采用以下技术方案:
一种水稻线粒体不育基因,所述基因的序列选自下列组的序列之一:
a)、具有SEQ ID NO:1的核苷酸序列;
b)、在严格条件下能够与a)所述核苷酸序列杂交的核苷酸序列;
c)、与a)或b)所述序列互补的核苷酸序列。
近年来,江西省农科院以东乡野生稻为细胞质供体培育了新型东野不育系D1A,该类型不育系为孢子体不育系,无花粉败育,败育彻底,育性极易稳定,命名为D1型细胞质,分子标记鉴定该不育系不含有已克隆的孢子体不育基因WA352。申请人通过线粒体测序和比较基因组学,在该D1型不育系线粒体基因组中鉴定到一个D1型特异的开放阅读框,该开放阅读框编码182个氨基酸,其序列如SEQ ID NO:1所示,能导致产生细胞质雄性败育。
本领域技术人员应该知晓,本发明所述的水稻线粒体不育基因还包括与核苷酸序列SEQ ID NO:1高度同源,并且具有同样的育性调控功能的高度同源的功能等价体序列。
所述高度同源的功能等价体序列包括在严格条件下能够与具有SEQ ID NO:1所示的序列的DNA杂交的DNA序列。本发明中使用的“严格条件”是公知的,包括诸如在含400mM NaCl、40mM PIPES(pH6.4)和1mM EDTA的杂交液中于60℃杂交12~16小时,然后在65℃下用含0.1%SDS、和0.1%SSC的洗涤液洗涤15~60分钟。
功能等价体序列还包括与SEQ ID NO:1所示序列有至少90%、95%、96%、97%、98%、或99%序列同一性,且具有育性调控功能的基因序列,可以从任何植物中分离获得。其中,序列同一性的百分比可以通过公知的生物信息学算法来获得,包括Myers和Miller算法(Bioinformatics,4(1):11-17,1988)、Needleman-Wunsch全局比对法(J.Mol.Biol.,48(3):443-53,1970)、Smith-Waterman局部比对法(J.Mol.Biol.,147:195-197,1981)、Pearson和Lipman相似性搜索法(PNAS,85(8):2444-2448,1988)、Karlin和Altschul的算法(Altschul等,J.Mol.Biol.,215(3):403-410,1990;PNAS,90:5873-5877,1993)。这对于本领域技术人员来说是熟悉的。
一种表达载体,其包含权利要求1所述的基因。
优选的,所述表达载体为PCAMBIA1301载体。
一种工程菌,其被如上所述的表达载体所转化。
优选的,所述工程菌为农杆菌。
本发明所提供的基因可被插入质粒、粘粒、酵母人工染色体、细菌人工染色体或其他适合转化进宿主细胞中的任何载体中。优选的宿主细胞是细菌细胞,尤其是用于克隆或储存多核苷酸、或用于转化植物细胞的细菌细胞,例如大肠杆菌、农杆菌、根瘤土壤杆菌和毛根土壤杆菌,最优选的为农杆菌。
在描述本发明的化合物、组合物、蛋白质、肽等以及方法之前,应当理解,这些实施方式不限于所描述的特定方法、方案以及试剂,这是因为它们可以变化。还应当理解,本文所使用的术语仅用于描述特定实施方式目的,并且不旨在限制本实施方式或权利要求的范围。
当宿主细胞是植物细胞时,含有本发明提供的基因的表达盒或载体可被插入被转化的植物细胞的基因组中。插入可以是定位的或随机的插入。优选地,插入通过诸如同源重组来实现。另外,表达盒或载体可保持在染色体外。本发明的表达盒或载体可存在于植物细胞的核、叶绿体、线粒体和/或质体中。最优选的,含有本发明提供的基因或DNA序列的表达盒或载体被插入植物线粒体DNA中。
如上所述的基因编码的氨基酸序列。
将本发明提供的基因序列转换为氨基酸序列,这对本领域技术人员来说是熟悉的。
优选的,如上所述的氨基酸序列,所述氨基酸序列如SEQ ID NO:2所示。
SEQ ID NO:2所示的氨基酸序列是由SEQ ID NO:1所示的核苷酸序列进行表达得到的。
一种引物对,其上游引物和下游引物的序列分别如SEQ ID NO:3和SEQ ID NO:4所示。
所述引物对根据SEQ ID NO:1所述的基因进行设计。
如上所述的基因和引物对在D1型水稻不育系及其相应的恢复系的鉴定和/或辅助育种中的应用。
一种鉴定含有D1型细胞质不育基因的方法,包括如下步骤:
利用如上中的引物对扩增待测水稻基因组DNA;
对扩增产物进行电泳鉴定,若产物中包含549bp的条带,则待测水稻样本含有D1型细胞质不育基因。
优选的,如上所述的鉴定含有D1型细胞质不育基因的方法,在所述扩增的反应程序中,Tm值为50℃,反应循环次数为28次。
本发明还提供了一种转基因方法,或称一种植物的生产方法,其包括:
(1)构建本发明提供的表达载体;
(2)将步骤(1)获得的表达载体直接导入植物细胞;或通过农杆菌等中间宿主细胞介导导入植物细胞;
(3)再生出转基因植物;和
(4)选择出转基因植物;并且
(5)任选地,增殖步骤(4)获得的植物以获得后代。
本发明的转基因植物使用植物生物技术领域技术人员已知的转化方法制备。任何方法可被用于将重组表达载体转化进植物细胞中,以产生本发明的转基因植物。转化方法可包括直接和间接的转化方法。合适的直接方法包括聚乙二醇诱导的DNA摄入、脂质体介导的转化、使用基因枪导入、电穿孔、以及显微注射等。在本发明的具体实施方式中,本发明使用了基于农杆菌的转化技术。农杆菌可包含质粒(例如Ti或Ri质粒等常规质粒,本发明优选采用PCAMBIA1301)和本发明提供的DNA元件(即上述基因或DNA序列),所述质粒和元件在用农杆菌转染后被转移至植物,而DNA元件被整合进植物细胞的基因组中,更具体的,被整合进线粒体基因组中。本发明的核苷酸序列尤其适用于水稻的植物细胞,但不排除在其它物种中也具有调节其育性的作用。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
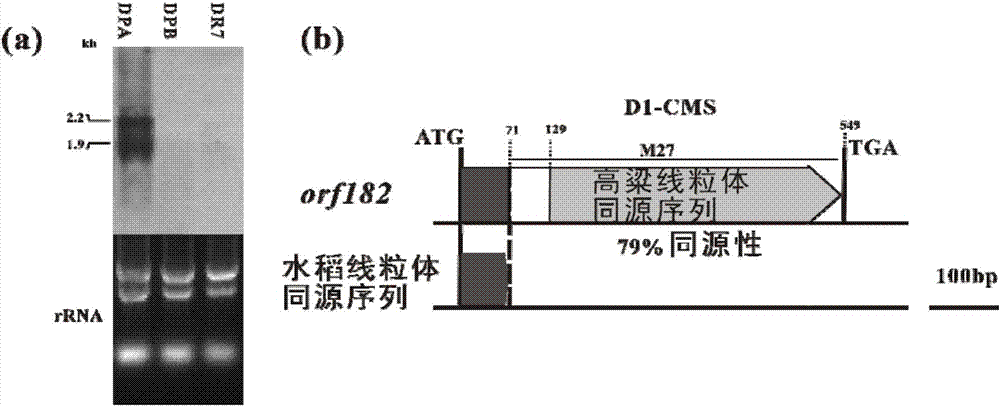
图1为不育候选基因orf182的结构和表达比较分析;(a)Northern Blot杂交比较D1-CMS DPA,保持系DPB和同质恢复系DR7在幼穗中的表达模式;(b)orf182基因结构,其中白色方框部分为未知来源序列区;
图2为Western blot检测ORF182在D1型不育系和保持系的表达;1,3分别是D1型不育系DPA和保持系DPA的幼穗总蛋白,2,4分别为D1型不育系DPA和保持系DPA的黄化苗总蛋白;
图3为转基因片段结构图;
图4为PCAMBIA1301载体图;
图5为orf182对转基因水稻株型和育性影响;(a)、(b)为野生型和转基因植株的植株表现,标尺=10cm;(c)、(d)分别为野生型和转基因开花时穗子表型,标尺=5mm;(e)和(g)、(f)和(h)分别为野生型和转基因抽穗期花药表现,标尺=2mm;(i)为野生型花粉I2-KI染色镜检图,(j)和(k)为转基因花粉I2-KI染色镜检图,标尺=30um;
图6为Western blot分析转基因植株蛋白表达,1,2分别为转基因植株的幼穗总蛋白;
图7为ORF182在大肠杆菌(E.coli)中的毒性验证.(a)IPTG或未加IPTG诱导的转orf182基因的大肠杆菌在液体培养基中的生长曲线,转空载体pET-28a的大肠杆菌为对照;(b)Western blot检测IPTG诱导的转基因大肠杆菌的orf182的表达;(c)37℃IPTG诱导培育2hour后,转orf182大肠杆菌和对照的耗氧量检测;(d)37℃IPTG诱导培育6hour后,转orf182大肠杆菌和对照的ATP含量检测。
具体实施方式
除非另有限定,本发明使用的所有技术和科学术语具有与所公开的实施方案所属领域的普通技术人员通常理解的相同的含义。虽然与本发明所述的方法和材料类似或等同的方法和材料可用于本实施方式的实践或测试中,但下文仍然描述了合适的方法和材料。本发明提及的所有出版物、专利申请、专利以及其他参考文献通过引用全部内容结合于本文中。在冲突的情况下,本说明书(包括定义)将起支配作用。此外,材料、方法以及实施例仅仅是说明性的,而不旨在限制。实施方式的其他特征和优点将从以下详细的说明书和权利要求中变得明显。
为了促进理解本文描述的实施方式这一目的,将参考某些实施方式,并且将使用特定语言来描述这些实施方式。本文所使用的术语仅用于描述具体实施方式目的,而不旨在限制本公开的范围。
下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
本发明公开了D1型不育基因orf182及其编码序列,并通过该基因序列设计特异性分子标记可快速高效的从野生稻中筛选鉴定出D1型细胞质用做新D1型细胞质不育系的培育。它通过比较基因组学,鉴定出一个D1型细胞质不育系的线粒体基因组特异序列,基因预测及表达差异分析鉴定出不育相关ORFs,并构建植物转化载体转化保持系验证及不育功能。
为了实现上述目的,本发明涉及以下技术措施:
一、不育候选基因orf182的筛选
以D1-CMS DPA线粒体基因组与分别与已测序的水稻线粒体基因组WA-CMS、LD-CMS、CW-CMS、N、Nipponbare、RT98C比对分析,筛选出D1-CMS线粒体特异序列。通过比较分析,筛选出3个完全为D1-CMS所特异的。以特异序列为探针,Northern Blot杂交检测DPA,DPB及同质恢复系DR7幼穗中的表达模式,发现线粒体特异序列M27在DPA能检测到两条大小分别为2.6kb和1.9kb的转录本,而DPB和DR7几乎检测不到杂交信号,随后对M27序列进行分析,检测到一个开放阅读框(ORFs),编码182个氨基酸,该ORFs由3部分组成,一部分为水稻线粒体序列片段,还有一部分为未知序列,最大一部分序列是与高粱线粒体基因组序列有79%同源的序列(图1)。目前克隆植物雄性不育基因基本都包含一段线粒体功能基因序列或已鉴定未知功能线粒体开放阅读框序列,而orf182未含有任何线粒体功能基因序列或开发阅读框序列。为进一步验证orf182是否能翻译功能蛋白,首先商业化制备了ORF182的单克隆抗体,分别提取DPA和DPB的幼穗和黄化苗的的线粒体总蛋白,western blot结果表明ORF182蛋白只在DPA线粒体中富集,检测到一条20KD左右的条带,而DPB不论是幼穗还是黄化苗都没有检测到杂交信号(图2)。与目前克隆的水稻线粒体不育基因不同是(WA352有3个跨膜结构域,ORF79和ORFH79均有1个跨膜结构域),通过线粒体跨膜结构域预测软件TMHMM(http://www.cbs.dtu.dk/services/TMHMM)预测,发现ORF182没有跨膜结构域(图3)。因此,orf182为一个新型不育候选基因,其核苷酸序列如SEQ ID NO:1所示。
二、不育候选基因orf182的转基因验证
为了验证orf182功能,采用PCR和基因合成的方法构建了一个转基因载体,该载体的启动子为Pubi,依次连接一个ATPγ导肽序列(其核苷酸如SEQ ID NO:5所示),orf182全基因序列和终止密码子为NOS(图4),整合的片段BamHI酶切连接到PCAMBIA1301载体的BamHI位点上(图5),农杆菌介导法转化保持系粤泰B,通过PCR验证,共获得12株T0代阳性苗,花粉育性检测表明有10株为完全无花粉,另外两株有少量的典败花粉,用无花粉型单株与野生型粤泰B回交获得BC1F1群体,后代也分离出无花粉型单株(图6),且符合1:1的遗传分离规律。分别提取转基因和野生型植株的幼穗总蛋白,western blot结果表明ORF182在转基因水稻中能翻译成功能蛋白(图7),因此,orf182为细胞质雄性不育基因。
三、ORF182在细菌中的作用方式
目前报道的不育相关基因编码的蛋白对细菌均具有致死的作用,为了验证ORF182对细菌的毒性,将orf182的编码序列克隆到细菌表达载体PET28a上,转化大肠杆菌,Western blot检测表明,在IPTG诱导下,ORF182在细菌中表达,对比IPTG诱导和无诱导的生长曲线结果发现,ORF182明显抑制细菌生长。同时,我们用氧电极检测耗氧量,发现带有orf182基因的呼吸速率降低了52%。
四、从其它栽培稻和野生稻中扩增orf182基因
根据orf182基因设计特异引物:
orf182F:SEQ ID NO:3所示;
orf182R:SEQ ID NO:4所述。
扩增片段大小为549bp,对520份栽培稻、446份野生稻品种进行PCR扩增检测,PCR程序如下:
表1来自中国的野生稻材料中不育基因orf182等位变异
注:频率为该基因型的野生稻数比总的含182基因的野生稻数。
申请人发现520分栽培稻品种均未扩增出该基因条带,只在18分来自中国的普通野生稻和1份来自中国的杂草稻中扩增出orf182基因条带,把这19份材料扩增出的orf182基因进行测序,共检测到5个SNPs位点,其中有3个导致3个氨基酸的变化,根据氨基酸的变异类型,可分为3个基因型,A1,A2,A3(如表1所示),其中A1的基因型为来源与DPA的orf182一样,A2的分布频率最高,A3的分布频率最低。利用鉴定到含orf182基因的野生稻材料与栽培稻杂交可以创造新的D1型不育系及其相应的恢复系。
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,但本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
SEQUENCE LISTING
<110> 江西省超级水稻研究发展中心
<120> 水稻线粒体不育基因及其应用
<160> 5
<170> PatentIn version 3.3
<210> 1
<211> 549
<212> DNA
<213> Oryza sativa
<400> 1
atgatgagat ttagttcaac ggataagaag gatagaagaa atatgctatt tgctgctatt 60
ccatctattt ggaaattcat ggacaacatt ttttttggtg gacctgggat gactatgcat 120
agcttaccac ttttcgtagt aaagaggctt gccgacactt gcgtgccagg cggcgctttc 180
ctgattgcac ttttgtgcag tctctcttcc acggcaatgg ccgctggtcc atccgactgg 240
atgcggggtg atccaaatga aacactccta cggcagaccg ataagcaaat agagaaggtc 300
aacgaggagt taaggaacgt gacatcccaa gccgtggaaa aagcgcagca gttccagttg 360
aacttgccgg gcacaagtga ggaacaaacg cacaccatcc gttctattct agaacatgat 420
cttgatggta tcgctctgaa tcaacgactt cgacgaatcc gaagatgggt caattctgga 480
gaaatcgaga atccggaaag cctattttgg cttcaaatta ttgaccaatt cagcaagtgg 540
ttcccatga 549
<210> 2
<211> 182
<212> PRT
<213> Oryza sativa
<400> 2
Met Met Arg Phe Ser Ser Thr Asp Lys Lys Asp Arg Arg Asn Met Leu
1 5 10 15
Phe Ala Ala Ile Pro Ser Ile Trp Lys Phe Met Asp Asn Ile Phe Phe
20 25 30
Gly Gly Pro Gly Met Thr Met His Ser Leu Pro Leu Phe Val Val Lys
35 40 45
Arg Leu Ala Asp Thr Cys Val Pro Gly Gly Ala Phe Leu Ile Ala Leu
50 55 60
Leu Cys Ser Leu Ser Ser Thr Ala Met Ala Ala Gly Pro Ser Asp Trp
65 70 75 80
Met Arg Gly Asp Pro Asn Glu Thr Leu Leu Arg Gln Thr Asp Lys Gln
85 90 95
Ile Glu Lys Val Asn Glu Glu Leu Arg Asn Val Thr Ser Gln Ala Val
100 105 110
Glu Lys Ala Gln Gln Phe Gln Leu Asn Leu Pro Gly Thr Ser Glu Glu
115 120 125
Gln Thr His Thr Ile Arg Ser Ile Leu Glu His Asp Leu Asp Gly Ile
130 135 140
Ala Leu Asn Gln Arg Leu Arg Arg Ile Arg Arg Trp Val Asn Ser Gly
145 150 155 160
Glu Ile Glu Asn Pro Glu Ser Leu Phe Trp Leu Gln Ile Ile Asp Gln
165 170 175
Phe Ser Lys Trp Phe Pro
180
<210> 3
<211> 21
<212> DNA
<213> 人工序列
<400> 3
atgatgagat ttagttcaac g 21
<210> 4
<211> 19
<212> DNA
<213> TCATGGGAACCACTTGCTG
<400> 4
tcatgggaac cacttgctg 19
<210> 5
<211> 234
<212> DNA
<213> Arabidopsis thaliana
<400> 5
atggcaatgg ctgttttccg tcgcgaaggg aggcgtctcc tcccttcaat cgccgctcgc 60
ccaatcgctg ctatccgatc tcctctctct tctgaccagg aggaaggact tcttggagtt 120
cgatctatct caactcaagt ggtgcgtaac cgcatgaaga gtgttaagaa catccaaaag 180
atcacaaagg caatgaagat ggttgctgct tccaagctta gagcagttca aggc 234
- 还没有人留言评论。精彩留言会获得点赞!