抑制Kdm6a基因表达的siRNA及其应用的制作方法
本发明涉及生物技术和医学领域,具体地说,是一种抗炎的针对Kdm6a的RNA干扰药物。本发明提供一组针对Kdm6a的表达及功能的干扰RNA的核苷酸序列,具有靶向Kdm6a基因表达及抗炎功能。本发明还公开了将该RNA干扰药物用于抵抗感染、治疗因感染导致的慢性炎症性疾病的策略。
背景技术:
Kdm6a(赖氨酸特异性去甲基化酶6a,Lysine-specific deMethylase 6a,Kdm6a)又名UTX,可以特异性去除H3K27me2/3的甲基基团,发挥H3K27去甲基化酶活性(Lee,MG.等,Science 318,447-450(2007))。该分子拥有高度保守的同源的C末端结构域即JMJC结构域,也是其酶活性结构域,主要发挥组蛋白去甲基化活性。该分子的N末端包含了6个重复序列的TPR结构域,主要发挥蛋白蛋白相互作用的功能。Kdm6a基因定位于X染色体,但是却不受X染色体失活的影响,在细胞和机体内广泛表达(Agger,K.等,Nature 449,731-734(2007))。
Kdm6a是H3K4甲基化转移酶复合体MLL2的组成部分,可以通过调控HOX基因来控制机体的状态(Cho,Y.W.等,J Biol Chem 282,20395-20406(2007);Issaeva,I.等,Mol Cell Biol 27,1889-1903(2007))。在多能细胞中,HOX基因大多保持沉默,并且以连续的高水平的H3K27me3为标志。随着机体的分化发育,Kdm6a被招募到HOX基因的启动子区,并且与MLL一起改变该基因启动子区的组蛋白修饰状态,使其H3K27甲基化水平降低,而H3K4甲基化水平增加,促进基因的表达(Agger,K.等,Nature 449,731-734(2007))。Kdm6a基因敲除的实验研究揭示了Kdm6a在多种生长发育过程中发挥重要作用。例如造血系统的生成和心血管的发育(Lee,S.等,Developmental cell 22,25-37(2012);Seenundun,S.等,EMBO J 29,1401-1411(2010);Shpargel,K.B.等,PLoS Genet 8,e1002964(2012);Thieme,S.等,Blood 121,2462-2473(2013);Wang,A.H.等,EMBO J 32,1075-1086(2013);Wang,C.等,Proc Natl Acad Sci U S A109,15324-15329(2012);Welstead,G.G.等,Proc Natl Acad Sci U S A 109,13004-13009(2012))。即在胚胎干细胞的分化发育过程中,Kdm6a对于外胚层和中胚层的分化是必需的(Morales Torres,C.等,PloS one 8,e60020(2013))。在小鼠造血祖细胞系EML中特异性敲除Kdm6a可以影响集落形成的能力,在原代小鼠骨髓细胞中特异性敲除Kdm6a可以通过调控关键基因MLL1、RUNX1和SCL的启动子区的H3K27me3水平而影响这些基因的表达,在白血病细胞系中特异性敲除Kdm6a可以影响细胞的增殖(Liu,J.等,Exp Hematol 40,487-498 e483(2012))。在心肌分化条件下,敲除了Kdm6a的胚胎干细胞分化的心肌细胞不能诱发心脏节律性收缩,并且Kdm6a缺陷的小鼠可以发生严重的心脏缺陷和胚胎致死(Lee,S.等,Developmental cell 22,25-37(2012))。同时,也有实验小组开展了Kdm6a的过表达研究,一系列的研究报道Kdm6a可以作为一些特异性疾病的潜在治疗靶点。2009年,由于Kdm6a的H3K27me2/3去甲基化功能,Kdm6a被作为抑癌基因在多种肿瘤中发挥作用,例如多发性骨髓瘤、食道癌和肾癌(Van Haaften,G.等,Nat Genet 41,521-523(2009))。除此之外,Kdm6a和jmjd3在正常和恶性化的T细胞中通过与包含BRG1的SWI/SNF染色体重塑复合物相互作用发挥组蛋白去甲基化非依赖的功能(Miller,S.A.等,Mol Cell 40,594-605(2010))。2012年,人们发现Kdm6a特定位点的功能缺失体可以导致遗传性疾病Kabuki综合征的发生(Miyake,N.等,Hum Mutat 34,108-110(2013))。
Kdm6a作为重要的表观修饰酶可以特异性去除H3K27me2/3的甲基化,在个体的分化、发育以及肿瘤组织的发生、发展过程中发挥着重要作用,然而在免疫系统中的功能受到的关注非常少。
RNA干扰(RNA interference,RNAi)是新近发展起来的一种封闭基因表达的有效方法。它采用与目的基因同源的21-23核苷酸长的干扰RNA(small interfering RNA,siRNA)转染至靶细胞,与细胞内的内切酶形成诱导沉默复合体(RISC),RISC以siRNA为模板特异的识别其同源基因mRNA并对其进行递进式进行剪切,形成强有效的瀑布效应,诱导序列特异性的mRNA降解,细胞表现特定基因的缺陷表型。该策略可以将癌症基因关闭,而仅有一个碱基突变则丧失RNA干扰作用,对正常细胞影响甚微,特异性强。
技术实现要素:
本发明所要解决的技术问题是提供一种抗炎的RNA干扰药物,采用RNAi技术,在mRNA水平针对Kdm6a基因,对表达Kdm6a的细胞的生物学行为进行干预,能有效抑制Kdm6a的表达。
为了解决上述技术问题,本发明采用的技术方案如下:
本发明的第一方面,提供一种抑制Kdm6a基因表达的siRNA,所述的siRNA选自si-Kdm6a1、si-Kdm6a2或si-Kdm6a3中的一种;
所述的si-Kdm6a1包括正义链SEQ ID NO.1和反义链SEQ ID NO.2;
所述的si-Kdm6a2包括正义链SEQ ID NO.3和反义链SEQ ID NO.4;
所述的si-Kdm6a3包括正义链SEQ ID NO.5和反义链SEQ ID NO.6。
其碱基序列和作用部位分别如下:
si-Kdm6a1:
SEQ ID No.1:5’-GCAUUUCAGUGGGCUAUUA-3’(+778-+796位)
SEQ ID No.2:3’-CGUAAAGUCACCCGAUAAU-5’
si-Kdm6a2:
SEQ ID No.3:5’-GCAGAUACAUGGUGUUCAA-3’(+1297-+1315位)
SEQ ID No.4:3’-CGUCUAUGUACCACAAGUU-5’
si-Kdm6a3:
SEQ ID No.5:5’-GCACCCACUCUACCUCAUA-3’(+2179-+2197位)
SEQ ID No.6:3’-CGUGGGUGAGAUGGAGUAU-5’。
所述的siRNA序列可以通过直接的化学合成、体外转录、质粒扩增、病毒复制等方式获得,因此本发明应包括包含所述序列的前述应用形式。
所述的siRNA序列可以采用合成的方式形成3’端含有2-4个dT或含有2-6个U的延伸结构的小双链RNA。
本发明所选用的siRNA序列是针对Kdm6a及其表达蛋白进行靶点治疗,具有靶向Kdm6a基因表达及抗炎功能,是针对Kdm6a基因mRNA不同位点选取的3段siRNA序列,称之为si-Kdm6a1、si-Kdm6a2和si-Kdm6a3。另设无关对照序列作为阴性对照(正义链SEQ ID No.7、反义链SEQ ID No.8)。
本发明所用的小鼠腹腔巨噬细胞是阳性表达Kdm6a的原代细胞。细胞接种于含10%的小牛血清的RPMI1640(Invitrogen公司)培养液,置于37摄氏度、体积分数为5%的CO2培养箱中常规培养12-24小时。优化转染条件,分别为si-Kdm6a1(正义链SEQ ID No.1、反义链SEQ ID No.2)、si-Kdm6a2(正义链SEQ ID No.3、反义链SEQ ID No.4)、si-Kdm6a3(正义链SEQ ID No.5、反义链SEQ ID No.6)和无关阴性对照(正义链SEQ ID No.7、反义链SEQ IDNo.8)以20nM的终浓度加入细胞培养液,于孵育后24~48小时收获细胞进行检测。
本发明从mRNA和蛋白质水平二个层次来检测si-Kdm6a1、si-Kdm6a2和si-Kdm6a3抑制Kdm6a基因表达。mRNA的检测采用RT-PCR和Q-PCR定量分析。技术路线:1)RT-PCR:按TRIzol总RNA提抽试剂盒提取总RNA。电泳鉴定RNA的质量,紫外光分光光度计定量。取总RNA1ug,加入20ul逆转录反应体系,用逆转录试剂盒(购自于TOYOBO公司),按说明书操作进行逆转录。Q-PCR反应体系按常规(试剂购自TOYOBO公司)。循环条件:95℃变性15秒,58℃退火15秒,72℃延伸20秒,最后延伸10分钟。另以β-actin的扩增产物为内参对照。Kdm6a蛋白表达水平的检测采用Western blot技术检测Kdm6a的表达。收集48h的各组细胞,制备细胞裂解液,用Kdm6a多抗进行Western blot检测。也可以采用免疫荧光标记和免疫组织化学技术等方法检测Kdm6a蛋白水平的表达
RNA干扰技术是目前高特异性的有效技术,因此无论是在功能基因组研究,还是基因治疗方面均具有广阔地应用前景。本发明根据Cenix等的siRNA user guide设计原则,针对Kdm6a基因不同靶位点设计了3条siRNA序列,用以抑制Kdm6a的表达。本发明证实Kdm6a的siRNA可望成为治疗炎性疾病的有效手段。本发明的siRNA可以单独使用或几条siRNA联合,还可以与其它药物和治疗手段联合,用于炎性疾病的治疗。
上述siRNA序列的给药途径可采用:直接裸DNA注射法、脂质体包裹DNA直接注射法、金包被DNA基因枪轰击法、繁殖缺陷细菌携带质粒DNA法以及复制缺陷腺病毒携带目的DNA法中的一种,其中:
1、直接裸DNA注射法
(1)新喷气注射系统释放裸DNA治疗序列,可以采用一种新的喷气注射系统,将裸DNA释放到体内的炎性部位中。沃尔瑟(W.Walter)博士和同事开发了一种便携的“高速喷气注射器”系统,在病毒媒介和脂质体基因释放系统之外提供了又一选择。
(2)裸DNA直接注射:将裸质粒DNA直接注射到机体的肌肉、皮内、皮下、粘膜、静脉内。这种方法简单易行。
2、脂质体包裹DNA直接注射法:包裹DNA的脂质体能与组织细胞发生膜融合,而将DNA摄入,减少了核酸酶对DNA的破坏。注射途径同裸DNA直接注射。
3、金包被DNA基因枪轰击法:将质粒DNA包被在金微粒子表面,用基因枪使包被DNA的金微粒子高速穿入组织细胞。
4、繁殖缺陷细菌携带质粒DNA法:选择一种容易进入某组织器官的细菌,将其繁殖基因去掉,然后用质粒DNA转为细菌,当这些细菌进入某组织器官后,由于不能繁殖,则自身裂解而释放质粒DNA。即:可口服的减毒沙门氏菌。
5、复制缺陷腺病毒携带目的DNA法:选择一种容易进入某组织器官的复制缺陷型腺病毒,携带目的RNA干扰序列,可以通过肌肉、皮内、皮下、粘膜、静脉内等途径在宿主体内表达目的RNA干扰序列。
本发明的第二方面,提供上述抑制Kdm6a基因表达的siRNA在制备抗炎药物中的应用。
本发明的第三方面,提供上述抑制Kdm6a基因表达的siRNA在制备抵抗感染或治疗因感染导致的慢性炎症性疾病的药物中的应用。
本发明的第四方面,提供一种针对Kdm6a的RNA干扰药物,所述的RNA干扰药物包括上述的si-Kdm6a1、si-Kdm6a2或si-Kdm6a3中的任意一种或两种以上的组合。
优选的,所述的RNA干扰药物还包括药学上可接受的载体,所述的药学上可接受的载体为药学上可接受的赋形剂,悬浮剂,填充剂和/或稀释剂。
本发明的第五方面,提供上述的针对Kdm6a的RNA干扰药物在制备抗炎药物中的应用。
本发明的第六方面,提供上述的针对Kdm6a的RNA干扰药物在制备抵抗感染或治疗因感染导致的慢性炎症性疾病的药物中的应用。
本发明优点在于:
本发明采用RNAi技术,在mRNA水平针对Kdm6a基因的siRNA对阳性表达Kdm6a的细胞的生物学行为进行逆转,实验证明抑制Kdm6a的表达可以降低炎症因子的水平,本发明研制的siRNA能有效抑制Kdm6a的表达,为RNAi技术应用于抗炎治疗提供了实验证据和有效新药。
附图说明
图1:Kdm6a siRNA干扰Kdm6a表达后Kdm6a在mRNA水平表达的分析。
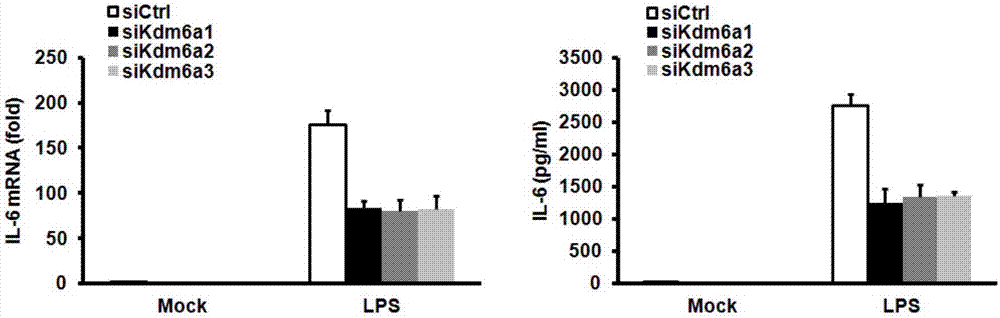
图2:干扰Kdm6a表达对巨噬细胞IL-6产生的抑制作用。
具体实施方式
下面结合实施例对本发明提供的具体实施方式作详细说明。以下列举部分实施例用于对本发明的进一步说明,但不限制本发明。
实施例1:Kdm6a siRNA干扰Kdm6a表达后Kdm6a在mRNA水平表达的分析
腹腔注射3%的脱水硫羟乙酸培养基2ml,4天后,颈椎脱臼法处死小鼠,75%酒精浸泡5-10分钟,小鼠腹部朝上,在腹中线剪开一小口,撕开皮肤,完全暴露腹膜。然后用20ml注射器注入10ml无血清1640培养基,针尖于腹膜下至腹腔则边,且针尖朝上,避开肠子和脂肪,缓慢抽吸,此时,腹腔灌洗液即含有大量巨噬细胞。将收集的腹腔液放于50ml的离心管。重复此步骤一次,共20ml。细胞悬液800g离心5分钟,弃上清,用含有10%FCS的DMEM重悬。细胞悬液置入培养板,37℃培养1小时后换液,贴壁细胞即为新鲜分离的小鼠腹腔巨噬细胞。
分别将si-Kdm6a1(正义链SEQ ID No.1、反义链SEQ ID No.2)、si-Kdm6a2(正义链SEQ ID No.3、反义链SEQ ID No.4)和si-Kdm6a3(正义链SEQ ID No.5、反义链SEQ ID No.6)以转染试剂INTERFERin(Invitrogen公司)瞬时转染小鼠巨噬细胞,48h收取细胞,提取总RNA,进行RT-PCR分析。同时设无关阴性对照si-Control(正义链SEQ ID No.7、反义链SEQ ID No.8)。
SEQ ID No.7:5’-UUCUCCGAACGUGUCACGU-3’
SEQ ID No.8:3’-AAGAGGCUUGCACAGUGCA-5’
所有SiRNA序列均由上海吉凯生物工程公司合成。
所用的Kdm6a引物(由上海生工生物工程公司合成)为:
5’-AAGGCTGTTCGCTGCTACG-3’(SEQ ID No.9)和
5’-GGATCGACATAAAGCACCTCC-3’(SEQ ID No.10)。
β-actin引物为:
5’-AGTGTGACGTTGACATCCGT-3’(SEQ ID No.11)和
5’-GCAGCTCAGTAACAGTCCGC-3’(SEQ ID No.12)。
结果显示,细胞经siRNA处理48h后检测,与阴性对照组相比,si-Kdm6a1、si-Kdm6a2和si-Kdm6a3组的Kdm6a mRNA表达明显下降,表明si-Kdm6a1、si-Kdm6a2和si-Kdm6a3转染成功阻抑了Kdm6a的表达,而的阴性对照siRNA寡核苷酸si-Control对Kdm6a的表达没有影响(图1)。
实施例2:干扰Kdm6a表达对巨噬细胞IL-6产生的抑制作用
分别将si-Kdm6a1(正义链SEQ ID No.1、反义链SEQ ID No.2)、si-Kdm6a2(正义链SEQ ID No.3、反义链SEQ ID No.4)和si-Kdm6a3(正义链SEQ ID No.5、反义链SEQ ID No.6)以转染试剂INTERFERin(Invitrogen公司)瞬时转染小鼠巨噬细胞,48h收取细胞,以100ng/ml LPS(又称脂多糖,为TLR4的配体,购自Sigma公司)处理不同时间后,收集细胞和培养上清,制备cDNA用于定量RT-PCR检测IL-6mRNA水平;或者用培养上清通过ELISA(所用试剂盒购自R&D公司)检测IL-6蛋白水平。
IL-6mRNA的定量RT-PCR分析和ELISA分析的结果如图2所示。结果显示:干扰Kdm6a在小鼠巨噬细胞的表达对IL-6产生起抑制作用。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
SEQUENCE LISTING
<110> 中国人民解放军第二军医大学
<120> 抑制Kdm6a基因表达的siRNA及其应用
<130> /
<160> 12
<170> PatentIn version 3.3
<210> 1
<211> 19
<212> RNA
<213> 人工序列
<400> 1
gcauuucagu gggcuauua 19
<210> 2
<211> 19
<212> RNA
<213> 人工序列
<400> 2
cguaaaguca cccgauaau 19
<210> 3
<211> 19
<212> RNA
<213> 人工序列
<400> 3
gcagauacau gguguucaa 19
<210> 4
<211> 19
<212> RNA
<213> 人工序列
<400> 4
cgucuaugua ccacaaguu 19
<210> 5
<211> 19
<212> RNA
<213> 人工序列
<400> 5
gcacccacuc uaccucaua 19
<210> 6
<211> 19
<212> RNA
<213> 人工序列
<400> 6
cgugggugag auggaguau 19
<210> 7
<211> 19
<212> RNA
<213> 人工序列
<400> 7
uucuccgaac gugucacgu 19
<210> 8
<211> 19
<212> RNA
<213> 人工序列
<400> 8
aagaggcuug cacagugca 19
<210> 9
<211> 19
<212> DNA
<213> 人工序列
<400> 9
aaggctgttc gctgctacg 19
<210> 10
<211> 21
<212> DNA
<213> 人工序列
<400> 10
ggatcgacat aaagcacctc c 21
<210> 11
<211> 20
<212> DNA
<213> 人工序列
<400> 11
agtgtgacgt tgacatccgt 20
<210> 12
<211> 20
<212> DNA
<213> 人工序列
<400> 12
gcagctcagt aacagtccgc 20
- 还没有人留言评论。精彩留言会获得点赞!
- 一种利用短单链DNA抑制昆虫基因表达的方法与流程
- 特异性抑制Eya2基因表达的siRNA及其重组载体和应用的制作方法与工艺
- 抑制罗汉果CAS基因表达的方法与流程
- 特异性抑制CLDN8基因表达的siRNA及其重组载体和应用的制作方法与工艺
- 抑制小鼠促性腺激素抑制激素基因表达的siRNA及其应用的制作方法与工艺
- 一种抑制梨种子赤霉素合成基因表达的方法与流程
- KPNA2基因的应用和抑制KPNA2基因表达的siRNA的应用的制造方法与工艺
- 特异性抑制PADI2基因表达的siRNA及其重组载体和应用的制造方法与工艺
- 一种高效表达小鼠促性腺激素抑制激素基因的慢病毒载体及其应用的制造方法与工艺
- 一种抑制人黑色素瘤RBM3基因表达的siRNA及其质粒载体的制造方法与工艺
- 大豆低温诱导人工合成启动子SP5及应用的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及gnd基因的表达载体的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及lrp基因的表达载体的制造方法与工艺
- 一种二值卷积神经网络处理器及其使用方法与流程
- 检测NUP214‑ABL1基因相对表达量的试剂盒和方法与流程
- 环介导的级联放大策略用于高灵敏检测DNA甲基转移酶活性的制造方法与工艺
- 一种基于高压静电场来促进作物优质高效安全生产的嫁接方法与流程
- 一种酶性DNA机器用于miRNA检测的方法与流程
- 转基因玉米MON87403品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 葡萄早熟基因VvWRKY13在调控植物中乙烯生物合成中的应用的制造方法与工艺