一种高间苯三酚合成能力的基因工程菌及构建方法和应用与流程
本发明涉基因工程及发酵工程领域。
背景技术:
间苯三酚又名1,3,5-三羟基苯、均苯三酚,是一种重要的精细化工产品,是合成黄酮、异黄酮类药物的中间体,间苯三酚本身可作为一种优良的平滑肌解痉药物,广泛应用于临床。间苯三酚还能抑制过氧化物酶活性,具有抗炎抗氧化作用,它可催化h2o2分解为分子氧和水,是一种重要的抗氧化酶。此外,间苯三酚还是一种性能优越的抗养护剂、稳定剂、燃料偶合剂、轮胎增粘剂等,具有广阔的市场需求。目前,间苯三酚的工业化生产方法主要为化学合成法,包括三硝基甲苯(tnt)法、异丙基苯法、氯代苯法和苯胺法。化学合成法存在多种弊端,如原料来源困难、副产物较多、分离提纯困难、环境污染严重等。以微生物发酵生产间苯三酚,可以克服化学法的多种弊端,并且生物法合成间苯三酚周期短,安全环保。
异源表达荧光假单胞菌聚酮合成酶基因phld可以合成间苯三酚(jihaneachkar,moxian,huiminzhao,j.w.frost.biosynthesisofphloroglucinol[j].journaloftheamericanchemicalsociety,2005,127(15):5332-5333.;wenjuanzha,sherylb.rubin-pitel,huiminzhao.characterizationofthesubstratespecificityofphld,atypeiiipolyketidesynthasefrompseudomonasfluorescens[j].journalofbiologicalchemistry,2006,281(42):32036-32047.)。在此基础上表达多重抗性激活因子mara,增强大肠杆菌对间苯三酚的耐受性,表达大肠杆菌自身的乙酰coa羧化酶基因(accase),细胞内丙二酸单酰coa的水平为原始菌株的3.6倍(yujincao,xinglinjiang,rubingzhang,moxian.improvedphloroglucinolproductionbymetabolicallyengineeredescherichiacoli[j].applmicrobiolbiotechnol,2011,91:1545–1552.)。然而,上述间苯三酚合成工程菌的产量还比较低,离实际应用的要求尚有一定差距,难以满足工业生产的需求。原因之一在于:间苯三酚作为一种酚类物质,本身就是一种优良的杀菌剂,对大肠杆菌的正常生长具有严重的抑制作用,由于间苯三酚抑制了大肠杆菌的生长,导致其合成产量无法提升。因此,我们需要进一步对工程菌株进行基因改造,以期提高间苯三酚的合成能力。groesl是大肠杆菌内重要的热激分子伴侣蛋白,该调节因子对间苯三酚发酵生产的影响暂无报道。
技术实现要素:
为了解决目标产物间苯三酚本身作为一种酚类物质具有杀菌作用,抑制大肠杆菌正常生长从而降低其自身产量的问题,本发明的一个目的在于提供一种高间苯三酚合成能力的基因工程菌及其构建方法,该方法是为了增强大肠杆菌对间苯三酚的耐受性,降低间苯三酚对大肠杆菌正常生长的抑制作用,进而提高大肠杆菌合成间苯三酚产量。具体步骤为:
1)制备含有分子伴侣蛋白groesl基因的重组质粒;
2)制备含有聚酮合成酶基因phld、多重抗性激活因子mara、乙酰coa羧化酶基因accase的重组质粒;
3)将步骤1)和步骤2)所得重组质粒导入到感受态细胞中,获得重组菌株。
步骤1)所述分子伴侣蛋白groesl基因来源于细菌,为groes蛋白和groel蛋白的基因或者与groes蛋白和groel蛋白的基因同源性超过70%的基因。
或者,步骤1)所述分子伴侣蛋白groesl基因并非来源于细菌,为与groes蛋白和groel蛋白的基因没有明显同源性,但与groes蛋白和groel蛋白的基因具有相同或相似功能的基因。
步骤2)所述聚酮合成酶基因phld,来源于荧光假单胞菌;所述多重抗性激活因子mara,来源于大肠杆菌;所述乙酰coa羧化酶基因accase,来源于大肠杆菌。
步骤2)所述聚酮合成酶基因phld,genebankid为11830552;所述多重抗性激活因子mara,genebankid为6060688;所述乙酰coa羧化酶基因accase,其中,亚基acca的genebankid为6062185,亚基accb的genebankid为6058890,亚基accc的genebankid为6058863,亚基accd的genebankid为6059083。
步骤3)所述感受态菌株,是大肠杆菌e.colibl21(de3)的感受态菌株。
优选的,本发明提供的高间苯三酚合成能力的基因工程菌的构建方法具体为:
1)将分子伴侣蛋白groesl基因连接到载体pet28a(+)上,获得重组质粒pet-groesl;
所述分子伴侣蛋白groesl的基因为groes和groel,来源于大肠杆菌,groesgenebankid:948655,groelgenebankid:948665。
2)将聚酮合成酶基因phld、多重抗性激活因子mara和乙酰coa羧化酶基因accase连接到载体pacyc上,获得重组质粒pacyc-phld/mara/accadbc;
所述聚酮合成酶基因phld,来源于荧光假单胞菌,genebankid:11830552;所述多重抗性激活因子mara,来源于大肠杆菌,genebankid:6060688;所述乙酰coa羧化酶基因accase,来源于大肠杆菌,其中,亚基acca的genebankid:6062185,亚基accb的genebankid:6058890,亚基accc的genebankid:6058863,亚基accd的genebankid:6059083;
3)再将步骤1)和步骤2)所得的重组质粒pet-groesl和pacyc-phld/mara/accadbc导入到感受态细胞e.colibl21(de3)中获得重组菌株。
本发明的另一个目的为,提供一种高间苯三酚合成能力的基因工程菌,该基因工程菌包含含有分子伴侣蛋白groesl基因的重组质粒和含有聚酮合成酶基因phld、多重抗性激活因子mara、乙酰coa羧化酶基因accase的重组质粒。
另外,本发明还提供利用上述基因工程菌生产间苯三酚的方法,具体步骤如下:
1)基因工程菌种子液按照接种量为培养基体积的1%-5%接种于培养基,培养温度为30-37℃,搅拌速度为300-800rpm,ph6.0-8.0,溶氧18%以上的条件下培养至od600为8-12,然后加入诱导剂iptg至终浓度0.1-1mmol/l,以40-80%的葡萄糖为底物继续分批补料发酵12-24h后结束培养;
2)将步骤1)得到的培养液进行离心取上清,上清采用等体积的乙酸乙酯萃取1-3次;
3)合并2)中所述萃取产物,减压蒸馏浓缩,所得固体粉末即为间苯三酚。
本发明具有以下优点:
groesl是大肠杆菌内重要的热激分子伴侣蛋白,该调节因子对间苯三酚发酵生产的影响暂无报道。本发明在大肠杆菌中过量表达了热激分子伴侣蛋白groesl基因,所得基因工程菌间苯三酚合成能力大大提高,分批补料发酵时每升发酵液间苯三酚产量可达到4.97-5.91g,较仅包含质粒pacyc-phld/mara/accadbc的菌株提高到1.5倍,该方法为间苯三酚生物合成的工业化应用打下了坚实的基础。
定义和缩写
在本文中使用下列的缩写或简称:
间苯三酚(phloroglucinol):pg
异丙基硫代半乳糖苷:iptg
分子伴侣蛋白基因:groesl
聚酮合成酶基因:phld
多重抗性激活因子:mara
乙酰coa羧化酶基因:accase
大肠埃希氏杆菌(escherichiacoli):e.coli
“基因型”指某一生物个体全部基因组合的总称,是该生物的细胞内所包含的、特有的那组基因。
“过量表达”或“过表达”指细胞内特定基因受到各种信号调控后,在生物体中超过原有水平表达,可以通过增强内源表达或引入外源基因来实现。
附图说明
图1pet-groesl重组质粒结构示意图;
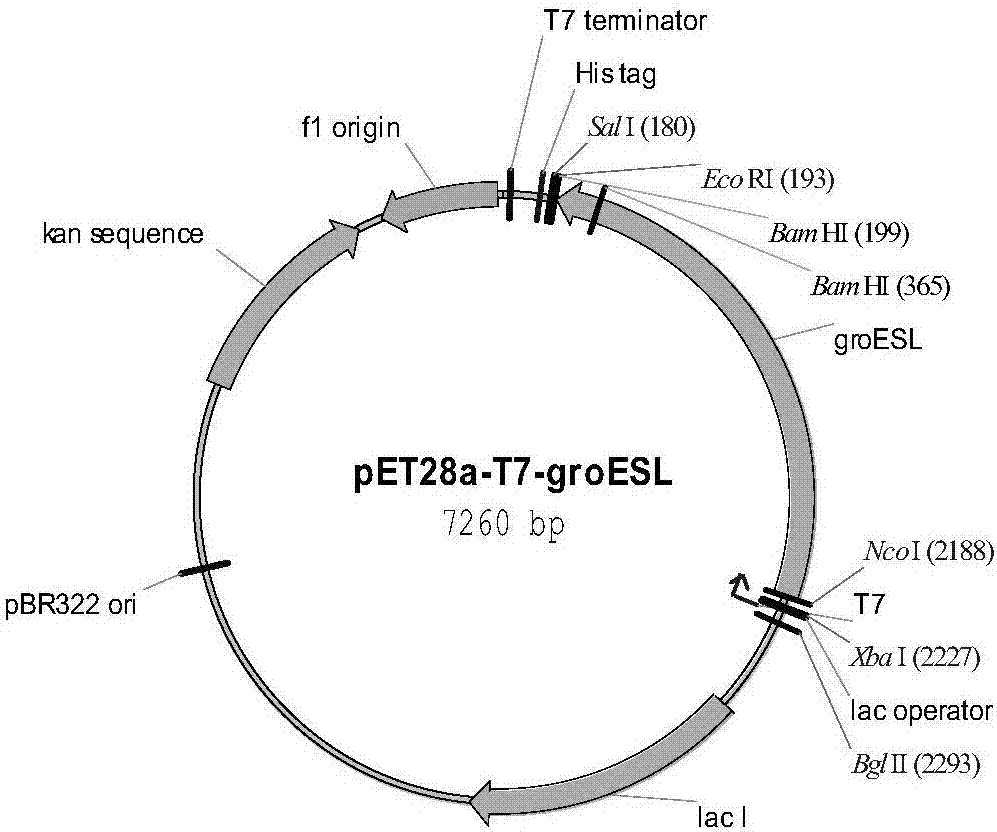
图2pet-t7-groesl重组质粒结构示意图;
图3pacyc-phld/mara/accadbc重组质粒示意图。
具体实施方式
下面通过实例来详细阐明本发明。但本发明并不限于以下实施例。
下述实施例中所涉及的实验方法若无特殊说明,均为常规技术。
下述实施例中所使用的材料、试剂等若无特殊说明,均可从商业途径获得。
所用限制性内切酶及t4dna连接酶均购自mbifermentas公司,质粒提取及胶回收所用试剂盒购自美国omega公司,操作步骤按照产品说明书进行;所有培养基如无特别说明均用去离子水配制。
培养基配方:
1)种子液培养基
lb培养基:酵母粉5g/l,nacl10g/l,蛋白胨10g/l,接种时补加卡那霉素50μg/ml,氯霉素50μg/ml。
m9培养基:nh4cl1.0g/l,na2hpo4·12h2o15.2g/l,kh2po43.0g/l,nacl0.5g/l,葡萄糖20g/l,mgso4·7h2o0.4g/l,1000×微量元素((nh4)6mo7o24·4h2o3.7g/l;znso4·7h2o2.9g/l;h3bo324.7g/l;cuso4·5h2o2.5g/l;mncl2·4h2o15.8g/l),接种时补加卡那霉素50μg/ml,氯霉素50μg/ml。
2)发酵培养基
k2hpo4·3h2o9.8g/l,citricacid·h2o2.1g/l,柠檬酸铁铵0.3g/l,(nh4)2so43.0g/l,葡萄糖20g/l,mgso4·7h2o0.4g/l,1000×微量元素((nh4)6mo7o24·4h2o3.7g/l;znso4·7h2o2.9g/l;h3bo324.7g/l;cuso4·5h2o2.5g/l;mncl2·4h2o15.8g/l),卡那霉素50μg/ml,氯霉素50μg/ml。
其中:k2hpo4·3h2o9.8g/l,citricacid·h2o2.1g/l,柠檬酸铁铵0.3g/l,(nh4)2so43.0g/l混合后调至ph7.0,121℃,20min高压蒸气灭菌。葡萄糖储液为500g/l,115℃,20min单独灭菌,mgso4·7h2o储液为200g/l,121℃,20min单独灭菌,1000×微量元素采用0.22μm滤菌膜过滤除菌,转接种子液时分别补加上述单独除菌的葡萄糖、mgso4·7h2o、1000×微量元素储液及抗生素。
实施例1
构建分子伴侣蛋白(groesl)的表达载体,具体过程如下:
以寡核苷酸5’-gaagatctgggttgatgtccgattgcgcccaaa-3’和5’-ggaattcttacatcatgccgcccatgccacccat-3’为引物,以大肠杆菌k-12[escherichiacolik-12]基因组dna为模版,采用大肠杆菌groesl基因自身的操纵调控原件,用聚合酶链式反应(pcr)方法扩增出groesl基因,并在5’端和3’端分别引入bglii和ecori位点,然后用上述酶切位点将此基因克隆到pet28a(+)(novagen)载体上,得到重组质粒pet-groesl。
构建聚烯酮酐合成酶(phld)、多重抗性因子(mara)和乙酰辅酶a羧化酶(accase)共表达的载体,具体过程如下:
以寡核苷酸5’-ataagaatgcggccgctcgatctcgatcccgcgaaat-3’和5’-atcgcttaagctagctgttgtaatgatttaatggatg-3’为引物,以原有质粒pet-phld/mara为模版,用聚合酶链式反应(pcr)方法扩增出聚烯酮酐合成酶基因(phld)和多重抗性基因基因(mara),并在5’端和3’端分别引入noti和aflii位点,然后用上述酶切位点将此基因克隆到原有质粒pacyc-accadbc上,得到重组质粒pacyc-phld/mara/accadbc。
pcr反应体系:
pcr扩增程序:
酶切体系:
酶切程序:37℃,60min。
按照takara感受态制备试剂盒的操作步骤制备e.colibl21(de3)的感受态细胞,将两种重组质粒pet-groesl和pacyc-phld/mara/accadbc通过热激法共同转化至上述制备的感受态细胞;将质粒pacyc-phld/mara/accadbc通过热激法转入上述制备的感受态细胞,形成对照菌株。
实施例2
构建分子伴侣蛋白(groesl)的表达载体,具体过程如下:
以寡核苷酸5’-catgccatgggcaatattcgtccattgcatgatcgcgt-3’和5’-ggaattcttacatcatgccgcccatgccacccat-3’为引物,以大肠杆菌k-12[escherichiacolik-12]基因组dna为模版,用聚合酶链式反应(pcr)方法扩增出groesl基因,并在5’端和3’端分别引入bglii和ecori位点,然后用上述酶切位点将此基因克隆到pet28a(+)(novagen)载体上,得到重组质粒pet-t7-groesl。
构建聚烯酮酐合成酶(phld)、多重抗性因子(mara)和乙酰辅酶a羧化酶(accase)共表达的载体,具体过程如下:
以寡核苷酸5’-ataagaatgcggccgctcgatctcgatcccgcgaaat-3’和5’-atcgcttaagctagctgttgtaatgatttaatggatg-3’为引物,以原有质粒pet-phld/mara为模版,用聚合酶链式反应(pcr)方法扩增出聚烯酮酐合成酶基因(phld)和多重抗性基因基因(mara),并在5’端和3’端分别引入noti和aflii位点,然后用上述酶切位点将此基因克隆到原有质粒pacyc-accadbc上,得到重组质粒pacyc-phld/mara/accadbc。pcr和酶切的体系与程序同实施例1。
按照takara感受态制备试剂盒的操作步骤制备e.colibl21(de3)的感受态细胞,将两种重组质粒pet-t7-groesl和pacyc-phld/mara/accadbc通过热激法共同转化至上述制备的感受态细胞;将质粒pacyc-phld/mara/accadbc通过热激法转入上述制备的感受态细胞,形成对照菌株。
实施例3
用构建好的工程大肠杆菌菌株发酵生产间苯三酚,其步骤如下:
1、摇瓶发酵实验
1)一级种子液的培养:在lb种子液培养基中接种固体lb平板上的实施例1制备得到的重组菌株单菌落,并加入终浓度为50μg/ml卡那霉素和34μg/ml氯霉素,37℃生长8-12h;在lb种子液培养基中接种固体lb平板上的实施例1制备得到对照菌株单菌落,加入终浓度34μg/ml氯霉素,37℃生长8-12h。
2)将步骤1)得到的一级种子液分别按1%(wt)接种量转接至250ml发酵摇瓶中,含50ml发酵培养基,转接种子液时各补加200g/l的mgso4.7h2o100μl、500g/l葡萄糖2ml、1000×微量元素50μl、终浓度50μg/ml卡那霉素(对照菌株不加卡那霉素)、终浓度50μg/ml氯霉素,每种菌株设定3个平行对照,37℃、180rpm培养。
3)细胞od600达到0.6-1.0间加入终浓度100μmol/l的iptg诱导。
4)iptg诱导后,37℃、180rpm继续培养24h后收集菌液,离心取上清,测定间苯三酚含量。
2、分批补料发酵实验
1)一级种子液的培养:重复上述步骤1、1)。
2)二级种子液的培养,将步骤1)得到的一级种子液分别按3%(wt)接种量转接至250ml三角瓶中,含50mlm9培养基,转接种子液时各补加200g/lmgso4.7h2o100μl、500g/l葡萄糖2ml、1000×微量元素50μl、终浓度50μg/ml卡那霉素、终浓度50μg/ml氯霉素,37℃、180rpm培养8-12h。
3)将步骤2)得到的二级种子液分别按1%(wt)接种量转接至5l发酵罐中,含2l发酵培养基中进行发酵,培养温度37℃、搅拌速度300-800rpm、ph6.5-7.5和溶氧18%以上的条件下培养至od600约为12,加入诱导剂iptg至终浓度100μmol/l,50%-80%葡萄糖储液继续补料发酵24小时,离心取上清,测定间苯三酚含量。
3、间苯三酚的含量检测
间苯三酚(pg)浓度测定:肉桂醛显色法。
采用反weisner检测法(wenjuanzha,sherylb.rubin-pitel,huiminzhao.exploitinggeneticdiversitybydirectedevolution:molecularbreedingoftypeiiipolyketidesynthasesimprovesproductivity[j].molecularbiosystems,2008,4(3):246-248.)测定发酵液中间苯三酚的含量,其原理是根据间苯三酚与肉桂醛的显色反应,具体步骤如下:
1)配制10mg/l的肉桂醛显色液(肉桂醛直接溶解于体积比1:3的浓盐酸/乙醇溶液中)。
2)向1.5ml离心管中加入1ml肉桂醛显色液,再加入5μl发酵液上清,颠倒混匀,室温放置15min。
3)用10mm光径比色杯读取od446值,od446值在2h内稳定;
4)绘制间苯三酚标准曲线,根据标准曲线计算间苯三酚含量。
根据本实施例操作步骤,摇瓶水平,含有单质粒pacyc-phld/mara/accadbc的对照菌株pg产量为0.70g/l,含有两种重组质粒pet-groesl和pacyc-phld/mara/accadbc的菌株产量为1.12g/l;在分批补料发酵罐水平,单质粒对照菌株的pg产量为3.90g/l,双质粒菌株的产量为5.91g/l。在发酵罐的相同发酵条件下,含有两种重组质粒pet-groesl和pacyc-phld/mara/accadbc的菌株比单质粒pacyc-phld/mara/accadbc的对照菌株间苯三酚浓度提高了约51%。
实施例4
用构建好的工程大肠杆菌菌株发酵生产间苯三酚,其步骤如下:
1、摇瓶发酵实验
1)一级种子液的培养:在lb种子液培养基中接种固体lb平板上的实施例2制备得到的重组单菌落,并加入终浓度50μg/ml卡那霉素和34μg/ml氯霉素,37℃生长8-12h;在lb种子液培养基中接种固体lb平板上的实施例2制备的对照菌株单菌落,加入终浓度34μg/ml氯霉素,37℃生长8-12h。
2)将步骤1)得到的一级种子液按1%(wt)接种量转接至250ml发酵摇瓶中,含50ml发酵培养基,转接种子液时各补加200g/lmgso4.7h2o100μl、500g/l葡萄糖2ml、1000×微量元素50μl、终浓度50μg/ml卡那霉素(对照菌株不加卡那霉素)、终浓度50μg/ml氯霉素,每种菌株设定3个平行对照,37℃、180rpm培养。
3)细胞od600达到0.6-1.0间加入终浓度100μmol/l的iptg诱导。
4)iptg诱导后,37℃、180rpm继续培养24h后收集菌液,离心取上清,测定间苯三酚含量。
2、分批补料发酵实验
1)一级种子液的培养:重复上述步骤1、1)。
2)二级种子液的培养:将步骤1)得到的一级种子液按3%(wt)接种量转接至250ml三角瓶中,含50mlm9培养基,转接种子液时各补加200g/lmgso4.7h2o100μl、500g/l葡萄糖2ml、1000×微量元素50μl、终浓度50μg/ml的卡那霉素、终浓度50μg/ml的氯霉素,37℃、180rpm培养8-12h。
3)将步骤2)得到的二级种子液按1%(wt)接种量转接至5l发酵罐中,含2l发酵培养基中进行发酵,培养温度37℃、搅拌速度300-800rpm、ph6.5-7.5和溶氧18%以上的条件下培养至od600约为12,加入诱导剂iptg至终浓度100μmol/l,50%-80%葡萄糖储液继续补料发酵24小时,离心取上清,测定间苯三酚含量。
3、间苯三酚的含量检测
间苯三酚的含量测定同实施例3.3
根据本实施例操作步骤,摇瓶水平,含有单质粒pacyc-phld/mara/accadbc的对照菌株pg产量为0.70g/l,含有两种重组质粒pet-t7-groesl和pacyc-phld/mara/accadbc的菌株产量为0.93g/l;在分批补料发酵罐水平,单质粒对照菌株的pg产量为3.90g/l,双质粒菌株的产量为4.97g/l。在发酵罐的相同发酵条件下,含有两种重组质粒pet-t7-groesl和pacyc-phld/mara/accadbc的菌株比单质粒pacyc-phld/mara/accadbc的对照菌株间苯三酚浓度可提高了约27%。
本实施例所列数据为多次重复试验的平均数值。
虽然本发明已经公开了示例性示范方案,但是本领域人员应该理解,在不背离由后附的权利要求所定义的本发明的精神和范围的条件下,可以进行各种形式和细节的变化,可以进行各种实施方案的任意组合。
- 还没有人留言评论。精彩留言会获得点赞!