抗菌肽HirJM79的基因工程菌的构建方法及其应用与流程
本发明属于基因工程技术领域,具体涉及抗菌肽HirJM79的基因工程菌的构建方法及其应用。
背景技术:
近年来,抗生素在动物养殖业中的大量滥用,导致抗生素耐药性菌株不断出现、药物残留、环境污染和生态破坏等诸多问题,严重威胁到人类健康和畜牧业的发展。因此,寻找一种能替代抗生素的新型抗菌制剂迫在眉睫。抗菌肽具有抗菌效果好、热稳定性好、无毒、无残留、无副作用、安全高效、对环境无污染且不易产生细菌耐药性等优点,有望成为解决抗生素滥用这一难题的有效方法。
抗菌肽是生物防御系统中产生的对抗外源性病原体的肽类物质,是生物天然的、防御系统的重要组成部分。抗菌肽来源极其广泛,从植物、昆虫、鸟类、哺乳动物、微生物都已被发现有抗菌肽的产生。迄今为止,已有近千种抗菌肽被相继分离纯化及鉴定。
细菌产生的抗菌肽是在其代谢过程中通过核糖体合成机制产生的具有抑菌活性的多肽类物质。抗菌肽在益生菌中较为普遍。几乎所有的益生菌都能产生一种或几种抗菌肽物质。近年来,国内外学者已从植物乳杆菌、嗜酸乳杆菌、双歧杆菌、嗜热链球菌、乳酸乳球菌等许多益生菌中分离纯化得到多种抗菌肽物质。
抗菌肽HirJM79是从希氏肠球菌DCH5分离纯化获得的抗菌肽,命名为HirJM79。抗菌肽HirJM79的结构基因编码74个氨基酸的前肽。其前肽包括30个氨基酸的信号肽和44个氨基酸的成熟肽。抗菌肽HirJM79具有较广的抗菌谱,尤其对单核细胞增生李斯特菌、金黄色葡萄球菌等病原菌有明显的抑制效果,具有较好的应用前景。
抗菌肽HirJM79在其产生菌希氏肠球菌DCH5中含量极低,从产生菌中提取抗菌肽产量低、费时长、工艺复杂且费用昂贵,无法实现大规模生产,从而制约抗菌肽HirJM79的实际应用。采用基因工程方法来研究和解决抗菌肽HirJM79的实际应用问题可提供一条新的有效技术手段。将HirJM79基因导入益生菌乳酸乳球菌中获得基因工程菌并进行高效表达,将此基因工程菌作为发酵菌株用于饲料发酵,可用作于动物饲料添加剂,提高饲料的营养价值和动物抗病能力。
技术实现要素:
本发明为了解决传统抗菌肽HirJM79生产方法抗菌肽产量低、费时长、工艺复杂且费用昂贵,无法实现大规模生产等问题,将HirJM79基因导入益生菌乳酸乳球菌中获得基因工程菌并进行高效表达。
本发明的第一个方面提供一种抗菌肽HirJM79的基因工程菌的构建方法,包括以下步骤:
步骤1:目的基因的获得
将经酶切位点修饰后的抗菌肽HirJM79基因克隆到表达载体上,将表达载体导入大肠杆菌后提取质粒,酶切后回收目的基因,将其放置于-20℃下保存备用;
步骤2:将步骤1中回收的目的基因和线性化质粒连接得到连接产物;
步骤3:获得表达抗菌肽HirJM79的基因工程菌
将步骤2得到的连接产物转化大肠杆菌感受态细胞后,提取重组质粒,经PCR和酶切鉴定后正确的质粒转化乳酸乳球菌感受态细胞,再用含氯霉素的培养基进行筛选,并经PCR验证、酶切鉴定后得到表达抗菌肽HirJM79的基因工程菌。
根据权利要求2所述的构建方法,其特征在于,所述步骤1中酶切位点是pstⅠ和HindⅢ。
优选地,上述步骤1中表达载体是经nisin诱导的表达载体pNZ8148。
优选地,上述步骤3中大肠杆菌是大肠杆菌MC1061;所述的乳酸乳球菌是乳酸乳球菌NZ9000。
优选地,上述步骤3中经PCR和酶切鉴定后正确的质粒采用电转化的方法导入乳酸乳球菌中。
优选地,上述步骤3中电转化方法的处理参数是2.0kV,25μF,200Ω,5ms。
本发明第二个方面提供构建的抗菌肽HirJM79基因工程菌在制备饲料添加剂中的应用。
本发明的第三个方面提供一种生产抗菌肽HirJM79的方法,发酵菌株为上述的第一个方面中涉及的方法构建的基因工程菌。
优选地,取上述的发酵菌株活化,在种子培养基中培养后,转接到发酵培养基中生产益生型抗菌肽HirJM79。
与现有技术相比,本发明具有以下有益效果:
1.本发明的抗菌肽来自对动物有益生作用的肠球菌,预期用于动物饲料添加剂中对动物会有更好的作用和益生效果,HirJM79抗菌肽的成熟肽分子量大约为5.1KDa具有显著的抗病原菌作用。
2.本发明所表达的抗菌肽HirJM79来自于肠球菌,对动物体没有毒性,因此用本发明的基因制备的抗菌肽与传统的抗生素药物相比,将是一种更为安全的抗病原菌的短肽类物质。
3.本发明以常用的益生菌乳酸乳球菌为宿主菌构建的基因工程菌,乳酸乳球菌本身就是对动物健康有利的益生菌,同时将抗菌肽HirJM79在乳酸乳球菌中获得了有效的分泌表达,因此,本发明的所构建的基因工程菌不仅具有乳酸乳球菌本身的益生作用,还具有抗菌肽HirJM79明显的抗病原菌作用,可以更好的作为益生型饲料添加剂安全有效地应用于动物饲料。
附图说明
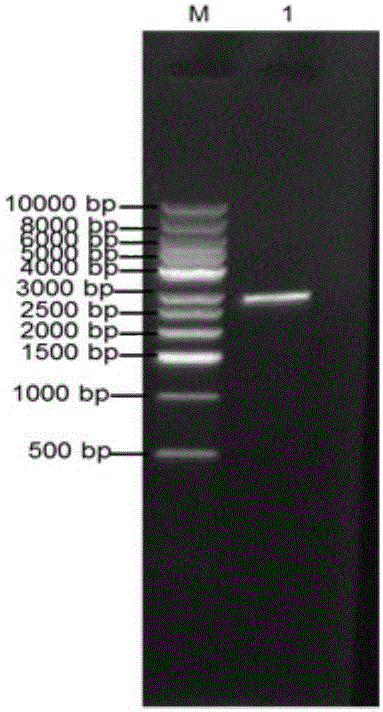
图1是含目的基因大肠杆菌DH5α质粒双酶切电泳图。
图2是pNZ8148质粒双酶切电泳图。
图3是大肠杆菌MC1061重组菌PCR产物电泳图。
图4是大肠杆菌MC1061重组质粒提取电泳图。
图5是含目的基因Hir JM79大肠杆菌MC1061重组质粒pNZ8148-HirJM79双酶切电泳图。
图6是乳酸乳球菌重组菌PCR产物电泳图。
图7是乳酸乳球菌NZ9000重组质粒pNZ8148-HirJM79提取电泳图。
图8是含目的基因Hir JM79乳酸乳球菌NZ9000重组质粒pNZ8148-HirJM79双酶切电泳图。
图9是重组基因工程菌对金黄色葡萄球菌的抑菌图;1-3:Nisin诱导表达后重组基因工程菌上清液;对照:未诱导的重组基因工程菌上清液。
图10是重组基因工程菌对单核细胞增生李斯特菌的抑菌图;1-3:Nisin诱导表达后重组基因工程菌上清液;对照:未诱导的重组基因工程菌上清液。
图11是重组基因工程菌对沙门氏菌的抑菌图;1-3:Nisin诱导表达后重组基因工程菌上清液;对照:未诱导的重组基因工程菌上清液。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于本发明而不用于限制本发明的范围。
实施例1
本发明所使用的主要材料如下:
菌株与载体:大肠杆菌MC1061、乳酸乳球菌NZ9000和pNZ8148质粒菌购于德国Mo Bi Tec公司;DNAMarker购于上海捷瑞有限公司;单核细胞增生李斯特菌、金黄色葡萄球菌以及沙门氏菌均为实验室分离保存。抗菌肽HirJM79基因由生工生物工程(上海)有限公司合成并转入大肠杆菌DH5α;引物由生工生物工程(上海)有限公司合成。
主要试剂与试剂盒:M17肉汤培养基购自青岛海博公司;限制性内切酶PstⅠ和HindⅢ、T4DNALigase、EX Taq购自TaKaRa Biotech公司;氯霉素、质粒提取和DNA凝胶回收试剂盒购自天根公司;nisin购于Sigma公司。
主要试剂的配制:
GM17:M17肉汤培养基121℃高压灭菌15min,冷却后加入过滤除菌的葡萄糖至终浓度为0.5%(质量体积比)。
SGM17:M17肉汤加入终浓度为0.5M蔗糖、2.5%甘氨酸、0.5%葡萄糖。M17肉汤中加入蔗糖和甘氨酸后121℃高压灭菌15min,冷却后加入0.22μm过滤除菌的葡萄糖至终浓度为0.5%(质量体积比)。
0.5M蔗糖/10%甘油:17.115g蔗糖溶解于80ml超纯水中,加入10ml甘油后混匀定容至100ml,0.22μm过滤除菌。
LB液体培养基:10g蛋白胨、5g酵母提取物、1g NaCl溶解于900ml蒸馏水中,调节pH值至7.0后,定容至1L后121℃高压灭菌15min
主要仪器:高速冷冻离心机、移液器、PCR仪均购于德国Eppendorf公司;核酸电泳槽、电泳仪、电转化仪购于Bio-Rad公司;凝胶成像仪购于上海天能公司;除菌过滤膜(0.22μm)购自What Man公司。
本发明中的抗菌肽HirJM79的核苷酸序列如SEQ NO:1所示,编码的成熟抗菌肽HirJM79的氨基酸序列如SEQ NO:2所示。
获得连接产物的具体步骤如下:
1.抗菌肽HirJM79基因由生工生物工程(上海)有限公司合成,两侧加PstⅠ和HindⅢ的酶切位点并导入导入大肠杆菌DH5α。按照质粒提取试剂盒提取由含目的基因的大肠杆菌DH5α质粒。
2.按照TaKaRa Biotech限制性内切酶PstⅠ和HindⅢ双酶切步骤1中提取的质粒,酶切产物经1%琼脂糖凝胶电泳(图1),目的基因片段采用天根公司DNA回收试剂和操作方法进行胶回收,-20℃保存备用。
质粒pNZ8148线性化:
采用TaKaRa Biotech限制性内切酶PstⅠ和HindⅢ操作说明双酶切pNZ8148质粒,线性化产物经1%琼脂糖凝胶电泳(图2),目的基因片段采用天根公司DNA回收试剂和操作方法进行胶回收,-20℃保存备用。
回收的目的基因和线性化质粒连接
按照TaKaRa Biotech的T4DNA连接酶试剂盒操作说明书对回收目的基因和质粒进行连接,获得连接产物。
实施例2制备大肠杆菌MC1061感受态细胞
本实施例制备大肠杆菌MC1061感受态细胞,具体步骤如下:
1、1%接种MC1061的LB液体培养基,于37℃振荡过夜培养;
2、取过夜培养菌液1%接种于LB液体培养基,37℃下振荡培养4h(此时细菌处于对数生长期),冰上放置10min;
3、4000g,4℃离心10min收集对数期细胞,弃上清,收集细菌细胞沉淀;
4、用1/10于之前液体培养基体积的预冷的0.1M CaCl2菌体,冰上放置30min;
5、4000g,4℃离心5min弃上清,收集细菌细胞沉淀;
6、用1/100于之前液体培养基体积的含0.1M CaCl2溶液重悬菌体;
7、吸取200μL分装于离心管,-80℃保存。
实施例3连接产物转化大肠杆菌MC1061感受态细胞
本实施例为连接产物转化大肠杆菌MC1061感受态细胞,具体步骤如下:
(1).取100μl大肠杆菌MCI061感受态细胞,加入10-50μl连接产物,轻柔混勻后,冰浴30min
(2).将EP管放入预热至42℃的水浴中90S;
(3).快速将EP管转移到冰浴中,使细胞冷却1-2min;
(4).每管加900μlLB培养液体基,37℃摇床温和震荡培养1.5h,使细菌复苏并充分表达质粒编码的抗生素抗性标记基因;
(5).吸取100μl复苏培养菌液分别涂布于含10μg/mL氯霉素的LB培养基平板上;
(6).将平板置于室温至液体吸收,倒置平板,37℃培养12-24h直至出现单菌落。
实施例4大肠杆菌MC1061重组质粒菌落PCR及双酶切鉴定
本实施例为大肠杆菌MC1061重组质粒菌落PCR及双酶切鉴定。
1.挑取上步骤获得的单菌落进行PCR鉴定
用于PCR扩增的引物
正向引物:AACTTGTCTAGCTGGCATC
反向引物:CTCCAAATACCAATAGAAGCC
扩增目的片段长度为481bp。
2.以单菌落为DNA模板的PCR反应体系如下:
扩增程序:94℃,5min,然后30个循环(94℃,1min;58℃,50S;72℃,1min);72℃延伸10min。PCR产物进行1%琼脂糖凝胶电泳(图3)。
3.重组质粒酶切鉴定:
挑取经PCR验证正确的单菌落于LB液体培养基于37℃振荡培养好的菌液,按照天根质粒提取试剂盒操作说明提取质粒后进行1%琼脂糖凝胶电泳(图4),提取质粒采用TaKaRa Biotech限制性内切酶PstⅠ和HindⅢ操作说明双酶切质粒,产物经1%琼脂糖凝胶电泳(图5)。
实施例5制备乳酸乳球菌NZ9000感受态细胞
本实施例制备乳酸乳球菌NZ9000感受态细胞,具体步骤如下:
1、乳酸乳球菌1%接种于SGM17(GM17含0.5M蔗糖,2.5%甘氨酸),培养至OD600≈0.5-0.8;
2、5000g,4℃离心10min收集菌体;
3、用冰预冷的含10%甘油的0.5M蔗糖的溶液洗涤菌体2次;
4、用1/100与之前培养基体积的含10%甘油的0.5M蔗糖溶液重悬菌体,于-80℃保存。
实施例6乳酸乳球菌电转化
本实施为乳酸乳球菌电转化,具体步骤如下:
取2μL经验证正确的重组质粒与40μL感受态细胞混合后,转入预冷的电转杯中,冰上放置10min。电转化条件:电压2000V,电容25μF,电阻200Ω。电击完毕后,立即往电转杯中加入1mL GM17培养基(含20mM MgCl2,2mM CaCl2)后,30℃静置培养2h,涂布于含5μg/ml氯霉素的GM17平板上,30℃培养直至出现单菌落。
实施例7乳酸乳球菌NZ9000重组质粒菌落PCR及双酶切验证
1.挑取上步骤获得的单菌落进行PCR验证
用于PCR扩增的引物如下:
正向引物:AACTTGTCTAGCTGGCATC
反向引物:CTCCAAATACCAATAGAAGCC
扩增目的片段长度为481bp。
2.以单菌落为DNA模板的PCR反应体系如下:
扩增程序:94℃,5min,然后30个循环(94℃,1min;58℃,50S;72℃,1min);72℃延伸10min。PCR产物进行1%琼脂糖凝胶电泳(图6)。
3.挑取经PCR验证正确的单菌落于GM17液体培养基于30℃振荡培养好的菌液,按照天根质粒提取试剂盒操作说明提取质粒后进行1%琼脂糖凝胶电泳(图7),提取质粒采用TaKaRa Biotech限制性内切酶PstⅠ和HindⅢ操作说明双酶切质粒,产物经1%琼脂糖凝胶电泳(图8)。
实施例8乳酸乳球菌NZ9000重组菌的诱导表达
重组菌4%接种于含5μg/ml氯霉素的GM17液体培养基待生长至OD600nm约为0.5时加入终浓度为10ng/ml nisin诱导培养4h获得培养菌液,4000g离心10min取上清液,将获得的上清液进行0.22μm过滤获得诱导后的无菌上清液,用于下一步的抑菌实验。
实施例9重组抗菌肽抑菌实验
本实验采用琼脂扩散法对重组表达的抗菌肽HirJM79的抑菌活性进行检测。将处于对数生长期的金黄色葡萄球菌、单核细胞增生李斯特菌、沙门氏菌培养物各取100μL涂布与20ml固体培养基中,再用8mm的打孔器打孔,加入200μL的待测样品上清液,以未经nisin诱导的含有抗菌肽HirJM79基因的乳酸乳球菌上清为对照,37℃培养观察。
采用琼脂扩散法对重组抗菌肽的抑菌活性进行检测,经37℃培养后,结果显示,重组抗菌肽HirJM79基因工程菌对沙门氏菌、金黄色葡萄球菌和单核细胞增生李斯特菌的抑菌效果明显(图9-11)。
实施例10表达抗菌肽HirJM79的基因工程菌的发酵培养
本实施例的种子和发酵培养基:
利用GM17培养基作为种子和发酵的培养基。补料液:500g/L葡萄糖。
发酵过程包括以下步骤:
1)挑取重组抗菌肽HirJM79基因工程菌单菌落于5ml GM17液体培养基中,30℃培养12-16小时。
2)2ml一级种子接种于200ml种子培养基中,30℃培养12-14小时。
3)二级种子接种于3.5L的发酵罐中,30℃,搅拌速度320-600转/分钟,溶氧保持在35%以上,用NaOH控制pH在6.8左右。葡萄糖耗尽后,以5g/L.h速度补充葡萄糖。
4)发酵液菌体OD600nm=8左右时加入终浓度为15ng/ml nisin,30℃培养,80小时后减慢葡萄糖补料速度,至结束发酵。
5)经检测80小时发酵结束时,重组抗菌肽HirJM79基因工程菌中产物抗菌肽HirJM79的浓度高达96.21mg/L。
以上对本发明的具体实施例进行了详细描述,但其只是作为范例,本发明并不限制于以上描述的具体实施例。对于本领域技术人员而言,任何对本发明进行的等同修改和替代也都在本发明的范畴之中。因此,在不脱离本发明的精神和范围下所作的均等变换和修改,都应涵盖在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!