生产洛伐他汀及莫纳可林J的基因工程菌的构建与应用的制作方法
本发明属于生物技术领域,更具体地,本发明涉及生产洛伐他汀及莫纳可林J的基因工程菌的构建与应用。
背景技术:
心脑血管疾病是一种严重威胁人类健康的疾病,其发病率和死亡率在许多国家和地区均排名第一,防止心脑血管疾病的一种有效途径是抑制肝脏胆固醇的过多合成。在胆固醇生物合成途径中,3-羟基-3-甲基戊二酰基-辅酶A(HMG-CoA)还原酶是控制胆固醇合成速度的关键酶,催化由HMG-CoA向甲羟戊酸的转化。因此抑制HMG-CoA还原酶的活性能达到减少或阻断胆固醇的体内合成的目的,从而防治高血脂病。
他汀类药物通过抑制3-羟基-3-甲基戊二酰基-辅酶A(HMG-CoA)还原酶来发挥作用,而该还原酶是细胞中催化胆固醇生物合成的限制性步骤。洛伐他汀(Lavostatin)和辛伐他汀(Simvastatin)是最常见的降低胆固醇药物,可以有效降低原发性高脂血症患者的TC和LDL-C,预防心脏病复发和动脉粥样硬化的发展,降低心肌血管再形成和非致死心肌梗死手术的危险。
洛伐他汀主要用土曲霉(Aspergillus terreus)或红曲霉(Monascus rubber)经深层发酵制取,而辛伐他汀是非天然产物,其合成主要包括化学合成法和生物合成法,化学合成法包括间接甲基化(侧链合成法)和直接甲基化;生物合成法,是莫纳可林J(Monacolin J)与侧链2,2-二甲基丁酞氯合成法。间接甲基化合成法和生物合成法都需要药物中间体莫纳可林J作为合成底物。
而莫纳可林J的合成包括生物发酵法和化学水解法。生物发酵法,是通过分子手段中断土曲霉(Aspergillus terreus)中的洛伐他汀生物合成途径,突变后的土曲霉菌株在发酵过程中积累中间产物代谢物莫纳可林J,经提取、分离和纯化后得到莫纳可林J。化学水解法,是经脱酯化、羟基保护、重新酯化、脱 保护四个化学反应步骤将天然产物洛伐他汀经水解得到莫纳可林J。
上述方法中,生产菌土曲霉(Aspergillus terreus)的次级代谢产物背景多,目标代谢产物得量低、纯化复杂,生产成本高昂;而化学合成法中,路线步骤多、生产时间长、底物转化率低,且在脱酯化反应中的副产物较多,总产率也很低。
因此,还需要进一步地研究和开发洛伐他汀或其中间产物的其它生产方法,以期简化生产工艺,降低生产成本。
技术实现要素:
本发明的目的在于提供生产洛伐他汀及莫纳可林J的基因工程菌的构建与应用。
在本发明的第一方面,提供一种生产洛伐他汀的方法,所述方法包括:
(1)提供酵母工程菌,所述酵母工程菌中转化有外源的下组基因的表达盒:LovB,LovC,LovG,LovA,NpgA,LovD,LovF;和
(2)培养(1)的酵母工程菌,从而生成洛伐他汀产物。
在本发明的另一方面,提供一种生产洛伐他汀中间体莫纳可林J的方法,所述方法包括:
(a)提供酵母工程菌,所述酵母工程菌中转化有外源的下组基因的表达盒:LovB,LovC,LovG,LovA,NpgA;和
(b)培养(a)的酵母工程菌,从而生成莫纳可林J产物。
在一个优选例中,所述的LovB,LovC,LovG,LovA,NpgA,LovD或LovF基因来源于土曲霉。
在另一优选例中,所述的LovB基因具有SEQ ID NO:1所示的核苷酸序列,或其简并序列,或与SEQ ID NO:1序列有70%以上(较佳地80%以上;更佳地90%以上;更佳的93%以上;更佳地95%以上;更佳的97%以上)相同性的编码同功能蛋白的核苷酸序列。
在另一优选例中,所述的LovC基因具有SEQ ID NO:2所示的核苷酸序列,或其简并序列,或与SEQ ID NO:2序列有70%以上(较佳地80%以上;更 佳地90%以上;更佳的93%以上;更佳地95%以上;更佳的97%以上)相同性的编码同功能蛋白的核苷酸序列。
在另一优选例中,所述的LovG基因具有SEQ ID NO:3所示的核苷酸序列,或其简并序列,或与SEQ ID NO:3序列有70%以上(较佳地80%以上;更佳地90%以上;更佳的93%以上;更佳地95%以上;更佳的97%以上)相同性的编码同功能蛋白的核苷酸序列。
在另一优选例中,所述的NpgA基因具有SEQ ID NO:4所示的核苷酸序列,或其简并序列,或与SEQ ID NO:4序列有70%以上(较佳地80%以上;更佳地90%以上;更佳的93%以上;更佳地95%以上;更佳的97%以上)相同性的编码同功能蛋白的核苷酸序列。
在另一优选例中,所述的LovD基因具有SEQ ID NO:5所示的核苷酸序列,或其简并序列,或与SEQ ID NO:5序列有70%以上(较佳地80%以上;更佳地90%以上;更佳的93%以上;更佳地95%以上;更佳的97%以上)相同性的编码同功能蛋白的核苷酸序列。
在另一优选例中,所述的LovF基因具有SEQ ID NO:6所示的核苷酸序列,或其简并序列,或与SEQ ID NO:6序列有70%以上(较佳地80%以上;更佳地90%以上;更佳的93%以上;更佳地95%以上;更佳的97%以上)相同性的编码同功能蛋白的核苷酸序列。
在另一优选例中,所述的LovA基因具有SEQ ID NO:7所示的核苷酸序列,或其简并序列,或与SEQ ID NO:7序列有70%以上(较佳地80%以上;更佳地90%以上;更佳的93%以上;更佳地95%以上;更佳的97%以上)相同性的编码同功能蛋白的核苷酸序列。
在本发明的另一方面,提供一种用于生产洛伐他汀的酵母工程菌,所述酵母工程菌中包含外源的下组基因的表达盒:LovB,LovC,LovG,LovA,NpgA,LovD,LovF。
在本发明的另一方面,提供一一种用于生产洛伐他汀中间体莫纳可林J的酵母工程菌,所述酵母工程菌中包含外源的下组基因的表达盒:LovB,LovC,LovG,LovA,NpgA。
在一个优选例中,所述的酵母工程菌是毕赤酵母。
在另一优选例中,所述的毕赤酵母是毕赤酵母GS115。
在本发明的另一方面,提供一种用于生产洛伐他汀的重组表达载体或表达构建物,所述的重组表达载体中包含以下基因的表达盒:LovB,LovC,LovG,LovA,NpgA,LovD,LovF。
在本发明的另一方面,提供一种用于生产洛伐他汀中间体莫纳可林J的重组表达载体或表达构建物,所述的重组表达载体中包含以下基因的表达盒:LovB,LovC,LovG,LovA,NpgA。
在本发明的另一方面,提供一种基因组合的用途,所述的基因组合包括下组基因:LovB,LovC,LovG,LovA,NpgA,LovD,LovF,该基因组合用于制备洛伐他汀中间体或其中间体莫纳可林J。
在本发明的另一方面,提供一种用于生产洛伐他汀的试剂盒,所述的试剂盒中包含所述的酵母工程菌。
在本发明的另一方面,提供一种用于生产洛伐他汀中间体莫纳可林J的试剂盒,所述的试剂盒中包含所述的酵母工程菌。
本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显而易见的。
附图说明
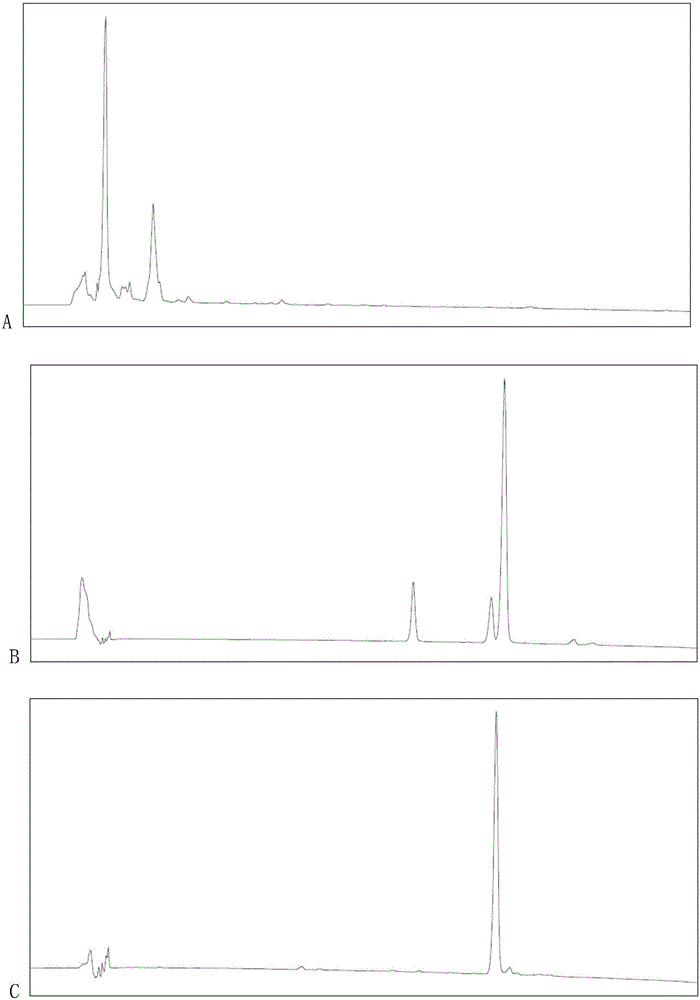
图1、生产莫纳可林J重组菌的发酵产物高效液相色谱分析图。
A为阴性对照菌株(未转入洛伐他汀聚酮合酶基因)发酵液样品的高效液相色谱图;
B为重组菌株发酵液样品的高效液相色谱图;
C为莫纳可林J标准品的高效液相色谱图。
图2、生产洛伐他汀重组菌的发酵产物高效液相色谱分析图。
A为阴性对照菌株(未转入洛伐他汀聚酮合酶基因)发酵液样品的高效液相色谱图;
B为重组菌株发酵液样品的高效液相色谱图;
C为洛伐他汀标准品的高效液相色谱图。
图3、生产莫纳可林J和洛伐他汀重组菌株的高密度发酵图谱。
A为生产莫纳可林J的重组菌株的高密度发酵过程,记载了随着发酵时间变化的细胞生物量,莫纳可林J产量。
B为生产洛伐他汀的重组菌株的高密度发酵图谱,记载了随着发酵时间变化的细胞生物量,莫纳可林J产量。
图4、生产莫纳可林J和洛伐他汀重组菌株的遗传稳定性图谱。
A为生产莫纳可林J的重组菌株的传代次数及不同代次的菌株的莫纳可林J产量;
B为生产洛伐他汀的重组菌株的传代次数及不同代次的菌株的洛伐他汀产量。
具体实施方式
本发明人经过深入的研究,通过基因重组技术在酵母工程菌株中引入了一系列外源基因,获得可生产洛伐他汀或其中间产物的酵母工程菌。所述酵母工程菌具有代谢背景低、异源表达能力强,可全细胞合成终产物以及终产物易分离且副产物少等特征,为工业化生产他汀类药物提供了新思路。
术语
如本文所用,所述的“表达盒”或“基因表达盒”是指包含有表达目的多肽所需的所有必要元件的基因表达系统,通常其包括以下元件:启动子、编码多肽的基因序列,终止子;此外还可选择性包括信号肽编码序列等;这些元件是操作性相连的。
如本文所用,所述的“可操作地连接(相连)”或“操作性连接(相连)”是指两个或多个核酸区域或核酸序列的功能性的空间排列。例如:启动子区被置于相对于目的基因核酸序列的特定位置,使得核酸序列的转录受到该启动子区域的引导,从而,启动子区域被“可操作地连接”到该核酸序列上。
如本文所用,所述的“表达构建物”是指重组DNA分子,它包含预期的核酸编码序列,其可以包含一个或多个基因表达盒。所述的“构建物”通常被包含在表达载体中。
如本文所用,所述的“外源”或“异源”是指来自不同来源的两条或多条核酸或蛋白质序列之间的关系,或者来自不同来源的蛋白(或核酸)与宿主细胞之间的关系。例如,如果核酸与宿主细胞的组合通常不是天然存在的,则核酸对于该宿主细胞来说是外源的。特定序列对于其所插入的细胞或生物体来说是“外源的”。
基因及其表达系统
本发明中,通过在酵母工程菌中转化入五基因组合或七基因组合来实现洛伐他汀或其中间体在酵母工程菌中的高效生产。所述的五基因组合包括如下基因:LovB,LovC,LovG,LovA,NpgA;所述的七基因组合包括如下基因:LovB,LovC,LovG,LovA,NpgA,LovD和LovF。上述的基因均是本领域已知的基因。
在本发明中,上述的基因可以是天然存在的,比如其可被分离或纯化自动植物或微生物。此外,所述的基因也可以是人工制备的,比如可以根据常规的基因工程重组技术来获得所述的基因,或者通过人工合成的方法来获得所述的基因。
上述的基因的核苷酸序列可以与SEQ ID NO:1~7所示的列相同,也可以是它们的简并的变异体。如本文所用,“简并的变异体”在本发明中是指编码具有同功能的蛋白质,但与选自SEQ ID NO:1~7所示的序列有差别的核酸序列。
所述的基因可以包括:只编码成熟多肽的编码序列;成熟多肽的编码序列和各种附加编码序列;成熟多肽的编码序列(和任选的附加编码序列)以及非编码序列。
本发明还涉及所述的基因的变异体,其编码的多肽与其相应的野生型多肽在氨基酸序列上不同,是野生型多肽的片段、类似物或衍生物。此多核苷酸的变异体可以是天然发生的等位变异体或非天然发生的变异体。这些核苷酸变异体包括取代变异体、缺失变异体和插入变异体。如本领域所知的,等位变异体是一个多核苷酸的替换形式,它可能是一个或多个核苷酸的取代、缺失或插入,但不会从实质上改变其编码的多肽的功能。
本发明还涉及与上述的序列杂交且两个序列之间具有至少50%,较佳地至少70%,更佳地至少80%相同性的多核苷酸。本发明特别涉及在严格条件下与本发明所述多核苷酸可杂交的多核苷酸。在本发明中,“严格条件”是指:(1)在较低离子强度和较高温度下的杂交和洗脱,如0.2×SSC,0.1%SDS,60℃;或(2)杂交时加有变性剂,如50%(v/v)甲酰胺,0.1%小牛血清/0.1%Ficoll,42℃等;或(3)仅在两条序列之间的相同性至少在90%以上,更好是95%以上时才发生杂交。并且,可杂交的多核苷酸编码的多肽与相应的野生型多肽有相同的生物学功能和活性。
应理解,虽然本发明的各基因优选获自土曲霉,但是获自其它微生物的与土曲霉中相应的基因高度同源(如具有70%以上,如80%、90%、95%、甚至98%序列相同性)的其它基因也在本发明考虑的范围之内。比对序列相同性的方法和工具也是本领域周知的,例如BLAST。
本发明的各基因的全长序列或其片段通常可以用PCR扩增法、重组法或人工合成的方法获得。对于PCR扩增法,可根据本发明所公开的有关核苷酸序列,尤其是开放阅读框序列来设计引物,扩增而得有关序列。当序列较长时,可以进行两次或多次PCR扩增,然后再将各次扩增出的片段按正确次序拼接在一起。
本发明也涉及包含所述的多核苷酸的载体,以及用所述的载体经基因工程产生的宿主细胞。
本发明中,各基因的序列可插入到重组表达载体中。术语“重组表达载体”指本领域熟知的细菌质粒、噬菌体、酵母质粒、植物细胞病毒、哺乳动 物细胞病毒或其他载体。总之,只要能在宿主体内复制和稳定,任何质粒和载体都可以用。表达载体的一个重要特征是通常含有复制起点、启动子、标记基因和翻译控制元件。
各基因的序列可以分别插入到重组表达载体中,多个重组表达载体共转宿主细胞;多个基因的表达盒也可以以串联的方式插入到同一重组表达载体中,转入宿主细胞。所述的重组表达载体还可包含与所述基因的序列操作性相连的表达调控序列,以便于蛋白的表达。应理解,在本领域人员了解了本发明的技术内容后,可以方便地构建重组表达载体。获得的重组表达载体也包含在本发明中。
表达调控序列或表达盒中,根据不同的需要,可以应用诱导型或组成型的启动子,诱导型的启动子可实现更可控的蛋白表达以及化合物生产,有利于工业化应用。
作为本发明的优选方式,提供了一种表达载体(表达构建物,)其包括以下基因的表达盒:LovB,LovC,LovG,LovA,NpgA;并且还提供了种表达载体(表达构建物,)其包括以下基因的表达盒:LovD和LovF基因。
表达载体(表达构建物)的建立目前已经是本领域技术人员熟悉的技术。因此,在得知了所需选择的基因之后,本领域技术人员易于进行表达构建物的建立。基因序列可以被插入到不同的表达构建物(如表达载体)中,也可以被插入到同一表达构建物中,只要在转入到细胞后其编码的多肽能够被有效地表达和发挥活性即可。作为本发明的优选方式,所述的表达载体是pPIC Z,pPIC3.5K和pAG32。
包含上述的适当基因序列以及适当启动子或者控制序列的载体,可以用于转化适当的宿主细胞,以使其能够表达蛋白质。本发明中,所述的宿主细胞优选的是酵母工程菌,更优选的是毕赤酵母,如毕赤酵母GS115。
用重组DNA转化宿主细胞可用本领域技术人员熟知的常规技术进行。当宿主是真核生物,可选用如下的DNA转染方法:磷酸钙共沉淀法,常规机械方法如显微注射、电穿孔、脂质体包装等。
获得的转化子可以用常规方法培养,培养中所用的培养基可以是本领域熟知的酵母培养基。在适于酵母细胞生长的条件下进行培养。
本发明通过基因重组技术获得的重组毕赤酵母菌株具有代谢背景低、异 源表达能力强,可全细胞合成终产物以及终产物易分离且副产物少等特征,将在很大程度上解决传统生物、化学方法合成存在的问题,为工业化生产他汀类药物提供新思路。
合成洛伐他汀或其中间体的方法
洛伐他汀的结构式如下式(I)所示,其中间体莫纳可林J的结构式如下式(II)所示。
本发明公开一种利用微生物异源合成生产洛伐他汀或其中间体的方法。所述方法包括:将五种基因(LovB,LovC,LovG,LovA,NpgA)转化酵母工程菌,从而生产洛伐他汀中间体莫纳可林J;或者,将七种基因(LovB,LovC,LovG,LovA,NpgA,LovD,LovF)转化酵母工程菌,从而生产洛伐他汀。
重组酵母工程菌的发酵培养可以采用本领域已知的酵母发酵方法,一种较为优选的方法是:于30℃、转速200r/min的液体YPD培养中,将重组菌培养至对数期,收集菌体使用无菌水洗涤两次后转移至MM培养基,于30℃、转速200r/min培养72-96h。发酵过程中每24h向液体培养基中添加0.5%的甲醇。
在获得了发酵产物后,从发酵产物中提取洛伐他汀或其中间体可以采用本发明已知的技术。可以采用高效液相色谱来对产物进行分析鉴定,以确定获得了所需的化合物。
本专利运用重组毕赤酵母异源生产洛伐他汀及其莫纳可林J,不仅解决了 生物发酵法中天然产生菌——土曲霉次级代谢背景大、产物难分离等问题,也避免了化学合成法中副产物多、纯化困难、环境污染大等不利因素,为工业生产降血脂药物洛伐他汀及辛伐他汀合成中间体莫纳可林J开辟了新途径。因此,本发明的重组毕赤酵母菌株具备工业化生产洛伐他汀及他汀类药物前体莫纳可林J的潜力。
本发明实现了利用重组酵母菌进行全细胞生物合成莫纳可林J和洛伐他汀的技术突破,为生产降血脂药物洛伐他汀、辛伐他汀及其他降血压药物衍生物提供了新途径。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。
培养基
YPD液体培养基:葡萄糖20.0g/L,蛋白胨20.0g/L,酵母膏10.0g/L;
YPD固体培养基:葡萄糖20.0g/L,蛋白胨20.0g/L,酵母膏10.0g/L,琼脂20g/L;
MM液体培养基:甲醇5mL/L,YNB 13.4g/L。
实施例1、表达质粒的构建
1、聚酮合成酶各相关基因整合入AOX1启动子表达质粒的构建
设计特异性引物,以土曲霉基因组为模板,以表1中相应引物,通过PCR扩增得到洛伐他汀聚酮合成酶相关基因(LovB,LovC,LovG,NpgA,LovD,LovF),使用EcoRI和XhoI双酶切质粒pPIC Z及各个基因片段,采用连接酶将各基因分别整合入质粒pPIC ZB(Invitrogen)中AOX1启动子下游,测序正确后即可得到具有AOX1启动各基因表达的质粒。
其中,LovB的基因序列如SEQ ID NO:1所示;
LovC的基因序列如SEQ ID NO:2所示;
LovG的基因序列如SEQ ID NO:3所示;
NpgA的基因序列如SEQ ID NO:4所示;
LovD的基因序列如SEQ ID NO:5所示;
LovF的基因序列如SEQ ID NO:6所示。
PCR扩增所用的引物如表1所示。
表1
2、质粒pPIC Z_BCGN的构建
使用BamH I和BglⅡ分别双酶切前面“1”中构建的质粒,分别回收得到包括启动子和终止子的LovB,LovC,LovG,NpgA各基因完整的表达盒。
同样采用BamH I和BglⅡ双酶切质粒pPIC Z,利用连接酶将各个基因完 整的表达盒依次头尾相连整合入质粒,即可得到包含有LovB,LovC,LovG,NpgA基因的质粒pPIC Z_BCGN。
3、质粒pPIC 3.5K_A的构建
以土曲霉基因组为模板,以表1中相应引物,通过PCR扩增得到基因LovA片段,使用Not I和Bln I双酶切PCR产物及质粒pPIC 3.5K,利用连接酶将二者接合,即可得到质粒pPIC 3.5K_A。
LovA的基因序列如SEQ ID NO:7所示。
4、质粒pAZh_DF的构建
以质粒pAG 32(获自美国加州理工大学)为模板,以表1中相应引物,通过PCR扩增得到潮霉素基因(Hyg)抗性表达盒片段,使用BamH I和Bgl II酶切质粒pPIC ZB及PCR产物,利用连接酶将二者接合,即得到质粒pAZh。
使用BamH I和BglⅡ双酶切前面“1”中构建的分别包含基因LovD和LovF表达盒的质粒,以及使用BamH1单酶切质粒pAZh,利用连接酶将酶切后的LovD和LovF表达盒头尾相连整合入质粒pAZh,即可得到质粒pAZh_DF。
实施例2、目标重组酵母菌的制备
1、重组菌株的PCR验证
各表达质粒电转化毕赤酵母GS 115,复苏后,涂布于具有抗性的YPD固体培养基上,培养3天后挑取新鲜的菌落在YPD液体培养基中培养,利用酵母基因组提取试剂盒提取各转化子的基因组,经克隆PCR反应鉴定聚酮合酶基因整合入毕赤酵母基因组的情况。
克隆PCR反应条件:
(1)初始变性95℃5min;
(2)变性95℃30s,退火50℃30s,延伸72℃1min/kb,循环反应30次;
(3)最后延伸72℃7min。
2、包含5种外源基因的重组菌的获得
将质粒pPIC Z_BCGN和pPIC 3.5K_A经线性化回收后,先后经电转化入毕赤酵母感受态,使用具有博来霉素和遗传霉素抗性的YPD固体培养筛选重组子,获得转化入5种外源基因(LovB,LovC,LovG,NpgA,LovA基因)的毕赤酵母基因工程菌。
3、包含7种外源基因的重组菌的获得
将前述2获得的包含5种外源基因的重组酵母菌制备成感受态,线性化后的质粒pAZh_DF经电转化入该感受态,使用具有潮霉素抗性的固体YPD培养基筛选重组子,获得转化入7种外源基因(LovB,LovC,LovG,NpgA,LovA,LovD和LovF)的毕赤酵母基因工程菌。
实施例3、重组工程菌5L罐高密度发酵工艺及产物定量分析
1、摇瓶(250mL锥形瓶)水平发酵
于30℃、转速200r/min的液体YPD培养基中,将重组菌培养至对数期,收集菌体使用无菌水洗涤两次后转移至装有100mL MM液体培养基的250mL锥形瓶中,于30℃、转速200r/min培养72-96h。发酵过程中每24h向液体培养基中添加0.5%(v/v)的甲醇。
2、5L发酵罐发酵
采用上罐基础培养基BSM(配方已由Invitrogen公司商业化)作为培养基,发酵过程分为分批阶段和补料阶段,其中补料阶段前期为甘油补料(流加),中后期为甲醇流加补料。其间控制发酵罐中搅拌转速在1000rpm;提供氧气供应,保证发酵液溶氧在30%~60%之间;连接氨水补料,维持发酵液pH为5.0左右。在发酵初始期,以甘油为碳源促进菌体生长,并提供甘油补料直至菌体生长到250g/L湿重时,停止甘油补料并切换至甲醇补料,逐步提高甲醇流加速率至16mL/h后维持稳定,在甲醇补料72h后发酵结束。
实施例4、重组菌株发酵产物的提取鉴定
经前述验证后的重组菌株,经YPD液体培养基培养至对数期,取100OD(注:OD值为酵母菌浓单位,1OD约为5x107个酵母细胞。OD值由紫外 分光光度计于600nm波长测得)菌体,利用无菌水洗两次后转入100mL MM液体培养基中,温度为30℃、转速为200r/min进行诱导发酵培养,时间为72-96h,其中每24h添加0.5%的无水甲醇。经发酵培养后的发酵液,取20mL使用等体积乙酸乙酯萃取样品三次。收集上层乙酸乙酯有机相,蒸馏后再溶于2mL甲醇,稀释十倍用于高效液相色谱(HPLC)分析。
高效液相色谱法分析,由反向高效液相色谱Agilent 1100完成,色谱柱使用C18柱,柱温30℃,紫外检测波长为238nm,洗脱条件如表2。
表2、目标产物HPLC流动相条件
包含5种外源基因的重组菌的发酵产物的高效液相鉴定图见图1B,图1A为阴性对照高效液相色谱图,图1C为标准品高效液相色谱图。由图可见,该重组酵母菌株可生产莫纳可林J。
包含7种外源基因的重组菌的发酵产物的高效液相色谱鉴定图见图2B,图2A为阴性对照高效液相色谱图,图2C为标准品高效液相色谱图。由图可见,该重组酵母菌株可生产洛伐他汀。
实施例5、发酵期间的细胞生物量和产物产量
根据实施例3的5L发酵罐发酵培养方法进行发酵。发酵期间间隔12h取样,测定细胞生物量和莫纳可林J产物量。
结果见图3,由图3A可见,随着发酵时间的增加,细胞生物量逐渐增加,同时莫纳可林J的产量也发生逐渐增加,在约发酵100小时的时候达到最高值,产量约215mg/L。
由图3B可见,起始阶段随着发酵时间的增加细胞生物量逐渐增加,发酵至约32小时后不再增加。洛伐他汀从发酵约23小时后产生,其产量发生逐 渐增加,在发酵约60-65小时的时候达到最高值,产量180-185mg/L。
实施例6、重组工程菌遗传稳定性的鉴定
将其前述获得的包含5种外源基因的重组酵母菌和包含7种外源基因的重组酵母菌活化后接种于含有100mL液体培养基的250mL锥形瓶中,进行摇瓶培养(30℃,200rpm),如实施例3中所述。并且,进行传代培养10代,测定每一代重组菌株的莫纳可林J产量和洛伐他汀产量,确定重组菌株的遗传稳定性。
结果见图4,每一代菌株均能稳定地生产莫纳可林J和洛伐他汀,且随着传代数的增加,产物产量还略有增加,摇瓶培养条件下,传代的菌株的莫纳可林J产量约为30mg/L;传代的菌株洛伐他汀产量约在20mg/L。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!