杂交瘤细胞株C11-6F7及其产生的HCMV单克隆抗体和应用的制作方法
本发明涉及一种单克隆抗体领域,尤其涉及杂交瘤细胞株c11-6f7及其产生的hcmv单克隆抗体和应用。
背景技术:
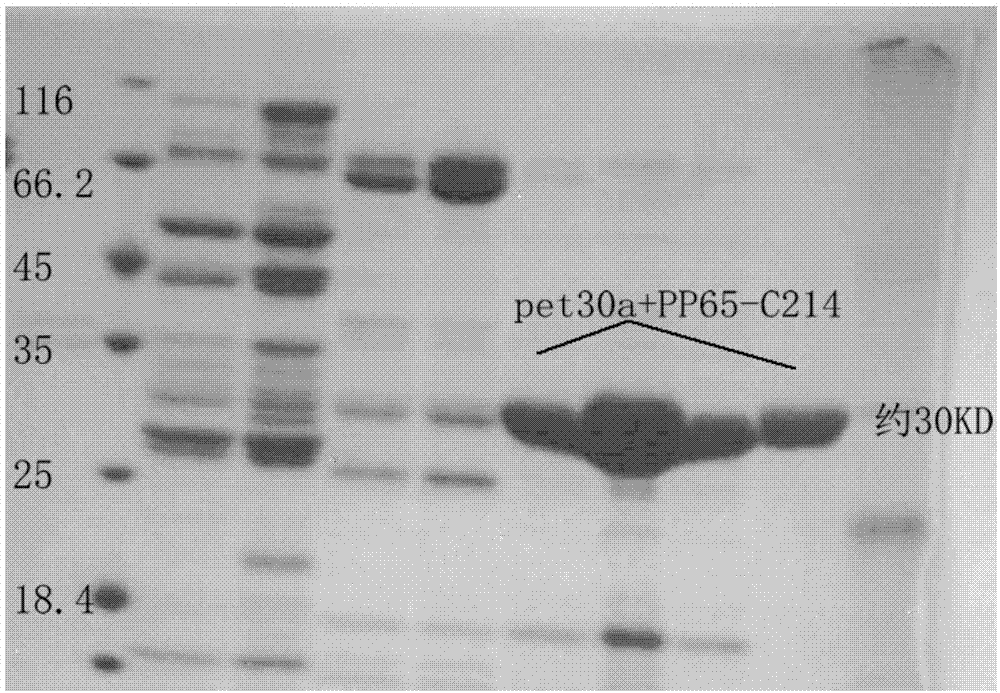
人巨细胞病毒(humancytomegalovirus,hcmv)为β属疱疹病毒亚科,双链线性dna病毒。传播途径多样,可经胎盘或生殖道上行感染,亦可经乳汁、血液、唾液等传播,感染后终身携带,病毒具有广泛的靶细胞,可侵犯全身各器官,所以临床症状复杂多变。巨细胞病毒在发展中国家的感染率为90%以上,相当普遍,虽然大多数成人感染者并无明显的临床症状(潜伏感染),但对胎儿、新生儿或者有免疫缺陷的个体会带来严重疾病。hcmv是先天性感染最常见的病原体之一,通过胎盘侵袭胎儿可引起死胎、流产、胎儿畸形等损害,无明显临床症状的先天性感染新生儿中约有10%-15%会产生明显的后遗症如智力障碍等;同时hcmv也是引起机体免疫功能低下的人群如hiv或器官移植患者并发感染死亡的常见病原体。因此,hcmv的早期快速检测以便及时给予患者抗病毒药物治疗显得至关重要。近年来流式细胞分析技术已成为临床检验医学发展的一个热点,其工作原理是在细胞分子水平上通过单克隆抗体对单个细胞或其他生物粒子进行多参数、高通量的定量分析,能同时从一个细胞中测得多个参数,能快速获得精确的实验结果,随着检测技术的不断完善,流式细胞分析对象已从原来的细胞膜成分向细胞内成分发展。病毒性疾病的诊断主要依赖于实验室检查,但细胞分离培养病毒非常耗时,同时病毒的特异性抗体检出率往往较低。利用流式细胞技术既可以检测到细胞表面吸附的病毒抗原,又可以检测到感染细胞内的病毒抗原,通过荧光标记的特异性识别病毒抗原的单克隆抗体可以快速定量检测出感染的细胞。目前国内检测hcmv的方法主要有荧光定量pcr或者elisa等方法,核酸检测试剂盒虽然具有灵敏度高特异性强等特点,但其检测的信号是核酸(包括潜伏感染),无法区分活动性感染和潜伏感染,无法解决活动性感染的问题。elisa等免疫法所用抗体为多克隆抗体,具有纯度及稳定性无法保障等问题,所以对于其应用在活动性感染检测中存在灵敏度低、特异性不高等缺点。因此,需要获得高质量hcmv单抗,以建立免疫学方法hcmv检测试剂盒。技术实现要素:为解决上述技术问题,本发明提供了杂交瘤细胞株c11-6f7,以及由该细胞株产生的hcmv单克隆抗体和应用。该人巨细胞病毒单克隆抗体灵敏度较高,能特异性结合pp65-c214蛋白;用该单抗制备的试剂盒在流式细胞平台上的应用能满足临床检测要求,检测准确度与目前市售的核酸检测试剂盒一致,性能优于进口试剂盒。本发明提供的杂交瘤细胞株c11-6f7,保藏于中国典型培养物保藏中心,保藏编号为cctccno:c2017196,保藏日期为2017年9月21日,保藏地点为湖北省武汉市武昌珞珈山武汉大学。本发明还提供了一种鼠源性抗hcmv单克隆抗体,所述抗体由保藏编号为cctccno:c2017196的杂交瘤细胞株c11-6f7分泌产生,识别抗原为ul83编码的pp65蛋白c末端214个氨基酸。本发明还提供了hcmv单克隆抗体在免疫测定方法中的应用,包括在流式细胞技术、elisa免疫测定法、免疫层析测定法、免疫细胞化学染色测定法和免疫组化染色测定法等方面的应用。本发明还提供了一种试剂盒,所述试剂盒包含上述hcmv单克隆抗体。本发明提供了高特异性识别hcmv单克隆抗体,应用在免疫荧光和流式细胞技术方面,能够对感染细胞进行检测,并可反映hcmv感染的活跃状态。本发明利用截短的pp65基因c末端642个基因表达pp65-c214蛋白,降低成本同时也降低了重组抗原的表达难度,且获得的重组抗原纯度较高;用该单抗制备的试剂盒在流式细胞平台上的应用能满足临床检测要求,检测准确度与目前市售的核酸检测试剂盒一致,性能优于进口试剂盒。附图说明图1是重组抗原pp65-c214蛋白纯化的sds-page电泳结果图;图2是westernblot检测pp65-c214单抗特异性结果图;图3是抗体6f7与进口试剂盒抗体分别用间接流式法检测样本后测得的平均荧光强度对比图;其中图a为抗体6f7用间接流式法检测样本后测得的平均荧光强度图,图b为进口试剂盒抗体用间接流式法检测样本后测得的平均荧光强度图。图4是用间接免疫荧光法将本发明单抗与进口试剂盒分别对临床样本进行对比检测的结果图;其中,图a为本发明单抗制备的试剂盒对临床样本进行检测的结果图;图b为进口试剂盒对临床样本进行检测的结果图。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅是本发明一部分实施例,而不是全部实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。本说明书实施例中所涉及病毒、细胞株等术语及试剂说明如下:hcmv:人巨细胞病毒;pp65:ul83编码的抗原蛋白;6f7:抗hcmv-pp65单克隆抗体;vh-f/r混合物:单链抗体重链扩增引物;vl-f/r混合物:单链抗体轻链扩增引物;trizon:从天根公司购买;m-mlv:反转录酶;taq:从promega公司购买。实施例1:hcmv-pp65-c214单克隆抗体的获得制备抗hcmv-pp65-c214单克隆抗体按如下步骤进行:1.免疫原的制备:从ncbi中找出ul83编码的蛋白序列,其c末端214个氨基酸按原核表达密码子优化后合成基因序列,连接至原核表达载体pet30a中,经iptg诱导表达。包涵体经超声波破碎后沉淀用8m尿素溶解再过镍柱纯化,20mm咪唑洗涤杂蛋白,分别收集50mm、100mm、200mm咪唑洗脱下来的蛋白,洗脱产物跑sds-page鉴定,电泳结果如图1所示,图中标注pp65-c214的为200mm咪唑洗脱下来的目的蛋白,纯化的sds-page结果电泳图。由图1可见,所得到的免疫原蛋白大小与预期大小吻合,初步鉴定为目标蛋白。经鉴定过的重组蛋白-80℃保存待用。2.复性:新的透析袋用蒸馏水煮5-10min,取出擦干,装水检漏,待用。从-80℃取出重组蛋白约6ml,已知od约0.678,加入透析袋中,对1l0.02mpbs(ph7.2)+6m尿素于4℃透析过夜,期间用磁力搅拌器不断搅拌;取出,再继续用4/3/2/1/0m尿素+pbs对其4℃透析各1-2小时,取出重组蛋白离心,12000rpm离心1min,取上清至另一干净的ep管中,测od约0.530,-80℃保存待用,该蛋白称之为重组抗原pp65-c214。3.用上述复性的重组抗原pp65-c214免疫小鼠,制备单克隆抗体,具体步骤如下:用复性后的免疫原对小鼠进行初次免疫及两次加强免疫,制备脾脏细胞,并将其与处于生长对数期的小鼠骨髓瘤细胞sp2/0进行融合,获得杂交瘤细胞。上述所得杂交瘤细胞经过有限稀释法进行单克隆,再通过间接elisa筛选出阳性单克隆细胞株。单克隆后的细胞经注射入弗氏不完全佐剂预免的小鼠腹腔,诱导产生腹水。实施例2:间接elisa测所得腹水效价及灵敏度2.1腹水效价:实施例1中得到的抗原pp65-c214用碳酸盐缓冲液作为包被液,将其稀释后包被96孔板,100ng/孔,37℃热孵2h,孵育完毕后pbs-t洗板1次。加入实施例1中得到的不同稀释倍数的pp65-c214腹水37℃孵育30min,设置阴性对照孔、阳性对照孔(3e4)和空白对照孔(抗体稀释液),孵育完毕后pbs-t洗板5次。酶标稀释液将hrp标记抗体(羊抗鼠igg-hrp)稀释1000倍,每孔100μl。37℃孵育30min。孵育完毕后pbs-t洗板5次。显色,a液:b液=1∶1,现配现用。每孔100μl,37℃孵育15min;加入终止液,50μl/孔,终止显色反应,检测吸光度,见表1,表1是腹水效价测定结果表。由表1可见,筛选出来的12株腹水效价测定结果如下,所得腹水效价均约46,腹水经400万倍稀释后已经基本消除非特异性反应,结果显示1∶400万倍稀释后所述抗体6f7与抗原pp65-c214反应依然呈现较高的吸光度值,表明该抗体具有较高的灵敏度和特异性。表1腹水稀释倍数1∶1万1∶5万1∶10万1∶50万1∶100万1∶200万1∶400万空白c11-2f80.9050.3890.3060.2420.220.2090.2320.047c11-3a92.1621.7931.3510.6410.4660.3450.2720.046c11-14b70.6020.2850.3230.2170.210.2060.3770.057c11-3e42.3261.9231.7311.0120.6730.4850.3220.032c11-6f72.682.1141.8011.1050.7230.5490.4220.058c11-2e21.3060.6360.4010.210.1190.0930.0790.063c11-6a71.3691.2561.1881.0340.8670.6780.4480.039c11-2e31.2051.0390.8360.5390.3540.2540.1810.009c11-7e31.0091.0090.7240.5410.3350.1870.1010.073c11-7e51.1090.8470.5680.4380.3170.1770.1460.0062.2灵敏度测定:将筛选的12株腹水浓度调整至1mg/ml,与商品化抗体(均为1mg/ml)a(菲鹏生物)/b(hytestltd)/c(上海生工)同时对不同稀释浓度抗原做间接elisa检测灵敏度,抗原pct用碳酸盐包被液稀释后包被96孔板,100ng/孔,做5个梯度稀释,37℃热孵2h,孵育完毕后pbs-t洗板1次。加入单克隆抗体,37℃孵育30min,设置空白对照(抗体稀释液)。孵育完毕后,pbs-t洗板5次。酶标稀释液将hrp标记抗体(羊抗鼠igg-hrp)稀释1000倍,每孔100μl。37℃孵育30min。孵育完毕后,pbs-t洗板5次。显色a液:显色b液=1∶1,现配现用。每孔100μl,37℃孵育15min;加入终止液,50μl/孔,终止显色反应,检测吸光度,结果见下表2,表2为腹水灵敏度测定结果表,从表2结果可以看出,6f7等4株腹水灵敏度均高于购买的几株商品化单抗。表2抗原倍比稀释100ng/孔50ng/孔25ng/孔12.5ng/孔6.25ng/孔3.125ng/孔空白a(1mg/ml)1.3421.1551.920.6710.4650.290.004b(1mg/ml)1.4341.3111.1981.1310.8690.690.012c(1mg/ml)1.2981.2050.820.6180.430.2570.006c11-2f81.0550.8790.1180.1090.1020.10.005c11-3a92.2592.0412.0331.851.6991.480.04c11-14b70.8780.4940.2480.1290.0630.0460.001c11-3e42.3092.2342.171.9861.2381.070.026c11-6f72.3612.1222.0861.9221.7351.6050.006c11-2e21.3441.1930.6060.3110.1650.0810.014c11-6a71.5491.3961.2971.0990.9720.7520.011c11-2e31.2051.0390.8360.5390.3540.2540.009c11-7e31.0091.0090.7240.5410.3350.1870.073c11-7e51.3581.2091.0940.8330.7060.5150.027实施例3腹水特异性检测及westernblot进一步验证3.1特异性检测:分别包被pp65基因n末端1041bp编码的pp65-n347抗原和pp65-c214抗原,采用竞争elisa法检测6f7抗体对pp65-n347的交叉反应,以此检测抗体特异性,抗原用碳酸盐包被液稀释后包被96孔板,100/50ng每孔,37℃热孵2h,孵育完毕后pbs-t洗板1次。加入单克隆抗体,37℃孵育30min,空白对照(抗体稀释液)。孵育完毕后,pbs-t洗板5次。酶标稀释液将hrp标记抗体(羊抗鼠igg-hrp)稀释1000倍,每孔100μl。37℃孵育30min。孵育完毕后,pbs-t洗板5次。显色a液:显色b液=1∶1,现配现用。每孔100μl,37℃孵育15min;加入终止液,50μl/孔,终止显色反应,检测吸光度,结果见表3,表3为腹水特异性检测表,由表3结果表明,6f7等所得抗体均不与pp65-n347发生交叉反应,只特异性结合抗原pp65-c214。表33.2westernblot进一步验证抗hcmv单克隆抗体特异性:将抗原pp65-n347和pp65-c214加入上样缓冲液,煮沸5min后各点样4孔,进行15%sds-page电泳。经半干转法将sds-page胶上的抗原蛋白pp65-c214转入nc膜上,放入含有5%脱脂奶粉的tbs-t封闭30min。取出nc膜分别按8孔道剪开,将4种单克隆抗体3a9/6f7/6a7/3e4分别1:1000稀释后孵育上述nc膜条,同时置于37℃孵育2h,tbs-t洗涤3次,10min/次,各加入二抗羊抗鼠igg-hrp,37℃孵育1h,tbs-t洗涤3次,加入显影液,置于凝胶成像仪中拍照,结果如图2所示,图2是westernblot检测pp65-c214单抗特异性结果图;有条带说明有抗原(pp65-c214)与抗体(腹水)特异性结合,没有条带说明没结合,由图2可见,所述6f7等其他四种单抗能与抗原pp65-c214特异性结合,而不与pp65-n347抗原发生非特异性结合反应。实施例4:比较本发明单抗及进口试剂盒的灵敏度mrc-5细胞(atcc)培养成单层后,消化收集细胞,用4%甲醛固定后用0.1m磷酸盐缓冲液(pbs)洗涤,再用pbs重悬制成细胞悬液;cmv接种到长至单层的mrc-5细胞,病变产生后收集细胞,用4%甲醛固定后用pbs洗涤,再用pbs重悬制成细胞悬液。上述mrc-5细胞和cmv感染细胞悬液分别加入6f7、进口试剂盒一抗(cmvbriteturbo,iqproducts),混匀后37℃温育20分钟。用pbs洗涤后,再分别加入羊抗鼠igg-fitc(购自广州锐达生物科技有限公司),混匀后37℃温育20分钟。pbs洗涤后,用流式细胞仪(aceanovecyte)检测。检测结果见图3,图3为抗体6f7与进口试剂盒抗体分别用间接流式法检测样本后测得的平均荧光强度对比图;其中图a为抗体6f7用间接流式法检测样本后测得的平均荧光强度图,图b为进口试剂盒抗体用间接流式法检测样本后测得的平均荧光强度图;由图3分析得到的检测结果,见表4,表4为抗体6f7与进口试剂盒抗体比较结果表,由此可见,间接免疫荧光法染色后,6f7产生的p/n大于进口试剂盒产生的p/n,更适合于用在间接流式细胞法和间接免疫荧光检测中,也就是说本发明获得单抗制备的试剂盒对样本检测具有更低的背景信号,更高的准确度,也即具有更高的灵敏度。表4实施例5:单抗6f7与进口试剂盒比较,检测cmv复发器官移植患者血液样本中的pp65抗原血液样本用进口试剂盒(cmvbriteturbo,iqproducts)中的红细胞裂解液裂解红细胞后,收集白细胞,计数,取20万细胞涂到载玻片上(每块载玻片涂20万个细胞,共涂2块载玻片),干燥后用进口试剂盒(cmvbriteturbo,iqproducts)固定液和通透液进行固定和通透。再分别滴加6f7抗体和进口试剂盒一抗,37℃温育20分钟。用pbs洗涤后,再分别加入羊抗鼠igg-fitc(购自广州锐达生物科技有限公司)和进口试剂盒二抗(cmvbriteturbo,iqproducts),混匀后37℃温育20分钟。pbs洗涤后,用荧光显微镜观察和拍照。结果见图4,图4是用间接免疫荧光法将本发明单抗与进口试剂盒分别对临床样本进行对比检测的结果图;其中,图a为本发明单抗制备的试剂盒对临床样本进行检测的结果图;图b为进口试剂盒对临床样本进行检测的结果图。实施例6:用流式细胞将单抗6f7与人巨细胞病毒核酸检测试剂盒(购自凯杰公司)对器官移植患者血液样本中的cmv进行检测的对比试验采集81位患者血液样本,按人巨细胞病毒核酸检测试剂盒(凯杰)说明书检测血浆中的cmvdna;血液样本采用ficoll分离液提取单个核白细胞,再按实施例1所述方法,用6f7和羊抗鼠igg-fitc(购自广州锐达生物科技有限公司)进行流式检测。将两种检测方法的结果统计见表5。表5为用流式细胞法将本发明单抗与人巨细胞病毒核酸检测试剂盒(购自凯杰公司)对器官移植患者血液样本中的cmv进行检测的对比试验的结果数据表。根据spss13.0统计结果可得,kappa>0.75同时p<0.05说明两种方法诊断结果一致性较好,均反映同一指标,且相异部分的差异不显著,结果显示所述单抗可以用于流式细胞平台对临床样本的检测,其检测结果的准确度与目前市售的分子诊断试剂盒一致。表5实施例7:单链抗体基因提取1、杂交瘤细胞rna提取及cdna合成:收集新鲜的15ml生长至对数期的分泌6f7的杂交瘤细胞,经无血清培养基洗涤后,用trizol法提取细胞总rna;再以总rna为模板,以oligodt和随机引物为引物,经m-mlv逆转录酶形成cdna。2、单链抗体重链和轻链基因的扩增:以上述cdna为模板,分别以本实验室保存的vh-f/r、vl-f/r为引物扩增得到单克隆抗体可变区的重链和轻链基因pcr产物。反应条件为94℃预变性5min,94℃变性30s,60℃退火30s,72℃延伸30s,共35循环,最后72℃10min。将上述pcr产物回收连接至t载体中,测序得到重链和轻链基因序列,均长约300bp左右。cmv-vh-p与本室其他鼠源单抗重链可变区氨基酸序列对比及blastp结果如下所示:测序所得的基因序列通过expasy在线翻译成氨基酸序列,blastp比对结果及其与本室其他鼠源单抗重链和轻链氨基酸序列进行同源性比对,结果显示6f7-vh和6f7-vl分别为鼠源单克隆抗体的重链和轻链可变区序列,其中重链可变区氨基酸序列与本室其他单抗重链可变区氨基酸序列的同源性均低于68%,中间存在几个同源性极低的片段可能为抗体高变区序列,cmv-vl-p与本室其他鼠源单抗轻链可变区氨基酸序列对比及blastp结果如下所示:结果表明扩增得到的所述两种单抗可变区基因序列没有被污染,为新发现的鼠源单链抗体可变区片段。原则上分泌单克隆抗体的细胞只产生一种类型的抗体分子,严格地说只产生含一种重链可变区和一种轻链可变区的抗体分子,因此所得到的基因即是所述hcmv抗原对应的鼠源抗体。本发明利用ul83编码表达的抗原pp65免疫小鼠获得了具有特异结合hcmv的单克隆抗体,有利于开展pp65抗原血症检测,更重要的是,通过免疫荧光及流式细胞技术验证了本发明的单抗对hcmv检测在特异性及灵敏度方面均达到hcmvpp65进口检测试剂盒的水平,不仅可以联合荧光定量pcr法检测得到更加客观准确的结果,同时也有利于改进现行hcmv抗原血症检测技术。单克隆抗体及其单链抗体基因的获得对hcmv临床诊断等研究具有潜在意义。以上所述是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和变形,这些改进和变形也视为本发明的保护范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 抗凝血因子ix单克隆抗体的杂交瘤细胞株的制作方法
- 抗凝血因子vii多克隆抗体的杂交瘤细胞株的制作方法
- 杂交瘤细胞株及其分泌的抗口蹄疫o型(o/gx/09-7)病毒的特异性单克隆抗体与应用
- 杂交瘤细胞株及其分泌的抗口蹄疫o型病毒的单克隆抗体与应用
- 抗lgr5蛋白单克隆抗体杂交瘤细胞及其产生的抗lgr5单克隆抗体和应用
- 抗gata3蛋白单克隆抗体杂交瘤细胞及其产生的抗gata3单克隆抗体和应用
- 抗cd56蛋白单克隆抗体杂交瘤细胞及其产生的抗cd56单克隆抗体和应用
- 抗pr蛋白单克隆抗体杂交瘤细胞及其产生的抗pr单克隆抗体和应用
- 抗pd-1蛋白单克隆抗体杂交瘤细胞及其产生的抗pd-1单克隆抗体和应用
- 抗egfr蛋白单克隆抗体杂交瘤细胞及其产生的抗egfr单克隆抗体和应用