全人源PD-L1单克隆抗体及其制备方法和应用与流程
本发明属于生物医药工程技术领域,具体涉及一种全人源pd-l1单克隆抗体及其制备方法和应用。
背景技术:
t细胞的活化是免疫系统发挥作用的重要步骤,不仅需要抗原递呈细胞(apc)所提供的第一信号,同时也受到共刺激信号(第二信号)的调节。共刺激信号是一类细胞表面的膜蛋白,起到协同调节t细胞增殖、活化及分化的作用。
程序性死亡因子1配体1(programmeddeath1ligand1,pd-l1)又称cd274,为b7家族成员,是pd-1的配体。pd-l1属于i型跨膜蛋白,共290个氨基酸,包含1个igv样区、1个igc样区、1个跨膜疏水区和1个由30个氨基酸组成的胞内区。与其他b7家族分子不同的是,pd-l1具有负向调节免疫应答的作用。研究发现,pd-l1主要表达于活化的t细胞、b细胞、巨噬细胞和树突状细胞等,除淋巴细胞外,pd-l1也表达于其他多种组织如胸腺、心脏、胎盘等的内皮细胞,以及各类非淋巴系如黑色素瘤、肝癌、胃癌、肾细胞癌、卵巢癌、结肠癌、乳腺癌、食道癌、头颈癌等。pd-l1在调节自身反应性t、b细胞和免疫耐受方面具有一定广泛性,并且在外周组织t和b细胞应答中起作用。pd-l1在肿瘤细胞上的高表达与癌症患者的不良预后相关。
与pd-l1相结合的程序性死亡因子1(programmeddeath-1,pd-1)又称cd279,是cd28家族成员,其胞质区含有2个酪氨酸残基,靠近n端的1个位于免疫受体酪氨酸抑制基序(immunoreceptortyrosine-basedinhibitorymotif,itim)中,靠近c端的1个位于免疫受体酪氨酸转化基序(immunoreceptortyrosine-basedswitchmotif,itsm)中。pd-1主要表达在活化的t淋巴细胞、b淋巴细胞和巨噬细胞表面。在正常情况下,pd-1能够抑制t淋巴细胞的功能,促进treg的功能,从而抑制自身免疫应答,防止自身免疫性疾病的发生。但在肿瘤的发生中,肿瘤细胞表达的pd-l1与pd-1结合后却能通过对淋巴细胞的抑制性作用促进肿瘤的免疫逃逸。pd-l1与pd-1的结合可导致多种生物学变化,引起免疫调控,如能够抑制淋巴细胞的增殖和活化、抑制cd4+t细胞向th1和th17细胞分化、抑制炎性细胞因子的释放等。
噬菌体抗体库技术模拟了人类b细胞的分化成熟过程,首先通过分子生物学手段将人类抗体的重链和轻链可变区基因连接起来形成单链抗体(single-chainvariablefragment,scfv),插入噬菌体载体上,使单链抗体scfv展示在噬菌体表面,再用特定的抗原筛选出特异性的噬菌体抗体,并用大肠杆菌表达大量单链抗体。
单克隆抗体在癌症的检测及生物靶向治疗方面成功的应用,引起了肿瘤治疗的变革。然而,传统的单抗(150kd)分子质量过大,难穿透组织,造成肿瘤区域的有效浓度较低,治疗效果不充分;传统的抗体具有很高的免疫原性,而改造的抗体很难达到原来的亲和力。此外,完全人源化的传统抗体开发周期长,生产成本高,稳定性不够等诸多因素限制其在临床中的应用及普及。
pd-1/pd-l1免疫疗法是通过阻断二者间的相互作用来提高免疫应答,具有治疗多种类型肿瘤及感染性疾病的潜力。程序性死亡受体-1(programmeddeath-1,pd-1)是cd28超家族成员,为一种重要的免疫抑制分子,主要表达在激活的t细胞和b细胞上。pd-1与其配体pd-ls(programmeddeath-1ligands,主要是pd-l1与pd-l2)结合能够抑制t细胞的增殖、活化和相关细胞因子的分泌,使机体免受自身免疫系统的攻击。但在机体的肿瘤微环境中,肿瘤细胞高表达pd-l1,与t细胞上的pd-1发生结合后,诱导t细胞的衰竭,抑制t细胞的功能,无法有效激活免疫系统,引起肿瘤细胞的免疫逃逸。而针对pd-1、pd-l1的单克隆抗体可以阻断pd-1和pd-l1的结合,使t细胞恢复活力,从而增强免疫应答。目前,多株抗pd-1和pd-l1的抗体已上市,用于多种肿瘤的治疗,如nivolumab(抗pd-1抗体)、keytruda(抗pd-l1抗体)等。
罗氏(roche)公司的atezolizumab(商品名tecentriq)的作用靶点为pd-l1,2016年5月19日fda提前四个月批准其作为二线药物用于治疗一种叫做urothelialcarcinoma的最常见晚期膀胱癌,被认为是最有前途的新一代免疫疗法之一。
阿斯利康(astrazeneca)针对pd-l1靶点的免疫疗法药物imfinzi(durvalumab),近期在一项非小细胞肺癌(nsclc)的3期和非小细胞肺癌(nsclc)的3期临床试验中取得了突破性的进展。研究人员表示,抗pd-l1药物比抗pd-1药物具有更高的选择性,并可能减少肺脏及其他器官的炎症。
本发明以重组人pd-l1胞外区蛋白为抗原,通过噬菌体展示文库的筛选和亲和力成熟后,制备得到高亲和力的抗pd-1特异性单克隆抗体,并通过体内外实验验证其高效生物学活性。
技术实现要素:
本发明的首要目的在于提供一种新的氨基酸序列的全人源抗人pd-l1单克隆抗体,编码该单克隆抗体的核苷酸的载体、宿主细胞及其用途。本发明涉及的抗体基因可变区的序列,可构建全长抗体分子,作为药物用于临床上发挥抑制肿瘤细胞增殖的作用。
为实现上述目的,本发明采用的技术方案是:
首先构建抗原pd-l1表达载体pcdna-hpd-l1-his,将重组质粒瞬时转染freestyletm293细胞,培养五天后将细胞上清通过镍柱进行纯化,得到纯化的蛋白即抗原人pd-l1-his。
采用kabat数据库cdr区分类方法进行6个cdr分类,统计各cdr中氨基酸出现频率,剔除结构保守的loop和远离结合区域的氨基酸,挑cdr上氨基酸残基在数据库中出现频率低的用于序列随机化,放弃氨基酸出现频率较高的残基;通过cdr长度信息统计,确定各类cdr的长度多样性。每个突变位点使用nwg,nwc和nsg(n=a,t,g或c;w=a或t;s=g或c)简并密码子。产生了14种具有长度多样性和序列多样性的cdr引物库,其中cdr-l1,l2,l3,h1和h2多样性介于105-107;长度多样性为6-10aa,11-14aa的cdr3-h3引物库序列多样性介于108-1012,采用高通量芯片基因合成方法合成,引物库包含用于pcr扩增的框架区和多样化的cdr区域。
pcr扩增重链及轻链的可变区。然后进行人源vh和vl的单链抗体库的构建,构建步骤是先将cdr-l1和cdr-l2通过扩增延伸和psti/mlui单一酶切位点克隆入pc3xk-vk-bla载体,构建成为pc3xk-vk-cdr1-cdr2-bla载体,扩增延伸cdr3和bpii/hindiii酶切位点克隆入pc3xk-vk-cdr1-cdr2-bla载体,构建成为pc3xk-vk-bla-lib。利用同样的方法构建pc3xk-vh-bla-lib。将vk-lib用saci和hindiii酶切位点克隆入pc3xf-scfv载体,构建成为pc3xfss-vk-lib载体,再将vh-lib用bamhi和sali酶切位点克隆入pc3xfss-vk-lib载体,电转化入tg1感受态细菌,构建成为单链组合抗体库pc3xfss-scfv-lib。
将得到的单抗链体库进行噬菌体展示及淘选,经elisa、竞争elisa及octet初步筛选后,选定一个单链抗体,进行亲和力成熟,选定一组抗体构建为全长igg分子,完成亲和力,细胞活性,以及动物体内活性等一系列测定,再对这些抗体可变区特别是cdr序列检索,确定具备抑制肿瘤细胞增殖作用的抗pd-l1的单克隆抗体的重链可变区cdr序列和轻链可变区cdr序列。
上述技术方案产生的有益效果在于:本发明提供的上述单克隆抗体,其用作抗pd-l1的抗体。该抗体可用于增强t细胞的功能以上调细胞介导的免疫应答和用于治疗t细胞功能失调性病症,例如肿瘤免疫,和用于治疗癌症。所述的全人源pd-l1单克隆抗体,具有低免疫原性的特点,且能够特异性结合多种肿瘤细胞(如人非小细胞肺癌hcc827)表面表达的pd-l1,恢复t细胞的功能,促进t细胞的增殖、活化和相关细胞因子(如il-2和ifn-γ)的分泌,从而增强免疫应答,用于多种肿瘤的治疗。
附图说明
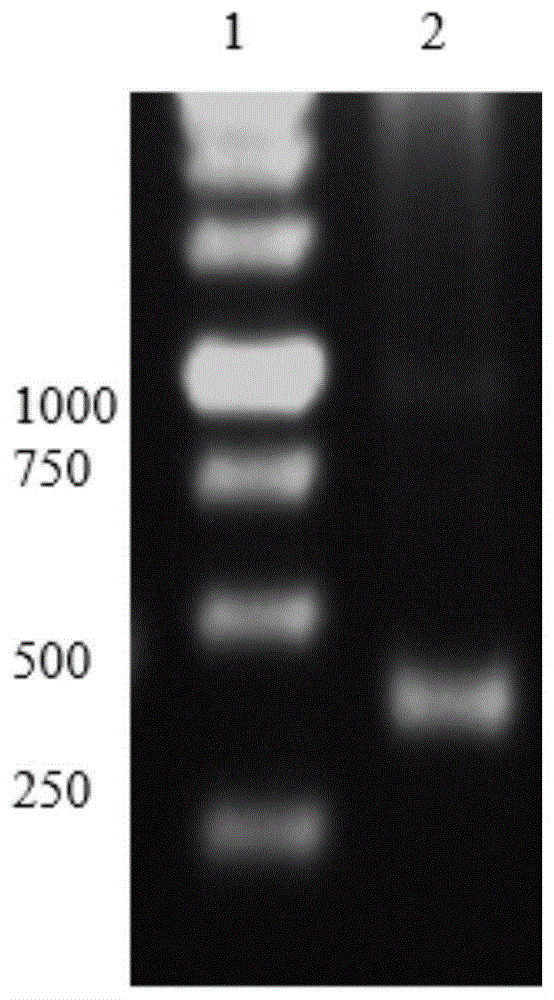
图1为琼脂糖凝胶电泳检测pd-l1基因。其中,泳道1为1kbdnaladder,泳道2为引物扩增后的pd-l1基因,与预期的345bp大小位置一致。
图2为sds-page(聚丙烯酰胺凝胶电泳)检测pd-l1蛋白的纯度。其中,泳道1为蛋白ladder,泳道2为还原性pd-l1蛋白(+dtt)。泳道3为非还原性pd-l1蛋白(-dtt),结果表明纯化后的pd-l1蛋白纯度较高,且以单体的形式存在。
图3为elisa测定人源化pd-l1单克隆抗体的结合活性。elisa结果表明,全人源pd-l1单克隆抗体可以与重组人源pd-l1(rhpd-l1)特异性抗原结合。
图4为elisa测定人源化pd-l1单克隆抗体的阻断活性。elisa结果表明,全人源pd-l1单克隆抗体可以阻断重组人源pd-l1(rhpd-l1)与hpd1-mfc的结合。
图5为elisa测定全人源pd-l1单抗与rpd-l2和mpd-l1的交叉反应。elisa结果表明,全人源pd-l1抗体能识别hpd-l1和m-pd-l1,但不与hpd-l2结合。
图6为facs测定全人源pd-l1单克隆抗体的结合活性。流式检测的结果表明,全人源pd-l1单抗能够识别细胞表面的pd-l1蛋白,且呈现出浓度梯度依赖特性。
图7为facs测定全人源pd-l1单克隆抗体的阻断活性。流式检测的结果表明,全人源pd-l1单抗能够阻断细胞表面的pd-l1蛋白与hpd-1-mfc的结合,且呈现出浓度梯度依赖特性。
图8为spr测定全人源pd-l1单克隆抗体的结合动力学常数,测得的其kd(m)值约为2.2806e-9。
图9为pd-l1单抗阻断cho-pd-l1-tcr/jurkat-pd-1-nfat细胞的结合。结果表明,全人源pd-l1单抗可阻断cho-pd-l1-tcr/jurkat-pd-1-nfat细胞pd-l1与pd-1的结合,且半数有效浓度为0.2058μg/ml。
图10为全人源pd-l1单克隆抗体的免疫原性预测结果,其中10(a)为重链可变区详细肽人类和免疫原性(phi)图,10(b)为轻链可变区的详细肽人类和免疫原性(phi)图。其中x轴代表相应的氨基酸序列的位置,y轴是其与hla等位基因结合的强度(最大值为8),与人胚系基因的同源性用右y轴的彩色线表示。cdr(kabat定义)用垂直虚线标记。其中各线条的代表的含义如下:灰色表示结合等位基因的强度在阈值的3-5%(左y轴),黑色表示结合等位基因的强度在阈值的度1-2%(左y轴)。
图11为mlr测定pd-l1单抗对t细胞的活化结果,其中11(a)为pd-l1单抗对ifn-γ的水平的影响,11(b)为pd-l1单抗对il-2的水平的影响。
图12为pd-l1抗体对体内移植瘤作用。其中12(a)为pd-l1抗体对肿瘤体积大小的影响,12(b)pd-l1抗体对小鼠体重的影响。
具体实施方式
下面结合实施例对本发明作详细的说明。
器材与试剂:
一、器材:
ni-nta树脂:购自qiagenge公司,货号30210;
超滤离心管:购自millipore公司,规格3kd;
酶标仪:购自biotek公司,型号为elx800;
流式仪:购自beckman公司,型号为cytoflex;
co2生化培养箱;购自thermo公司,型号为heracell240i;
countstar细胞计数仪:购自上海睿珏生物科技公司,型号为ic1000;
涡旋仪:购自上海沪西分析仪器厂有限公司,型号为wh-2;
倒置显微镜:购自宁波舜宇仪器有限公司,型号为xd;
超净台工作台:购自苏州净化设备有限公司,型号为sw-cj-2f;
离心机:购自湖南湘仪实验室仪器开发有限公司,型号为l535-1;
二、试剂:
primestarhsdnapolymerase:购自takara,货号r010a;
fdbamhi:购自thermo公司,货号fd0054;
fdxhoi:购自thermo公司,货号fd0694;
t4dnaligase:购自thermo公司,货号el0011;
expifectamine:购自invitrogen公司,货号a14524;
pcdna3.1+:购自invitrogen公司;
鼠源anti-his一抗:购自武汉三鹰生物技术有限公司,货号66005-1-ig;
羊抗人hrp二抗:购自pierce公司,货号31413;
羊抗鼠fitc二抗:购自jackson公司,货号115-095-166;
rhpd-l2抗原:购自acro公司,货号pd2-h5220;
mpd-l1抗原:购自acro公司,货号pd1-m5220;
rhpd-l1抗原:自研;
rhpd1-mfc抗原:自研;
bio-rhpd-l1-avi-his抗原:自研;
opd:中文名邻苯二胺,购自sigma公司,货号p8412;
h2so4:购自国药集团,规格500ml;
cho-rpd-l1细胞:自主构建;
cho-pdli-tcr细胞:购自bps公司;
jurkat-pd1-nfat细胞:购自bps公司;
t细胞:从健康人血中分离而得;
dc细胞:从健康人血中分离cd14+细胞并刺激分化而得;
山羊血清:购自博士的博士德生物公司,货号ar0009;
生物素:购自genecopoeia公司,货号bira500;
tpbs(100ml):0.1mltween20+99.9mlpbs;
facsbuffer(100ml):99mlpbs+1mlbsa;
optimem:购自thermo公司,货号22600-134;
dmem培养基:购自sigma公司,货号d6429;
pbs缓冲液;购自hyclone公司,货号sh30256.01;
胰酶:购自hyclone公司,货号sh30042.01;
penicillin-streptomycin:购自hyclone公司,货号sv30010;
实施例1:构建噬菌体展示文库
1.1抗体库的设计及cdr合成
本文构建单链抗体基因库的germline基因:包含两种人源igg型抗体轻链可变区master基因,vk2和vk3;两种人源igg型抗体重链可变区master基因,vh3和vh4。使用absys抗体数据库下载抗体序列,采用kabat数据库cdr区分类方法进行6个cdr分类,统计各cdr中氨基酸出现频率,剔除结构保守的loop和远离结合区域的氨基酸,挑cdr上氨基酸残基在数据库中出现频率低的用于序列随机化,放弃氨基酸出现频率较高的残基;通过cdr长度信息统计,确定各类cdr的长度多样性。每个突变位点使用nwg,nwc和nsg(n=a,t,g或c;w=a或t;s=g或c)简并密码子。产生了14种具有长度多样性和序列多样性的cdr引物库,其中cdr-l1,l2,l3,h1和h2多样性介于105-107;长度多样性为6-10aa,11-14aa的cdr3-h3引物库序列多样性介于108-1012,采用高通量芯片基因合成方法合成,引物库包含用于pcr扩增的框架区和多样化的cdr区域。
1.2构建scfv单链抗体展示抗体库
pcr扩增重链及轻链的可变区。然后进行人源vh和vl的单链抗体库的构建,构建步骤是先将cdr-l1和cdr-l2通过扩增延伸和psti/mlui单一酶切位点克隆入pc3xk-vk-bla载体,构建成为pc3xk-vk-cdr1-cdr2-bla载体,扩增延伸cdr3和bpii/hindiii酶切位点克隆入pc3xk-vk-cdr1-cdr2-bla载体,构建成为pc3xk-vk-bla-lib。利用同样的方法构建pc3xk-vh-bla-lib。将vk-lib用saci和hindiii酶切位点克隆入pc3xf-scfv载体,构建成为pc3xfss-vk-lib载体,再将vh-lib用bamhi和sali酶切位点克隆入pc3xfss-vk-lib载体,电转化入tg1感受态细菌,构建成为单链组合抗体库pc3xfss-scfv-lib。
1.3高通量测序分析抗体库质量
pcr扩增文库质粒的scfv区,胶回收后经2%琼脂糖凝胶电泳电泳确保样品特征性条带完整清晰,控制dna总量≥5μg,od260/280为1.8~2.0。样品送至联川生物科技有限公司测序。
实施例2:pd-l1抗原的表达与纯化
2.1合成pd-l1基因
ncbi数据库检索pd-l1的基因序列(genbankaccession:ay714881.1),分析其核苷酸序列,针对核苷酸序列进行去相关酶切位点或减少茎环结构等改造,委托通用生物系统(安徽)有限公司全基因合成抗人pd-l1全长基因,其核苷酸序列如seqidno:7所示,氨基酸序列如seqidno:8所示。
2.2克隆pd-l1基因
2.2.1pcr扩增bamhi-pd-l1-xhoi
设计pd-l1基因的上下游引物p1和p2:
p1:aatggatccactggtgacgcatttactgtcacggttcc(下划线为bamhi酶切位点)
p2:aatctcgagttagtggtggtggtggtggtgacctcctccattgactttcacagtaattcgcttgt(下划线为xhoi酶切位点)
以合成的含有pd-l1基因的质粒(p-pd-l1)为模板,使用primestarhs聚合酶(takara公司),pcr扩增得到pd-l1基因片段。其扩增体系,具体如下:
pcr反应程序,具体如下:
2.2.2双酶切
bamhi/xhoi酶切载体pcd-cavi-his(改造自pcdna3.1+)与目的片段bamhi-pd-l1-xhoi,酶切产物经dna胶回收后用于连接转化。酶切体系如下:
2.2.3连接转化与测序
取3μl酶连产物,转化入dh-5a感受态细胞,涂布氨苄板后挑克隆送测序,即获得真核表达质粒pcd-pd-l1-avi-his,测序鉴定载体序列正确。
2.3抗原pd-l1蛋白表达与纯化
2.3.1pd-l1的表达与鉴定
向24孔培养板中接种expi293细胞,接种密度2.5~3×106cells/ml,接种量1ml/孔,转染时细胞活率大于90%。将1μgdna(pcd-pd-l1-avi-his)稀释于50μloptimem,轻轻浑匀,再将2.7μl稀释于50μloptimem中,轻轻浑匀,室温孵育5分钟后将所得dna稀释液和所得expifectamine稀释液混合,轻轻浑匀,室温孵育20分钟,将所得dna--expifectamine复合物(总体积约100μl)加入培养孔板中,前后摇动培养板使其分布均匀。将细胞放入培养箱继续培养16h,按照5μl/ml的添加比例加入转染enhancer1,50μl/ml的添加比例加入转染enhancer2,1μl/ml的添加比例加入抗生素,轻轻混匀,继续培养4天,细胞活率低于50%时,收集全部细胞离心。
用鼠源anti-his作为一抗,通过免疫印迹法检测expi293细胞转染的pcd-pd-l1-avi-his的表达,结果如附图1所示。其中,泳道1为1kbdnaladder,泳道2为引物扩增后的pd-l1基因,与预期的345bp大小位置一致。在确认pd-l1抗原表达后,扩大转染体系至30ml(操作同上)。
2.3.2pd-l1蛋白的纯化与纯度鉴定
收集培养基上清液,用ni-nta树脂纯化pd-l1-avi-his,随后用截留分子量为3kda的超滤离心管超滤浓缩pd-l1-avi-his,经sds-page验证其纯度,结果如附图2所示:其中,泳道1为蛋白ladder,泳道2为还原性pd-l1蛋白(+dtt)。泳道3为非还原性pd-l1蛋白(-dtt)。附图2表明:纯化后的pd-l1蛋白纯度较高,且是单体。
实施例3:pd-l1抗体的产生
3.1噬菌体展示文库筛选和富集
取40μlm280磁珠,加入1mlpbs洗2次,重悬于1.5ml3%milk-pbs封闭剂,室温温育20-30分钟,1mltpbs洗2次,重悬于40μl封闭剂。将磁珠分到2个2mlep管,每管1ml,分别加入5x1011cfu的重组phage,室温温育1小时。将生物素化的抗原分别稀释到0.2mg/ml,总体积20μl,加入上述ep管中,室温温育1小时,随后用1mltpbs洗3次并用0.1ml封闭剂重悬。
将上述噬菌体-磁珠复合物置于磁力柱静置5分钟,加入1mlpbs,然后每管加入0.5ml盐酸-甘氨酸洗脱液,混匀后室温,旋转,温育5-7分钟洗脱磁珠上的噬菌体颗粒。将洗脱溶液加入10ml培养的tg1(约1x109克隆,预先加入40μl2mtris-base中和液),置于50ml离心管中,37度,静置30分钟,然后37c,250rpm摇30分钟。取感染后的tg1菌液氨苄板,置于30度培养箱过夜培养。
对平板上的克隆数进行定量,并用该平板上的菌落制备下一轮的重组噬菌体筛选备用。经过三轮的筛选和富集,最终得到一个具有阻断活性的候选克隆。
3.2亲和力成熟
由于筛选得到的候选克隆亲和力较低,通过分析候选克隆的cdr区序列,设计引物对lcdr3、hcdr1、hcdr2、和hcdr3区进行突变,构建4个突变cdr区的质粒库和噬菌体展示库,筛选后得到若干亲和力提高的具有阻断活性的候选克隆。其中,lcdr3、hcdr1、hcdr2、和hcdr3引物序列见表1、2、3、4:
表1:lcdr3引物序列
表2:hcdr1引物序列
表3:hcdr2引物序列
表4:hcdr3引物序列
3.3全人源pd-l1抗体的产生
经过三轮的噬菌体展示文库筛选和富集,得到一系列单cdr突变亲和力提高的克隆,再通过“cdr-grafting”对优选cdr进行组合配对,最终得到若干亲和力提高的多cdr突变的scfv单链抗体。将所得scfv抗体的轻重链分别导入pcd-l和pcd-h(自研)载体中,转染expi293细胞,得到全人源pd-l1单克隆抗体。
实施例4:elisa测定全人源pd-l1单克隆抗体的结合活性
rhpd-l1抗原稀释至0.2μg/ml,4℃铺板过夜,tpbs(pbs+0.5%tween-20)洗涤3次,37℃培养箱封闭1h。封闭后再用tpbs洗3次,然后加入全人源pd-l1单克隆抗体,从起始浓度1μg/ml做3倍梯度稀释100μl/孔,依次稀释八个浓度梯度。室温震荡孵育1h,tpbs洗3次后加入羊抗人hrp二抗,室温震荡孵育30min。tpbs洗3次,加入opd显色,并用h2so4终止。
酶标仪测定od490nm吸光值,结果如附图3所示。附图3表明:全人源pd-l1单克隆抗体可以与重组人源pd-l1(rhpd-l1)抗原特异性结合。
实施例5:elisa测定全人源pd-l1单克隆抗体的阻断活性
rhpd1-mfc抗原稀释至1μg/ml,4℃铺板过夜,tpbs洗涤3次,37℃烘箱封闭1h,tpbs洗3次后加入pd-l1抗体及生物素标记的pd-l1,pd-l1抗体从起始浓度8μg/ml做3倍梯度稀释100μl/孔,依次稀释八个浓度梯度,生物素标记的pd-l1的浓度为50ng/ml。室温震荡孵育1h,tpbs洗3次后加入羊抗人hrp二抗,室温震荡孵育30min。tpbs洗3次,加入opd显色,用h2so4终止。
酶标仪测定od490nm吸光值,结果如附图4所示。附图4表明:全人源pd-l1单克隆抗体可以阻断重组人源pd-l1(rhpd-l1)与hpd1-mfc的结合。
实施例6:elisa测定全人源pd-l1单抗与mpd-l1和hpd-l2的交叉反应
rhpd-l1,mpd-l1和hpd-l2抗原分别用pbs稀释至0.2μg/ml,4℃铺板过夜,tpbs洗涤3次,37℃烘箱封闭1h,tpbs洗3次后加入全人源pd-l1单克隆抗体,从起始浓度200μg/ml做5倍梯度稀释100μl/孔,依次稀释八个浓度梯度。室温震荡孵育1h,tpbs洗3次后加入羊抗人hrp二抗,室温震荡孵育30min。tpbs洗3次,加入opd显色,用h2so4终止。
酶标仪测定od490mm吸光值,结果如附图5所示。附图5表明:全人源pd-l1单克隆抗体能识别hpd-l1和m-pd-l1,但不与hpd-l2结合。
实施例7:facs测定全人源pd-l1单克隆抗体的结合活性
用胰酶消化cho-rpd-l1细胞,细胞计数后均分成5管,每管约2-8*105个细胞,1000rpmx5min离心弃培养基后,每管加入200μlfacsbuffer,5μl正常山羊血清,冰浴封闭30min。用1mlfacsbuffer清洗细胞一次后加入100μlfacsbuffer和从10μg/ml做10倍梯度稀释的全人源pd-l1单克隆抗体(即10,1,0.1,0.01μg/ml),冰浴30min后洗2次,再加入羊抗人fitc二抗(1:200),避光冰浴30min后洗2次,加入400μlfacsbuffer重悬,上beckmancytoflex流式机检测。
流式检测结果如附图6所示。附图6表明,全人源pd-l1单克隆抗体能够识别细胞表面的pd-l1蛋白,且呈现出浓度梯度依赖特性。
实施例8:facs测定全人源pd-l1单克隆抗体的阻断活性
用胰酶消化cho-rpd-l1细胞,细胞计数后均分成6管,每管约2-8*105个细胞,1000rpmx5min离心弃培养基后每管加入200μlfacsbuffer,5μl正常山羊血清,冰浴封闭30min。用1mlfacsbuffer清洗细胞一次后加入100μlfacsbuffer和从10μg/ml做10倍梯度稀释的全人源pd-l1单克隆抗体(共四个浓度梯度,即10,1,0.1,0.01μg/ml)以及0.5μg/ml的hpd1-mfc,冰浴60min后洗2次,再加入羊抗鼠fitc二抗(1:200),避光冰浴30min后洗2次,加入400μlfacsbuffer重悬,上beckmancytoflex流式机检测。
流式检测的结果如附图7所示。附图7表明,全人源pd-l1单克隆抗体能够阻断细胞表面的pd-l1蛋白与hpd-1-mfc的结合,且呈现出浓度梯度依赖特性。
实施例9:spr测定全人源pd-l1单抗与pd-l1的结合动力学常数
将放入sa芯片放入get200芯片槽,用pbs作流动相,prime两次,用pbs稀释生物素标记的bio-rhpd-l1-avi-his抗原至50ng/ml标记通道2,留通道1做空白对照。当2通道的ru值30~40时,停止标记。然后将用pbs稀释pd-l1单抗至10μg/ml,做2倍浓度梯度稀释,共6个浓度梯度。设定程序,确定结合2分钟,解离10分钟,再生1分钟。
测定结果如附图8所示。附图8表明:kd(m)值约为2.2806×10-9。
实施例10:pd-l1抗体阻断cho/jurkat细胞的结合测试
取对数生长期的cho-pd-l1-tcr细胞,胰酶消化后用f12+10%fbs+1%ps培养基重悬细胞使细胞浓度达到5ⅹ105cells/ml。在96孔板中加入100μl细胞混悬液,每个浓度3个复孔,细胞浓度50000cells/well,并在黑色康宁96孔板四周加入100μlpbs缓冲液,co2培养箱培养16-24h。用1640+10%fbs培养基稀释抗体终浓度为100μg/ml,再做3倍梯度稀释,共9个梯度。准备jurkat-pd1-nfat细胞,用理论buffer混悬使细胞浓度达到6.25ⅹ105cells/ml。弃去96孔板中全部cho-pd-l1-tcr培养上清,加入pd-l1单抗稀释液40μl每孔并室温孵育20min后,黑色康宁96孔板中加入40μljurkat-pd1-nfat,细胞浓度25000cells/孔,96孔板周围加入80μl的pbs,随后放入co2培养箱中培养6h后每孔加入80μl已经达到室温的promegabio-glotmluciferaseassarysystem,并放置在室温用振荡器震荡10min后上机检测。
测试结果如附图9所示。附图9表明:人源性pd-l1单抗可阻断cho-pd-l1-tcr/jurkat-pd-1-nfat细胞pd-l1与pd-1的结合,且半数有效浓度分别为0.2058μg/ml。
实施例11:全人源pd-l1单克隆抗体免疫原性预测
t表位预测对于高亲和力的ada的产生,必要的一步就是治疗蛋白上t细胞表位通过apcs上的mhcii类分子提呈给cd4+t细胞,从而促进细胞因子的释放与b细胞产生抗体。因此治疗性蛋白上的t细胞表位对于免疫原性有一定影响。人mhcii分子是由hla-dr,hla-dp,hla-dq等基因编码的α/β异源二聚体,这些基因有着非常多的等位基因。一般认为hla-dp和hla-dq与过敏原引起的t细胞反应以及ada的形成关系不大,因此主要是hla-dr在ada的形成中发挥作用。t细胞表位依赖于线性肽段,长度在15-20个氨基酸,各种算法被开发出用于预测肽段与mhcii分子(主要是hla-dr)的结合。通过对pd-l1抗体的轻重链cdr的氨基酸序列的分析,利用iedb等数据库分析和计算机模拟,分析轻重链上可能存在免疫原性的氨基酸位置与丰度。
预测结果如附图10所示。其中,10(a)为重链可变区详细肽人类和免疫原性(phi)图,10(b)为轻链可变区的详细肽人类和免疫原性(phi)图;x轴代表相应的氨基酸序列的位置,y轴是其与hla等位基因结合的强度(最大值为8),与人胚系基因的同源性用右y轴的彩色线表示。cdr(kabat定义)用垂直虚线标记。其中各线条的代表的含义如下:灰色表示结合等位基因的强度在阈值的3-5%(左y轴),黑色表示结合等位基因的强度在阈值的度1-2%(左y轴)。
实施例12:mlr反应测定pd-l1抗体对t淋巴细胞的活化
ficoll离心法分离pbmc后,利用磁珠法(cd14beads,mitenyibiotec)分离cd14细胞,刺激培养分化成dc细胞,在dc细胞培养的第7天,抽健康志愿者20ml血分离pbmc,再分离cd4+t细胞,重悬于1640完全培养基(含有50umbta巯基乙醇),调整细胞密度至2x106cells/ml。收集dc细胞,重悬于1640完全培养基,细胞计数,调整dc细胞密度至2x105cells/ml。合并t细胞和dc细胞,传96孔平底细胞培养板,每孔加入100μl(相当于1x105cd4+t细胞和1x104dc细胞。配制不同浓度的测试或对照抗体(实验组加入40,4,0.4μg/ml的pd-l1抗体,阴性对照组加入40μg/ml的赫赛汀单抗,阴性对照组加入30nmpma+3umionomycin),体积100μl,每个抗体浓度做3平行。培养3天,收集100μl细胞上清,离心500gx10分钟,取上清立即使用或者保存于-80c冰箱,humanifn-γflexset和humanil-2flexset(bd公司)试剂盒检测inf-γ和il-2表达。
活化结果如附图11所示。其中11(a)为pd-l1单抗对ifn-γ的水平的影响,11(b)为pd-l1单抗对il-2的水平的影响。t细胞和树突细胞混合培养体系中加入赫赛汀不会导致ifn-γ和il-2明显释放,但是在培养的t细胞中加入pma和ionomycin能够明显促进ifn-γ和il-2的释放。在0.4-40μg/ml浓度范围内,全人源pd-l1抗体对ifn-γ和il-2的表达具有明显的促进作用,且作用效果具有显著地浓度依赖性。
实施例13:pd-l1抗体对nsg小鼠异种移植瘤模型的治疗作用
流式细胞仪测hcc827细胞表面pd-l1高表达。外周血单个核细胞获取:无菌条件下收取健康人血100ml于肝素钠抗凝管颠倒混匀后,加入ficoll淋巴细胞分离液再缓缓向内加入血液使体积为1:1混合,垂直静止1min,轻拿离心管置于backman温控离心机离心,离心管由上至下分为4层:轻轻吸取第二层乳白色细胞,用pbs洗涤次,弃上清,离心,再洗涤,重复3次后细胞计数。细胞接种:将0.1ml5ⅹ106个hcc827细胞皮下接种于每只小鼠的右后背,在细胞接种7天后0.1ml5ⅹ106-1ⅹ107个外周血单个核细胞尾静脉接种于小鼠体内,同时开始给药pd-l1抗体10μl/g,浓度为1mg/ml,一周两次给药并称重量瘤。
pd-l1抗体对体内移植瘤作用如附图12所示。其中12(a)为pd-l1抗体对肿瘤体积大小的影响,12(b)为pd-l1抗体对小鼠体重的影响。
sequencelisting
<110>安徽安科生物工程(集团)股份有限公司
<120>全人源pd-l1单克隆抗体及其制备方法和应用
<130>2019
<160>8
<170>patentinversion3.3
<210>1
<211>12
<212>prt
<213>人工序列
<400>1
argalaserglnthrvalileglyx1tyrleuala
1510
其中,x1是ser或arg;
<210>2
<211>8
<212>prt
<213>人工序列
<400>2
pheglythrserpheargalathr
15
<210>3
<211>9
<212>prt
<213>人工序列
<400>3
leuglnx2glnglypheprox3thr
15
其中,x2是thr或arg,x3是tyr或leu;
<210>4
<211>11
<212>prt
<213>人工序列
<400>4
serglyphethrpheaspx4tyrtrpmethis
1510
其中,x4是arg或glu;
<210>5
<211>17
<212>prt
<213>人工序列
<400>5
x5ilex6aspx7glyglyx8thrx9tyralaaspservallysser
151015
其中,x5是thr或ser;x6是asp或thr;x7是ser或thr;x8是glu或val;x9是asn或his;
<210>6
<211>6
<212>prt
<213>人工序列
<400>6
serglnaspleualatyr
15
<210>7
<211>636
<212>dna
<213>人工序列
<400>7
gcatttactgtcacggttcccaaggacctatatgtggtagagtatggtagcaatatgaca60
attgaatgcaaattcccagtagaaaaacaattagacctggctgcactaattgtctattgg120
gaaatggaggataagaacattattcaatttgtgcatggagaggaagacctgaaggttcag180
catagtagctacagacagagggcccggctgttgaaggaccagctctccctgggaaatgct240
gcacttcagatcacagatgtgaaattgcaggatgcaggggtgtaccgctgcatgatcagc300
tatggtggtgccgactacaagcgaattactgtgaaagtcaatgccccatacaacaaaatc360
aaccaaagaattttggttgtcgatccagtcacctctgaacatgaactgacatgtcaggct420
gagggctaccccaaggccgaagtcatctggacaagcagtgaccatcaagtcctgagtggt480
aagaccaccaccaccaattccaagagagaggagaagctgttcaatgtgaccagcacactg540
agaatcaacacaacaactaatgagattttctactgcacttttaggagattagatcctgag600
gaaaaccatacagctgaattggtcatcccagaacta636
<210>8
<211>226
<212>prt
<213>人工序列
<400>8
lysthrhisthrcysproprocysproalaprogluleuleuglygly
151015
proservalpheleupheproprolysprolysaspthrleumetile
202530
serargthrprogluvalthrcysvalvalvalaspvalserhisglu
354045
aspprogluvallyspheasntrptyrvalaspglyvalgluvalhis
505560
asnalalysthrlysproargglugluglntyralaserthrtyrarg
65707580
valvalservalleuthrvalleuhisglnasptrpleuasnglylys
859095
glutyrlyscyslysvalserasnlysalaleuproalaproileglu
100105110
lysthrileserlysalalysglyglnproarggluproglnvaltyr
115120125
thrleuproproserargaspgluleuthrlysasnglnvalserleu
130135140
thrcysleuvallysglyphetyrproseraspilealavalglutrp
145150155160
gluserasnglyglnprogluasnasntyrlysthrthrproproval
165170175
leuaspseraspglyserphepheleutyrserlysleuthrvalasp
180185190
lysserargtrpglnglnglyasnvalphesercysservalmethis
195200205
glualaleuhisasnhistyrthrglnlysserleuserleuserpro
210215220
glylys
225
- 还没有人留言评论。精彩留言会获得点赞!