一种检测羊肚菌中核苷类成分的方法与流程
本发明涉及食药用菌分析检测领域,具体涉及一种检测羊肚菌中核苷类成分的方法,特别地是利用HPLC检测羊肚菌中鸟苷、尿苷和腺苷3种核苷类成分。
背景技术:
羊肚菌(Morchella esculenta),是一种名贵的食药用真菌。传统中医认为羊肚菌性平,味甘寒,无毒,具有消化助食、益肠胃、化痰理气、补肾、壮阳、提神醒脑之功能,有较高的药食用价值以及广阔的开发前景。现代医学研究表明,羊肚菌子实体中含有丰富的蛋白质、核苷、脂肪酸、碳酸化合物、生物素、粗纤维等营养成分。但是,据调查,目前对羊肚菌活性成分的深入研究主要集中在对多糖的研究,而对羊肚菌中所含核苷类成分的检测鲜见报道。前期很多学者对药食用真菌中所含有的核苷类成分进行了深入研究,并发现核苷类成分具有抗肿瘤、调节中枢神经、提高免疫力、促进血液循环等药理作用。可见,羊肚菌中核苷类成分的检测对羊肚菌进行全面质量控制是非常重要的。
目前,尚未有关于羊肚菌中核苷类成分含量检测的报道。关于核苷类成分的分析检测在同类珍稀药食用菌中有较多的研究,被广泛作为真菌药材的质量和品质评价指标。如2015版《中国药典》冬虫夏草质量标准以腺苷含量作为唯一的化学成分控制指标。也有较多文献对药食用真菌中核苷类成分进行了研究,但文献报道的检测核苷类成分的方法都不能直接应用于羊肚菌中核苷的检测,如将2015版《中国药典》中百令胶囊腺苷和尿苷的高效液相色谱测定方法直接应用于羊肚菌3种核苷类成分检测存在峰形不对称,基线漂移等问题;《高效液相色谱定量分析比较4种虫草药材的核苷类成分》采用0.5%磷酸溶液提取核苷类成分并测定了4种虫草类药材的尿苷、肌苷、鸟苷和腺苷含量,但是将该提取方法用于提取羊肚菌中的核苷类成分结果发现核苷含量非常低。其他很多文献采用的10%甲醇提取方法应用于羊肚菌核苷提取也存在含量很低的问题。同时,发明人在大量的实验研究过程中发现,上述分析检测方法进行方法学考察的过程中,存在稳定性不好的问题,其RSD不能达到低于5%的检测要求,可能是样品中核苷类成分的提取和处理方法对其含量测定有很大的影响。前期文献报道了真菌类物种中核苷类物质测定时会互相转化,如《Simultaneous determination of eleven nucleosides and related compounds in Cordyceps by capillary electrochromatography》文章中推测室温浸渍提取所得腺苷含量较低可能是转化成了其他化合物;《冬虫夏草水提取过程中腺苷转化途径研究》结果发现不同提取方法对冬虫夏草腺苷含量具有显著影响,如在室温水提取条件下腺苷酸(三磷酸腺苷、二磷酸腺苷、单磷酸腺苷)可以转化为腺苷,腺苷可以转化为肌苷。由此可见,样品处理过程对于准确测定药食用真菌药材中核苷类成分的含量起着非常关键的作用。
技术实现要素:
为了同时检测鸟苷、尿苷和腺苷3种核苷类成分,本发明提供了一种HPLC检测条件,对羊肚菌中3种核苷成分能同时稳定的、精密的测定;除此外,本发明还提供了提取羊肚菌中核苷的方法,这对于准确测定药食用真菌药材中核苷类成分的含量是非常关键的。
本发明是通过以下技术方案来实现的:
(1)供试品溶液制备:取羊肚菌粉末,加入纯水,超声提取,取上清液经水系滤头滤过,静置处理,即得待测定供试品溶液;
(2)核苷混合对照品溶液制备:分别精密称取尿苷、鸟苷、腺苷适量,加入纯水摇匀,制成尿苷、鸟苷和腺苷的混合对照品溶液;
(3)HPLC检测:将上述步骤(1)和步骤(2)所得的供试品和对照品溶液,进行高效液相色谱检测,HPLC色谱条件为:采用ZORBAX SB-AQ150*4.6mm,5μm色谱柱,检测波长为260nm,柱温保持24~26℃之间,流速为0.8mL/min;采用梯度洗脱,流动相A为0.04M磷酸二氢钾水溶液,流动相B为乙腈;按体积百分比计,所述梯度洗脱条件为:0~8min,流动相A为100%,流动相B为0%;8~45min,流动相A由100%匀速变为85%;流动相B由0%匀速变为15%。
在一些实施例中,所述步骤(1)中供试品溶液制备方法为:取过3号筛的羊肚菌粉末0.2g,用10mL纯水超声提取,取上清液经水系滤头滤过,静置处理,即得待测定供试品溶液。
在一些实施例中,所述步骤(1)中供试品溶液制备方法中的超声提取条件为:25~35℃超声提取30min。
在一些实施例中,所述步骤(1)中供试品溶液制备方法中的静置处理方法为:放置于6℃环境下16~28h。
在一些实施例中,所述步骤(2)中核苷混合对照品溶液制备方法为:分别精密称取尿苷、鸟苷、腺苷适量至100mL容量瓶中,用纯水溶解,加水并定容至刻度,摇匀,即得单一对照品溶液;分别精密吸取单一核苷对照品母液10.00mL于50mL容量瓶中,加入纯水稀释并定容至刻度,摇匀,制成尿苷、鸟苷和腺苷质量浓度分别为9μg/mL、8μg/mL、9μg/mL的核苷混合对照品溶液。
本发明具有如下有益效果:
1.本发明的高效液相色谱检测方法首次同时检测了羊肚菌中腺苷、尿苷和鸟苷含量,所得色谱图基线稳定,峰形良好,分离度高,能够为羊肚菌质量控制提供科学依据。
2.本发明采用纯水在25-35℃下超声30min提取羊肚菌中核苷的方法能够准确的测定其中腺苷、鸟苷和尿苷的含量,三种核苷的加样回收率都在98~102%范围内,且RSD值在1.5%以内,能够很好的反映样品中这三种核苷的真实含量。
3.本发明发现样品提取之后,在6℃环境下静置处理16~28h时具有很好的稳定性,其RSD值在5%以内,解决了羊肚菌核苷检测方法的稳定性问题。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中U、A、G分别为尿苷、腺苷和鸟苷:图1为羊肚菌核苷类成分不同提取方法的核苷含量的结果图,其中①~⑨分别为:
①水提取,30℃超声提取30min,料液比1:50;
②0.5%H3PO3提取,30℃超声提取30min,料液比1:50;
③20%甲醇提取,30℃超声提取30min,料液比1:50;
④水提取,25℃超声提取25min,料液比1:75;
⑤0.5%H3PO3提取,35℃超声提取25min,料液比1:75;
⑥20%甲醇提取,35℃超声提取25min,料液比1:75;
⑦水提取,浸渍提取50min,料液比1:100;
⑧0.5%H3PO3提取,浸渍提取50min,料液比1:100;
⑨20%甲醇提取,浸渍提取50min,料液比1:100。
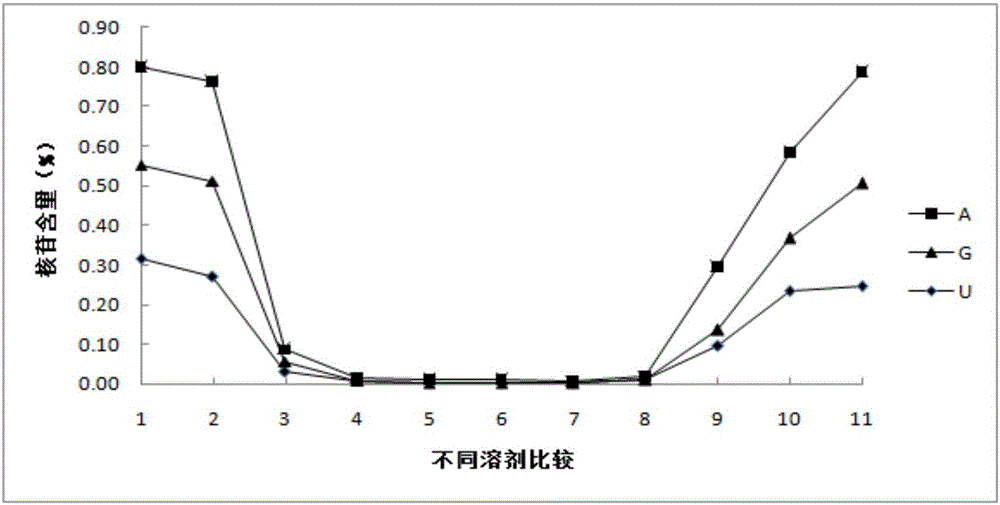
图2为羊肚菌不同提取溶剂的核苷含量的结果图,其中,提取溶剂分别为10%甲醇,20%甲醇,40%甲醇,60%甲醇,80%甲醇,90%甲醇,100%甲醇,0.5%H3PO3,0.05M Na2HPO4,0.02M PBS(磷酸盐缓冲液),沸水。
图3为羊肚菌核苷水提液在6℃环境下静置36个小时之内供试品样品所含核苷类成分稳定性变化趋势结果图。
图4为羊肚菌水提液在图3中16~28h之内核苷类成分稳定性变化的放大趋势图。
图5为羊肚菌核苷20%甲醇提取液在6℃环境下静置36个小时之内供试品样品所含核苷类成分稳定性变化趋势结果图。
图6为羊肚菌核苷水提液在室温环境下静置36个小时之内供试品样品所含核苷类成分稳定性变化趋势结果图。
图7为核苷混合物对照品和供试品溶液的HPLC色谱图(从下往上分别为核苷混合对照品溶液,两份平行样品溶液)。
图8为羊肚菌样品系统适应性实验色谱图。
图9为羊肚菌样品专属性实验色谱图。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐述本发明,而非以任何方式限制本发明的范围。
实施例1羊肚菌核苷类成分提取方法和提供溶剂的优化
1.1仪器与试剂:
仪器:高效液相色谱仪型号为Agilent 1260,电子天平(万分之一和十万分之一)型号为Mettler Toledo,超声清洗仪型号为KQ-500DB,超纯水仪型号为MILLI-Q。
试剂:磷酸二氢钾为分析级别,购于成都科龙;乙腈为HPLC级别,购于Spectrum;尿苷、鸟苷和腺苷(含测级)购于中国药品生物制品检定所。
羊肚菌培植冻干品来源于乳源南岭好山好水食品有限公司的栽培基地。
1.2分析方法:
在实验过程中发现不同提取方法以及不同提取溶剂对羊肚菌核苷类成分的含量都有影响,即羊肚菌核苷类成分存在稳定性的问题。因此,分别考察了不同提取方法和不同提取溶剂对羊肚菌核苷类成分含量的影响,以下为9种提取羊肚菌核苷类成分的方法:
①取过3号筛的羊肚菌粉末0.2g,精密称定于50mL三角瓶中,加入超纯水10mL,在30℃下超声提取30min,摇匀,取上清液经0.45μm水系滤头滤过后,静置处理16h后即得。
②取过3号筛的羊肚菌粉末0.2g,精密称定于50mL三角瓶中,加入0.5%磷酸提取液10mL,在30℃超声提取30min,摇匀,取上清液经0.45μm水系滤头滤过后,静置处理16h后即得。
③取过3号筛的羊肚菌粉末0.2g,精密称定于50mL三角瓶中,加入20%甲醇提取液10mL,在30℃超声提取30min,摇匀,取上清液经0.45μm水系滤头滤过后,静置处理16h后即得。
④取过3号筛的羊肚菌粉末0.2g,精密称定于50mL三角瓶中,加入超纯水15mL,在25℃超声提取25min,摇匀,取上清液经0.45μm水系滤头滤过后,静置处理16h后即得。
⑤取过3号筛的羊肚菌粉末0.2g,精密称定于50mL三角瓶中,加入0.5%磷酸提取液15mL,在35℃超声提取25min,摇匀,取上清液经0.45μm水系滤头滤过后,静置处理16h后即得。
⑥取过3号筛的羊肚菌粉末0.2g,精密称定于50mL三角瓶中,加入20%甲醇提取液15mL,在35℃超声提取25min,摇匀,取上清液经0.45μm水系滤头滤过后,静置处理16h后即得。
⑦取过3号筛的羊肚菌粉末0.2g,精密称定于50mL三角瓶中,加入超纯水20mL,浸渍提取50min,摇匀,取上清液经0.45μm水系滤头滤过后,静置处理16h后即得。
⑧取过3号筛的羊肚菌粉末0.2g,精密称定于50mL三角瓶中,加0.5%H3PO3提取液20mL,浸渍提取50min,摇匀,取上清液经0.45μm水系滤头滤过后,静置处理16h后即得。
⑨取过3号筛的羊肚菌粉末0.2g,精密称定于50mL三角瓶中,加入20%甲醇提取液20mL,浸渍提取50min,摇匀,取上清液经0.45μm水系滤头滤过后,静置处理16h后即得。
另外,在考察不同提取方法对羊肚菌核苷类成分含量影响时,发现提取溶剂的不同对核苷的含量和稳定性也有影响,因此在提取条件为料液比1:50,超声提取30min的情况下考察不同提取溶剂对核苷类成分含量的影响,按照提取方法①所述的方法制备供试品溶液,其中,提取溶剂分别为①10%甲醇,②20%甲醇,③40%甲醇,④60%甲醇,⑤80%甲醇,⑥90%甲醇,⑦100%甲醇,⑧0.5%H3PO3,⑨0.05M Na2HPO4,⑩0.02M PBS,沸水。
HPLC检测:吸取上述不同提取方法和不同提取溶剂获得的供试品溶液,注入到高效液相色谱仪中进行检测,记录40min以内的色谱图;其中,HPLC色谱条件为:采用Agilent ZORBAX SB-AQ150*4.6mm,5μm色谱柱,检测波长为260nm,柱温保持24~26℃之间,流速为0.8mL/min,进样量10μL,进样盘温度6℃;采用梯度洗脱,流动相A为0.04M磷酸二氢钾水溶液,流动相B为乙腈;按体积百分比计,所述梯度洗涤条件为:0~8min,流动相A为100%,流动相B为0%;8~45min,流动相A由100%匀速变为85%;流动相B由0%匀速变为15%。
HPLC检测结果:对HPLC检测条件进行优化,得到了不同提取方法和不同提取溶剂的羊肚菌核苷类成分的HPLC色谱图,并通过计算获得各个条件下供试品溶液样品所对应的核苷类成分的含量。以核苷类成分含量为纵坐标,提取方法为横坐标,得到如图1所示的不同提取方法所对应的核苷成分含量结果图,其中图1中横坐标表示9种不同的提取方法,依次对应于实施例中所述的①~⑨种方法。同样,以核苷类成分含量为纵坐标,提取溶剂为横坐标,得到如图2所示的不同提取溶剂所对应的核苷成分含量结果图,其中横坐标表示11种不同的提取溶剂,依次对应实施例所提到的种溶剂。可见,通过比较不同提取溶剂、提取时间及料液比对羊肚菌核苷的提取效果,得出最佳的提取方式为:以纯水作为溶剂,料液比设定为1:50,超声提取30min。
实施例2羊肚菌核苷类成分提取液稳定性变化趋势的探讨
在进行方法学验证的过程中,发现直接将获得的供试品溶液放置不同时间后进行HPLC检测其精密度,结果发现部分数据不合格,即提取液稳定性不好(不到4h),故进行了提取液稳定性的考察,并分别考察了水提和20%醇提两种方法的提取液稳定性的变化趋势。
根据实施例1羊肚菌核苷类成分提取方法中的①和③提取样品,分别考察在6℃环境下放置36个小时每间隔1个小时供试品样品所含核苷类成分含量的变化,同时,比较了羊肚菌核苷类成分水提液在室温环境下放置36个小时每间隔1个小时对应的供试品样品所含核苷类成分含量的变化。
根据实施例1所述的色谱检测条件对上述的供试品样品分别进行HPLC检测。
HPLC检测结果:通过实施例1的色谱检测条件获得了羊肚菌核苷水提液和醇提液在6℃环境下静置36个小时之内每间隔1个小时供试品溶液样品的HPLC色谱图,以及水提液在室温环境下静置36个小时之内每间隔1个小时供试品溶液样品的HPLC色谱图。以放置时间为横坐标,核苷类成分的峰面积为纵坐标,获得水提液、20%甲醇提取液在6℃下和水提液在室温环境下放置36h之内所含核苷类成分稳定性变化趋势图,如图3、图5和图6所示。图3为羊肚菌核苷水提液在6℃环境下放置36个小时每间隔1个小时所对应的供试品溶液样品中所含核苷类成分的峰面积值,图4为羊肚菌核苷水提液在16~28h内核苷类成分峰面积变化的放大图,由图可知在6℃环境下放置16h时开始出现平衡起点,在其后12h内,能达到较好的稳定性。图5为羊肚菌核苷20%甲醇提取液在6℃环境下放置36个小时每间隔1个小时所对应的供试品溶液样品中所含核苷类成分的峰面积值,由图可知20%甲醇提取液在36小时内核苷类成分的峰面积在持续变化,即溶液稳定性较差。图6为羊肚菌核苷水提液在室温环境下放置36个小时每间隔1个小时所对应的供试品溶液样品中所含核苷类成分的峰面积值,由图6可知,水提液在室温环境下放置时其核苷类成分的峰面积也在不停的变化,其稳定性达不到检测要求。
因此,通过这部分实验得出,羊肚菌核苷水提液在6℃环境下放置16h时出现平稳起点,并在其后的12h之内其所含的核苷类成分含量是稳定的,适合准确测定羊肚菌中核苷类成分并对其进行方法学考察。
实施例3HPLC检测羊肚菌中核苷类成分的方法建立
根据实施例1和2确定羊肚菌样品提取最佳方法为:以纯水作为溶剂,料液比设定为1:50,超声提取30min,以及依据水提液在6℃环境下放置16~28h核苷类成分稳定性建立其羊肚菌样品的HPLC检测方法。
供试品溶液制备:取过3号筛的羊肚菌粉末0.2g,精密称定于50mL三角瓶中,加入超纯水10mL,在30℃下超声提取30min,摇匀,取上清液经0.45μm水系滤头滤过后,6℃环境下静置16h,即得待测供试品溶液。
核苷混合对照品溶液制备:分别精密称取尿苷,鸟苷,腺苷适量于100mL容量瓶中,用超纯水溶解,加水并定容至刻度,摇匀,即得单一对照品溶液;分别精密吸取单一核苷对照品母液10.00mL于50mL容量瓶中,加入超纯水稀释并定容至刻度,摇匀,制成尿苷、鸟苷和腺苷质量浓度分别为9μg/mL、8μg/mL、9μg/mL核苷混合对照品溶液。
HPLC检测:吸取上述步骤所得供试品和对照品溶液,注入到高效液相色谱仪中进行检测,记录40min以内的色谱图;其中,HPLC色谱条件为:采用Agilent ZORBAX SB-AQ150*4.6mm,5μm色谱柱,检测波长为260nm,柱温保持24~26℃之间,流速为0.8mL/min,进样量10μL,进样盘温度6℃;采用梯度洗脱,流动相A为0.04M磷酸二氢钾水溶液,流动相B为乙腈;按体积百分比计,所述梯度洗涤条件为:0~8min,流动相A为100%,流动相B为0%;8~45min,流动相A由100%匀速变为85%;流动相B由0%匀速变为15%。
HPLC检测结果:如图7所示为羊肚菌核苷混合对照品溶液和两份平行供试品溶液(样品溶液-1和样品溶液-2)的HPLC色谱图。由图可知,优化后的色谱检测条件所获得的色谱图分离度和峰型都较好,并检测到含有尿苷(Uridine)、鸟苷(Guanosine)、和腺苷(Adenosine)3种核苷类成分。
实施例4HPLC检测羊肚菌中核苷类成分的方法学考察
对实施例3中所建立的HPLC检测羊肚菌中核苷类成分的方法进行以下方面的方法学考察。
4.1系统适应性考察:
单个对照品溶液的制备:
腺苷对位溶液:称取腺苷对照品约5mg于100mL容量瓶中,用空白溶液(超纯水)溶解并定容至刻度,摇匀即得。
鸟苷对位溶液:称取鸟苷对照品约5mg于100mL容量瓶中,用空白溶液(超纯水)溶解并定容至刻度,摇匀即得。
尿苷对位溶液:称取尿苷对照品约5mg于100mL容量瓶中,用空白溶液(超纯水)溶解并定容至刻度,摇匀即得。
按照实施例3所述方法制备供试品和核苷混合对照品溶液。系统平衡后取空白溶液进样2针,对照品溶液进样6针,记录色谱图。计算对照品溶液中尿苷、鸟苷、腺苷与各自相邻峰的分离度、对称因子,计算尿苷、鸟苷、腺苷单个样品连续进样6针各峰面积的RSD值。如图8所示,为核苷混合对照品溶液6次进样的HPLC色谱图。通过比较药典标准,发现本实验的色谱峰分离度良好,对照品溶液中各主峰与各自相邻峰的分离度小于1.5,对称因子在1.30~1.39之间,单个腺苷、鸟苷和尿苷对照品溶液连续进样6针的峰面积RSD值不超过5.0%。由此可知本实验的系统适用性检测合格。
4.2专属性考察
按照实施例3和实施例4.1所述方法制备供试品溶液、核苷混合对照品溶液和尿苷、鸟苷、腺苷对位溶液,并按照实施例3所述的HPLC色谱条件进行检测,记录色谱图。同时,记录尿苷对位溶液、鸟苷对位溶液、腺苷对位溶液在各自色谱峰的保留时间;核苷混合对照品溶液和供试品溶液中各主峰的保留时间。
如图9所示,从下往上依次为空白溶液、供试品样品溶液、核苷混合对照品溶液、尿苷对位溶液、鸟苷对位溶液和腺苷对位溶液的HPLC色谱图。其中,尿苷、鸟苷和腺苷三个对位溶液的保留时间分别为:8.013min,17.147min,30.393min。供试品溶液中尿苷、鸟苷和腺苷三个主峰的保留时间分别为:8.033min,17.127min,30.380min。核苷对照品溶液中尿苷、鸟苷和腺苷三个主峰的保留时间分别为:8.040min,17.087min,30.347min。可见,3种核苷类成分的保留时间在供试品溶液和核苷混合对照品溶液中的绝对值差小于0.2min,即实验的专属性检测结果是合格的。
4.3精密度考察
按照实施例3制备供试品溶液和核苷混合对照品溶液的方法。平行称取6份供试品,制得6份供试品溶液。分别取供试品液各进样1针,按照实施例3所述的HPLC色谱分析条件进行检测,记录色谱图。以供试品前后附近2针对照品溶液计算6份供试品中尿苷、鸟苷、腺苷的含量,并记录供试品液中的尿苷、鸟苷、腺苷的峰面积、含量以及计算含量的RSD值。结果计算得尿苷平均百分含量为0.158%,RSD为2.8%;鸟苷平均百分含量为0.104%,RSD为3.3%;腺苷平均百分含量为0.130%,RSD为4.3%。
4.4稳定性考察
按照实施例3所述方法制备供试品溶液后在6℃环境下静置16h,并将供试品溶液置于6℃进样盘中,在不关机的情况下,分别于0、2、4、6、8、10、12h(可根据实际操作更改时间)取样,分别进样一针,记录色谱图。同时记录各时间点供试品溶液中尿苷、鸟苷、腺苷的峰面积,以及各峰面积与0h对应峰面积的比值。计算得尿苷峰面积RSD为0.77%,鸟苷峰面积RSD为1.07%,腺苷峰面积RSD为4.08%,可见样品在放置16h后的12h内是稳定的。
4.5标准曲线、定量线和检测线考察
按照实施例3所述的方法制备供试品和核苷混合对照品溶液。精密吸取配制的核苷混合对照品溶液1mL于100mL容量瓶中,用超纯水稀释并定容至刻度,摇匀即得稀释100倍的混合对照品溶液。将稀释100倍后的核苷混合对照品溶液用超纯水逐级稀释至一定浓度,取该稀释液(平行3份),各进样一针,进样量为10μL,按照实施例3所述的HPLC色谱条件进行分析,记录色谱图。以信噪比(S/N)约为10时相应浓度确定为最低定量限,信噪比(S/N)约为3时相应浓度确定为最低检测线。
取核苷混合对照品溶液,设置进样量分别为5μL、7.5μL、10μL、15μL,每个进样2针(最低浓度点以定量限实验中最后2针计),按照实施例3所述的HPLC色谱条件进行分析检测。计算尿苷、鸟苷、腺苷的峰面积平均值,以尿苷、鸟苷、腺苷的峰面积平均值对其浓度进行二元线性回归,以峰面积(Y)为纵坐标,溶液浓度(X)为横坐标进行回归计算,得回归方程、相关系数与线性关系(表1)。
表1 3种羊肚菌核苷类成分的回归方程、相关系数、线性范围、定量限及检测限
4.6加样回收率考察
供试品溶液II制备:称取供试品粉末约0.1g,精密称定于50mL三角瓶中,精密加入实施例3项下的核苷混合对照品溶液5mL,再加入超纯水5mL,超声提取30min,摇匀,取上清液经0.45μm水系滤膜滤过后,6℃环境下静置16h即得,平行制备6份。
取实施例3项下供试品溶液2份,各进样一针;然后取各供试品溶液II,每份进样一针,按照实施例3所述的HPLC色谱条件进行分析,记录色谱图。计算尿苷、鸟苷、腺苷的峰面积,以实施例3项下供试品溶液以及供试品溶液II前后附近2针对照品溶液计算各供试品溶液II中尿苷、鸟苷、腺苷实际测定值、理论值、单个回收率和回收率的RSD值,如表2所示。
表2 3种羊肚菌核苷类成分的加样回收试验结果
通过表3可知,尿苷、鸟苷和腺苷三种核苷类成分的平均回收率范围为99.91%~100.0%,回收率RSD范围为0.96%~1.1%,即三种核苷成分的加样回收检测符合药典要求。
- 还没有人留言评论。精彩留言会获得点赞!