基于唾液特异糖蛋白糖链结构的肝癌相关筛查/评估的产品及应用的制作方法
本发明涉及一种基于唾液特异糖蛋白的肝肿瘤标志物的确定及其相关产品、应用。
背景技术
肝癌(hepatocellularcarcinoma,hcc)在我国属于高发病率和高死亡率的癌症。目前,hcc的各种检测方法分别受其技术特点的限制,均存在特异性低、取样不便和不能早期诊断等缺陷。近年来有大量研究表明:随着肿瘤的发生发展,患者的肿瘤组织、血清和唾液等体液中发生了糖蛋白糖基化异常改变。
专利文献cn105675893a公开了一种基于血清/共同基于血清和唾液中蛋白检测糖链标志物以鉴别肝炎患者的方案。其中:
基于血清检测时,当ptl-i、pna、aal、ltl、stl、bs-i、ptl-ii、sba、uea-i、mal-i、pha-e+l都上调,同时aca下调时可以将其与健康人区别,即患有肝病;在此基础上,当wfa、gsl-ii、mal-ii、sja、lel、pwm、bpl都上调,同时eel下调时,可以确定样品对应的人群患有重型乙型肝炎。
基于血清和唾液共同检测时,当stl、sba、wfa、gsl-ii都上调,同时aca下调时可以将其与健康人区别,即患有肝病。
上述方案在检测样本时所需凝集素较多,且需作组合统计,因此对于肝癌(hcc)的筛查、诊断以及评估仍不够简便、有效。
有必要指出的是,血液中的一些因子能够随体液循环到达唾液腺,或随唾液分泌进入口腔或导致唾液中的基因转录谱发生改变,引起某些蛋白质的丰度或种类改变,从而反映出血液中部分蛋白质水平的变化。但目前研究发现,人唾液中有1939种蛋白质,人血浆中有3020种蛋白质,仅有27%的唾液蛋白质组与血浆蛋白质组重合。血浆蛋白质组学发现的177个与心血管疾病相关的潜在生物标志物的蛋白质中,也仅有40%的蛋白质出现在唾液蛋白质组中;在已列出的1058个潜在癌症相关生物标志物的蛋白质中,仅有34%的蛋白质出现在唾液蛋白质组中。这表明许多血液循环中的生物标志物并非能够在唾液中得到鉴定。另外,即使是同一种蛋白,较之于血清,其在唾液中的含量通常明显较低。所以在实践中,两者没有必然的联系,往往需要研究人员经过大量的实验和分析,才能判断是否有蛋白质组重合的可能性。
也因此,上述方案分别基于血清检测、基于血清和唾液共同检测给出了不同的方案。
技术实现要素:
关于肝癌(hcc)的筛查、诊断以及评估等,发明人通过大量实验和分析,确定了以下结论:
一、相比唾液中其他糖蛋白糖链结构,凝集素ltl所识别的fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac糖链结构在肝硬化(hc)、hcc患者唾液中均为高表达,并呈稳定递增趋势;且相比健康志愿者(hv)、乙肝(hb)和hc,fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac糖链结构在hcc患者唾液中表达水平最高(p≤0.0005)。
二、进一步的,8种岩藻糖基化o-糖链(m/z652.216(fuc)1(glcnac)1(galnac)1,828.269(fuc)1(gal)1(glcnac)1(galnac)1,833.314(fuc)1(glcnac)1(galnac)2,995.367(fuc)1(gal)1(glcnac)2(galnac)1,1144.295(fuc)1(sia)1(sulf-gal)1(gal)1(galnac)1,1157.420(fuc)1(gal)2(glcnac)2(galnac)1,1163.417(fuc)2(glcnac)2(gal)1(galnac)1,1193.402(fuc)1(gal)2(glcnac)2(galnac)1)仅存在于hcc患者的唾液中,而未见于hv、hb和hc的唾液中。
根据以上第一个结论,已经可得出以下应用方案:
一种用于肝癌(hcc)筛查、早期诊断、风险评估、药物筛选和/或疗效评估的产品,针对唾液样本,包括:
a、用于获取两种特定糖蛋白糖链结构的表达水平的装置,所述两种特定糖蛋白糖链结构分别为fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac;
b、用于判别以上两种特定糖蛋白糖链结构是否高表达的标识、模块或处理器。这里的“标识”倾向于类似试纸条的形式作定性结论的显示(有无、对照比较等),“模块”、“处理器”倾向于以数值量化结果显示,当然还可以显示和/或输出定性结论;具体实现方法属于常规技术手段。
以应用该产品进行药物筛选、疗效评估为例,可测定对象给药(疗程)之前和之后不同时间点上述两种特定糖蛋白糖链结构的表达水平,若表达水平未见降低,则表明该药物的疗效不佳。
上述装置包括凝集素芯片、孵育盒和生物芯片扫描系统,其中凝集素芯片上至少设置有凝集素ltl(这种凝集素能够特异性识别糖蛋白上fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac糖链结构)。
上述标识、模块或处理器预先记录有健康(hv)、乙肝(hb)、肝硬化(hc)、肝癌(hcc)对应的参考值,用于与样本结果对照确定是否高表达。例如,可设荧光信号数值比值大于1.5,就确定是高表达;荧光信号数值比值小于0.67,就确定是低表达;比值在0.67~1.5之间表达没变化。
一种凝集素单独作为唾液特异糖蛋白糖链结构识别的试剂以制备相关产品的用途,所述凝集素为ltl,所述相关产品为试剂盒、设备、可操作系统和/或它们的组合,用途为肝癌(hcc)筛查、早期诊断、风险评估、药物筛选和/或疗效评估。
根据以上第二个结论,可得出以下应用方案:
特定糖链的识别单元在构建用于基于唾液样本作肝癌(hcc)筛查、早期诊断、风险评估、药物筛选和/或疗效评估的产品方面的用途,所述识别单元识别以下八种岩藻糖基化o-糖链之任一或任意组合(通过判断“有”、“无”即可得出结论):
m/z652.216(fuc)1(glcnac)1(galnac)1,
m/z828.269(fuc)1(gal)1(glcnac)1(galnac)1,
m/z833.314(fuc)1(glcnac)1(galnac)2,
m/z995.367(fuc)1(gal)1(glcnac)2(galnac)1,
m/z1144.295(fuc)1(sia)1(sulf-gal)1(gal)1(galnac)1,
m/z1157.420(fuc)1(gal)2(glcnac)2(galnac)1,
m/z1163.417(fuc)2(glcnac)2(gal)1(galnac)1,
m/z1193.402(fuc)1(gal)2(glcnac)2(galnac)1。
一种用于肝癌(hcc)筛查、早期诊断、风险评估、药物筛选和/或疗效评估的产品,针对唾液样本,该产品包括:
a、凝集素ltl;
b、用于耦联凝集素ltl的亲和层析固相载体;
c、用于从含有fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac糖链结构的糖蛋白中分离出o-糖链的试剂和装置;
d、用于解析各种o-糖链的化学组成式的装置;
e、用于判别所解析的各种o-糖链中是否含有前述八种岩藻糖基化o-糖链之任一或任意组合的标识、模块或处理器。
上述用于耦联凝集素ltl的亲和层析固相载体可以选择fe3o4磁性微粒、琼脂糖凝胶、葡聚糖凝胶、玻璃微球等。
上述用于解析各种o-糖链的化学组成式的装置有多种可选类型,其工作原理可以是基质辅助激光解析飞行时间质谱法maldi-ms、快原子轰击质谱fab-ms、电喷雾质谱es-ms、液相色谱法、液相色谱-质谱联用法、核磁共振nmr等,通过获取o-糖链的m/z信息得出化学组成式。
附图说明
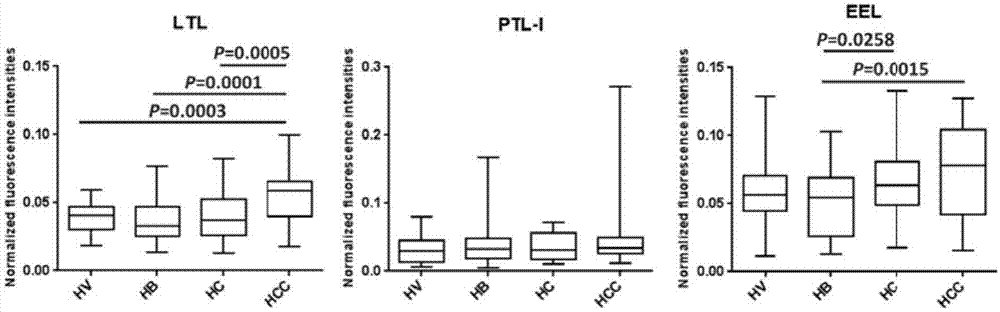
图1为凝集素ltl、ptl-i、eel的nfi箱图对照分析。图中,纵坐标表示凝集素芯片上该凝集素所对应的归一化荧光强度nfi,各箱图中自上而下的每个横线分别代表该组数据的最大值、后四分位数、中位数、前四分位数和最小值。图中横线代表两端所示两组间的比较,p为根据单因素方差分析所获得的p-value,其中p<0.05表示差异显著,p<0.01表示差异非常显著,p<0.001表示差异极显著。hv:健康志愿者唾液,hb:乙肝患者唾液,hc:肝硬化患者唾液,hcc:肝癌患者唾液。
图2为唾液芯片各探针结合ltl强度散点图。图中横线代表两端所示两组间的比较,p为根据单因素方差分析所获得的p-value,其中p<0.05表示差异显著,p<0.01表示差异非常显著,p<0.001表示差异极显著。hv:健康志愿者唾液,hb:乙肝患者唾液,hc:肝硬化患者唾液,hcc:肝癌患者唾液。
图3为四组混合唾液样本sds-page银染显色与ltl印迹实验结果,其中:a为银染显色的结果图;b为ltl凝集素印迹后于635nm波长下扫描获得的结果图;b1~b4分别为标记出的在凝集素印迹中表达差异明显的条带。各条带样本信息为:1:proteinladder,2:健康志愿者唾液,3:乙肝患者唾液,4:肝硬化患者唾液,5:肝癌患者唾液。
具体实施方式
以下详细介绍本申请的相关验证实验及分析,发明人具体的研发过程不限于此。
一、慢性乙型肝炎、肝硬化和肝癌患者唾液蛋白质差异糖链结构的筛选
研究方法:
1.1、唾液样本的收集及预处理
本实验所采用的健康志愿者及慢性乙肝、肝硬化和肝癌患者的唾液样本均严格经过西北大学、第四军医大学唐都医院、陕西省人民医院以及西安交通大学第二附属医院的伦理审批(humanresearchethicscommittees(hrecs))。所有捐赠唾液样本的志愿者连同协助采样指导的临床医师均对本研究工作知情、同意且高度配合,在均一的采样要求之下完成唾液样本的采集。其具体要求为:样本捐献者需无糖尿病,除肝脏外其他的器官应无炎症以及肿瘤等慢性疾病,在采样时捐献者需确定在采集唾液前3小时内未进食并且24小时内未服用药物,然后用洁净无菌的生理盐水(0.9%nacl)漱口三次,确保捐献者口腔卫生和无食物残渣的前提下,捐献者舌尖抵住上颚并于舌下收集自然分泌的唾液样本收集至2ml离心管,立即加入10μl蛋白酶抑制剂(proteaseinhibitorcocktail,sigma-aldrich,u.s.a)于冰浴暂存。在临床医师指导下共收集唾液样本215例:其中健康志愿者51例(hv,n=51),乙肝引起的慢性肝炎患者51例(hb,n=51),慢性肝硬化患者68例(hc,n=68),肝癌患者45例(hcc,n=45)。具体的样本信息如表1所示。
唾液采集12小时内,将唾液按1ml分装至离心管中,若有量少不足1ml者可加入1×pbs补足至1ml,10,000g×15min离心,小心吸取上清液,经微量核酸蛋白测定仪(nano-drop)测定浓度后按1mg唾液蛋白:10μl蛋白酶抑制剂的量加入蛋白酶抑制剂,混匀后分装于-80℃贮藏。
表1用于肝病诊断小规模凝集素芯片逐例检测的唾液样本信息
1.2、个例唾液蛋白的荧光标记与定量
取经nano-drop定量的唾液样本100μg,等体积地加入0.1mol/lna2co3/nahco3ph9.3缓冲液,按照1mg:120μl利用dmso溶解cy3荧光干粉并向样本中加入5μl荧光溶液于室温孵育3小时,期间样本严格避光且保持震荡。反应结束后,向样本中加入10μl4m羟胺溶液,于冰上反应5分钟,待充分封闭过量的游离荧光后,利用sephadexg-25分子筛凝胶柱对蛋白样本进行分离。用新1.5ml离心管收集荧光样本并进行定量,荧光标记后的样本避光防止荧光基团猝灭,于-20℃贮藏。
1.3、凝集素芯片逐例检测唾液蛋白质糖链表达差异
本实验利用一款实验室自制的14探针小规模凝集素芯片,具体包括凝集素mal-ii、uea-i、ptl-i、ltl、rca120、dsa、gna、pha-e+l、eel、aal、stl、aca、wga、mal-i。高规格超洁、表面微观平整的75×25mm载玻片经去污洗剂、强酸清洁后,利用(3-glycidyloxypropyl)trithoxysilane试剂对玻片表面进行环氧硅烷修饰,使玻片表面具有可以偶联凝集素-nh2的环氧基团。利用smartarrayer48点样仪定量点样阴性质控(bsa)、内参探针ptl-ii、14种检测探针和阳性质控(cy3荧光标记的bsa),每个质控或探针平行点样3个点,制成一款9×7(点间距850μm)的凝集素微阵列芯片,点样后4℃保藏。每张环氧化玻片点制4个阵列,阵列覆盖面确保可匹配于芯片反应盒的胶条封闭区,据此每张芯片可同时检测4个不同的蛋白样本。
在进行凝集素芯片检测样本之前,从4℃取出芯片,于37℃真空干燥器内负压回温30min,随后利用1×pbst于水平震荡摇床70rpm清洗5min×2次,再用1×pbs清洗5min×2次,以充分清洗未偶联至玻片上的游离凝集素。清洗完成后用小型载玻片离心机甩干残留的pbs。在上样前,向孵育盒的各阵列区域内先加入120μl凝集素芯片封闭液对玻片空白表面的环氧化基团进行封闭以降低荧光扫描时玻片背底的信号值。待孵育盒密封后于恒温孵育箱内37℃反应1h,封闭完成后,1×pbst清洗5min×2次,1×pbs清洗5min×2次,甩干后向孵育盒的各阵列区域内加入蛋白样本孵育体系(80μl凝集素芯片孵育液,8μl4m羟胺,2μl0.1%tween-20,4μgcy3标记的唾液蛋白样本,超纯水补足终体积至120μl),于37℃恒温孵育3h,待反应结束后1×pbst清洗5min×2次,1×pbs清洗5min×2次,甩干并扫描。凝集素芯片最终的数据读取采用axon公司所产的genepix4000b芯片扫描仪实现,扫描参数设定为:激发波长532nm,pmt功率70%,激发强度为100%。
1.4、凝集素芯片数据分析
凝集素芯片荧光信号的数值化过程通过genepixpro(4000b)软件完成,通过对每个阵列的数据提取,获得的数据包括:探针信号减去背景信号所获得的净差值fi(fluorescentintensity)、背景的标准方差sd(standarddeviation)等数据。在分析过程中,首先根据各个点的fi/sd判断该点数据的有效性,取fi/sd≥1.5的点作为有效数据,计算各个探针标准归一化荧光信号值nfi(normalizedfluorescentintensity),即用各个探针的medianfi值除以14个检测探针fi值之和,用算式表示为:nfix=medianfix/(medianfi1+medianfi2+medianfi3+…+medianfi14),据此可获得每个阵列上14种凝集素探针所对应的nfi并用作统计学分析。
这里的统计学分析主要是利用graphpadprism6.0对hv、hb、hc和hcc四组数据进行组间单因素方差分析(one-wayanovaanalysis),具体方法为将数据按组录入“column”分析程式,根据作图需求选择箱图“box&shiskers”或散点图“scatter&sd”
等。随后进入“analyze”分析程式通过组间两两对比并报告差异显著性p-value。
研究结果:
2.1凝集素芯片分析肝病患者唾液糖蛋白糖链表达差异
利用图1所示的凝集素芯片阵列对215例唾液样本进行逐例检测,通过芯片数据处理获得各nfi值,通过各组数据计算出的平均nfi结果如表2所示。各平均nfi结果可以直观地显示各组唾液样本与各个探针的结合情况,并且根据其标准差sd可以评估各凝集素对个例样本检测的离散程度。除实验数据外,表中还枚举了每个凝集素探针所特异识别的糖链糖型,如凝集素mal-ii识别的siaα2-3gal、siaα2-3galnac唾液酸化糖链结构,gna识别的manα1-3man多甘露糖糖链结构等。
表2个例唾液凝集素芯片检测结果
alectinprobe,该芯片阵列所含的14种凝集素探针;bspecificitytoglycopatterns,各凝集素特异识别的糖链糖型(glc,葡萄糖;glcnac,乙酰葡糖胺;gal,半乳糖;galnac,乙酰半乳糖胺;man,甘露糖;sia,唾液酸;fuc,岩藻糖);cnfi,芯片数据归一化处理后对应各探针归一化荧光强度,表格内数据显示了样本平均nfi及其标准差sd。
2.2肝癌患者唾液差异糖蛋白糖链的筛选
利用表2中列举的各个平均nfi值进行组间两两对比求得各相较组之间的ratio值,并且定义ratio>1.500代表该凝集素所识别的糖链在组间对比中体现高表达,ratio<0.667代表该凝集素所识别的糖链在组间对比中体现低表达。通过组间比较后,发现凝集素mal-ii、aal、stl、aca、wga、mal-i识别的糖链在组间对比中无表达差异。另外8种组间存在差异的凝集素(uea-i,ptl-i,ltl,rca120,dsa,gna,pha-e+l,eel)及详细的数据如表3所示。分析发现,相较于hv和hb,识别galnacα-1,3gal和galnacα-1,3galβ-1,3/4glc结构的凝集素ptl-i其平均nfi在hcc组中高表达,而hcc与hc之间对比无差异;相较于hb,识别galα1-3(fucα1-2)gal结构的凝集素eel其平均nfi在hcc组中高表达,而hcc相较于hv、hc间对比无差异;相较于hv、hb和hc,识别fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac结构的凝集素ltl其平均nfi在hcc组中均体现出高表达。平均nfi的差异分析表明这3种凝集素识别的糖链在肝癌患者唾液中有相对高表达的趋势。
表3四组唾液检测平均nfi的差异分析
表中列举了hv、hb、hc和hcc四组平均nfi两两对比计算获得的ratio值,并定义ratioa/b>1.500表示当a、b两组间比较某一凝集素识别的特定糖链结构的表达水平时,a组较b组高表达,在表中标以向上箭头;ratioa/b<0.667表示当a、b两组间比较某一凝集素识别的特定糖链结构的表达水平时,a组较b组低表达,在表中标以向下箭头。
利用统计学分析ltl、ptl-i以及eel所对应的个例数据,通过单因素方差分析判断这3种凝集素识别的糖链结构在肝癌患者唾液中的差异显著性,其结果如图1所示,一系列统计学数据可在图上直观地反应出各组间比较的差异显著性及离散程度。根据各组间单因素方差分析的结果来看,凝集素ltl识别的fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac结构在hcc中较其他三组均显著增多(p≤0.0005),而其他三组间均无差异,说明这一糖链结构在肝癌患者唾液糖蛋白中特异地发生高表达。ptl-i所识别的galnacα-1,3gal、galnacα-1,3galβ-1,3/4glc结构表达强度虽经nfi平均值比较得出其在肝癌唾液中表达有一定上调,但经单因素方差分析看来,该糖链结构的表达强度在hb组、hcc组中出现了较大的浮动范围,在这两组中呈现了一种不稳定表达的趋势,故而不存在差异显著性。凝集素eel所识别的galα1-3(fucα1-2)gal结构在hcc组中较hb组显著增多(p=0.0015),这一结果与平均nfi比较的结果基本一致,但hcc组相较于hv组、hc组均无显著差异。
所以,最后可以得出:相比其他糖蛋白,凝集素ltl识别的fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac糖链结构在hb、hc、hcc患者唾液中均为高表达,并呈稳定递增趋势;且相比hv、hb和hc,fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac结构在hcc患者唾液中表达水平最高(p≤0.0005)。故,可以考虑以此作为肝癌(hcc)筛查、早期诊断、风险评估、药物筛选和/或疗效评估的依据。
二、利用凝集素ltl对健康志愿者和乙肝、肝硬化和肝癌患者唾液特定糖蛋白的分离及糖链鉴定
研究方法:
利用90例严格符合各阶段典型特征的慢性肝病患者唾液样本(hb,n=30;hc,n=30;hcc,n=30)和30例健康志愿者唾液样本验证ltl识别的fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac结构在hcc组中的上调表达。通过将120例唾液样本制成唾液芯片,利用凝集素ltl检测该芯片上各例患者唾液中fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac结构的丰度并对比分析差异。另外通过等蛋白质质量混合获得各组的混合唾液样本,利用sds-page蛋白变性电泳以及凝集素印迹实验(lectinblotting)来验证各组混合唾液样本中fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac结构的丰度差异。经上述一系列验证后利用一种四氧化三铁纳米磁珠表面偶联上凝集素ltl制成凝集素磁性微粒复合物(ltl-magneticparticlecompounds,lmpcs)来富集各组唾液混合样本中的特定糖蛋白,利用pngasef酶切法、naclo氧化法分离特定糖蛋白上的n-糖链和o-糖链,并由基质辅助激光电离飞行时间质谱(matrix-assistedlaserdesorptionionization-timeofflight-massspectrum,maldi-tof-ms)对糖链进行质谱鉴定并对糖链结构进行推测,获得凝集素ltl识别的健康志愿者和乙肝、肝硬化、肝癌患者唾液特定糖蛋白糖链谱并对比分析差异,具体如下。
3.1唾液样本的选取、混合及定量
本实验所采集的样本均来自第四军医大学唐都医院,提供样本的志愿者均具有乙肝五项指标化验和肝功能化验数据,根据指导采样的临床医师对样本进行分组。在数据统计上,采取了如下化验数据的统计和临床阈值参考:乙肝表面抗原hbsag;乙肝e抗原hbeag;乙肝核心抗体hbcab;谷丙转氨酶alt(正常参考值:0~40u/l);谷草转氨酶ast(正常参考值:0~40u/l);谷氨酰转肽酶ggt(正常参考值:0~50u/l);白蛋白albumin(正常参考值:35~55g/l);甲胎蛋白afp(正常参考值:0~200ng/ml)。此外,对年龄和性别作以统计,统计信息如表4。
表4用于验证及质谱鉴定的唾液样本信息统计
唾液样本的采集和处理方法同前文所述,利用微量核酸蛋白测定仪对表中所列120例唾液样本进行定量,随后按质量取每例唾液样本500μg进行混合。获得健康志愿者(hv)、慢性乙型肝炎(hb)、慢性肝硬化(hc)及肝癌(hcc)四支唾液混合样本。利用bca蛋白定量试剂盒(碧云天生物技术,中国上海)测定混合样本浓度。
3.2唾液芯片设计和糖链糖型差异验证
本实验设计了一种以健康志愿者及慢性肝炎、肝硬化、肝癌患者各30例的唾液样本作为反应探针的唾液芯片,共计120例唾液探针,加上4个阴性质控和4个阳性质控,每个样本于芯片上点制连续的3个重复,制成一款12×32(点间距1mm)的唾液微阵列芯片。利用凝集素ltl相对定量检测唾液芯片上各例唾液样本中fucα1-2galβ1-4glcnac、fucα1-3(galβ1-4)glcnac结构的表达丰度时,利用cy5荧光染料标记凝集素ltl并配成反应体系(400μl凝集素芯片孵育液,40μl4m羟胺,10μl0.1%tween-20,20μgcy5标记的凝集素ltl,超纯水补足终体积至600μl)上样于唾液芯片。唾液芯片与cy5-ltl结合反应完成并清洗后,最终于genepix4000b芯片扫描仪上完成数据采集(参数设定为:激发波长635nm,pmt功率70%,激发强度为100%)。
在获取各探针的nfi数值后,通过检验扫描系统所提供的各数据的标准差值(sd),剔除sd<1.5的数据,然后取每个探针3个重复点的median值,将各唾液样本的median值数据按hv、hb、hc和hcc四组录入graphpadprism6.0软件中制作散点图并通过krustal-wallistest和one-wayanovaanalysis进行统计学分析。
3.3聚丙酰胺凝胶电泳(sds-page)及条带显色
将sda-page凝胶转移至电泳槽内,检查凝胶玻片方向和电极方向以确保电流在通路状态下。在本研究中,经sds-page分离的蛋白样本在凝胶上需通过两种显色方法鉴定目的条带,即利用氧化银银染显色(silverstaining)对比总蛋白差异以及利用凝集素印迹实验来验证ltl识别的特定糖蛋白糖链表达差异。用于银染的唾液蛋白样本上样量为8μg,用于lectinblotting的唾液蛋白样本上样量为30μg,按照实验需求取等质量的各组样本并加入4μl5×loadingbuffer,用超纯水补足至20μl,震荡混匀后将样本体系置于沸水中水浴5min,水浴后快速离心并于冰上冷却后上样。按照proteinladder、hv、hb、hc、hcc的顺序依次向各个凝胶孔上样。电泳参数设定为:80v恒压模式下,待loadingbuffer于浓缩胶层内形成一条细长且水平的直线时,调整电源至110v恒压模式至电泳结束。
银染显色:用于银染的sds-page凝胶应在电泳反应结束后及时从胶板中取出,于固定液(50%乙醇,10%冰醋酸,水)中浸泡2h以上。固定至凝胶体积缩小到一半后于浸泡液(30%乙醇,6.8%五水乙酸钠,0.2%硫代硫酸钠,0.15%戊二醛,水)中反应30min。经浸泡液反应后于超纯水中浸泡重新溶胀,换水浸泡20min×3次。利用染色液(0.5%硝酸银,0.1%甲醛,水)浸泡凝胶目的是使银离子与胶内蛋白质结合。所有反应过程均于摇床上低速震荡,保持各步反应液与凝胶的均匀接触。染色反应20min后用超纯水漂洗凝胶和反应器皿1min,然后倒入显色液(2.5%碳酸钠,0.1%甲醛,水)。在凝胶中条带显色至适当程度后及时用终止液(1%冰乙酸,水)终止并采集图像,同时全过程中严格使用超纯水,避免各步溶液中引入cl-、co32-、so42-等离子对显色反应造成影响。
凝集素印迹实验:用于印迹实验的sds-page凝胶在电泳反应结束后从胶板内取出,裁剪去多余部分后浸泡在1×转膜缓冲液中10min,与其浸泡在一起的还应有和凝胶等面积的滤纸4张、经甲醇浸泡活化30s的pvdf印迹膜1张。从电泳槽通路的正极到负极,印迹体系应该为:滤纸2张、pvdf印迹膜、凝胶、滤纸2张,按顺序排放好各层材料并保证各层材料之间紧密贴合无气泡后置于电泳槽内,设定参数300ma恒流电泳1h45min完成印迹反应。待反应完成后取出印迹后的pvdf膜,过程中应避免污染和物理损坏,将膜置于稀释至工作浓度的carbo-freeblocking封闭液中1h以脱去非特异性游离多糖在膜上的吸附。封闭后将pvdf膜转移至1×tbs中,加入终浓度为5μg/ml的cy5-ltl和终浓度为0.1mm的ca2+,4℃避光震荡12h。反应结束后用1×tbst清洗15min×3次,整个清洗过程也应注意严格避光以防止荧光猝灭。利用storm840多功能图像分析仪扫描荧光信号图像,参数设置pmt为800、分辨率100dpi、激发光波长635nm。
3.4凝集素-磁性微粒复合体的制备及对应糖蛋白的磁性分离
本实验利用一种实验室制备的环氧化fe3o4磁性微粒,偶联上凝集素ltl制成凝集素磁性微粒复合体(ltl-magneticparticlecompounds,lmpcs),然后通过lmpcs与样本的混合、磁性分离、清洗及洗脱,获得该凝集素ltl所亲和结合的特异糖蛋白。首先取环氧化fe3o4磁性微粒3mg(该材料通过一种免疫共沉淀方法获得并经环氧化修饰,具体的方法见文献[46]),加入1ml的偶联缓冲液重复颠倒直至充分混匀后,置于磁性分离器上待磁性微粒完全吸附至磁铁上时弃去上清液实现清洗,该清洗步骤×3次。随后利用600μl偶联缓冲溶液溶解300μg的ltl凝集素加入该磁性微粒体系中重悬混匀,置于水平震荡摇床上180rpm、25℃反应6h完成凝集素ltl与磁性微粒的偶联。待偶联完成后于磁性分离器上磁分离同时弃去上清液,加入1ml磁粒封闭液通过重悬、震荡、磁分离弃上清步骤清洗此时的lmpcs,重复3次清洗之后加入600μl磁粒封闭液于摇床上反应1h封闭其多余的环氧基团。完成封闭后,利用结合缓冲溶液清洗lmpcs共3次,于此同时,利用600μl体积的结合缓冲溶液溶解唾液样本2mg(如果唾液原始浓度过小,利用10kda超滤离心管(milliporecorp,u.s.a)在装盛对应质量样本后于14,000×g离心超滤获得浓缩后的样本,然后利用结合缓冲溶液定容至600μl)后加入lmpcs体系中重悬,180rpm震荡、25℃反应3h。在洗脱前,利用清洗缓冲溶液,重复如前所述的清洗步骤至少5次。利用nano-drop实时测定清洗液中蛋白质浓度,待检测到清洗液中蛋白质浓度为0时即说明非特异性结合的蛋白质已分离彻底。加入400μl洗脱缓冲液,于摇床上180rpm震荡20min,磁性分离后收集上清液,此时特定的糖蛋白由于凝集素变性而溶于上清液中,然后再加入200μl洗脱缓冲液重复一次洗脱步骤并收集上清液。
3.5酶法分离糖蛋白n-糖链(n-glycans)
取经lmpcs分离获得的特定糖蛋白200μg加入10kda超滤管(milliporecorp,u.s.a)中,首先加入8m尿素至超滤管内最大载液量刻度处,然后经14,000×g离心10min将无机盐离子、非蛋白类小分子随溶剂经超滤膜过滤至收集套管中;加入400μl8m尿素混匀后离心并重复此步骤3次以使蛋白质样本充分变性;加入稀释好的1×dtt工作液400μl并充分吹吸混匀,56℃下反应45min后14,000×g离心10min;向管内加入400μl1×iam工作液并于室温下避光反应30min封闭二硫键;加入400μl的40mmol/lnh4hco3离心换液以除去残余的各步反应液并重复此步骤3次;加入20μl用盐酸预活化的trypsin蛋白酶,37℃过夜酶切;反应结束后沸水浴1min以灭活trypsin蛋白酶,然后为超滤膜换上新的收集套管,向超滤膜内加入2μlpngase-f糖苷酶,反应10h后14,000×g离心10min,加入400μl40mmol/lnh4hco3重复一次离心,两次离心后n-糖链已滤至新的收集套管中,将n-糖链溶液于离心浓缩仪上-20℃真空离心冻干。
3.6naclo氧化法分离o-糖链(o-glycans)
取经lmpcs分离所获得的糖蛋白200μg加入10kda超滤管中,14,000×g离心10min去除原溶剂相,加入400μl超纯水混匀后离心,重复该清洗至少7次,naclo在后续的反应中对ph有严格要求,因此实验过程中特别注意超纯水的质量以及清洗的彻底程度;最后一次清洗后依次加入200μl超纯水、100μl6%naclo,置于水平震荡摇床上室温下反应30min;反应结束后冰浴预冷,加入15μl的10%甲酸(提前于冰上预冷配制)终止次氯酸钠的氧化反应,为避免反应过于剧烈,反应体系一直保持在冰浴中10min;离心后加入400μl超纯水重复清洗至少7次以充分去除上步反应剩余的甲酸;完成最后一次清洗后,经离心此时滤膜内应剩余约30μl体积的溶液,向滤膜内加入170μl超纯水并用甲酸调ph至7.6左右,然后加入6.64μl6%naclo,换上新的收集套管并用封口膜将体系密封起来于室温下反应24h。反应结束后加入8μl预冷的10%甲酸终止反应,离心后再加入200μl超纯水混匀并离心,两次离心后o-糖链已充分滤至新的收集管中,将o-糖链溶液于离心浓缩仪上-20℃真空离心冻干。
3.7糖链的凝胶除盐
sepharosecl-4b的清洗和非极性平衡:取1.5ml的无酶离心管,加入100μl的sepharosecl-4b凝胶,加入800μl的甲醇水洗脱液,重悬混匀后9,000×g离心5min,从离心机中取出后于离心管孔板中竖直静置30s,待凝胶平面水平后用移液器小心吸弃上清液,用甲醇水洗脱液重复上述步骤5次;加入正丁醇清洗液重复离心、弃上清步骤2次后获得待上样的凝胶。
糖链上样除盐:取500μl正丁醇清洗液重新溶解冻干后的n/o-糖基化糖链样本,然后上样至预先平衡好的sepharosecl-4b凝胶中,于水平震荡摇床上80rpm震荡反应1h,根据固液两相的极性差异,极性的糖链会疏于液相而结合至凝胶粒内;待糖链与凝胶结合后,9,000×g离心5min并用移液器吸弃上清液,然后再加入500μl正丁醇清洗液混匀后离心弃上清,重复此清洗步骤5次以除去样本中的非极性多肽和盐离子;清洗完成后加入500μl甲醇水洗脱液,于摇床上180rpm震荡反应20min,此时因甲醇溶液的极性而使糖链重新溶于洗脱液中,反应结束后9,000×g离心并用新的无酶管收集上清液,再用500μl甲醇水洗脱液重复洗脱1次。将纯化后的n/o-糖链溶液于离心浓缩仪上-20℃真空离心冻干。
3.8n-/o-糖链的maldi-tof-ms质谱解析
利用5μl的1:1甲醇:水溶液(v:v)重新溶解冻干后的糖链结晶,吹吸混匀保证管底微量糖链样本的充分溶解后,取2μl上样至brukermtpanchorchip384点的靶板样品孔上,待样品自然风干结晶,观察不锈钢靶板上样本结晶的形状,糖链样本在适宜浓度下结成的晶型应该是在圆形液滴的范围内呈星状向外放射开来。随后在原样本结晶的范围内再加上2μldhb基质,等待自然风干重新结晶,将上样有糖链结晶的mtpanchorchip384点靶板装载于maldi-tof/tof-ms(brukerdaltonic,germany),在tof-ms模式下通过一级质谱解析原始样本,其参数选定为:在“rp_700-4000_da.par”的多糖测定谱段下,根据标准品校准该范围内的解析精度,根据记录的靶点位置依次解析n-糖基化糖链(1000-3750da)和o-糖基化糖链(500-1800da)。
3.9质谱数据分析
利用分析软件flexanalysis打开以“.ref”为后缀的质谱数据,设置谱峰信噪比(s/n)≥3为自动筛选条件,读取各峰的数据,若因信躁影响使得个别可见峰未读取出来,可通过软件界面中“+(findmassspectrum)”手动将个别较高峰添加至数据列表中。通过上述一系列操作,可获得“m/z.”、“s/n”、“qualityfac.”、“res.”、“intens.”及“area”共6项数值化数据。在信噪比有效的条件下(s/n≥3)选取各峰的“m/z.”和“intens.”列举生成文本文档,导入glycoworkbench软件并自动分析糖链结构,分析参数设定为:选择glycomedb数据库,选择离子通道为“[m+na]+”和“[m+h]+”,电荷最多+1,前体离子容忍度为±1da,碎片离子容忍度为±0.5da。
研究结果:
4.1唾液芯片对ltl识别唾液糖链糖型差异的验证
120例定量的唾液样本在同一孵育环境下与凝集素ltl竞争结合,通过各唾液探针点的nfi反映出各样本fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac结构的表达丰度。凝集素ptl-ii所识别的bloodgroup-hantigen和t-antigen结构在hv、hb、hc和hcc中均稳定表达且无差异。利用cy5-ptl-ii与唾液芯片反应,芯片扫描结果显示:芯片上各唾液探针点样均一,阴性质控和阳性质控均有良好的指示作用,并且内参凝集素ptl-ii上样后显示出样本探针定量均一性好,无定量不准确而造成的实验误差。利用cy5-ltl与唾液芯片反应,基于芯片扫描结果,利用各唾液探针fi的median值根据hv、hb、hc和hcc分组绘制散点图,如图2所示。
通过hv、hb、hc和hcc四组的组间krustal-wallistest和one-wayanovaanalysis统计学分析(如表5)发现凝集素ltl所识别的fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac结构在hcc组中相较于hv组和hb组均有显著的表达增多趋势(p<0.0001),在hc组中相较于hv组(p=0.0002)和hb(p=0.0019)组有显著的表达增多趋势,而在hv与hb组间、hc与hcc组间则无显著性差异。
表5四组样本的组间krustal-wallistest和one-wayanova分析
amultiplecomparison(1vs.2),在四组样本间两两对比形成的分组;bmeanrankdiff.,通过krustal-wallistest获得的组间均值评级差值,meanrankdiff.=(meanrank2–meanrank1);csignificant,差异显著性,若组间meanrankdiff>20且p<0.05则为yes,反之为no。
4.2凝集素印迹验证混合样本结果
三组慢性肝病患者和健康志愿者唾液样本分别通过混合消除组内个体差异后,混合样本通过sds-page电泳并经银染实验评估hv、hb、hc和hcc唾液蛋白差异(如图3a)。银染结果表明四组唾液蛋白的条带基本一致,大于100kda的大分子蛋白条带在本实验中染色较浅且因“拖尾”现象而使得条带不明显。在10~100kda间的高峰度蛋白条带的数量和着色深度基本一致(如70kda、60kda、15kda、10kda附近的较宽条带)。而在25~15kda之间大约20kda处有一呈黄色的条带明显地显示出该处蛋白条带在hc、hcc组中较hv、hb组颜色更深一些,这说明该条带对应部分蛋白在hbv引起的肝病发展后期有表达上调的趋势。
通过ltl的凝集素印迹实验(lectinblotting)结果(如图3b)可以观察到凝集素ltl与hv、hb、hc和hcc四组唾液样本的糖蛋白进行特异性结合,显示出约7条明显的条带,除了3条结合水平相近的条带外,图中标示出了4条有明显结合差异的条带(b1~b4),如分子量约为90kda的b1、约60kda的b2、约25kda的b4显示了从健康到肝癌过程中fucα1-2galβ1-4glcnac、fucα1-3(galβ1-4)glcnac糖型表达增多的趋势,其中b2条带反映出ltl与hcc组的结合明显强于hv、hb和hc三组;有且仅有1条分子量约为34kda的条带b3在这一过程中显示出该糖型表达减少的趋势,ltl与hv组的结合明显强于hb、hc和hcc三组。这一结果基本与凝集素芯片、唾液芯片的结果相符,验证说明了在消除个体差异的混合样本中,唾液蛋白质的表达水平受银染显色灵敏度限制并没体现出明显的差异,而在蛋白水平无变化的基础上ltl所识别的fucα1-2galβ1-4glcnac和fucα1-3(galβ1-4)glcnac糖链结构在hcc患者唾液糖蛋白中有增多的现象。
4.3经ltl-lmpcs分离的糖蛋白n-糖链maldi-tof-ms解析
利用lmpcs分离hv、hb、hc和hcc患者唾液中ltl识别的特定糖蛋白,然后利用pngasef内切酶专一地分离特定糖蛋白上的n-糖链,通过maldi-tof-ms质谱鉴定各糖链质荷比(m/z.),取质谱鉴定获得的信噪比s/n>3的各个n-糖链峰并搜索糖链数据库glycomedb进行分析,推测获得了n-糖链结构信息,并得出各个n-糖链峰对应的质谱数据,包括m/z.、n-糖链结构、相对峰强度等。
通过maldi-tof-ms共鉴定到了29种n-糖链,其中在hv、hb、hc和hcc各组中分别鉴定到了21、25、29和28种n-糖链。在这些糖链当中,共有21种n-糖链(如m/z1419.476(man)3+(man)3(glcnac)2,1444.507(gal)1(glcnac)1(fuc)1+(man)3(glcnac)2等)在四组中均被鉴定到,4种n-糖链(m/z1743.581(man)5+(man)3(glcnac)2,1905.634(man)6+(man)3(glcnac)2,2158.777(fuc)2(gal)2(galnac)3+(man)3(glcnac)2,和2905.036(fuc)1(gal)5(glcnac)5+(man)3(glcnac)2)在hb、hc、hcc三组慢性肝病患者的唾液中被鉴定到。值得注意的是,有1种n-糖链(m/z2205.766(neuac)1(fuc)2(gal)1(glcnac)1(man)2+(man)3(glcnac)2)仅存在于hc组的唾液样本中,有3种n-糖链(m/z1257.423(man)2+(man)3(glcnac)2,1501.529(gal)1(glcnac)2+(man)3(glcnac)2,和1704.608(gal)1(glcnac)3+(man)3(glcnac)2)仅存在于hc和hcc两组的唾液样本中。
4.4经ltl-lmpcs分离的糖蛋白o-糖链maldi-tof-ms解析
利用naclo氧化法分离特定糖蛋白上的o-糖链,通过maldi-tof-ms质谱鉴定各糖链质荷比(m/z.),取质谱鉴定获得的信噪比s/n>3的各个n-糖链峰通过搜索糖链数据库glycomedb进行分析(根据o-糖链酸的修饰特点,在通过质荷比进行糖链信息比对时应对应地加上糖链修饰基团a:58da和b:72da进行分析比对),推测获得了o-糖链结构信息,并得出各个o-糖链峰对应的质谱数据,包括m/z.、n-糖链结构、相对峰强度等。
通过maldi-tof-ms共鉴定到了35种o-糖链,其中在hv、hb、hc和hcc各组中分别鉴定到了20、18、19和24种。其中,9种o-糖链(如m/z572.256(neuac)1(galnac)1,1097.383(fuc)1(neuac)1(gal)1(galnac)1等)在hv、hb、hc和hcc四组唾液样本中均鉴定到,还有5种o-糖链(如m/z781.256(gal)3(galnac)1,938.345(fuc)2(gal)1(glcnac)1(galnac)1等)仅存在于hv组,以及9种o-糖链(其中有8种含fuc的糖链,如m/z828.269(fuc)1(gal)1(glcnac)1(galnac)1,995.367(fuc)1(gal)1(glcnac)2(galnac)1等)仅存在于hcc组。此外,在这一肝病发生发展过程中的早期,也就是hv和hb组唾液样本中共同鉴定到了2种o-糖链(m/z600.115(sulf-glcnac)1(galnac)1和935.296(fuc)1(gal)3(galnac)1),对应地在该疾病发展过程的晚期,也就是hc和hcc组中共同鉴定到了3种o-糖链(m/z1322.444(fuc)1(neuac)1(gal)1(glcnac)2(galnac)1,1339.392(fuc)1(neuac)1(sulf-gal)1(gal)1(glcnac)1(galnac)1和1355.454(fuc)1(gal)3(glcnac)2(galnac)1)。另外,4种o-糖链(如m/z762.168(gal)1(sulf-glcnac)1(galnac)1,1259.436(fuc)1(neuac)1(gal)2(glcnac)1(galnac)1等)存在于hv、hb和hc组唾液中,而有3种o-糖链(m/z617.224(fuc)1(met-gal)1(galnac)1,1177.407(fuc)2(glcnac)2(gal)1(galnac)1和1308.444(fuc)1(neuac)1(gal)1(glcnac)2(galnac)1)存在于hb、hc和hcc组的唾液中。
而根据凝集素ltl识别糖蛋白糖链末端岩藻糖的特性,对上述35种糖链进行进一步的分析,发现在hv、hb、hc和hcc各组中分别鉴定到了8、8、10和16种岩藻糖基化o-糖链。其中,2种岩藻糖基化o-糖链((m/z751.261/773.243(fuc)1(gal)2(galnac)1,1097.383(fuc)1(neuac)1(gal)1(galnac)1)在hv、hb、hc和hcc四组唾液样本中均鉴定到,1种岩藻糖基化o-糖链(m/z935.296(fuc)1(gal)3(galnac)1)存在于hv和hb组中,3种岩藻糖基化o-糖链(m/z1322.444(fuc)1(neuac)1(gal)1(glcnac)2(galnac)1,1339.392(fuc)1(neuac)1(sulf-gal)1(gal)1(glcnac)1(galnac)1,and1355.454(fuc)1(gal)3(glcnac)2(galnac)1)存在于hc和hcc组中。另外,有2种岩藻糖基化o-糖链(m/z896.289(fuc)1(neugc)1(gal)1(galnac)1,and1259.436(fuc)1(neuac)1(gal)2(glcnac)1(galnac)1)存在于hv、hb和hc组中,3种岩藻糖基化o-糖链(m/z617.224(fuc)1(met-gal)1(galnac)1,1177.407(fuc)2(glcnac)2(gal)1(galnac)1,and1308.444(fuc)1(neuac)1(gal)1(glcnac)2(galnac)1)存在于hbv引起的一系列肝病中(即hb、hc和hcc组中)。重要的是,有3种岩藻糖基化o-糖链(m/z938.345(fuc)2(gal)1(glcnac)1(galnac)1,1083.383(fuc)1(neuac)1(gal)1(galnac)1,and1402.520(fuc)1(neuac)1(gal)1(glcnac)1(sulf-glcnac)1(galnac)1)仅存在于hv组中,以及8种岩藻糖基化o-糖链(m/z652.216(fuc)1(glcnac)1(galnac)1,828.269(fuc)1(gal)1(glcnac)1(galnac)1,833.314(fuc)1(glcnac)1(galnac)2,995.367(fuc)1(gal)1(glcnac)2(galnac)1,1144.295(fuc)1(sia)1(sulf-gal)1(gal)1(galnac)1,1157.420(fuc)1(gal)2(glcnac)2(galnac)1,1163.417(fuc)2(glcnac)2(gal)1(galnac)1),1193.402(fuc)1(gal)2(glcnac)2(galnac)1)仅存在于hcc组中。
所以,最后可以得出:8种仅在hcc组鉴定到的岩藻糖基化o-糖链(m/z652.216(fuc)1(glcnac)1(galnac)1,828.269(fuc)1(gal)1(glcnac)1(galnac)1,833.314(fuc)1(glcnac)1(galnac)2,995.367(fuc)1(gal)1(glcnac)2(galnac)1,1144.295(fuc)1(sia)1(sulf-gal)1(gal)1(galnac)1,1157.420(fuc)1(gal)2(glcnac)2(galnac)1,1163.417(fuc)2(glcnac)2(gal)1(galnac)1)和1193.402(fuc)1(gal)2(glcnac)2(galnac)1);针对唾液样本进行检测,只需测定其是否含有这8种岩藻糖基化o-糖链之任一或任意组合,即可作出肝癌(hcc)筛查、早期诊断、风险评估、药物筛选和/或疗效评估的结果。
- 还没有人留言评论。精彩留言会获得点赞!