一种血清淀粉样蛋白A胶体金免疫比浊法检测试剂盒的制作方法
本发明涉及医学检测技术领域,具体涉及一种血清淀粉样蛋白a胶体金免疫比浊法检测试剂盒。
背景技术:
血清淀粉样蛋白a(serumamyloidaprotein,saa)是一类多基因编码的多形态蛋白家族,是组织淀粉样蛋白a的前体物质,属于急性时相反应蛋白,其相对分子量约12000。在急性时相反应中,如炎症或感染急性期,经il-1、il-6和tnf刺激,saa在肝脏中由被激活的巨噬细胞和纤维母细胞合成,在48~72小时内浓度迅速升高,可升高到最初浓度的100~1000倍,但其半衰期短,只有50分钟左右,并在疾病恢复期迅速下降。某些疾病,如病毒感染、移植排斥反应、冠心病等,saa的敏感性高,可为临床提供更好的参考价值,作为一个新的检测指标,saa受到人们越来越多的关注。
现有的血清淀粉样蛋白a免疫比浊检测试剂盒,直接使用胶乳微球偶联抗体,用得到胶乳抗体复合物试剂进行检测,一方面,测试中产生的沉淀附着于杯壁上,不利于仪器的清洗,另一方面,得到的胶乳试剂测试的线性范围较窄。
技术实现要素:
根据第一方面,一种实施例中提供一种抗体-胶体金复合物,所述抗体-胶体金复合物为偶联有抗体的胶体金,所述抗体选自可特异性结合至血清淀粉样蛋白a的抗体。
根据第二方面,一种实施例中提供一种组合物,含有保存液以及第一方面所述抗体-胶体金复合物。
根据第三方面,一种实施例中提供一种试剂组合,包括第一方面所述抗体-胶体金复合物或第二方面所述组合物,第二方面所述组合物即为r2试剂。
根据第四方面,一种实施例中提供一种试剂盒,包括第一方面所述抗体-胶体金复合物,或第二方面所述组合物,或第三方面所述试剂组合。
根据第五方面,一种实施例中提供第一方面所述抗体-胶体金复合物,或第二方面所述组合物,或第三方面所述试剂组合,或第四方面所述试剂盒在检测血清淀粉样蛋白a中的应用。
根据第六方面,一种实施例中提供第一方面所述抗体-胶体金复合物的制备方法,包括:将抗体与胶体金混合,反应得到所述抗体-胶体金复合物。
依据上述实施例的抗体-胶体金复合物及其检测血清淀粉样蛋白a的试剂盒,将抗体偶联至胶体金微球,不再使用胶乳作为偶联载体,用于检测血清淀粉样蛋白a时,能够提高线性范围,并且有效避免沉淀物附着反应杯壁上。
附图说明
图1显示为实施例1与普通免疫比浊法检测所得的血清样淀粉蛋白a浓度结果对比图;
图2显示为实施例1与普通免疫比浊法检测后,清洗对应的反应槽,所测得的本底电压结果图;
图3显示为实施例2与普通免疫比浊法检测所得的血清样淀粉蛋白a浓度结果对比图;
图4显示为实施例2与普通免疫比浊法检测后,清洗对应的反应槽,所测得的本底电压结果图。
具体实施方式
下面通过具体实施方式结合附图对本发明作进一步详细说明。其中不同实施方式中类似元件采用了相关联的类似的元件标号。在以下的实施方式中,很多细节描述是为了使得本申请能被更好的理解。然而,本领域技术人员可以毫不费力的认识到,其中部分特征在不同情况下是可以省略的,或者可以由其他元件、材料、方法所替代。在某些情况下,本申请相关的一些操作并没有在说明书中显示或者描述,这是为了避免本申请的核心部分被过多的描述所淹没,而对于本领域技术人员而言,详细描述这些相关操作并不是必要的,他们根据说明书中的描述以及本领域的一般技术知识即可完整了解相关操作。
另外,说明书中所描述的特点、操作或者特征可以以任意适当的方式结合形成各种实施方式。同时,方法描述中的各步骤或者动作也可以按照本领域技术人员所能显而易见的方式进行顺序调换或调整。因此,说明书和附图中的各种顺序只是为了清楚描述某一个实施例,并不意味着是必须的顺序,除非另有说明其中某个顺序是必须遵循的。
本文中为部件所编序号本身,例如“第一”、“第二”等,仅用于区分所描述的对象,不具有任何顺序或技术含义。而本申请所说“连接”、“联接”,如无特别说明,均包括直接和间接连接(联接)。
根据第一方面,在一些实施例中,提供一种抗体-胶体金复合物,所述抗体-胶体金复合物为偶联有抗体的胶体金,所述抗体选自可特异性结合至血清淀粉样蛋白a的抗体。
在一些实施例中,通过胶体金来增强浊度,达到提高线性范围的作用。
在一些实施例中,通过胶体金来改变反应后清洗能力,解决免疫比浊反应后产生的沉淀物附着在反应杯的杯壁上,造成杯壁不利于清洗的问题,并且同样达到定量检测目的。
在一些实施例中,本发明旨在建立一种新的血清淀粉样蛋白a检测方法,线性范围、特异性以及清洗效果都能满足要求,可以用于生化仪器、特定蛋白仪器的检测。
在一些实施例中,所述抗体-胶体金复合物是由抗体与胶体金按照(1-6):3的质量比混合反应得到。
在一些实施例中,血清淀粉样蛋白a包括但不限于人源血清淀粉样蛋白a。人源血清淀粉样蛋白a通常存在于人血液样本中,具体可以是血清样本、血浆样本、全血样本等等。
在一些实施例中,所述抗体包括但不限于单克隆抗体、多克隆抗体中的至少一种。
在一些实施例中,所述抗体包括但不限于羊抗人血清淀粉样蛋白a多克隆抗体、鼠抗人血清淀粉样蛋白a单克隆抗体、兔抗人血清淀粉样蛋白a多克隆抗体等等中的至少一种。抗体可从市场上购买得到,也可以自己制备。
在一些实施例中,所述胶体金是由氯金酸在还原剂作用下反应得到。本领域技术人员可通过常规方法制备得到胶体金。
在一些实施例中,所述还原剂包括但不限于白磷、维生素c(l-抗坏血酸)、柠檬酸钠、鞣酸中的至少一种。
根据第二方面,在一些实施例中,提供一种组合物,含有保存液以及第一方面所述抗体-胶体金复合物。抗体-胶体金复合物是离心后的少量固体,所以,将抗体-胶体金复合物加入保存液后,几乎不改变保存液成分的浓度,同时,抗体-胶体金复合物与保存液混合后,混合液中抗体-胶体金复合物的浓度即为离心前的胶体金的浓度。
在一些实施例中,所述保存液含有第二缓冲剂、第二表面活性剂、第二防腐剂、稳定剂中的至少一种。
在一些实施例中,所述保存液含有如下终浓度的组分中的至少一种:5-50mmol/l第二缓冲剂、0.5-10g/l第二表面活性剂、0.5-5g/l第二防腐剂、0.5-10g/l稳定剂。抗体-胶体金复合物与保存液混合后,保存液中各组分浓度几乎不变,因此,前述第二缓冲剂、第二表面活性剂、第二防腐剂、稳定剂的浓度也是对应组分在保存液与胶乳抗体复合物混合后形成的混合液中的终浓度。
在一些实施例中,所述保存液中第二缓冲剂的浓度具体可以包括但不限于5mmol/l、10mmol/l、15mmol/l、20mmol/l、25mmol/l、30mmol/l、35mmol/l、40mmol/l、45mmol/l、50mmol/l等等。
在一些实施例中,所述保存液中所述第二表面活性剂的浓度具体可以包括但不限于0.5g/l、0.6g/l、0.7g/l、0.8g/l、0.9g/l、1g/l、2g/l、3g/l、4g/l、5g/l、6g/l、7g/l、8g/l、9g/l、10g/l等等。
在一些实施例中,所述保存液中第二防腐剂的浓度具体可以包括但不限于0.5g/l、0.6g/l、0.7g/l、0.8g/l、0.9g/l、1g/l、2g/l、3g/l、4g/l、5g/l等等。
在一些实施例中,所述保存液中稳定剂的浓度具体可以包括但不限于0.5g/l、0.6g/l、0.7g/l、0.8g/l、0.9g/l、1g/l、2g/l、3g/l、4g/l、5g/l、6g/l、7g/l、8g/l、9g/l、10g/l等等。
在一些实施例中,所述保存液中的第二缓冲剂包括但不限于磷酸缓冲盐溶液(pbs)、氨基丁三醇(tris)、甘氨酸、硼酸盐、4-羟乙基哌嗪乙磺酸(hepes)、3-(n-吗啉基)-2-羟基丙磺酸(mopso)、吗啉乙磺酸(mes)中的至少一种。
在一些实施例中,所述保存液中的第二表面活性剂包括但不限于聚乙烯吡络烷酮、丙三醇、聚乙二醇6000、聚乙二醇8000、聚乙二醇10000、聚乙二醇20000、吐温20、吐温40、吐温80中的至少一种。
在一些实施例中,所述保存液中的第二防腐剂包括但不限于叠氮化钠、proclin-950、proclin-300、krovin100、krovin300、krovin500、krovin750、硫柳汞中的至少一种。
在一些实施例中,所述保存液中的稳定剂包括但不限于蔗糖、海藻糖、牛血清白蛋白、酪蛋白、甘露醇、明胶中至少一种。
在一些实施例中,抗体-胶体金复合物与保存液混合后,所得的混合液中胶体金的浓度为0.05-0.2wt%,具体可以包括但不限于0.05wt%、0.06wt%、0.07wt%、0.08wt%、0.09wt%、0.1wt%、0.11wt%、0.12wt%、0.13wt%、0.14wt%、0.15wt%、0.16wt%、0.17wt%、0.18wt%、0.19wt%、0.2wt%等等。
根据第三方面,在一些实施例中,提供一种试剂组合,包括第一方面所述抗体-胶体金复合物或第二方面所述组合物,第二方面所述组合物即为r2试剂。
在一些实施例中,还包括r1试剂,所述r1试剂含有第一缓冲剂、第一表面活性剂、第一溶血剂、第一防腐剂中的至少一种。
在一些实施例中,所述r1试剂含有如下终浓度的组分中的至少一种:25-50mmol/l第一缓冲剂、0.5-10g/l第一表面活性剂、0.2-5g/l第一溶血剂、0.5-5g/l第一防腐剂。
在一些实施例中,所述r1试剂中的第一缓冲剂的浓度包括但不限于25mmol/l、30mmol/l、35mmol/l、40mmol/l、45mmol/l、50mmol/l等等。
在一些实施例中,所述r1试剂中的第一表面活性剂的浓度包括但不限于0.5g/l、0.6g/l、0.7g/l、0.8g/l、0.9g/l、1g/l、2g/l、3g/l、4g/l、5g/l、6g/l、7g/l、8g/l、9g/l、10g/l等等。
在一些实施例中,所述r1试剂中的第一溶血剂的浓度包括但不限于0.2g/l、0.3g/l、0.4g/l、0.5g/l、0.6g/l、0.7g/l、0.8g/l、0.9g/l、1g/l、2g/l、3g/l、4g/l、5g/l等等。
在一些实施例中,所述r1试剂中的第一防腐剂的浓度包括但不限于0.5g/l、0.6g/l、0.7g/l、0.8g/l、0.9g/l、1g/l、2g/l、3g/l、4g/l、5g/l等等。
在一些实施例中,所述r1试剂中的第一缓冲剂包括但不限于磷酸缓冲盐溶液(pbs)、氨基丁三醇(tris)、甘氨酸、硼酸盐、4-羟乙基哌嗪乙磺酸(hepes)、3-(n-吗啉基)-2-羟基丙磺酸(mopso)、吗啉乙磺酸(mes)中的至少一种。
在一些实施例中,所述r1试剂中的第一表面活性剂包括但不限于聚乙烯吡络烷酮(cas登录号:9003-39-8)、丙三醇(cas登录号:56-81-5)、聚乙二醇6000(peg6000)、聚乙二醇8000(peg8000)、聚乙二醇10000(peg10000)、聚乙二醇20000(peg20000)、吐温20(tween-20)、吐温40(tween-40)、吐温80(tween-80)中的至少一种。
在一些实施例中,所述r1试剂中的第一溶血剂选自皂苷、tritonx-100、tritonx-405中的至少一种。其中,皂苷具有溶血作用,可与胆甾醇结合生成不溶性分子复合物,破坏血红细胞的渗透性而发生崩解。
在一些实施例中,所述r1试剂中的第一防腐剂包括但不限于叠氮化钠(cas登录号:26628-22-8)、proclin-950、proclin-300、krovin100、krovin300、krovin500、krovin750、硫柳汞(cas登录号:54-64-8)中的至少一种。
根据第四方面,在一些实施例中,提供一种试剂盒,包括第一方面所述抗体-胶体金复合物,或第二方面所述组合物,或第三方面所述试剂组合。
在一些实施例中,所述试剂盒还包括用于独立容纳所述r1试剂、r2试剂的容器。
通常情况下,r1试剂与r2试剂独立分装于不同的容器中,或者同一容器的不同腔室中,形成套装试剂盒产品。
在一些实施例中,所述试剂盒还包括包装说明书。
根据第五方面,在一些实施例中,提供第一方面所述抗体-胶体金复合物,或第二方面所述组合物,或第三方面所述试剂组合,或第四方面所述试剂盒在检测血清淀粉样蛋白a中的应用。
在一些实施例中,所述应用包括用于检测样本中血清淀粉样蛋白a的浓度。
在一些实施例中,所述样本可以为体液样本。
在一些实施例中,所述体液样本包括但不限于全血、血清、血浆中的至少一种。
根据第六方面,在一些实施例中,提供第一方面所述抗体-胶体金复合物的制备方法,包括:将抗体与胶体金混合,反应得到所述抗体-胶体金复合物。
在一些实施例中,所述抗体与胶体金按照(1-6):3的质量比混合反应。
在一些实施例中,所述胶体金是由氯金酸在还原剂作用下反应得到。本领域技术人员可通过常规方法制备得到胶体金。
在一些实施例中,所述还原剂包括但不限于白磷、维生素c(l-抗坏血酸)、柠檬酸钠、鞣酸中的至少一种。
在一些实施例中,将氯金酸水溶液与还原剂混合,加热至沸腾,反应得到所述胶体金。
在一些实施例中,所述氯金酸水溶液的初始质量浓度为0.01%。
在一些实施例中,氯金酸水溶液与还原剂混合,加热至沸腾后,反应时间为15-30min。
在一些实施例中,氯金酸水溶液与还原剂混合反应结束后,调节反应液ph至6.0-7.0,加入抗体,调节反应液ph至6.5-7.5,反应得到所述抗体-胶体金复合物。
在一些实施例中,反应得到所述抗体-胶体金复合物后,调节含有所述抗体-胶体金复合物的溶液的ph至6.0-8.0。
在一些实施例中,反应得到所述抗体-胶体金复合物后,离心,去除上清液,向所得抗体-胶体金复合物中加入保存液,制得含有所述抗体-胶体金复合物的组合物,该组合物即为r2试剂。离心后的固体即为抗体-胶体金复合物。
在一些实施例中,本发明将抗体偶联至胶体金微球,不再使用胶乳作为偶联载体,用于检测血清淀粉样蛋白a时,可以提高试剂的线性范围,有效避免沉淀附着在反应杯壁上不易清洗的问题。
在一些实施例中,本发明试剂盒检测线性范围为0.2-300mg/l,宽于现有的免疫比浊法。
以下实施例中,如无特别说明,调节ph所用试剂为氢氧化钠水溶液、盐酸。
实施例1
本实施例提供测定血清淀粉样蛋白a浓度的试剂盒的制备方法,包括如下步骤:
1)r1试剂的制备:
在调配罐中加入适量的水,调节搅拌器至合适转速,依次投入第一缓冲剂、第一表面活性剂、第一溶血剂、第一防腐剂,搅拌10-20分钟至完全溶解,溶液澄清透明无沉淀后,调节ph至8.0,定容至最终体积。溶解后通过微孔滤膜过滤,收集滤液,将过滤后的r1试剂成品放置在储存容器中,进行分装标识。所得的r1试剂含有如下终浓度的组分:5mmol/l第一缓冲剂、0.5g/l第一表面活性剂、0.2g/l第一溶血剂、0.5g/l第一防腐剂,余量为水。其中,第一缓冲剂为tris(即氨基丁三醇,亦称三羟甲基氨基甲烷),第一表面活性剂为peg6000,第一溶血剂为皂苷,第一防腐剂为proclin-300。皂苷具有溶血作用,可与胆甾醇结合生成不溶性分子复合物,破坏血红细胞的渗透性而发生崩解,皂苷的加入,使得该试剂盒可用于检测全血中的血清淀粉样蛋白a。
2)r2试剂的制备:
采用柠檬酸三钠(c6h5na3o7、cas登录号为68-4-2)还原法制备胶体金溶液,具体操作如下:将0.01%氯金酸水溶液加热至沸腾,再按照1ml/100ml的体积比加入1%柠檬酸三钠水溶液(即每100ml氯金酸水溶液中加入1ml柠檬酸三钠水溶液),继续加热煮沸15min,冷却至室温后用蒸馏水恢复至原体积(即对氯金酸水溶液进行加热之前的体积)。将胶体金颗粒溶液ph调节至7.5,按照鼠抗人血清淀粉样蛋白a单克隆抗体:胶体金=2:1的质量比,边搅拌边逐渐加入鼠抗人血清淀粉样蛋白a单克隆抗体(简称saa单克隆抗体),使用hcl调节ph至6.5,在该酸性环境下,搅拌反应20分钟,得到saa抗体-胶体金溶液,待其冷却,使用1wt%的naoh水溶液调节saa抗体-胶体金溶液的ph至碱性环境中稳定,调节抗人saa抗体-胶体金微球溶液的ph至碱性环境的方法具体是使用1wt%的naoh水溶液调节,每5~15秒加入一滴naoh水溶液,使10滴ph变化量为0.5~1.0个ph,将金标抗体溶液的ph从5.0调节到8.0,将混合液以15000rpm转速离心1小时,去除上清液,向所得的抗人saa抗体-胶体金微球复合物中加入保存液,定容至目标体积,所得溶液中胶体金的含量为0.05wt%,微孔滤膜过滤、分装,进行标识。本实施例中所使用的保存液中含有如下终浓度的组分:5mmol/l第二缓冲剂、0.5g/l第二表面活性剂、0.5g/l第二防腐剂、0.5g/l稳定剂,余量为水。其中,第二缓冲剂为tris(三羟甲基氨基甲烷),第二表面活性剂为tween-20,第二防腐剂为proclin-300,稳定剂为海藻糖、牛血清白蛋白的混合物,海藻糖、牛血清白蛋白在保存液中的浓度分别为0.25g/l、0.25g/l。
对比例1
普通免疫比浊法的试剂即为对照组,主要制备过程如下:
该对照组r1试剂的制备同实施例1中r1试剂的制备方法。
r2的制备:
将实施例1中的胶体金换成成品的100nm粒径的聚苯乙烯胶乳微球。后续制备成抗体-胶乳复合物,向标记好的胶乳微球-saa抗体复合物中加入适量的与实施例1相同的保存液,超声重悬后,调节ph至8.0,定容至最终体积。
采用实施例1的r1、r2试剂检测全血样本中血清样淀粉蛋白a的浓度,具体步骤如下:
在足量抗体存在时,浊度的高低与样本中血清样淀粉蛋白a的含量成正比,在540nm波长下,通过与全血样本比较,可定量检测出样品中全血中血清样淀粉蛋白a的含量。
使用实施例1制备的r1、r2试剂测试已知浓度(使用深圳市国赛生物技术有限公司的aristo全自动特定蛋白分析仪测试赋值得到)的全血样本,并使用对比例1的普通免疫比浊法制得的r1、r2试剂测试同样的样本,对测试结果进行对比。
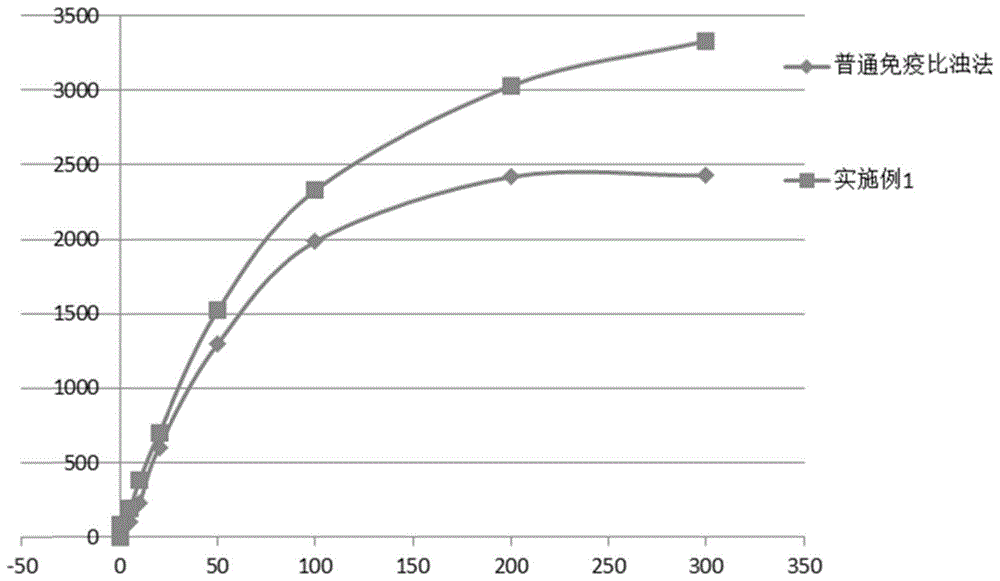
图1所示为实施例1的检测试剂与对比例1的普通免疫比浊法试剂检测所得的血清样淀粉蛋白a浓度结果对比图,横坐标为浓度(mg/l),纵坐标为反应度(该反应度由分析仪根据吸光度进行自动换算得到)。
从图1的结果可以发现,使用本实施例1制得的试剂检测全血样本,全血的线性范围比普通的免疫比浊法r2试剂的线性范围宽。实施例1的试剂盒检测线性范围为0.1-300mg/l,而普通免疫比浊法制得的试剂盒检测全血样本时,在血清样淀粉蛋白a浓度大于200mg/l时出现钩状效应,其检测线性范围为0.2-200mg/l,显著窄于本实施例的线性范围。
检测完成后,分别清洗分析仪器上盛放本实施例试剂的反应槽、普通免疫比浊法检测试剂的反应槽,测定其本底电压,结果如图2所示,横坐标为时间(单位:s),纵坐标为清洗后的本底电压(单位:mv)。
从图2可以发现,盛放实施例1的试剂的反应槽清洗后的本底电压低于盛放普通免疫比浊法检测试剂的反应槽清洗后的本底电压(单位:mv),说明实施例1的检测试剂产生的沉淀更少,反应槽清洗效果更好,更有利于仪器清洗。
后续实施例中提及的对照组(普通免疫比浊法)与本实施例的对照组相同。
实施例2
本实施例提供测定血清淀粉样蛋白a浓度的试剂盒制备方法,包括如下步骤:
1)r1试剂的制备:
在调配罐中加入适量的水,调节搅拌器至合适转速,依次投入第一缓冲剂、第一表面活性剂、第一溶血剂、第一防腐剂,搅拌10-20分钟至完全溶解,溶液澄清透明无沉淀后,调节ph至6.0,定容至最终体积。溶解后通过微孔滤膜过滤,收集滤液,将过滤后的r1试剂成品放置在储存容器中,进行分装标识。所得的r1试剂含有如下终浓度的组分:50mmol/l第一缓冲剂、10g/l第一表面活性剂、5g/l第一溶血剂、5g/l第一防腐剂,余量为水。其中,第一缓冲剂为tris(即氨基丁三醇,亦称三羟甲基氨基甲烷),第一表面活性剂为peg6000,第一溶血剂为皂苷,第一防腐剂为proclin-300。
2)r2试剂的制备:
采用柠檬酸三钠还原法制备胶体金溶液,具体操作如下:将0.01%氯金酸水溶液加热至沸腾,再按照1ml/100ml的体积比加入1%柠檬酸三钠水溶液(即每100ml氯金酸水溶液中加入1ml柠檬酸三钠水溶液),继续加热煮沸15min,冷却至室温后用蒸馏水恢复至原体积(即对氯金酸水溶液进行加热之前的体积)。将胶体金颗粒溶液ph调节至7.5,按照羊抗人血清淀粉样蛋白a多克隆抗体:胶体金=1:3的质量比,边搅拌边逐渐加入羊抗人saa多克隆抗体,使用hcl调节ph至5.0,在该酸性环境下,搅拌反应20分钟,得到羊抗人saa多克隆抗体-胶体金溶液,待其冷却,使用1wt%的naoh水溶液调节saa抗体-胶体金溶液的ph至碱性环境中稳定,调节羊抗人saa多克隆抗体-胶体金微球溶液的ph至碱性环境的方法具体是使用1wt%的naoh水溶液调节,每5~15秒加入一滴naoh水溶液,使10滴ph变化量为0.5~1.0个ph,将金标抗体溶液的ph从5.0调节到6.0,将混合液以15000rpm转速离心1小时,去除上清液,向所得的抗人saa抗体-胶体金微球复合物中加入保存液,定容至目标体积,所得溶液中胶体金的含量为0.2wt%,微孔滤膜过滤、分装,进行标识。本实施例中所使用的保存液中含有如下终浓度的组分:50mmol/l第二缓冲剂、10g/l第二表面活性剂、5g/l第二防腐剂、10g/l稳定剂,余量为水。其中,第二缓冲剂为tris(三羟甲基氨基甲烷),第二表面活性剂为tween-20,第二防腐剂为proclin-300,稳定剂为海藻糖、牛血清白蛋白的混合物,海藻糖、牛血清白蛋白在保存液中的浓度分别为5g/l。
采用本实施例的r1、r2试剂检测全血样本中血清样淀粉蛋白a的浓度,具体步骤如下:
在足量抗体存在时,浊度的高低与样本中血清样淀粉蛋白a的含量成正比,在540nm波长下,通过与已知浓度的样本比较,可定量检测出样品中全血中血清样淀粉蛋白a的含量。
使用本实施例的方法做出的r1、r2试剂测试已知浓度(使用深圳市国赛生物技术有限公司的aristo全自动特定蛋白分析仪测试赋值得到)的样本,并使用对比例1的普通免疫比浊法制得的r1、r2试剂测试同样的样本,对测试结果进行对比。
图3所示为本实施例2与普通免疫比浊法检测所得的血清样淀粉蛋白a浓度结果对比图,横坐标为浓度(mg/l),纵坐标为反应度(该反应度由分析仪根据吸光度进行自动换算得到)。
从图3的结果可以发现,使用本实施例2制得的试剂检测全血样本,全血的线性范围仍比普通的免疫比浊法r2试剂的线性范围高。本实施例2的试剂盒检测线性范围为0.1-300mg/l,而普通免疫比浊法制得的试剂盒检测全血样品时,在血清样淀粉蛋白a浓度大于200mg/l时出现钩状效应,其检测线性范围为0.2-200mg/l,显著窄于本实施例的线性范围。
检测完成后,分别清洗分析仪器上盛放本实施例试剂的反应槽、普通免疫比浊法检测试剂的反应槽,测定其本底电压,结果如图4所示,横坐标为时间(单位:s),纵坐标为清洗后的本底电压(单位:mv)。
从图4可以发现,盛放本实施例试剂的反应槽清洗后的本底电压低于盛放普通免疫比浊法检测试剂的反应槽清洗后的本底电压,说明本实施例2的检测试剂产生的沉淀更少,反应槽清洗效果更好,更有利于仪器清洗。
以上应用了具体个例对本发明进行阐述,只是用于帮助理解本发明,并不用以限制本发明。对于本发明所属技术领域的技术人员,依据本发明的思想,还可以做出若干简单推演、变形或替换。
- 还没有人留言评论。精彩留言会获得点赞!
- 基于量子点的CA15‑3免疫层析试纸条的制备方法与制造工艺
- 肌红蛋白荧光免疫层析试纸条用活化荧光乳胶微球及应用的制造方法与工艺
- 铁蛋白荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 全程C‑反应蛋白荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 25‑羟基维生素D荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 25‑羟基维生素D3荧光免疫层析用活化荧光乳胶微球的制造方法与工艺
- 降钙素原荧光免疫层析检测卡用活化荧光乳胶微球的制造方法与工艺
- 一种改变量子点荧光色的方法与制造工艺
- 一种基于荧光免疫层析技术的定量检测计算方法与制造工艺