一种适用于多种基因型小麦小孢子培养的方法与流程
本发明属于植物组织培养领域,涉及一种适用于多种基因型小麦小孢子培养的方法,特别涉及一种培养小麦小孢子获得再生植株的方法及专用培养基。
背景技术:
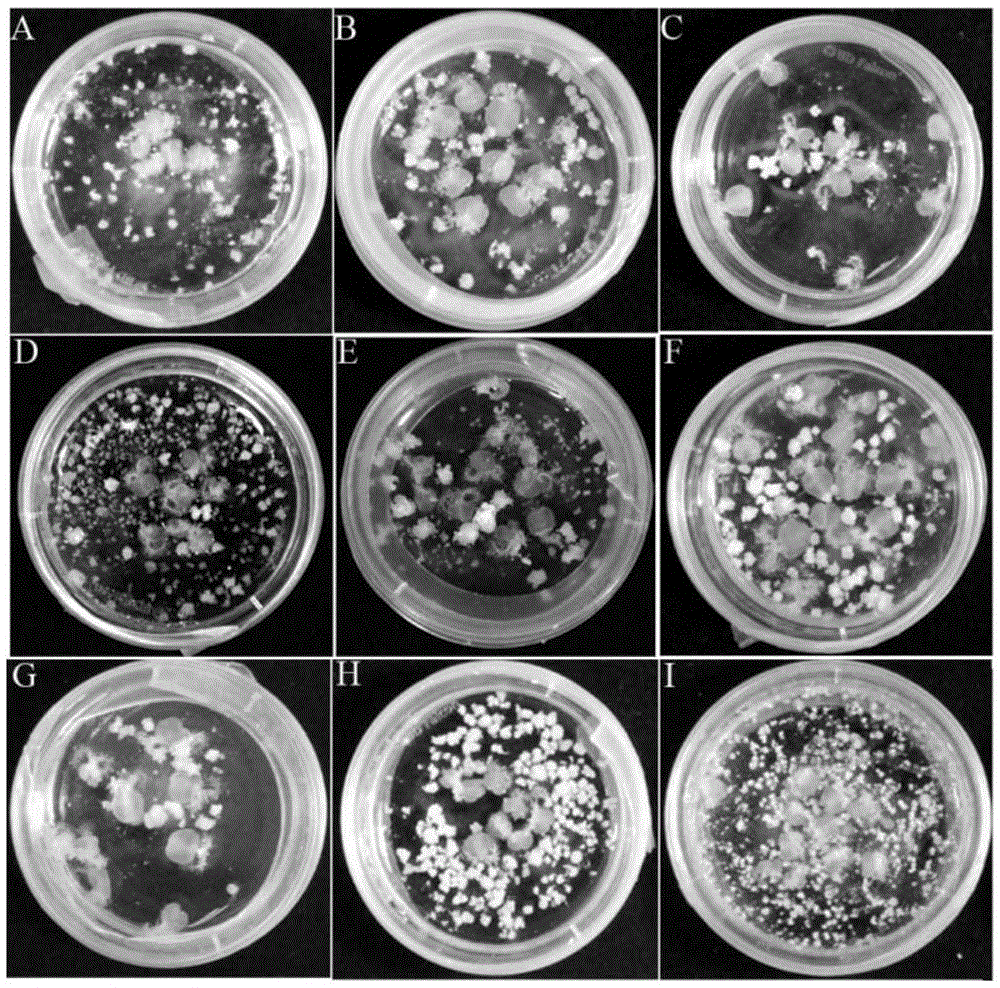
:小麦作为最重要的粮食作物之一,是人类蛋白质、维生素、纤维及镁、磷等物质的主要摄取来源。据1997年召开的“世界食物和可持续发展农业”大会估计,世界小麦需求量将以1.6%的速率增长,2020年将达到7.75亿吨,比1993年的5.52亿吨增长40%。我国2020年小麦需求量将约为1.4~1.5亿吨,比目前产量增加4600~5600万吨,增长49~60%。建国以来,我国已培育出小麦品种2000多个,实现品种更新换代6~8次,单产从43公斤/亩提高到350公斤/亩,为保障我国粮食的有效供给作出了巨大贡献。但近十多年来,小麦产量提高速度趋缓,单产处于徘徊状态。鉴于目前耕地面积减少和持续的人口增长,我国小麦生产依然面临很大挑战。小麦作为自花授粉作物,杂交育种和小麦转基因技术被认为是提高小麦产量的重要途径。但杂交育种和转基因材料获得纯合株系需要连续自交多代,每代都需要经过大量地鉴定筛选,该过程在一年一个世代的情况下,一般需要5~6年时间。在单倍体育种中,通过构建DH群体,避免杂交育种中杂交分离现象,一代获得纯合系,缩短育种周期3~4年。由于每个等位基因在DH系中是纯合稳定的,因而可以提高后代选择效率,利于小麦新种质的创制。小麦转基因技术结合小孢子培养,选取转基因T0或T1代植株幼穗进行小孢子培养,在1~2年内获得转基因植株纯合系,缩短周期4~5年。通过小麦小孢子培养可快速获得DH群体和转基因纯合株系。构建DH群体,从杂交组配到稳定纯系的获得,相当于常规育种F3代,育种周期大概3~4年。转基因小麦,在获得转基因植株后,通过小孢子培养在一个世代可以获得纯合系。但小麦小孢子培养具有基因型依赖性,不同基因型小麦小孢子胚状体产生频率和难易程度不同。Hu等对不同基因型小麦和它们的杂交后代进行小孢子培养,发现小麦Chris基因型具有较好再生情况,但是Chris与Sinton杂交后代具有小孢子再生率显著高于亲本。通过小麦小孢子培养能够实现一代获得纯系,缩短了小麦品种培育过程中连续自交年限。因此,对重要小麦转基因受体材料和国内主要遗传育种材料进行小孢子培养基因型筛选,通过小孢子培养,快速获得小麦DH群体和转基因小麦纯合系,对于加速小麦单倍体育种和转基因小麦的商业化进程,具有重要的意义和应用价值。技术实现要素:本发明的目的是提供一种培养小麦小孢子获得再生植株的方法。本发明所提供的培养小麦小孢子获得再生植株的方法,具体可包括:(1)将待培养小麦的小孢子接种于胚状体诱导培养基,进行诱导培养,得到小孢子胚状体;(2)将所述小孢子胚状体接种于再生培养基,进行再生培养,得到再生苗;所述再生培养基的溶剂为水,溶质及浓度如下:KNO31500mg/L;NH4NO3250mg/L;KH2PO4200mg/L;CaCl2·2H2O450mg/L;MgSO4·7H2O350mg/L;KI0.75mg/L;MnSO415mg/L;H3BO35mg/L;ZnSO4·7H2O7.5mg/L;CoCl·6H2O0.025mg/L;CuSO4·5H2O0.025mg/L;Na2MoO4·2H2O0.25mg/L;FeSO4·7H2O27.80mg/L;Na2EDTA37.20mg/L;VB110mg/L;VB61mg/L;烟酸(AcideNicotinique)1mg/L;肌醇(Myo-Inositol)200mg/L;泛酸钙(Ca-Pantothenate)1.0mg/L;抗坏血酸(Ascorbicacid)1.0mg/L;麦芽糖30000mg/L;2,4-D0.10mg/L;玉米素5.0mg/L;CuSO425mg/L;pH5.70。(3)将所述再生苗接种于生根培养基,进行生根培养,得到所述待培养小麦的再生植株。在所述方法步骤(1)中,接种于所述胚状体诱导培养基的所述小孢子可从经过如下处理的小麦幼穗中分离获得:将所述小麦幼穗(以幼穗顶部距旗叶下端2~3cm为佳)置于500mg/L的CuSO4水溶液中4℃避光处理10天。从经过如上处理的所述小麦幼穗中分离获得所述小孢子具体是按照如下步骤进行:1)将经过如上处理所述小麦幼穗剪去麦芒后用5.25%(体积分数)NaClO消毒3min;用无菌水清洗(如清洗3次,每次1min);2)去除所述小麦幼穗外颖,收集小花置于小孢子提取缓冲液中,于组织搅拌器中6000g搅拌7s,重复3~5次;用300目滤网过滤去除破碎组织;3)用滤孔直径为100μm的无菌筛过滤步骤2)的滤液,将所得滤液于4℃100g离心5min;4)用所述小孢子提取缓冲液重悬步骤3)离心所得沉淀,再于4℃100g离心5min;5)用NPB99缓冲液重悬步骤4)离心所得沉淀,再于4℃100g离心5min;6)用2ml所述NPB99缓冲液重悬步骤5)离心所得沉淀;7)取一个离心管,加入2ml30%Percoll缓冲液(配方:溶液Ⅰ:121.33g/L甘露醇,2.13g/L2-吗啉乙磺酸(MES),pH7.0,抽滤灭菌;溶液Ⅱ:2.13g/L2-吗啉乙磺酸(MES),pH7.0,抽滤灭菌;上述2种溶液的溶剂均为水;溶液Ⅲ:50mlPercoll,抽滤灭菌;将上述3种溶液按照体积比I:II:III为6:1:3的比例混匀),再将步骤6)重悬后的小麦小孢子轻轻平铺在所述30%Percoll缓冲液上方,于4℃100g离心5min,在离心所得混合液的中心位置出现一条“白色”条带(即单核后期或双核早期小孢子);8)吸取所述“白色”条带,加入所述NPB99缓冲液后于4℃100g离心5min(该步离心可 重复操作一次),所得沉淀即为目的小麦小孢子。其中,所述小孢子提取缓冲液的溶剂为水,溶质及浓度如下:KNO31900mg/L;NH4NO3165mg/L;KH2PO4170mg/L;CaCl2·2H2O440mg/L;MgSO4·7H2O370mg/L;FeSO4·7H2O27.8mg/L;Na2EDTA37.2mg/L;D-甘露醇72866mg/L;2-吗啉乙磺酸(MES)150mg/L;pH7.0。所述NPB99缓冲液的溶剂为水,溶质及浓度如下:KNO31415mg/L;(NH4)2SO4232mg/L;KH2PO4200mg/L;CaCl2·2H2O83mg/L;MgSO4·7H2O93mg/L;KI0.4mg/L;MnSO45mg/L;H3BO35mg/L;ZnSO4·7H2O5mg/L;CoCl·6H2O0.0125mg/L;CuSO4·5H2O0.0125mg/L;Na2MoO4·2H2O0.0125mg/L;FeSO4·7H2O27.8mg/L;Na2EDTA37.2mg/L;VB15mg/L;VB60.5mg/L;烟酸(AcideNicotinique)0.5mg/L;肌醇(Myo-Inositol)50mg/L;谷氨酰胺500mg/L;谷胱甘肽0.615mg/L;麦芽糖90g/L;2,4-D0.2mg/L;6-糠氨基嘌呤(Kinetin)0.2mg/L;头孢噻肟(Cefotaxime)100mg/L;pH7.0。在所述方法的步骤(1)中,进行所述诱导培养的过程中,在所述胚状体诱导培养基中加入了来自于所述待培养小麦的子房;每ml所述胚状体诱导培养基中加入3个所述子房。在所述方法的步骤(1)中,将所述小孢子接种于所述胚状体诱导培养基后,所述小孢子在所述胚状体诱导培养基中的含量约为2×105个/ml。在所述方法的步骤(1)中,所述诱导培养条件为28℃避光培养至所述小孢子胚状体的直径为1~2mm时止(4~6周)。在所述方法的步骤(2)中,所述再生培养的条件为16h光照/8h黑暗、23℃培养至所述再生苗长到2~3cm时止(4~5周)。在所述方法的步骤(3)中,所述生根培养的条件为16h光照/8h黑暗、23℃培养3~4周。在所述方法中,所述胚状体诱导培养基的溶剂为水,溶质及浓度如下:KNO31415mg/L;(NH4)2SO4232mg/L;KH2PO4200mg/L;CaCl2·2H2O83mg/L;MgSO4·7H2O93mg/L;KI0.4mg/L;MnSO45mg/L;H3BO35mg/L;ZnSO4·7H2O5mg/L;CoCl·6H2O0.0125mg/L;CuSO4·5H2O0.0125mg/L;Na2MoO4·2H2O0.0125mg/L;FeSO4·7H2O27.8mg/L;Na2EDTA37.2mg/L;VB15mg/L;VB60.5mg/L;烟酸(AcideNicotinique)0.5mg/L;肌醇(Myo-Inositol)50mg/L;谷氨酰胺500mg/L;谷胱甘肽0.615mg/L;聚蔗糖(Ficoll-400)100000mg/L;麦芽糖90000mg/L;2,4-D0.2mg/L;糠氨基嘌呤(Kinetin)0.2mg/L;头孢噻肟(Cefotaxime)100mg/L;pH7.0。所述生根培养基由1/2MS大量元素、1/2MS微量元素、1/2MS有机成分、30g/L 蔗糖和0.6mg/LNAA组成,具体而言其配方如下:溶剂为水,溶质及浓度如下:KNO3950mg/L;NH4NO3825mg/L;KH2PO485mg/L;CaCl2·2H2O220mg/L;MgSO4·7H2O185mg/L;KI0.415mg/L;MnSO411.15mg/L;H3BO33.10mg/L;ZnSO4·7H2O4.30mg/L;CoCl·6H2O0.0125mg/L;CuSO4·5H2O0.0125mg/L;Na2MoO4·2H2O0.125mg/L;FeSO4·7H2O13.9mg/L;Na2EDTA18.65mg/L;肌醇(Myo-Inositol)50mg/L;VB10.05mg/L;VB60.25mg/L;烟酸(AcideNicotinique)0.25mg/L;NAA0.6mg/L;蔗糖30g/L;植物凝胶(Pytagel)3g/L;pH5.70。所述方法还包括对步骤(3)获得的所述再生植株进行染色体倍性鉴定,对单倍体植株进行进行人工加倍的步骤。所述人工加倍的方法为秋水仙素处理。本发明的另一个目的是提供一种用于培养小麦小孢子获得再生植株的培养基。本发明所提供的用于培养小麦小孢子获得再生植株的培养基,为如下(A)或(B):(A)所述再生培养基;(B)由所述胚状体诱导培养基、所述再生培养基和所述生根培养基组成。所述培养基在培养小麦小孢子获得再生植株中的应用也属于本发明的保护范围。在本发明中,所述小麦可为多种基因型小麦,如郑麦7698、周麦22、矮抗58、轮选987、Bobwhite、Fielder、Cadenza、Florida或科农199。本发明所提供的培养小麦小孢子获得再生植株的方法,适用于多种基因型小麦品种,并且采用该方法时每穗的胚状体诱导数、再生苗数、绿苗数以及自然加倍率显著高于传统的常规小孢子培养方法。本发明对于加速小麦单倍体育种和转基因小麦的商业化进程,具有重要的意义和应用价值。附图说明图1为小麦小孢子分离纯化和培养过程。A.小麦幼穗选取;B-C.小麦幼穗去芒和消毒;D-F.有活性小麦小孢子提取、分离过程;G.单核后期小麦小孢子;H.小麦小孢子胚状体诱导。图2为不同基因型小麦小孢子胚状体诱导情况。A.科农199;B.矮抗58;C.Bobwhite;D.Cadenza;E.Fielder;F.Florida;G.轮选987;H.周麦22;I.郑麦7689。图3为不同基因型小麦小孢子胚状体诱导再生成苗。A.科农199;B.矮抗58;C.Bobwhite;D.Cadenza;E.Fielder;F.Florida;G.轮选987;H.周麦22;I.郑麦7698。图4为不同基因型小麦小孢子再生情况统计图。A.胚状体诱导再生情况;B.再生苗统计情况;C.白化苗统计情况;D.绿苗再生统计情况。图5为小麦小孢子再生苗倍性检测。A和C.Fielder野生型叶片气孔大小和染色体目数检测;B和D.Fielder小孢子培养再生植株气孔和染色体数目检测。图6为不同基因型小麦小孢子再生植株自然加倍频率统计。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。下述实施例中所涉及的小麦品种有:郑麦7698、周麦22、矮抗58、轮选987、Bobwhite、Fielder、Cadenza、Florida、科农199。郑麦7698:记载于“田伟,张慎举,郭振升等.超级小麦郑麦7698生长发育特性及其配套技术研究.河南农业科学,2011年07期”一文,公众可从申请人处获得,但仅限于重复本发明。周麦22:记载于“倪永静,任德超,葛君等.秸秆还田与氮肥配施对‘周麦22’灌浆速率及产量的影响.中国农业学通报,2013年24期”一文,公众可从申请人处获得,但仅限于重复本发明。矮抗58:记载于“张希太.NaN3诱变小麦矮抗58后代变异的研究及SSR分析.作物研究,2011年03期”一文,公众可从申请人处获得,但仅限于重复本发明。轮选987:记载于“杨丽.小麦品种轮选987的选育与推广.中国农业科学院,种植,2006,硕士论文”一文,公众可从申请人处获得,但仅限于重复本发明。Bobwhite和科农199:均记载于“刘洋.普通小麦新品种陕农33组织培养高频再生体系的建立.西北农林科技大学,作物遗传育种,2014,硕士”一文,公众可从申请人处获得,但仅限于重复本发明。Fielder:记载于“王晓敏.小麦与条锈菌互作过程中活性氧和防御基因的防御反应及抗病相关基因的鉴定与功能验证.西北农林科技大学,植物病理学,2010,博士论文”一文,公众可从申请人处获得,但仅限于重复本发明。Cadenza:记载于“白彩虹.小麦吸氮量、株高、产量和苗期根系性状的QTL定位.西北农林科技大学,植物营养学,2014,博士论文”一文,公众可从申请人处获得,但仅限于重复本发明。Florida:记载于“刘洋,王根平,王超杰等.普通小麦新品种陕农33未成熟胚高频再生体系的建立.西北农业学报,2015年02期”一文,公众可从申请人处获得,但仅限于重复本发明。下述实施例中所涉及的各种培养基及缓冲液配方如下:1、小孢子提取缓冲液配方如表1所示。溶剂为水,表中各组分浓度均为在小麦小孢子提取缓冲液中的终浓度。表1小麦小孢子提取缓冲液配方(pH7.0)成分mg/L大量元素KNO31900NH4NO3165KH2PO4170CaCl2·2H2O440MgSO4·7H2O370铁盐FeSO4·7H2O27.8Na2EDTA37.2其它D-Mannitol72866MES1502、NPB99缓冲液配方如表2所示。溶剂为水,表中各组分浓度均为在NPB99缓冲液中的终浓度。表2NPB99缓冲液的配方(pH7.0)成分mg/L大量元素KNO31415(NH4)2SO4232KH2PO4200CaCl2·2H2O83MgSO4·7H2O93微量元素KI0.4MnSO45H3BO35ZnSO4·7H2O5CoCl·6H2O0.0125CuSO4·5H2O0.0125Na2MoO4·2H2O0.0125铁盐FeSO4·7H2O27.8Na2EDTA37.2维生素Thiamine-HCl(VB1)5Pyridoxine-HCl(VB6)0.5AcideNicotinique0.5Myo-Inositol50Glutamine500Glutithione0.615其它Maltose900002,4-D0.2Kinetin0.2Cefotaxime100pH7.03、胚状体诱导培养基配方如表3所示。溶剂为水,表中各组分浓度均为在胚状体诱导培养基中的终浓度。表3胚状体诱导培养基的配方(pH7.0)成分mg/L大量元素KNO31415(NH4)2SO4232KH2PO4200CaCl2·2H2O83MgSO4·7H2O93微量元素KI0.4MnSO45H3BO35ZnSO4·7H2O5CoCl·6H2O0.0125CuSO4·5H2O0.0125Na2MoO4·2H2O0.0125铁盐FeSO4·7H2O27.8Na2EDTA37.2维生素Thiamine-HCl(VB1)5Pyridoxine-HCl(VB6)0.5AcideNicotinique0.5Myo-Inositol50Glutamine500Glutithione0.615其它Ficoll-400100000Maltose900002,4-D0.2Kinetin0.2Cefotaxime100pH7.04、再生培养基配方如表4所示。溶剂为水,表中各组分浓度均为在再生培养基中的终浓度。表4再生培养基的配方(pH5.70)成分mg/L大量元素KNO31500NH4NO3250KH2PO4200CaCl2·2H2O450MgSO4·7H2O350微量元素KI0.75MnSO415H3BO35.0ZnSO4·7H2O7.5CoCl·6H2O0.025CuSO4·5H2O0.025Na2MoO4·2H2O0.25铁盐FeSO4·7H2O27.8Na2EDTA37.2维生素Thiamine-HCl(VB1)10Pyridoxine-HCl(VB6)1AcideNicotinique1Myo-Inositol200Ca-Pantothenate1Ascorbicacid1其它Maltose300002,4-D0.1Zeatin5CuSO425pH5.705、生根培养基配方如表5所示。由1/2MS大量元素、1/2MS微量元素、1/2MS有机成分、30g/L蔗糖和0.6mg/LNAA组成。溶剂为水,表中各组分浓度均为在生根培养基中的终浓度。表5生根培养基的配方(pH5.70)实施例1、培养多种基因型小麦小孢子获得再生植株供试小麦品种:包括生产上大面积推广的品种和转基因受体材料。其中,生产上大面积推广的品种有郑麦7698、周麦22、矮抗58和轮选987;转基因受体材料有Bobwhite、Fielder、Cadenza、Florida和科农199。1、将各供试小麦品种种植于温室或者田间。2、在小麦幼穗期,选取8个幼穗,以幼穗顶部距旗叶下端2~3cm为佳,此时小孢子发育时期为单核中后期和双核早期(如图1中A和G所示),4℃低温CuSO4溶液(500mg/L)预处理幼穗(浸泡)10天。3、取步骤2预处理后的小麦幼穗,剪去麦芒,用5.25%(体积分数)NaClO消毒3min;用无菌水清洗3次(如图1所示)。将搅拌杯放置在冰上预冷,并加入小孢子提取缓冲液(表1);在无菌纸上,去除小麦幼穗外颖,收集小花到预冷搅拌杯中。4、以6000g搅拌7s,重复3~5次;用300目筛网过滤搅拌后的小孢子提取缓冲液到预冷烧杯中,去除破碎组织,得到滤液1。用滤孔直径为100μm的无菌筛过滤滤液1,到50ml无菌离心管中,得到滤液2。将滤液2在4℃,100g离心5min,收 集小孢子。轻轻地缓慢倒掉上清液,保留沉淀;用新的小孢子提取缓冲液重悬沉淀,再100g离心5min(如图1所示)。5、倒掉上清,将沉淀转移到15ml离心管中,加入15mlNPB99缓冲液(表2),4℃100g离心5min。倒掉上清,加入2mlNPB99缓冲液重悬沉淀。在一个新的离心管中加入2ml30%Percoll缓冲液(配方:溶液Ⅰ:121.325g/L甘露醇,2.133g/L2-吗啉乙磺酸(MES),pH7.0,抽滤灭菌;溶液Ⅱ:2.132g/L2-吗啉乙磺酸(MES),pH7.0,抽滤灭菌;溶液Ⅲ:50mlPercoll,抽滤灭菌;上述3种溶液的溶剂均为水;将上述3种溶液按照体积比I:II:III为6:1:3的比例混匀),将重悬后的沉淀轻轻铺于30%Percoll缓冲液上,4℃100g离心5min,在混合液中心位置出现一条“白色”条带(如图1所示)。6、吸取“白色”条带位置处的小孢子,转移到一个新的15ml离心管中,用NPB99缓冲液洗涤一次。4℃100g离心5min收集小孢子,倒掉上清,加入适量的NPB99缓冲液重悬小孢子(如图1所示)。7、在小培养皿中加入3.3ml胚状体诱导培养基(表3),吸取200μl小孢子悬浮液到每个培养皿中,每个培养皿中加入3个子房/ml胚状体诱导培养基(同一个培养皿中的小孢子和子房来自于同一小麦品种)。用封口膜密封每个小培养皿,放置到大培养皿中,在大培养皿中心放置加有无菌水的培养皿,28℃避光培养4~6周(如图1所示),至胚状体直径长到1~2mm。8、统计不同基因型小麦小孢子胚状体诱导情况(不同基因型小麦小孢子愈伤诱导情况如图2所示)。发现郑麦7698小孢子胚状体诱导情况最好,“胚状体数/穗”数值由大到小依次为郑麦7698>Cadenza>周麦22>科农199>Fielder>Florida>矮抗58>Bobwhite>轮选987,差异显著性分析如表6和图4所示。9、将直径为1~2mm的胚状体转移到再生培养基(表4)中培养,23℃,16h光照/8h黑暗培养4~6周,待再生苗长到2~3cm,将再生苗转移生根培养基(表5)中,培养3~4周,获得再生植株(不同基因型小麦小孢子胚状体诱导再生成苗情况如图3所示)。10、统计不同基因型小麦每小穗小孢子再生苗数、白化苗数和绿苗数。“再生苗数/穗”数值由大到小依次为:Cadenza>郑麦7698>周麦22>Fielder>矮抗58>科农199>Florida>Bobwhite>轮选987。“白化苗数/穗”数值由大到小依次为:郑麦7698>周麦22>Cadenza>Fielder>矮抗58>科农199>Florida>Bobwhite>轮选987。“绿苗数/穗”数值由大到小依次为:Cadenza>郑麦7698>周麦22>Fielder>科农199>Florida>矮抗58>Bobwhite>轮选987(如表6和图4所示)。11、将再生植株移栽到土中,取叶片中间部位检测气孔大小和部分根尖检测染色体数目,初步确定再生苗倍性(如图5所示)。用秋水仙素处理单倍体植株,进行人工加倍。继续培养所得再生植株至成熟,获得成熟后的种子。12、统计不同基因型小麦小孢子再生植株的自然加倍率。如图6所示,自然加倍率依次为:Bobwhite>轮选987>Fielder>科农199>Cadenza>周麦22>Florida>矮抗58>郑麦7698。表6不同基因型小麦小孢子培养、再生相关指数统计基因型胚状体数/穗再生苗数/穗白化苗数/穗绿苗数/穗科农19988.35±5.5120.67±2.0815.67±3.065±1.05矮抗5855.45±7.02**22±2.6517.45±2.084.67±1.53Bobwhite34.67±7.00**10.34±1.53**6.67±1.153.67±0.58Candenza489±13.53**110.45±10.1238.77±4.16**71.67±7.64**Fielder77.33±8.0230.67±4.1618.67±4.93311.35±1.53Florida59.67±6.43*13.67±3.798.67±3.054.67±0.58轮选98733.67±4.51**8.55±1.534.67±1.52*3.67±0.57周麦22262.67±13.20**81±8.19**59.58±5.51**21.45±3.21**郑麦7698545.50±17.62**95.55±7.51**72.84±4.16**22.67±3.79**当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1