miR-133小分子核酸药物在制备抗胃癌药物中的应用的制作方法
本发明涉及生物医药技术领域,更具体地讲,miR-133小分子核酸药物在制备抗胃癌药物中的应用。
背景技术:
胃癌是消化系统常见的恶性肿瘤,同时也是一种恶性程度极高的肿瘤,总体5年生存率只有20-30%。在我国,其发病率和死亡率均居所有恶性肿瘤的第2位。随着标准的胃癌D2根治手术的规范性开展,以及各种新型放、化疗手段的应用,其临床疗效得到一定程度的提高。然而,即使在得到根治性切除且接受了规范的辅助性化疗的情况下,仍有部分患者出现肿瘤的复发和转移,提示现有治疗手段的局限性。目前认为,胃癌是一种生物学异质性很大的肿瘤,其发生由多种基因组和表观遗传学机制共同参与。因此,进一步深入认识胃癌发生、发展过程中的细胞和分子机制,对于更精细化的诊治这一顽疾,具有重要的科学意义和临床实用价值。
microRNA(miRNA)是一类长度约为22个核苷酸的非编码小片段RNA,其进化保守,其通过与mRNA(messenger RNA)的3’非翻译区(3’untranslational region,3’-UTR)相互作用从而调控mRNA的翻译,进而广泛参与发育、肿瘤、炎症等多种生物学活动。研究发现,miRNA在许多人类肿瘤中均有异常的表达,它们或通过改变癌基因或抑癌基因的表达,直接影响肿瘤的生长、增殖和凋亡,或与肿瘤的表型、分期及患者生存有相关性,从而以早期诊断和监测病情的生物标志物的身份出现。
miR-133家族最早于2002年在小鼠肌肉发育过程研究中被鉴定发现,其序列在物种中高度保守。在人类基因组中,miR-133家族包含三个家族成员:miR-133-a-1、miR-133a-2和miR-133b,它们依次分别位于第18、20和6号染色体上。miR-133的成熟序列包括miR-133a-3p和miR-133b,其均为miR-133的初级转录产物(pri-miRNA)发卡结构的3’端剪切而来,两个成熟序列在结构上高度同源,只有3’端存在一个碱基的差异。研究证实,miR-133的表达异常与多种骨骼肌和心肌的疾病相关。近年来,miR-133在 肿瘤领域中的作用亦被逐步揭示,包括膀胱癌、前列腺癌和胃癌。例如,在人膀胱癌中,miR-133a可以直接靶向并调节癌基因GSTP1的表达,而miR-133a的下调表达则通过增强GSTP1介导的抗凋亡效应,从而促进膀胱癌的发生发展(Uchida等,MiR-133a induces apoptosis through direct regulation of GSTP1in bladder cancer cell lines,Urol Oncol,31卷1期)。在胃癌中,miR-133的表达与肿瘤大小、浸润深度及外周器官转移呈负相关性,其功能异常是影响胃癌预后的独立危险因素(Cheng等,miR-133is a key negative regulator of CDC42-PAK pathway in gastric cancer,Cell Signal,26卷12期)。然而,miR-133在胃癌发生发展中所扮演的角色、确切的分子生物学机制以及是否可以作为小分子核酸药物用于临床治疗胃癌尚无相关报道。
技术实现要素:
本发明涉及生物医药技术领域,提供了微小RNA-miR-133的新的医药用途,具体是指miR-133在恶性肿瘤分子靶向治疗中的应用;本发明还揭示了miR-133小分子核酸药物在胃癌治疗中的潜在价值。
本发明的第一方面,提供了miR-133的新的医药用途,具体是指miR-133在制备抗胃癌药物中的应用;所述的miR-133的序列如下:
miR-133a-3p:5’-UUUGGUCCCUUCAACCAGCUG-3’(SEQ ID NO.1)
miR-133b:5’-UUUGGUCCCUUCAACCAGCUA-3’(SEQ ID NO.2)
上述miR-133a-3p和miR-133b在制备抗胃癌药物中可以单独应用或同时应用。
所述的药物,是指能够提高或增加miR-133a-3p或/和miR-133b的表达量的试剂。
本发明中提及的miR-133b/a-3p,即指miR-133a-3p或/和miR-133b。
所述的药物能够通过靶向抗凋亡分子Mcl-1和Bcl-xL抑制胃癌细胞的增殖。
所述的抗胃癌是指预防或治疗胃癌。
所述的miR-133是包括但不限于:miR-133序列、特异性干扰miR-133基因表达、加工的小干扰分子,如siRNA分子、miRNA分子、反义核苷酸等,miR-133序列的表达质粒及其高表达腺病毒与慢病毒。
在本发明的一个优选实施例中,所述的miR-133体内表达试剂为 AgomiR-133(购自广州锐博公司)。
本发明中,所述的药物是指以miR-133为唯一活性成份,或者是含有miR-133的药物组合物。
所述的药物组合物是指含有有效量的所述的miR-133或其抑制剂,以及药学上可接受的载体。
所述的药物是指miR-133或含有miR-133序列的miR-133体内活性成分AgomiR-133,具有抗肿瘤活性,可用于临床治疗胃癌。
上述含有miR-133序列的miR-133体内活性成分AgomiR-133为AgomiR-133b/a-3p,具体合成方法为:
Agomir-133的序列基于miR-133b/a-3p的成熟序列合成后,在3’端连接一个胆固醇分子,协助核酸进入细胞。5’端前两个核苷酸与3’端四个核苷酸之间通过硫代反应加入硫代骨架修饰,全部核苷酸分子都进行甲基化修饰,用来增强小分子核酸的稳定性。
所述“药学上可接受的”的成分是适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)的,即有合理的效益/风险比的物质。
所述“有效量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。
任何适用的给药途径都是可以的,包括但不限于:口服、静脉内注射、皮下注射、肌肉给予、局部给予、植入、缓释给予、心脏内给予等;优选的,所述给药方式是非肠道给予的。
有益效果
本发明经实验证明,在胃癌发生过程中,miR-133的表达受到显著抑制;恢复miR-133的表达可以通过靶向抗凋亡分子Mcl-1和Bcl-xL抑制胃癌细胞的增殖,从而发挥抗肿瘤作用。
本发明为胃癌的临床治疗提供了新的潜在分子靶点。
附图说明
图1.在胃癌中miR-133b/a-3p表达显著下调
(A)14对胃癌标本的miRNA组的热力图分析。所示结果为每例样本读取值的log2对数,并与单纯计数板读取值进行标化。热力图分析通过带有DESeq包的R软件完成(padj<0.05,log2倍数变化>3)。RNA序列从TCGA数据库 下载得到。(B)qRT-PCR方法对正常胃黏膜永生细胞GES和胃癌细胞系SGC7901和MNK45中miR-133b/a-3p的表达进行定量。U6snRNA的表达作为内参。数据以均值±标准差(n=5)的形式表达,**,p<0.01。(C)qRT-PCR方法对临床获取的20例胃癌及相应的正常胃组织中miR-133b/a-3p的表达进行定量分析。miR-133b/a-3p的表达以U6作为内参。
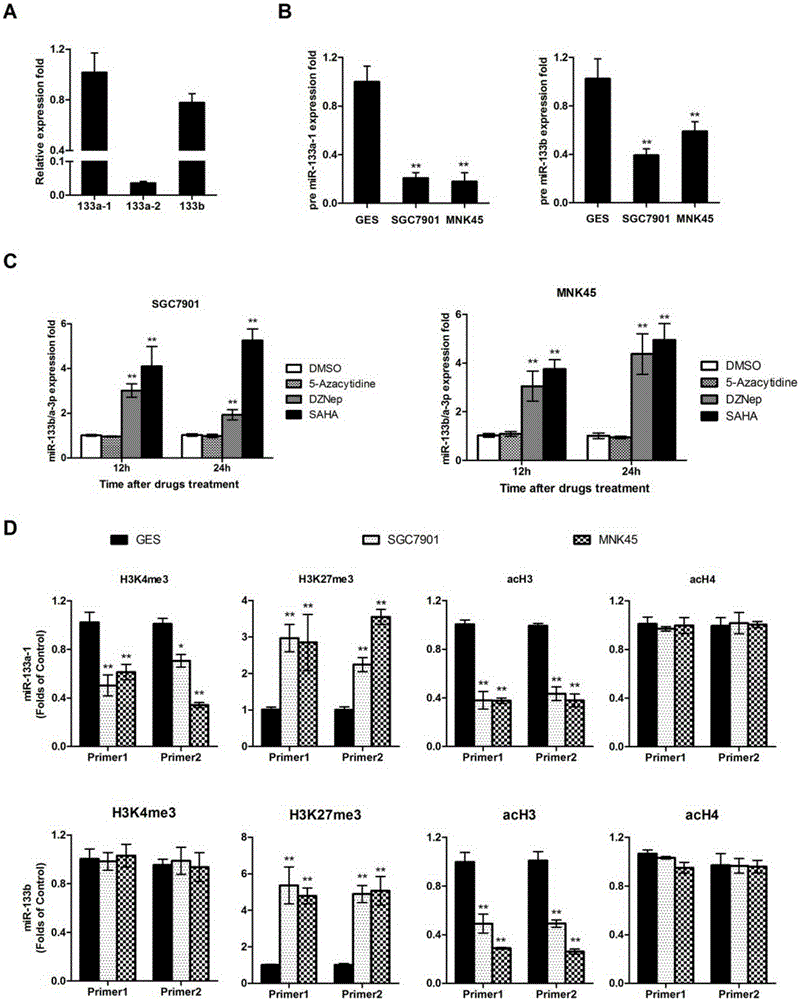
图2.组蛋白修饰介导胃癌发生过程中miR-133b/a-3p的下调
(A)qRT-PCR方法检测GES细胞系中miR-133的三个前体Pri-miR-133a-1,pri-miR-133a-2and pri-miR-133b的表达。数据以均值±标准差(n=5)的形式表达。(B)qRT-PCR方法检测胃癌细胞系SGC7901和MNK45中miR-133的三个前体Pri-miR-133a-1,pri-miR-133a-2and pri-miR-133b的表达。GES细胞系作为对照。数据表达形式同(A),**,p<0.01。(C)对胃癌细胞分别以DNA甲基化抑制剂5-氮杂胞苷(10nM)、组蛋白甲基化抑制剂DZNep(10nM)或组蛋白去乙酰化酶抑制剂SAHA(10nM)处理一段时间,qRT-PCR检测miR-133b/a-3p的表达情况。数据以均值±标准差(n=3)的形式表达,**,p<0.01。(D)对正常胃组织永生细胞和胃癌细胞系进行ChIP分析,RT-PCR法对miR-133a-1和miR-133b启动子区域H3Kme3、H3K27me3、H3乙酰化和H4乙酰化水平进行分析。数据表达形式同(C),**,p<0.01。
图3.miR-133b/a-3p降低细胞活性并促进细胞凋亡
(A)SGC7901和MNK45细胞按照5:4的比例转染miR-133a-3p和miR-133b的混合物,使终浓度为20nM或100nM。转染后36小时,采用qRT-PCR方法检测miR-133b/a-3p的表达量。数据以均值±标准差(n=5)的形式表达。(B)SGC7901和MNK45细胞按照(A)中的方法进行转染,采用CCK8方法检测细胞增殖情况。数据表达形式同(A),**,p<0.01。(C)以20nM浓度的miR-133b/a-3p转染细胞72小时,然后对细胞采用Annexin V和PI染色,采用流式细胞术检测。Annexin V阳性同时PI阴性的细胞被认为是凋亡细胞。数据以均值±标准差(n=3)的形式表达,**,p<0.01。(D)细胞的转染方法同(C),转染24小时后,对细胞进行无血清和低氧培养24小时。采用TUNEL染色法分析凋亡细胞,以红色箭头指示。TUNEL(绿色)、DAPI(蓝色)。图4.miR-133b/a-3p直接靶向抗凋亡分子Mcl-1和Bcl-xL。
(A)所示为miR-133b/a与其靶位点配对结合的示意图,该图经由TargetScan网站下载(www.targetscan.org)。(B)按照相关步骤,HEK293细胞(1× 104)共转染100ng pMIR-Mcl-1的3’-UTR荧光素酶报告质粒和40ng pTK-Renilla-荧光素酶质粒或其结合段突变的报告质粒与对照或miR-133b/a-3p(终浓度20nM)共转染。24小时后,检测荧光素活性并与Renilla荧光素活性进行标化。数据以均值±标准差(n=3)的形式表达,**,p<0.01。(C)HEK293细胞转染pMIR-Bcl-xL 3’-UTR区荧光报告质粒和相应RNA。荧光素活性检测方法同(B)。(D)SGC7901细胞转染20nM miR-133b/a-3p,36小时后通过qRT-PCR方法检测Mcl-1和Bcl-xL两个靶分子RNA水平的表达,通过western blot方法检测蛋白水平的表达。(E)MNK45细胞接受如(D)中SGC7901同样的处理,36小时后通过qRT-PCR方法检测Mcl-1和Bcl-xL两个靶分子RNA水平的表达,通过western blot方法检测蛋白水平的表达。(F)检测I期到IIIB期不同分期的代表性胃癌标本中Mcl-1和Bcl-xL的表达,miR-133b/a-3p的表达在图下方显示。N代表相应的周围正常胃组织,T代表胃癌组织。
图5.miR-133b/a-3p抑制体内肿瘤的生长,其下调与胃癌进展显著相关。
(A)miR-133对裸鼠荷瘤动物成瘤的生物学作用。同一只裸鼠的两侧后肢外侧分别皮下注射1×106个SGC7901或MNK45细胞,而后通过小鼠尾静脉注射AgomiR-133b/a-3p或AgomiR-NC,浓度均为每只小鼠5nM,每周一次。在指定时间测量肿瘤体积。数据以均值±标准差(n=5)的形式表达。*,p<0.05;**,p<0.01。(B)采用qRT-PCR方法对小鼠成瘤瘤体内miR-133b/a-3p的表达进行检测。数据以均值±标准差(n=5)的形式表达。**,p<0.01。(C)采用免疫组化方法对小鼠成瘤瘤体内Bcl-xL and Mcl-1的表达进行检测。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
除非另有描述,本发明的实施将采用分子生物学、微生物学、重组DNA和免疫学的常规技术,这些均是本领域技术人员所知的。这些技术在下列文献中有完整的描述:例如,Sambrook《分子克隆实验指南》第2版(1989);《DNA克隆》第I和II卷(D.N.Glover编辑1985);《寡核苷酸合成》(M.J.Gait编辑,1984);《核酸杂交》(B.D.Hames和S.J.Higgins编辑.1984);《蛋白质纯化:原理和实践》第2版(Springer-Verlag,N.Y.),以及《实验免疫学手 册》I-IV卷(D.C.Weir和C.C.Blackwell编辑1986)。或者,可按照试剂生产商所提供的说明书进行。
除非另外说明,否则百分比和份数按重量计算。除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同。此外,任何与所记载内容相似或均等的方法及材料皆可应用于本发明中。文中所述的较佳实施方法与材料仅作示范之用。
实施例1
本发明人调阅下载癌症基因组图集(TCGA)数据库中包含14对胃癌标本的miRNA数据资料,通过R语言对显著差异性表达的miRNA进行分析。发现与正常对照样本相比,胃癌组织中的miR-133-a-1、miR-133a-2和miR-133b均发生显著下调(图1A)。
进而,我们体外培养胃癌细胞系SGC7901和MNK45,以正常胃壁组织永生细胞系GES作为对照,通过qRT-PCR方法对上述结果进行验证。发现在胃癌细胞系中miR-133的成熟片段miR-133b/a-3p的表达较对照细胞GES亦显著下调(图1B)。
为了进一步证实上述实验结果,我们采集20例临床胃癌冰冻组织标本(标本来源于上海长征医院普外二科(胃肠外科),经病理科医生明确诊断为胃癌),发现癌组织中miR-133b/a-3p的表达显著低于同一个体中正常对照组织中的表达量(图1C)。以上结果提示,在胃癌发生过程中,miR-133b/a-3p的表达会发生下调。
本发明人研究了miR-133b/a-3p在胃癌组织中发生稳定下调的分子机制。因为在人类基因组中,共有三个miR-133的前体,即miR-133a-1(18号染色体),miR-133a-2(20号染色体)and miR-133b(6号染色体)。我们首先分析了成熟的miR-133b/a-3p的来源,通过对GES细胞系中三个miR-133前体的qRT-PCR分析,发现miR-133b/a-3p主要来源于miR-133a-1和miR-133b(图2A)。而胃癌细胞系中miR-133前体miR-133a-1和and miR-133b的表达同样显著低于其在GES细胞系中(图2B)。鉴于表观遗传学修饰在miRNA表达调控中的重要作用,我们研究了DNA甲基化、组蛋白甲基化和组蛋白乙酰化三种表观遗传修饰在miR-133表达调控中的作用。发现组蛋白甲基化抑制剂DZNep和组蛋白去乙酰化酶抑制剂SAHA均可以显著增加胃癌细胞系中miR-133b/a-3p的表达,而DNA甲基化抑制剂5-氮杂胞苷则不影响 miR-133b/a-3p的表达(图2C),提示组蛋白修饰参与了miR-133b/a-3p的表达调控。进而,我们采用染色质免疫共沉淀(CHIP)方法对miR-133a-1和miR-133b启动子区域的表观遗传学修饰水平进行定量检测。发现胃癌细胞中与转录激活相关的两个位点H3K4me3甲基化水平和H3乙酰化水平均显著降低;相反,与转录抑制相关的位点H3K27me3甲基化水平则显著升高(图2D)。相似的,胃癌细胞系中miR-133b的H3乙酰化水平显著降低而H3K27me3甲基化水平显著升高。因此,我们的研究证实,miR-133的下调是组蛋白修饰介导的而与DNA的甲基化无关。
为了研究在胃癌中miR-133下调所产生的生物学效应,我们合成了miR-133的拟似物(mimics)用于体外高表达miR-133(图3A)。使用interferin转染试剂将miR-133mimics或miR-133抑制剂(inhibitor)转染胃癌细胞系后,采用CCK-8细胞增殖检测技术,发现恢复miR-133的表达可显著抑制胃癌细胞的增殖(图3B)。进而,我们将胃癌细胞系转染miR-133,72小时后通过Annexin V和PI凋亡染色,并进行流式细胞术检测,发现转染miR-133后可以显著增加Annexin V阳性细胞的比例(图3C),提示miR-133能够诱导胃癌细胞的凋亡。为了验证上述实验结果,我们对细胞培养进行了TUNEL和DAPI的双重染色,发现转染miR-133的胃癌细胞培养中观察到许多凋亡小体,而转染对照组则仅观察到极少量的TUNEL阳性细胞(图3D)。上述研究结果提示,miR-133可以抑制胃癌细胞的增殖。
进一步我们探讨了miR-133作用的靶分子。虽然既往研究报道过一些miR-133的靶点,本研究中我们首先通过TargetScan(www.targetscan.Org)在线软件分析其作用的靶点,结合前述实验结果,推测Mcl-1和Bcl-xL(图4A)可能是miR-133发挥抗肿瘤作用的靶点;因为这两个分子都与细胞凋亡密切相关。通过构建上述分子的双荧光报告基因表达载体,我们发现miR-133在Mcl-1和Bcl-xL的3’UTR区域存在保守的靶位点。根据双荧光报告基因的检测结果,我们证实miR-133的作用靶点是抗凋亡分子Mcl-1和Bcl-xL(图4B-C)。进一步通过qPCR和Western Blot实验证实,转染miR-133的拟似物能够降低胃癌细胞系中Mcl-1和Bcl-xL蛋白水平的表达但不影响mRNA水平的表达(图4D-E),提示miR-133可能通过抑制转录后翻译而不影响mRNA的降解。此外,在这些可用的胃癌临床标本中,我们发现Mcl-1和Bcl-xL的表达与miR-133的表达呈显著负相关性,并与胃癌疾病的进展相关(图4F)。上述结果提示, miR-133通过直接靶向Mcl-1和Bcl-xL的3’UTR区域发挥作用。
最后,我们通过构建胃癌裸鼠荷瘤动物模型,对miR-133的体内抗肿瘤效应进行了研究。我们首先合成了miR-133的体内活性药物胆固醇连接的miR-133(AgomiR-133b/a-3p)及其空白对照agomiR-NC。将1×106胃癌细胞皮下注射于裸鼠的后肢后,每次一次通过尾静脉注射AgomiR-133b/a-3p共6周,观察对荷瘤裸鼠肿瘤生长的影响。发现AgomiR-133b/a-3p可以显著延迟肿瘤成瘤时间及肿瘤大小。最后我们处死小鼠,获取肿瘤组织标本,进行qPCR和组织病理学分析。发现AgomiR-133b/a-3p处理的小鼠其miR-133的水平显著升高,伴随Mcl-1和Bcl-xL的表达显著下降,与体外实验相吻合。综上所述,我们得出结论,miR-133可以抑制胃癌肿瘤生长,可以作为治疗胃癌的一种潜在的靶向药物。
实施例2:体外实验中高表达miR-133对胃癌细胞的影响
委托上海吉玛制药技术有限公司合成miR-133的拟似物(mimics),序列如下:
UUUGGUCCCUUCAACCAGCUG(SEQ ID NO.1)
或UUUGGUCCCUUCAACCAGCUA(SEQ ID NO.2)。
实验方法:
1、胃癌细胞培养与转染:胃癌细胞SGC7901与MNK45购自中科院细胞库,使用含有10%FBS的DMEM培养基培养,每36h进行1:3传代。细胞转染使用INTERFERin转染试剂(购自Polyplus-transfection公司)并按试剂说明书转染RNA。
2、实时定量RT-PCR:细胞总RNA使用TRIzol(Invitrogen)抽提,总mNRA使用Fast200试剂盒(购自上海飞捷生物)抽提。qRT-PCR使用SYBR RT-PCR试剂盒(Takara)并在LightCycler(Roche)实时定量PCR仪上完成。miRNA的相对定量使用2-ΔΔCt法计算(U6为内参),mRNA的相对定量使用GAPDH作为内参照。
实验结果:使用INTERFERin转染试剂将miR-133mimics或miR-133inhibitor转染胃癌细胞系后,采用CCK-8细胞增殖检测技术,发现恢复miR-133的表达可显著抑制胃癌细胞的增殖(图3B)。进而,我们将胃癌细胞系转染miR-133,72小时后通过Annexin V和PI凋亡染色,并进行流式细 胞术检测,发现转染miR-133后可以显著增加Annexin V阳性细胞的比例(图3C),提示miR-133能够诱导胃癌细胞的凋亡。为了验证上述实验结果,我们对细胞培养进行了TUNEL和DAPI的双重染色,发现转染miR-133的胃癌细胞培养中观察到许多凋亡小体,而转染对照组则仅观察到极少量的TUNEL阳性细胞(图3D)。上述研究结果提示,miR-133在体外实验中可以抑制胃癌细胞的增殖。
实施例3:体内实验中高表达miR-133可以抑制胃癌生长。
实验方法:
1、将SGC7901或MNK45细胞制备单细胞悬液,以无菌注射器将1×106个细胞通过皮下注射方法接种于裸鼠右侧腋下,以制作胃癌裸鼠荷瘤动物模型。核酸药物AgomiR-133(购自广州锐博公司)尾静脉注射进胃癌裸鼠荷瘤动物模型体内。
2、实时定量RT-PCR:细胞总RNA使用TRIzol(Invitrogen)抽提,总mNRA使用Fast200试剂盒(购自上海飞捷生物)抽提。qRT-PCR使用SYBR RT-PCR试剂盒(Takara)并在LightCycler(Roche)实时定量PCR仪上完成。miRNA的相对定量使用2-ΔΔCt法计算(U6为内参)。
3、免疫组化:
1)取小鼠肿瘤组织,石蜡包埋,切片,烤片60℃,1h;
2)脱蜡及复水:二甲苯10min,100%乙醇5min,95%乙醇5min,90%乙醇5min,85%乙醇5min,80%乙醇5min,75%乙醇5min,60%乙醇5min,50%乙醇5min,30%乙醇5min,自来水1min,双氧水1min;
3)1份30%H2O2加10份蒸馏水,室温10min,蒸馏水洗3次,每次3min;
4)抗原修复:将切片浸入0.01M枸橼酸缓冲液,微波中最大火力(98℃-100℃)加热至沸腾,冷却(约5-10min),反复两次;
5)将切片自然冷却至室温,PBS洗涤3次,每次5min;
6)封闭,5%BSA,室温20min,甩去多余液体;
7)滴加一抗(MCL-1与Bcl-xL),37℃,1h,或者4℃过夜;
8)PBS洗涤3次,每次3min;
9)滴加二抗,37℃,15-30min;
10)PBS洗涤3次,每次3min;
11)滴加SABC,37℃,30min;
12)PBS洗涤3次,每次5min;
13)1ml蒸馏水中分别滴加显色剂,混匀;
14)DAB显色剂配置好后,滴加于切片,室温,镜下检测反应时间(约5min);
15)自来水冲洗干净,过蒸馏水;
16)苏木素复染2min,自来水冲洗;
17)脱水:30%乙醇3min,50%乙醇3min,70%乙醇3min,80%乙醇3min,90%乙醇3min,95%乙醇3min,100%乙醇3min,二甲苯20min;
18)树胶封片,镜检。
实验结果:在胃癌裸鼠荷瘤动物模型中,每周一次通过尾静脉注射AgomiR-133b/a-3p共6周,观察对荷瘤裸鼠肿瘤生长的影响。发现AgomiR-133b/a-3p可以显著延迟肿瘤成瘤时间及肿瘤大小。最后我们处死小鼠,获取肿瘤组织标本,进行qPCR和组织病理学分析。发现AgomiR-133b/a-3p处理的小鼠其miR-133的水平显著升高,伴随Mcl-1和Bcl-xL的表达显著下降,证明了miR-133的有效性。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可作出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!